第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册 (1)(word版有答案)
文档属性
| 名称 | 第八单元海水中的化学测试题-2021-2022学年九年级化学鲁教版下册 (1)(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 354.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-10 18:03:18 | ||
图片预览


文档简介
第八单元《海水中的化学》测试题
一、单选题
1.下列物质的化学式与俗名不一致的是
A.Ca(OH)2——消石灰 B.NaOH——纯碱
C.Hg——水银 D.NaHCO3——小苏打
2.分类是科学研究的重要方法,下列物质对应的类别不正确的是
选项 A B C D
物质 铜 小苏打 氨气 熟石灰
类别 单质 盐 化合物 氧化物
A.A B.B C.C D.D
3.下列各项措施中,不属于乳化在日常生产生活中的应用的是
A.用肥皂洗去衣服上的油渍
B.用洗洁精洗去碗筷上残留的油污
C.用洗衣粉清洗衣服上的污渍
D.用盐酸清洗盛石灰水试剂瓶瓶壁上的“白膜”(碳酸钙)
4.下列除去杂质(括号内物质)的方法正确的是
A.NaOH 溶液(Na2CO3 ):加适量稀盐酸 B.Cu(氧化铜):加入足量稀硫酸,过滤
C.CO2 (CO):通入氧气,点燃 D.CaO(CaCO3):加足量水溶解、过滤
5.下列关于溶液说法正确的是
A.将不饱和溶液变为饱和溶液,溶质质量分数一定增大 B.降低温度溶液中一定能析出溶质
C.无色透明的液体不一定都是溶液 D.溶液的体积为溶质和溶剂体积之和
6.下列各组离子可在同一溶液中大量共存的是
A.Na+、、 B.H+、C1-、
C.Cu2+、C1-、OH- D.H+、、OH-
7.类推是化学学习中常用的思维方法,下列类推结果正确的是
A.活泼金属能与盐酸反应放出气体,则能与盐酸反应放出气体的固体一定是活泼金属
B.碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性
C.溶液中有晶体析出时,溶质的质量减小,所以溶液的溶质质量分数一定减小
D.酸能使石蕊试液变红,CO2也能使紫色的石蕊试液变红,所以CO2是酸
8.如下图所示是硝酸钾和氯化钠的溶解度曲线,下列叙述正确的是
A.KNO3和NaCl的溶解度相等
B.NaCl的溶解度受温度影响更大
C.将A点的KNO3溶液转化为B点的该溶液可采取增加溶剂
D.60℃时,NaCl溶液和KNO3溶液的溶质质量分数可能相等
9.下列实验现象描述不正确的是
A.加热铜绿固体时绿色粉末逐渐变黑
B.硫磺燃烧闻到了有刺激性气味
C.煅烧碳酸钙听到了尖锐的爆鸣声
D.镁带燃烧看到了耀眼的白光
10.明代宋应星所著的《天工开物》收录了井盐的生产过程:“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述。该制盐过程涉及的操作是
A.蒸馏 B.溶解 C.过滤 D.蒸发
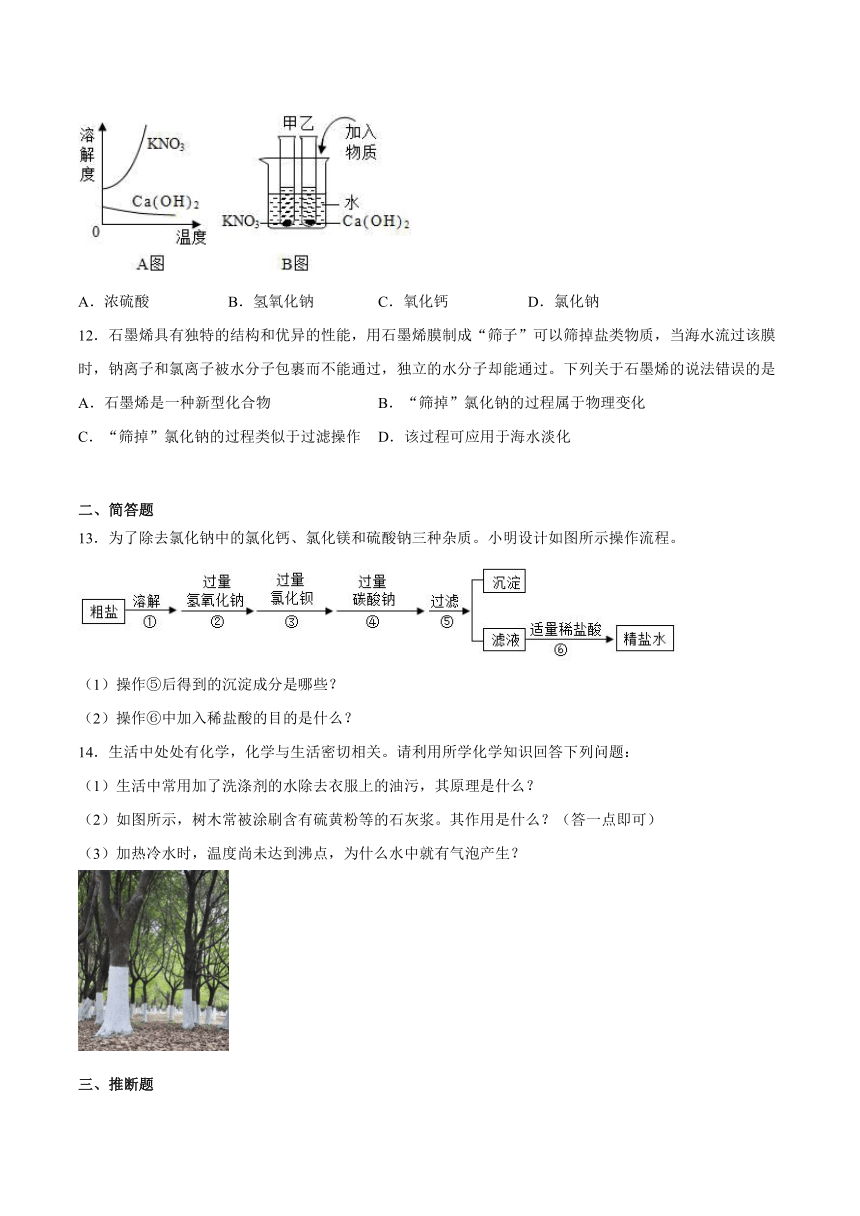
11.A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体减少,乙试管中的固体增加,则加入的物质不可能是
A.浓硫酸 B.氢氧化钠 C.氧化钙 D.氯化钠
12.石墨烯具有独特的结构和优异的性能,用石墨烯膜制成“筛子”可以筛掉盐类物质,当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过。下列关于石墨烯的说法错误的是
A.石墨烯是一种新型化合物 B.“筛掉”氯化钠的过程属于物理变化
C.“筛掉”氯化钠的过程类似于过滤操作 D.该过程可应用于海水淡化
二、简答题
13.为了除去氯化钠中的氯化钙、氯化镁和硫酸钠三种杂质。小明设计如图所示操作流程。
(1)操作⑤后得到的沉淀成分是哪些?
(2)操作⑥中加入稀盐酸的目的是什么?
14.生活中处处有化学,化学与生活密切相关。请利用所学化学知识回答下列问题:
(1)生活中常用加了洗涤剂的水除去衣服上的油污,其原理是什么?
(2)如图所示,树木常被涂刷含有硫黄粉等的石灰浆。其作用是什么?(答一点即可)
(3)加热冷水时,温度尚未达到沸点,为什么水中就有气泡产生?
三、推断题
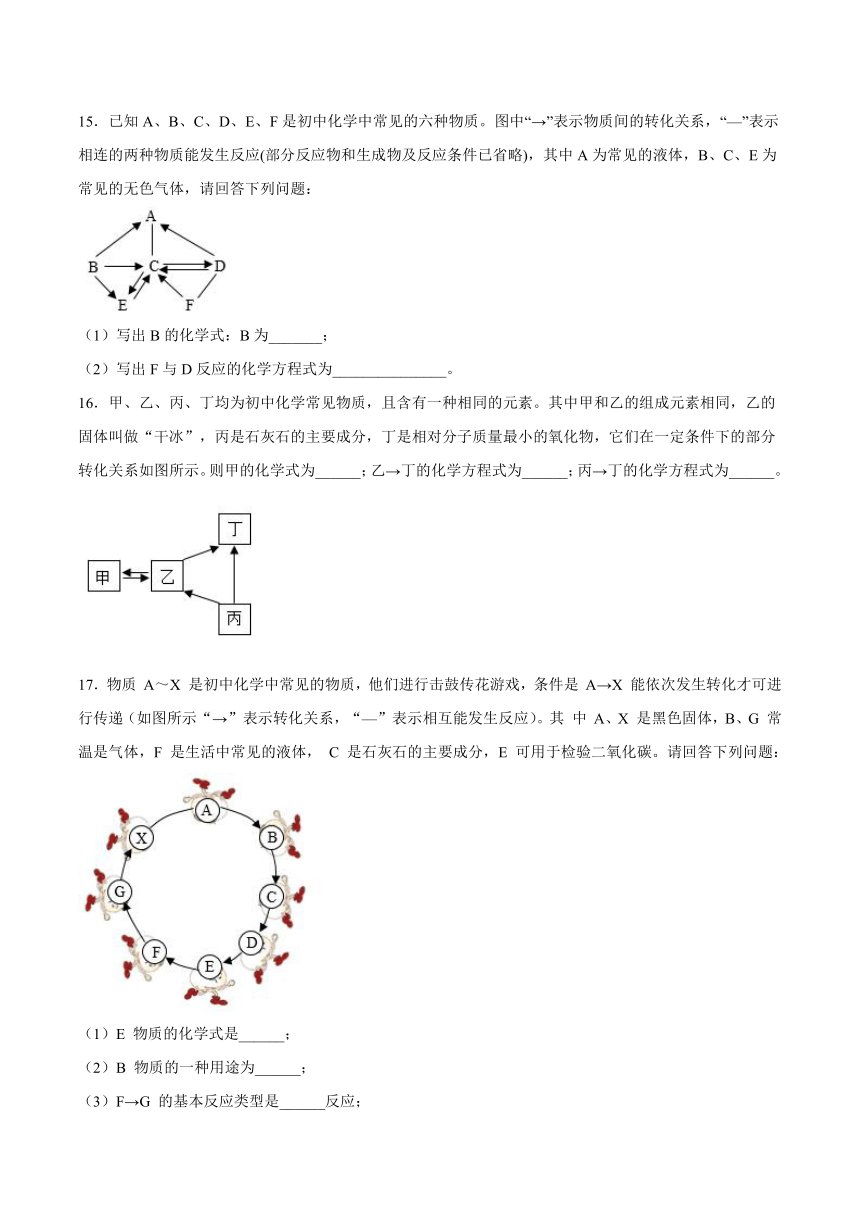
15.已知A、B、C、D、E、F是初中化学中常见的六种物质。图中“→”表示物质间的转化关系,“—”表示相连的两种物质能发生反应(部分反应物和生成物及反应条件已省略),其中A为常见的液体,B、C、E为常见的无色气体,请回答下列问题:
(1)写出B的化学式:B为_______;
(2)写出F与D反应的化学方程式为_______________。
16.甲、乙、丙、丁均为初中化学常见物质,且含有一种相同的元素。其中甲和乙的组成元素相同,乙的固体叫做“干冰”,丙是石灰石的主要成分,丁是相对分子质量最小的氧化物,它们在一定条件下的部分转化关系如图所示。则甲的化学式为______;乙→丁的化学方程式为______;丙→丁的化学方程式为______。
17.物质 A~X 是初中化学中常见的物质,他们进行击鼓传花游戏,条件是 A→X 能依次发生转化才可进行传递(如图所示“→”表示转化关系,“—”表示相互能发生反应)。其 中 A、X 是黑色固体,B、G 常温是气体,F 是生活中常见的液体, C 是石灰石的主要成分,E 可用于检验二氧化碳。请回答下列问题:
(1)E 物质的化学式是______;
(2)B 物质的一种用途为______;
(3)F→G 的基本反应类型是______反应;
(4)A~X 物质中氧化物有______种;
(5)A 和 X 反应的化学方程式可能为______。
四、实验题
18.某同学设计了如下图装置制取并收集一矿泉水瓶二氧化碳气体,并用于证明二氧化碳与氢氧化钠溶液能否发生反应。
(1)该同学用大理石与稀盐酸反应来制取二氧化碳,他选用的发生装置是_________,发生反应的化学方程式为_____________。
(2)该同学用图中矿泉水瓶收集一瓶二氧化碳,他检验二氧化碳是否已收集满的正确方法是__________。
(3)为了证明二氧化碳能否与氢氧化钠发生反应,该同学向盛满二氧化碳的矿泉水瓶中加入一定量氢氧化钠溶液,立即盖紧瓶盖,振荡,观察到矿泉水瓶变瘪,请解释变瘪的原因是_____________。
(4)接着该同学向变瘪后的矿泉水瓶内的溶液中加入氯化钡溶液,若观察到___________,即证明有碳酸钠存在,从而证明二氧化碳与氢氧化钠发生了反应。
19.在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式:______。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
(提出问题)滤液中除水外还含有哪些物质?
(猜想)小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是______(写一种猜想)。
(讨论)你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。______。
(实验设计)设计一个简单的实验证明你的猜想正确。
实验步骤 实验现象 实验结论
取样于试管中______; ______ 你的猜想正确
五、计算题
20.实验室中有一瓶因存放不当而变质的固体氢氧化钠,某同学为测定其变质情况,取25g样品放入烧杯中,向其中加入260g过量的稀盐酸,得到280.6g溶液。请计算:
(1)反应生成二氧化碳的质量为______g。
(2)25g样品中碳酸钠的质量分数(写出计算过程)。
21.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)写出反应的化学方程式_______。
(2)a点溶液中含有的离子是_______。
(3)当pH=7时,列出求解参加反应的硫酸质量(X)的比例式________。
(4)计算稀硫酸中溶质的质量分数________。
(5)若用质量分数98%的浓硫酸配制上述实验所需稀硫酸,需要浓硫酸质量为________。
(6)向恰好完全反应时的溶液中加入24克水,所得溶液的溶质质量分数_______。
参考答案
1.B 2.D 3.D 4.B 5.C 6.A 7.B 8.D 9.C 10.D 11.D 12.A
13.
(1)氢氧化镁、硫酸钡、碳酸钙、碳酸钡
(2)除去过量的氢氧化钠和碳酸钠
14.(1)洗涤剂能乳化油污。
(2)保护树木,防止冻伤,并防止害虫生卵。
(3)气体的溶解度随温度的升高而减小。
15.
(1)O2
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑或Na2CO3+2HCl=2NaCl+H2O+CO2↑或或
16.CO
17.
(1)Ca(OH)2
(2)灭火、人工降雨等
(3)分解
(4)四
(5)或
18.
(1) B
(2)将燃着的木条放在瓶口,木条熄灭,证明已满
(3)可能是CO2与NaOH发生了反应,也可能是CO2溶于水了
(4)产生白色沉淀
19.
(1)
(2) 含有氢氧化钠和氢氧化钙 小明,理由:碳酸钠和氢氧化钙能反应,不能共存 滴加碳酸钠溶液 试管中出现白色浑浊
20.
(1)解:有质量守恒定律可知,反应生成的二氧化碳的质量=25g+260g 280.6g=4.4g
答:反应生成二氧化碳的质量为4.4g。
(2)解:设样品中碳酸钠的质量为 x
=
x=10.6g
样品中碳酸钠的质量分数=×100%=42.4%
答:样品中碳酸钠的质量分数为 42.4%。
21.
(1)
(2)H+、Na+、
(3)
(4)9.8%
(5)1g
(6)解:设生成硫酸钠的质量为z
加24克水后所得溶液的溶质质量分数为
答:所得溶液的溶质质量分数为2.84%。
一、单选题
1.下列物质的化学式与俗名不一致的是
A.Ca(OH)2——消石灰 B.NaOH——纯碱
C.Hg——水银 D.NaHCO3——小苏打
2.分类是科学研究的重要方法,下列物质对应的类别不正确的是
选项 A B C D
物质 铜 小苏打 氨气 熟石灰
类别 单质 盐 化合物 氧化物
A.A B.B C.C D.D
3.下列各项措施中,不属于乳化在日常生产生活中的应用的是
A.用肥皂洗去衣服上的油渍
B.用洗洁精洗去碗筷上残留的油污
C.用洗衣粉清洗衣服上的污渍
D.用盐酸清洗盛石灰水试剂瓶瓶壁上的“白膜”(碳酸钙)
4.下列除去杂质(括号内物质)的方法正确的是
A.NaOH 溶液(Na2CO3 ):加适量稀盐酸 B.Cu(氧化铜):加入足量稀硫酸,过滤
C.CO2 (CO):通入氧气,点燃 D.CaO(CaCO3):加足量水溶解、过滤
5.下列关于溶液说法正确的是
A.将不饱和溶液变为饱和溶液,溶质质量分数一定增大 B.降低温度溶液中一定能析出溶质
C.无色透明的液体不一定都是溶液 D.溶液的体积为溶质和溶剂体积之和
6.下列各组离子可在同一溶液中大量共存的是
A.Na+、、 B.H+、C1-、
C.Cu2+、C1-、OH- D.H+、、OH-
7.类推是化学学习中常用的思维方法,下列类推结果正确的是
A.活泼金属能与盐酸反应放出气体,则能与盐酸反应放出气体的固体一定是活泼金属
B.碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性
C.溶液中有晶体析出时,溶质的质量减小,所以溶液的溶质质量分数一定减小
D.酸能使石蕊试液变红,CO2也能使紫色的石蕊试液变红,所以CO2是酸
8.如下图所示是硝酸钾和氯化钠的溶解度曲线,下列叙述正确的是
A.KNO3和NaCl的溶解度相等
B.NaCl的溶解度受温度影响更大
C.将A点的KNO3溶液转化为B点的该溶液可采取增加溶剂
D.60℃时,NaCl溶液和KNO3溶液的溶质质量分数可能相等
9.下列实验现象描述不正确的是
A.加热铜绿固体时绿色粉末逐渐变黑
B.硫磺燃烧闻到了有刺激性气味
C.煅烧碳酸钙听到了尖锐的爆鸣声
D.镁带燃烧看到了耀眼的白光
10.明代宋应星所著的《天工开物》收录了井盐的生产过程:“汲水而上,入于釜中煎炼,顷刻结盐,色成至白”的描述。该制盐过程涉及的操作是
A.蒸馏 B.溶解 C.过滤 D.蒸发
11.A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体减少,乙试管中的固体增加,则加入的物质不可能是
A.浓硫酸 B.氢氧化钠 C.氧化钙 D.氯化钠
12.石墨烯具有独特的结构和优异的性能,用石墨烯膜制成“筛子”可以筛掉盐类物质,当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过。下列关于石墨烯的说法错误的是
A.石墨烯是一种新型化合物 B.“筛掉”氯化钠的过程属于物理变化
C.“筛掉”氯化钠的过程类似于过滤操作 D.该过程可应用于海水淡化
二、简答题
13.为了除去氯化钠中的氯化钙、氯化镁和硫酸钠三种杂质。小明设计如图所示操作流程。
(1)操作⑤后得到的沉淀成分是哪些?
(2)操作⑥中加入稀盐酸的目的是什么?
14.生活中处处有化学,化学与生活密切相关。请利用所学化学知识回答下列问题:
(1)生活中常用加了洗涤剂的水除去衣服上的油污,其原理是什么?
(2)如图所示,树木常被涂刷含有硫黄粉等的石灰浆。其作用是什么?(答一点即可)
(3)加热冷水时,温度尚未达到沸点,为什么水中就有气泡产生?
三、推断题
15.已知A、B、C、D、E、F是初中化学中常见的六种物质。图中“→”表示物质间的转化关系,“—”表示相连的两种物质能发生反应(部分反应物和生成物及反应条件已省略),其中A为常见的液体,B、C、E为常见的无色气体,请回答下列问题:
(1)写出B的化学式:B为_______;
(2)写出F与D反应的化学方程式为_______________。
16.甲、乙、丙、丁均为初中化学常见物质,且含有一种相同的元素。其中甲和乙的组成元素相同,乙的固体叫做“干冰”,丙是石灰石的主要成分,丁是相对分子质量最小的氧化物,它们在一定条件下的部分转化关系如图所示。则甲的化学式为______;乙→丁的化学方程式为______;丙→丁的化学方程式为______。
17.物质 A~X 是初中化学中常见的物质,他们进行击鼓传花游戏,条件是 A→X 能依次发生转化才可进行传递(如图所示“→”表示转化关系,“—”表示相互能发生反应)。其 中 A、X 是黑色固体,B、G 常温是气体,F 是生活中常见的液体, C 是石灰石的主要成分,E 可用于检验二氧化碳。请回答下列问题:
(1)E 物质的化学式是______;
(2)B 物质的一种用途为______;
(3)F→G 的基本反应类型是______反应;
(4)A~X 物质中氧化物有______种;
(5)A 和 X 反应的化学方程式可能为______。
四、实验题
18.某同学设计了如下图装置制取并收集一矿泉水瓶二氧化碳气体,并用于证明二氧化碳与氢氧化钠溶液能否发生反应。
(1)该同学用大理石与稀盐酸反应来制取二氧化碳,他选用的发生装置是_________,发生反应的化学方程式为_____________。
(2)该同学用图中矿泉水瓶收集一瓶二氧化碳,他检验二氧化碳是否已收集满的正确方法是__________。
(3)为了证明二氧化碳能否与氢氧化钠发生反应,该同学向盛满二氧化碳的矿泉水瓶中加入一定量氢氧化钠溶液,立即盖紧瓶盖,振荡,观察到矿泉水瓶变瘪,请解释变瘪的原因是_____________。
(4)接着该同学向变瘪后的矿泉水瓶内的溶液中加入氯化钡溶液,若观察到___________,即证明有碳酸钠存在,从而证明二氧化碳与氢氧化钠发生了反应。
19.在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式:______。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
(提出问题)滤液中除水外还含有哪些物质?
(猜想)小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是______(写一种猜想)。
(讨论)你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。______。
(实验设计)设计一个简单的实验证明你的猜想正确。
实验步骤 实验现象 实验结论
取样于试管中______; ______ 你的猜想正确
五、计算题
20.实验室中有一瓶因存放不当而变质的固体氢氧化钠,某同学为测定其变质情况,取25g样品放入烧杯中,向其中加入260g过量的稀盐酸,得到280.6g溶液。请计算:
(1)反应生成二氧化碳的质量为______g。
(2)25g样品中碳酸钠的质量分数(写出计算过程)。
21.实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
(1)写出反应的化学方程式_______。
(2)a点溶液中含有的离子是_______。
(3)当pH=7时,列出求解参加反应的硫酸质量(X)的比例式________。
(4)计算稀硫酸中溶质的质量分数________。
(5)若用质量分数98%的浓硫酸配制上述实验所需稀硫酸,需要浓硫酸质量为________。
(6)向恰好完全反应时的溶液中加入24克水,所得溶液的溶质质量分数_______。
参考答案
1.B 2.D 3.D 4.B 5.C 6.A 7.B 8.D 9.C 10.D 11.D 12.A
13.
(1)氢氧化镁、硫酸钡、碳酸钙、碳酸钡
(2)除去过量的氢氧化钠和碳酸钠
14.(1)洗涤剂能乳化油污。
(2)保护树木,防止冻伤,并防止害虫生卵。
(3)气体的溶解度随温度的升高而减小。
15.
(1)O2
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑或Na2CO3+2HCl=2NaCl+H2O+CO2↑或或
16.CO
17.
(1)Ca(OH)2
(2)灭火、人工降雨等
(3)分解
(4)四
(5)或
18.
(1) B
(2)将燃着的木条放在瓶口,木条熄灭,证明已满
(3)可能是CO2与NaOH发生了反应,也可能是CO2溶于水了
(4)产生白色沉淀
19.
(1)
(2) 含有氢氧化钠和氢氧化钙 小明,理由:碳酸钠和氢氧化钙能反应,不能共存 滴加碳酸钠溶液 试管中出现白色浑浊
20.
(1)解:有质量守恒定律可知,反应生成的二氧化碳的质量=25g+260g 280.6g=4.4g
答:反应生成二氧化碳的质量为4.4g。
(2)解:设样品中碳酸钠的质量为 x
=
x=10.6g
样品中碳酸钠的质量分数=×100%=42.4%
答:样品中碳酸钠的质量分数为 42.4%。
21.
(1)
(2)H+、Na+、
(3)
(4)9.8%
(5)1g
(6)解:设生成硫酸钠的质量为z
加24克水后所得溶液的溶质质量分数为
答:所得溶液的溶质质量分数为2.84%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
