第九单元溶液单元巩固练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第九单元溶液单元巩固练习-2021-2022学年九年级化学人教版下册(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 131.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-10 00:00:00 | ||
图片预览

文档简介
第八单元《溶液》单元巩固练习
附相对原子质量:H-1;C-12;N-14;O-16;Fe-56
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
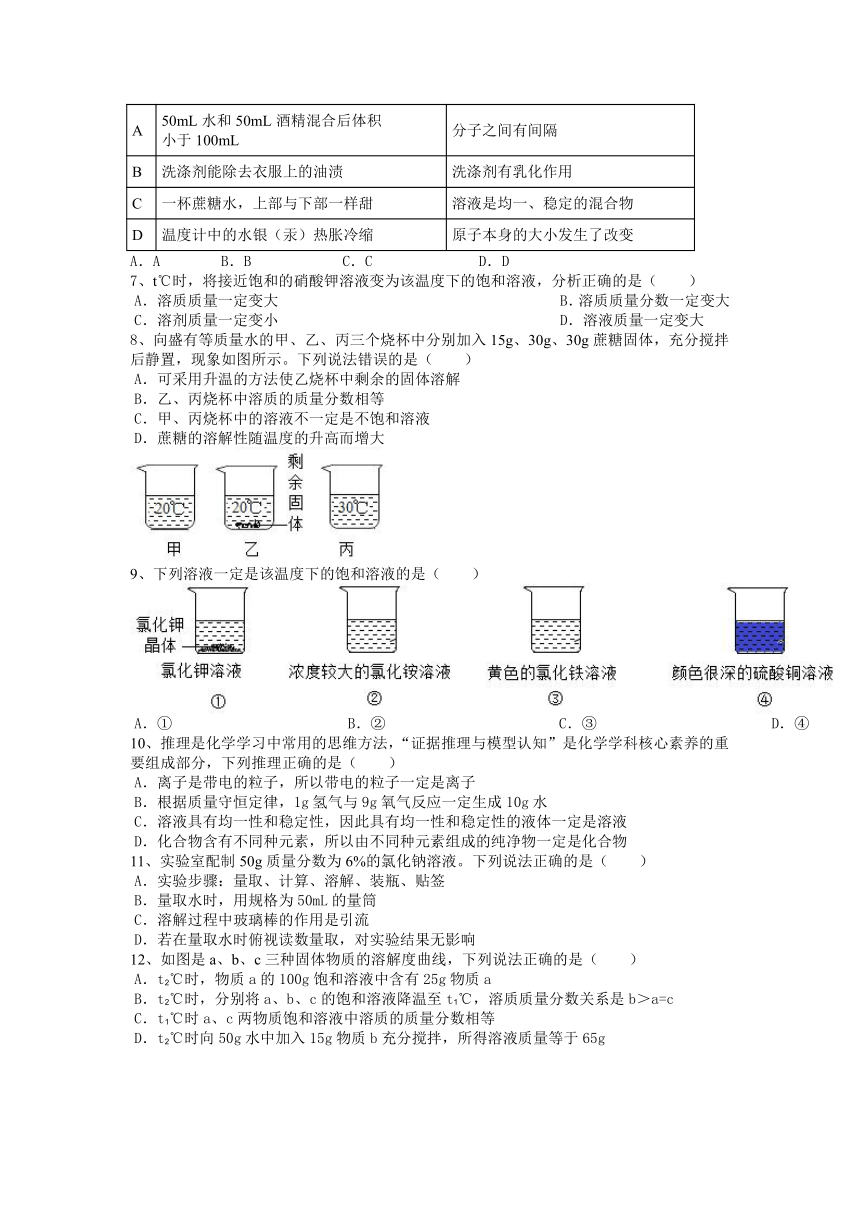
1、厨房中的下列调料与水混合不能形成溶液的是( )
A.白糖 B.花生油 C.食盐 D.米酒
2、判断下列变化是化学变化的是( )
A.加热冷水有气泡 B.灯泡发光 C.冷却溶液出现沉淀 D.酚酞溶液变红
3、水是生活中常见的重要物质,下列说法正确的是( )
A.实验必须:溶剂一定是水
B.生活常识:油锅着火用水来扑灭
C.人体必需:水是人体中含量最多的物质
D.实验认识:电解水说明了水是由氢气和氧气组成的
4、下列有关氯化钠溶液的说法中,不正确的是( )
A.氯化钠溶于水时,溶液温度基本不变
B.氯化钠溶液中含有钠离子、氯离子、水分子
C.氯化钠溶液是均一、稳定的混合物
D.室温下,氯化钠饱和溶液不能再溶解任何物质
5、一定能增大二氧化碳在水中溶解度的操作是( )
A.边升温边加压 B.边降温边加压
C.边升温边减压 D.边降温边减压
6、善于用化学的眼光看世界,能够提高我们的科学素养.你认为下列变化事实和相应解释不一致的是( )
事 实 解 释
A 50mL水和50mL酒精混合后体积
小于100mL 分子之间有间隔
B 洗涤剂能除去衣服上的油渍 洗涤剂有乳化作用
C 一杯蔗糖水,上部与下部一样甜 溶液是均一、稳定的混合物
D 温度计中的水银(汞)热胀冷缩 原子本身的大小发生了改变
A.A B.B C.C D.D
7、t℃时,将接近饱和的硝酸钾溶液变为该温度下的饱和溶液,分析正确的是( )
A.溶质质量一定变大 B.溶质质量分数一定变大
C.溶剂质量一定变小 D.溶液质量一定变大
8、向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增大
9、下列溶液一定是该温度下的饱和溶液的是( )
A.① B.② C.③ D.④
10、推理是化学学习中常用的思维方法,“证据推理与模型认知”是化学学科核心素养的重要组成部分,下列推理正确的是( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水
C.溶液具有均一性和稳定性,因此具有均一性和稳定性的液体一定是溶液
D.化合物含有不同种元素,所以由不同种元素组成的纯净物一定是化合物
11、实验室配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.实验步骤:量取、计算、溶解、装瓶、贴签
B.量取水时,用规格为50mL的量筒
C.溶解过程中玻璃棒的作用是引流
D.若在量取水时俯视读数量取,对实验结果无影响
12、如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
二、本大题包括5小题,共28分
13、化学与人类生活息息相关。
(1)洗洁精可以洗去餐具上的油污,是因为洗洁精在水中对油污有 作用。
(2)要使块状冰糖加速溶解,通常先将冰糖 (填操作),再放入热水中搅拌。
(3)铝制品在空气中不易锈蚀,是因为其表面易生成致密的 (填化学式)膜。
(4)碘酒可用于医疗消毒,碘酒中的溶剂是 (填名称)。
(5)食盐水能导电,原因是食盐水中存在大量能自由移动的 (填微粒符号)。
14、研究溶液对于生产、生活有重要意义。表1是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
(1)20℃时,NaCl的溶解度 (填“>”或“<”)KNO3的溶解度。
(2)“40℃时,KNO3的溶解度为63.9g。”这句话的含义是 。
(3)60℃时,将100g KNO3放入100g水中,充分溶解后,形成的是60℃时KNO3的 (填“饱和”或“不饱和”)溶液。
(4)若要从硝酸钾和少量氯化钠的混合物中提纯硝酸钾,应采用 (填“降温”或“蒸发”)结晶法。
15、卓筒井手工制盐的工艺流程包括下面五个步骤。
①“Ⅱ汲卤”获得卤水为悬浊液,溶液部分中氯化钠的浓度为7%,下表是氯化钠在不同温度时的溶解度。
温度(℃) 20 40 60 80
氯化钠的溶解度(g/100g水) 36.0 36.6 37.3 38.4
根据表中数据可得出:20℃时,氯化钠溶解度为 ,该卤水的溶液部分是氯化钠的 (选填“饱和”或“不饱和”)溶液。
②“Ⅲ滤卤”与实验操作过滤的原理一样其目的是为了分离溶液和 。
③“Ⅳ煎盐”用井中产生的天然气作为燃料,加热卤水,除去其中的溶剂,CH4燃烧的化学方程式是 ,该步骤和实验操作 (选填“降温结晶”或“蒸发结晶”)的原理相似。
④当地人利用工具将卤水在室外风吹日晒一段时间后,浓度可提高至约17%,该步骤称为“晒卤”,应位于步骤 (选填“Ⅱ”、“Ⅲ”或“Ⅳ”)之后,请比较卓筒井手工制盐中“晒卤”和“煎盐”,两者的原理有何相似之处和不同之处 。
16、农业上常用质量分数为16%的氯化钠溶液进行选种。现需要配制80g溶质质量分数为16%的氯化钠溶液,请按要求回答下列问题:
(1)该实验正确的操作顺序是 (填序号)。
A.①②③④⑤ B.④⑤①②③ C.④⑤②①③ D.④①⑤②③
(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠 g,量取所用的水最好选用
规格的量筒(填序号)(已知:ρ水=1.0g/mL)。
A.100mL B.50mL C.10mL
(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,应 (填序号)。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母 D.减少砝码
(4)溶解时,将水倒入盛氯化钠的烧杯中,用玻璃棒进行搅拌,其目的是 。
(5)将配制好的溶液装瓶并贴上标签。小明同学贴标签有不妥之处,如图所示,请在右侧的空白标签上填写正确内容。
(6)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是 (填序号)。
A.用量筒量取水时俯视读数
B.往烧杯中倾倒量取好的蒸馏水时,少量水溅出
C.所用氯化钠晶体未充分干燥
D.转移已称好的氯化钠固体时,部分洒落在烧杯外
17、实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)反应生成氧气的质量为 g;
(2)参加反应过氧化氢溶液的质量分数是多少?
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、B 2、D 3、C 4、D 5、B 6、D 7、B 8、B 9、A 10、D
11、B 12、C
二、本大题包括5小题,共28分
13、答案:(1)乳化。
(2)研磨。
(3)Al2O3。
(4)酒精。
(5)Na+、Cl-。
14、答案:(1)>;
(2)40℃时,KNO3在100g水中达到饱和状态时溶解的质量为63.9g或40℃时,100g水中最多可溶KNO3质量为63.9g;
(3)不饱和;
(4)降温。
15、答案:①36.0g;不饱和;
②不溶性杂质;
③CH4+2O2CO2+2H2O;蒸发结晶;
④Ⅱ;“晒卤”和“煎盐”都是将水蒸发;“晒卤”增大了溶质的质量分数,蒸发结晶利用溶剂的蒸发得到了晶体。
16、答案:(1)B;
(2)12.8;A;
(3)A;
(4)加速溶解;
(5);
(6)CD。
17、解:(1)根据质量守恒定律,反应产生氧气的质量=70g-68.4g=1.6g
(2)设产生1.6g氧气需要H2O2的质量为x
2H2O22H2O+O2↑
68 32
x 1.6g
解得:x=3.4g
所用过氧化氢溶液的溶质质量分数:
答:参加反应过氧化氢溶液的质量分数是5%。
附相对原子质量:H-1;C-12;N-14;O-16;Fe-56
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、厨房中的下列调料与水混合不能形成溶液的是( )
A.白糖 B.花生油 C.食盐 D.米酒
2、判断下列变化是化学变化的是( )
A.加热冷水有气泡 B.灯泡发光 C.冷却溶液出现沉淀 D.酚酞溶液变红
3、水是生活中常见的重要物质,下列说法正确的是( )
A.实验必须:溶剂一定是水
B.生活常识:油锅着火用水来扑灭
C.人体必需:水是人体中含量最多的物质
D.实验认识:电解水说明了水是由氢气和氧气组成的
4、下列有关氯化钠溶液的说法中,不正确的是( )
A.氯化钠溶于水时,溶液温度基本不变
B.氯化钠溶液中含有钠离子、氯离子、水分子
C.氯化钠溶液是均一、稳定的混合物
D.室温下,氯化钠饱和溶液不能再溶解任何物质
5、一定能增大二氧化碳在水中溶解度的操作是( )
A.边升温边加压 B.边降温边加压
C.边升温边减压 D.边降温边减压
6、善于用化学的眼光看世界,能够提高我们的科学素养.你认为下列变化事实和相应解释不一致的是( )
事 实 解 释
A 50mL水和50mL酒精混合后体积
小于100mL 分子之间有间隔
B 洗涤剂能除去衣服上的油渍 洗涤剂有乳化作用
C 一杯蔗糖水,上部与下部一样甜 溶液是均一、稳定的混合物
D 温度计中的水银(汞)热胀冷缩 原子本身的大小发生了改变
A.A B.B C.C D.D
7、t℃时,将接近饱和的硝酸钾溶液变为该温度下的饱和溶液,分析正确的是( )
A.溶质质量一定变大 B.溶质质量分数一定变大
C.溶剂质量一定变小 D.溶液质量一定变大
8、向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法错误的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.乙、丙烧杯中溶质的质量分数相等
C.甲、丙烧杯中的溶液不一定是不饱和溶液
D.蔗糖的溶解性随温度的升高而增大
9、下列溶液一定是该温度下的饱和溶液的是( )
A.① B.② C.③ D.④
10、推理是化学学习中常用的思维方法,“证据推理与模型认知”是化学学科核心素养的重要组成部分,下列推理正确的是( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水
C.溶液具有均一性和稳定性,因此具有均一性和稳定性的液体一定是溶液
D.化合物含有不同种元素,所以由不同种元素组成的纯净物一定是化合物
11、实验室配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.实验步骤:量取、计算、溶解、装瓶、贴签
B.量取水时,用规格为50mL的量筒
C.溶解过程中玻璃棒的作用是引流
D.若在量取水时俯视读数量取,对实验结果无影响
12、如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
二、本大题包括5小题,共28分
13、化学与人类生活息息相关。
(1)洗洁精可以洗去餐具上的油污,是因为洗洁精在水中对油污有 作用。
(2)要使块状冰糖加速溶解,通常先将冰糖 (填操作),再放入热水中搅拌。
(3)铝制品在空气中不易锈蚀,是因为其表面易生成致密的 (填化学式)膜。
(4)碘酒可用于医疗消毒,碘酒中的溶剂是 (填名称)。
(5)食盐水能导电,原因是食盐水中存在大量能自由移动的 (填微粒符号)。
14、研究溶液对于生产、生活有重要意义。表1是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ 0 20 40 60 80
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4
KNO3 13.3 31.6 63.9 110 169
(1)20℃时,NaCl的溶解度 (填“>”或“<”)KNO3的溶解度。
(2)“40℃时,KNO3的溶解度为63.9g。”这句话的含义是 。
(3)60℃时,将100g KNO3放入100g水中,充分溶解后,形成的是60℃时KNO3的 (填“饱和”或“不饱和”)溶液。
(4)若要从硝酸钾和少量氯化钠的混合物中提纯硝酸钾,应采用 (填“降温”或“蒸发”)结晶法。
15、卓筒井手工制盐的工艺流程包括下面五个步骤。
①“Ⅱ汲卤”获得卤水为悬浊液,溶液部分中氯化钠的浓度为7%,下表是氯化钠在不同温度时的溶解度。
温度(℃) 20 40 60 80
氯化钠的溶解度(g/100g水) 36.0 36.6 37.3 38.4
根据表中数据可得出:20℃时,氯化钠溶解度为 ,该卤水的溶液部分是氯化钠的 (选填“饱和”或“不饱和”)溶液。
②“Ⅲ滤卤”与实验操作过滤的原理一样其目的是为了分离溶液和 。
③“Ⅳ煎盐”用井中产生的天然气作为燃料,加热卤水,除去其中的溶剂,CH4燃烧的化学方程式是 ,该步骤和实验操作 (选填“降温结晶”或“蒸发结晶”)的原理相似。
④当地人利用工具将卤水在室外风吹日晒一段时间后,浓度可提高至约17%,该步骤称为“晒卤”,应位于步骤 (选填“Ⅱ”、“Ⅲ”或“Ⅳ”)之后,请比较卓筒井手工制盐中“晒卤”和“煎盐”,两者的原理有何相似之处和不同之处 。
16、农业上常用质量分数为16%的氯化钠溶液进行选种。现需要配制80g溶质质量分数为16%的氯化钠溶液,请按要求回答下列问题:
(1)该实验正确的操作顺序是 (填序号)。
A.①②③④⑤ B.④⑤①②③ C.④⑤②①③ D.④①⑤②③
(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠 g,量取所用的水最好选用
规格的量筒(填序号)(已知:ρ水=1.0g/mL)。
A.100mL B.50mL C.10mL
(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,应 (填序号)。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母 D.减少砝码
(4)溶解时,将水倒入盛氯化钠的烧杯中,用玻璃棒进行搅拌,其目的是 。
(5)将配制好的溶液装瓶并贴上标签。小明同学贴标签有不妥之处,如图所示,请在右侧的空白标签上填写正确内容。
(6)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是 (填序号)。
A.用量筒量取水时俯视读数
B.往烧杯中倾倒量取好的蒸馏水时,少量水溅出
C.所用氯化钠晶体未充分干燥
D.转移已称好的氯化钠固体时,部分洒落在烧杯外
17、实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。请回答:
(1)反应生成氧气的质量为 g;
(2)参加反应过氧化氢溶液的质量分数是多少?
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、B 2、D 3、C 4、D 5、B 6、D 7、B 8、B 9、A 10、D
11、B 12、C
二、本大题包括5小题,共28分
13、答案:(1)乳化。
(2)研磨。
(3)Al2O3。
(4)酒精。
(5)Na+、Cl-。
14、答案:(1)>;
(2)40℃时,KNO3在100g水中达到饱和状态时溶解的质量为63.9g或40℃时,100g水中最多可溶KNO3质量为63.9g;
(3)不饱和;
(4)降温。
15、答案:①36.0g;不饱和;
②不溶性杂质;
③CH4+2O2CO2+2H2O;蒸发结晶;
④Ⅱ;“晒卤”和“煎盐”都是将水蒸发;“晒卤”增大了溶质的质量分数,蒸发结晶利用溶剂的蒸发得到了晶体。
16、答案:(1)B;
(2)12.8;A;
(3)A;
(4)加速溶解;
(5);
(6)CD。
17、解:(1)根据质量守恒定律,反应产生氧气的质量=70g-68.4g=1.6g
(2)设产生1.6g氧气需要H2O2的质量为x
2H2O22H2O+O2↑
68 32
x 1.6g
解得:x=3.4g
所用过氧化氢溶液的溶质质量分数:
答:参加反应过氧化氢溶液的质量分数是5%。
同课章节目录
