第九单元溶液题测试题—2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液题测试题—2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 181.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-10 21:27:18 | ||
图片预览



文档简介
第九单元《溶液》测试题
一、单选题
1.把少量下列物质分别放入水中,充分搅拌后,不能得到溶液的是
A.蔗糖 B.酒精 C.汽油 D.氯化钠
2.“类推”是学习化学过程中常用的思推方法,现有以下类推结果,其中正确的是
A.分解反应有多种物质生成,所以有多种物质生成的一定是分解反应
B.单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质
C.金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2
D.衣服上的油污可以用加入洗涤剂的水洗掉,是乳化作用,所以用汽油溶解油脂也是乳化作用
3.从化学的角度对下列词句进行解释,错误的是
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
4.下列各组中的两种物质混合,充分搅拌后,不能得到溶液的是
A.碘和汽油 B.碘和酒精
C.高锰酸钾和汽油 D.高锰酸钾和水
5.下列物质不能溶于水形成溶液的是
A.花生油 B.蔗糖 C.食盐 D.味精
6.下列关于溶液的说法正确的是
A.只有水能作为溶剂 B.饱和溶液不能再溶解任何物质
C.溶液是均一的、稳定的混合物 D.溶液中溶剂质量大于溶质质量
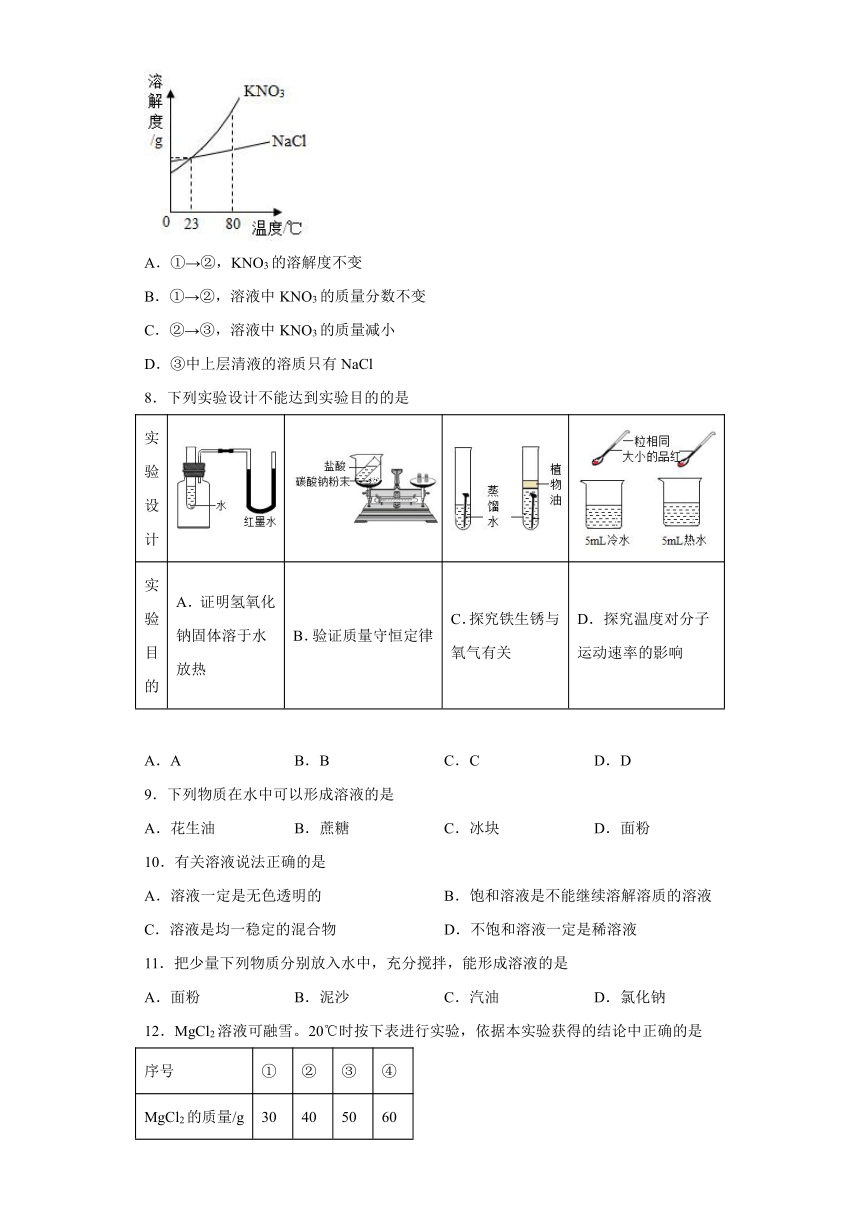
7.提纯含少量NaCl杂质的KNO3,部分实验过程如下,相关物质的溶解度曲线如图所示。下列说法正确的是
A.①→②,KNO3的溶解度不变
B.①→②,溶液中KNO3的质量分数不变
C.②→③,溶液中KNO3的质量减小
D.③中上层清液的溶质只有NaCl
8.下列实验设计不能达到实验目的的是
实验设计
实验目的 A.证明氢氧化钠固体溶于水放热 B.验证质量守恒定律 C.探究铁生锈与氧气有关 D.探究温度对分子运动速率的影响
A.A B.B C.C D.D
9.下列物质在水中可以形成溶液的是
A.花生油 B.蔗糖 C.冰块 D.面粉
10.有关溶液说法正确的是
A.溶液一定是无色透明的 B.饱和溶液是不能继续溶解溶质的溶液
C.溶液是均一稳定的混合物 D.不饱和溶液一定是稀溶液
11.把少量下列物质分别放入水中,充分搅拌,能形成溶液的是
A.面粉 B.泥沙 C.汽油 D.氯化钠
12.MgCl2溶液可融雪。20℃时按下表进行实验,依据本实验获得的结论中正确的是
序号 ① ② ③ ④
MgCl2的质量/g 30 40 50 60
水的质量/g 100 100 100 100
(已知:20℃时,MgCl2的溶解度为54.6g/100g水)
A.MgCl2的溶解度随温度升高而升高
B.①中MgCl2溶液的浓度为30%
C.影响溶解性的因素可以是固体性质
D.④中再加10g水可使MgCl2全部溶解
13.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 除去水中的异味和色素 用活性炭吸附
B 鉴别硬水和软水 取样,分别加入肥皂水,振荡
C 除去粗盐中的难溶性杂质 溶解,蒸发,结晶
D 探究分子之间有空隙 将水、酒精各50mL倒入100mL量筒中
A.A B.B C.C D.D
14.在去瓤的新鲜冬瓜内倒入100g饱和的氯化钠溶液,常温下经过一段时间,同学们绘制成了如图所示的函数图像,横坐标表示时间,纵坐标可表示(不考虑水的蒸发现象)。
(1)溶质质量分数;(2)溶液的密度;(3)溶解度;(4)溶剂的质量;(5)溶液的体积
A.(1)(2)(3) B.(3)(4)(5) C.(1)(2) D.(2)(5)
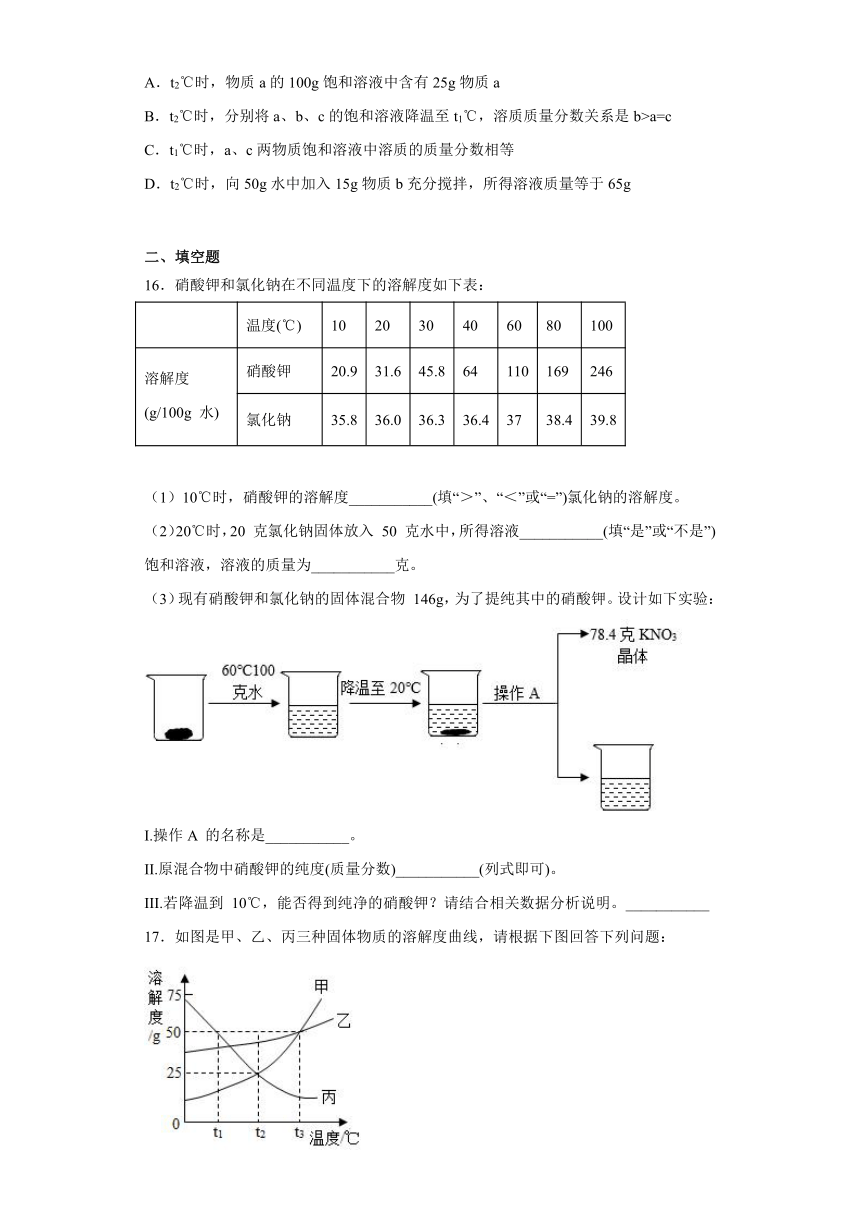
15.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时,a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时,向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
二、填空题
16.硝酸钾和氯化钠在不同温度下的溶解度如下表:
温度(℃) 10 20 30 40 60 80 100
溶解度 (g/100g 水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36.0 36.3 36.4 37 38.4 39.8
(1)10℃时,硝酸钾的溶解度___________(填“>”、“<”或“=”)氯化钠的溶解度。
(2)20℃时,20 克氯化钠固体放入 50 克水中,所得溶液___________(填“是”或“不是”)饱和溶液,溶液的质量为___________克。
(3)现有硝酸钾和氯化钠的固体混合物 146g,为了提纯其中的硝酸钾。设计如下实验:
I.操作A 的名称是___________。
II.原混合物中硝酸钾的纯度(质量分数)___________(列式即可)。
III.若降温到 10℃,能否得到纯净的硝酸钾?请结合相关数据分析说明。___________
17.如图是甲、乙、丙三种固体物质的溶解度曲线,请根据下图回答下列问题:
(1)t2℃时甲物质的溶解度是___________;
(2)t3℃时,在50g水中至少加入___________g乙物质才能形成饱和溶液。
(3)丙物质的不饱和溶液想变成饱和溶液,可行的方法是___________。(答一点即可)
(4)将t2℃时甲、乙、丙三种物质的饱和溶液分别升温到t3℃(忽略水的蒸发),所得溶液溶质质量分数由大到小的顺序是___________。
18.2020年9月,中国向世界宜布了2030年前实现“碳达峰”、2060年前实现“碳中和”的目标。
(1)实现“碳中和”,能源转型首当其冲,氢能是绿色能源,光伏发电可为电解水制氢气提供电能,电解水的化学方程式为______。光伏发电用到的高纯硅可用SiO2制取,SiO2中Si元素的化合价为______。
(2)CO2的捕获与封存也是实现膜中和的重要途径,有科学家提出设想:将排放到空气中的二氧化碳液化后压入到冰冷的深海中进行封存,二氧化碳在深海中溶解度比在通常状况下水中的溶解度______(填“大”、“小”或“不变”),原因是______。
(3)CO2若合理利用,也是一种重要原料。CO2与H2在催化条件下能反应生成甲醇(CH4O),反应的化学方程式为,X的化学式为______,CH4O由______种不同元素组成,1molCH4O中约含______个碳原子。
19.水与溶液对于生产、生活有着重要意义。
(1)家庭生活中常用净水器,净水器滤芯中可用____________去除水中杂质。
(2)在水中加入洗涤剂可以除去衣物上的油污,这是利用了洗涤剂的__________作用。
(3)下表是碳酸钠的部分溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
①由表中数据可知,碳酸钠属于____________物质(“易溶”“可溶”“微溶”或“难溶”)
②小东同学进行了如下图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入________g碳酸钠;升温至60℃时,烧杯④中会出现的现象是______。
③20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是______(填字母序号),该物质形成的溶液中存在的微粒有_______。
A.氢氧化钠 B.碳酸钙 C.硝酸铵 D.氯化钠
(4)现有 两个反应,其反应规律和金属与金属化合物溶液的置换反应类似,则Br2、C12、12三种非金属活动性顺序由大到小为_____。
三、推断题
20.已知A、B、C、D、E都是初中常见的物质,且 A、B、C、D、E都含有一种相同元素,B、E为黑色固体。A和B混合生成C和D,且B在反应前后不发生改变;E在C中燃烧放出大量的热,生成的气体可使澄清石灰水变浑浊。请推断:
(1)写出D的化学式 ;
(2)写出C与E反应的文字表达式(或符号表达式): ;写出D转化为C的文字表达式(或符号表达式): ;
(3)A物质可发生分解反应,其微观示意图如下,请在方框内画出丙的微粒图示。
(4)按下图装置进行实验(气密性良好),将液体滴入瓶中,关闭活塞。请根据表中现象,写出符合要求的物质,并从上述物质中选择。
现象
物质
气球变鼓,一段时间后不恢复原状
固体
液体
21.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
四、实验题
22.以下是初中化学学习过程中的基本实验,请回答下列问题。
(1)实验Ⅰ,该实验的目的是__________;
(2)实验Ⅱ,过滤操作后,滤液仍浑浊的原因可能是__________(写一种即可);
(3)实验Ⅲ,水的作用是________(选填字母编号)
A.作反应物 B.隔绝空气 C.提供热量
(4)实验Ⅳ,称量一定质量氯化钠的过程中,若发现天平指针偏右,此时应该________(填字母编号),至指针指向标尺中央。
A.调节游码和砝码 B.调节平衡螺母 C.减少氯化钠固体 D.增加氯化钠固体
23.请根据图一、二、三、四中所示实验回答下列问题:
(1)若用图一装置来收集氧气,应从___________导管(填a、b)通入气体。
(2)图二电解水的实验中,___________管(填A、B)内所收集的气体是氢气;该实验中,常会在水中放少量硫酸或氢氧化钠,其目的是___________。
(3)在某温度下把相同质量的甲、乙两物质分别放入相同质量的水中,溶解情况如图三所示,请问:质量分数较大的是___________(甲或乙)的溶液。
(4)根据图四所示实验,滴管中的水挤入小试管后,请你推测U形管中___________端液面(填“a”或“b”)会下降。
五、计算题
24.根据所学知识回答下列问题:
(1)要配置质量分数为4%的氯化钠溶液100g来选种,需要氯化钠的质量为___________,水的质量为___________。
(2)如果对100g 4%的NaCl溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解。以下各题要求写出计算过程,结果精确到0.1%)
①蒸发10g水,所得溶液的溶质质量分数是多少?___________
②增加5g氯化钠后,所得溶液的溶质质量分数是多少?___________
③增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?___________
25.现在 70g20%的硫酸铵溶液,试计算下列问题。
(1)若向上述溶液中加入 30g 水,求所得溶液中溶质的质量分数?
(2)若向上述溶液中加入10g 硫酸铵,完全溶解,求所得溶液中硫酸铵的质量分数?
参考答案
1.C 2.B 3.A 4.C 5.A 6.C 7.C 8.B 9.B 10.C 11.D 12.D 13.C 14.C 15.C
16.(1)<
(2) 是 68
(3) 过滤 ×100% 否,10℃时氯化钠的溶解度为35.8g,降温至10℃时,溶液中36g氯化钠会有部分氯化钠与硝酸钾一起结晶析出,则得到的硝酸钾晶体中混有氯化钠
17.(1)25g
(2)25g
(3)升高温度(或加入丙物质等)
(4)乙>甲>丙
18.(1) +4
(2) 大 温度越低,压强越大,气体的溶解度增大
(3) H2O 3三 6.02×1023
19.(1)活性炭
(2)乳化
(3) 易溶 1.8 有晶(固)体或有粉末析出 A Na+、OH-、H2O
(4)Cl2>Br2>I2
20.(1)H2O
(2)碳+氧气二氧化碳 水氢气+氧气
(3)
(4)
现象
物质
气球变鼓,一段时间后不恢复原状
固体
二氧化锰
液体
过氧化氢
21.75 a>b>c
22.(1)测定空气里氧气含量
(2)滤纸破损、液面高于滤纸边缘
(3)BC
(4)D
23.(1)a
(2) A 增强水的导电性
(3)乙
(4)a
24.(1) 4g 96g
(2) 蒸发10g水后,溶质的质量分数为:100%≈4.4% 增加5g氯化钠后溶质的质量分数为:100%≈8.6% 增加5g氯化钠和5g水后,溶质的质量分数为:100%≈8.2%
25.(1)14%
(2)30%
一、单选题
1.把少量下列物质分别放入水中,充分搅拌后,不能得到溶液的是
A.蔗糖 B.酒精 C.汽油 D.氯化钠
2.“类推”是学习化学过程中常用的思推方法,现有以下类推结果,其中正确的是
A.分解反应有多种物质生成,所以有多种物质生成的一定是分解反应
B.单质是由同种元素组成的纯净物,所以由同种元素组成的纯净物一定是单质
C.金属铝与盐酸反应生成AlCl3和H2,所以金属铁与盐酸反应生成FeCl3和H2
D.衣服上的油污可以用加入洗涤剂的水洗掉,是乳化作用,所以用汽油溶解油脂也是乳化作用
3.从化学的角度对下列词句进行解释,错误的是
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
4.下列各组中的两种物质混合,充分搅拌后,不能得到溶液的是
A.碘和汽油 B.碘和酒精
C.高锰酸钾和汽油 D.高锰酸钾和水
5.下列物质不能溶于水形成溶液的是
A.花生油 B.蔗糖 C.食盐 D.味精
6.下列关于溶液的说法正确的是
A.只有水能作为溶剂 B.饱和溶液不能再溶解任何物质
C.溶液是均一的、稳定的混合物 D.溶液中溶剂质量大于溶质质量
7.提纯含少量NaCl杂质的KNO3,部分实验过程如下,相关物质的溶解度曲线如图所示。下列说法正确的是
A.①→②,KNO3的溶解度不变
B.①→②,溶液中KNO3的质量分数不变
C.②→③,溶液中KNO3的质量减小
D.③中上层清液的溶质只有NaCl
8.下列实验设计不能达到实验目的的是
实验设计
实验目的 A.证明氢氧化钠固体溶于水放热 B.验证质量守恒定律 C.探究铁生锈与氧气有关 D.探究温度对分子运动速率的影响
A.A B.B C.C D.D
9.下列物质在水中可以形成溶液的是
A.花生油 B.蔗糖 C.冰块 D.面粉
10.有关溶液说法正确的是
A.溶液一定是无色透明的 B.饱和溶液是不能继续溶解溶质的溶液
C.溶液是均一稳定的混合物 D.不饱和溶液一定是稀溶液
11.把少量下列物质分别放入水中,充分搅拌,能形成溶液的是
A.面粉 B.泥沙 C.汽油 D.氯化钠
12.MgCl2溶液可融雪。20℃时按下表进行实验,依据本实验获得的结论中正确的是
序号 ① ② ③ ④
MgCl2的质量/g 30 40 50 60
水的质量/g 100 100 100 100
(已知:20℃时,MgCl2的溶解度为54.6g/100g水)
A.MgCl2的溶解度随温度升高而升高
B.①中MgCl2溶液的浓度为30%
C.影响溶解性的因素可以是固体性质
D.④中再加10g水可使MgCl2全部溶解
13.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 除去水中的异味和色素 用活性炭吸附
B 鉴别硬水和软水 取样,分别加入肥皂水,振荡
C 除去粗盐中的难溶性杂质 溶解,蒸发,结晶
D 探究分子之间有空隙 将水、酒精各50mL倒入100mL量筒中
A.A B.B C.C D.D
14.在去瓤的新鲜冬瓜内倒入100g饱和的氯化钠溶液,常温下经过一段时间,同学们绘制成了如图所示的函数图像,横坐标表示时间,纵坐标可表示(不考虑水的蒸发现象)。
(1)溶质质量分数;(2)溶液的密度;(3)溶解度;(4)溶剂的质量;(5)溶液的体积
A.(1)(2)(3) B.(3)(4)(5) C.(1)(2) D.(2)(5)
15.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是
A.t2℃时,物质a的100g饱和溶液中含有25g物质a
B.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a=c
C.t1℃时,a、c两物质饱和溶液中溶质的质量分数相等
D.t2℃时,向50g水中加入15g物质b充分搅拌,所得溶液质量等于65g
二、填空题
16.硝酸钾和氯化钠在不同温度下的溶解度如下表:
温度(℃) 10 20 30 40 60 80 100
溶解度 (g/100g 水) 硝酸钾 20.9 31.6 45.8 64 110 169 246
氯化钠 35.8 36.0 36.3 36.4 37 38.4 39.8
(1)10℃时,硝酸钾的溶解度___________(填“>”、“<”或“=”)氯化钠的溶解度。
(2)20℃时,20 克氯化钠固体放入 50 克水中,所得溶液___________(填“是”或“不是”)饱和溶液,溶液的质量为___________克。
(3)现有硝酸钾和氯化钠的固体混合物 146g,为了提纯其中的硝酸钾。设计如下实验:
I.操作A 的名称是___________。
II.原混合物中硝酸钾的纯度(质量分数)___________(列式即可)。
III.若降温到 10℃,能否得到纯净的硝酸钾?请结合相关数据分析说明。___________
17.如图是甲、乙、丙三种固体物质的溶解度曲线,请根据下图回答下列问题:
(1)t2℃时甲物质的溶解度是___________;
(2)t3℃时,在50g水中至少加入___________g乙物质才能形成饱和溶液。
(3)丙物质的不饱和溶液想变成饱和溶液,可行的方法是___________。(答一点即可)
(4)将t2℃时甲、乙、丙三种物质的饱和溶液分别升温到t3℃(忽略水的蒸发),所得溶液溶质质量分数由大到小的顺序是___________。
18.2020年9月,中国向世界宜布了2030年前实现“碳达峰”、2060年前实现“碳中和”的目标。
(1)实现“碳中和”,能源转型首当其冲,氢能是绿色能源,光伏发电可为电解水制氢气提供电能,电解水的化学方程式为______。光伏发电用到的高纯硅可用SiO2制取,SiO2中Si元素的化合价为______。
(2)CO2的捕获与封存也是实现膜中和的重要途径,有科学家提出设想:将排放到空气中的二氧化碳液化后压入到冰冷的深海中进行封存,二氧化碳在深海中溶解度比在通常状况下水中的溶解度______(填“大”、“小”或“不变”),原因是______。
(3)CO2若合理利用,也是一种重要原料。CO2与H2在催化条件下能反应生成甲醇(CH4O),反应的化学方程式为,X的化学式为______,CH4O由______种不同元素组成,1molCH4O中约含______个碳原子。
19.水与溶液对于生产、生活有着重要意义。
(1)家庭生活中常用净水器,净水器滤芯中可用____________去除水中杂质。
(2)在水中加入洗涤剂可以除去衣物上的油污,这是利用了洗涤剂的__________作用。
(3)下表是碳酸钠的部分溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
①由表中数据可知,碳酸钠属于____________物质(“易溶”“可溶”“微溶”或“难溶”)
②小东同学进行了如下图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入________g碳酸钠;升温至60℃时,烧杯④中会出现的现象是______。
③20℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是______(填字母序号),该物质形成的溶液中存在的微粒有_______。
A.氢氧化钠 B.碳酸钙 C.硝酸铵 D.氯化钠
(4)现有 两个反应,其反应规律和金属与金属化合物溶液的置换反应类似,则Br2、C12、12三种非金属活动性顺序由大到小为_____。
三、推断题
20.已知A、B、C、D、E都是初中常见的物质,且 A、B、C、D、E都含有一种相同元素,B、E为黑色固体。A和B混合生成C和D,且B在反应前后不发生改变;E在C中燃烧放出大量的热,生成的气体可使澄清石灰水变浑浊。请推断:
(1)写出D的化学式 ;
(2)写出C与E反应的文字表达式(或符号表达式): ;写出D转化为C的文字表达式(或符号表达式): ;
(3)A物质可发生分解反应,其微观示意图如下,请在方框内画出丙的微粒图示。
(4)按下图装置进行实验(气密性良好),将液体滴入瓶中,关闭活塞。请根据表中现象,写出符合要求的物质,并从上述物质中选择。
现象
物质
气球变鼓,一段时间后不恢复原状
固体
液体
21.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
四、实验题
22.以下是初中化学学习过程中的基本实验,请回答下列问题。
(1)实验Ⅰ,该实验的目的是__________;
(2)实验Ⅱ,过滤操作后,滤液仍浑浊的原因可能是__________(写一种即可);
(3)实验Ⅲ,水的作用是________(选填字母编号)
A.作反应物 B.隔绝空气 C.提供热量
(4)实验Ⅳ,称量一定质量氯化钠的过程中,若发现天平指针偏右,此时应该________(填字母编号),至指针指向标尺中央。
A.调节游码和砝码 B.调节平衡螺母 C.减少氯化钠固体 D.增加氯化钠固体
23.请根据图一、二、三、四中所示实验回答下列问题:
(1)若用图一装置来收集氧气,应从___________导管(填a、b)通入气体。
(2)图二电解水的实验中,___________管(填A、B)内所收集的气体是氢气;该实验中,常会在水中放少量硫酸或氢氧化钠,其目的是___________。
(3)在某温度下把相同质量的甲、乙两物质分别放入相同质量的水中,溶解情况如图三所示,请问:质量分数较大的是___________(甲或乙)的溶液。
(4)根据图四所示实验,滴管中的水挤入小试管后,请你推测U形管中___________端液面(填“a”或“b”)会下降。
五、计算题
24.根据所学知识回答下列问题:
(1)要配置质量分数为4%的氯化钠溶液100g来选种,需要氯化钠的质量为___________,水的质量为___________。
(2)如果对100g 4%的NaCl溶液进行如下处理,求所得溶液中溶质质量分数。(假设每次增加的溶质皆完全溶解。以下各题要求写出计算过程,结果精确到0.1%)
①蒸发10g水,所得溶液的溶质质量分数是多少?___________
②增加5g氯化钠后,所得溶液的溶质质量分数是多少?___________
③增加5g氯化钠和5g水后,所得溶液的溶质质量分数是多少?___________
25.现在 70g20%的硫酸铵溶液,试计算下列问题。
(1)若向上述溶液中加入 30g 水,求所得溶液中溶质的质量分数?
(2)若向上述溶液中加入10g 硫酸铵,完全溶解,求所得溶液中硫酸铵的质量分数?
参考答案
1.C 2.B 3.A 4.C 5.A 6.C 7.C 8.B 9.B 10.C 11.D 12.D 13.C 14.C 15.C
16.(1)<
(2) 是 68
(3) 过滤 ×100% 否,10℃时氯化钠的溶解度为35.8g,降温至10℃时,溶液中36g氯化钠会有部分氯化钠与硝酸钾一起结晶析出,则得到的硝酸钾晶体中混有氯化钠
17.(1)25g
(2)25g
(3)升高温度(或加入丙物质等)
(4)乙>甲>丙
18.(1) +4
(2) 大 温度越低,压强越大,气体的溶解度增大
(3) H2O 3三 6.02×1023
19.(1)活性炭
(2)乳化
(3) 易溶 1.8 有晶(固)体或有粉末析出 A Na+、OH-、H2O
(4)Cl2>Br2>I2
20.(1)H2O
(2)碳+氧气二氧化碳 水氢气+氧气
(3)
(4)
现象
物质
气球变鼓,一段时间后不恢复原状
固体
二氧化锰
液体
过氧化氢
21.75 a>b>c
22.(1)测定空气里氧气含量
(2)滤纸破损、液面高于滤纸边缘
(3)BC
(4)D
23.(1)a
(2) A 增强水的导电性
(3)乙
(4)a
24.(1) 4g 96g
(2) 蒸发10g水后,溶质的质量分数为:100%≈4.4% 增加5g氯化钠后溶质的质量分数为:100%≈8.6% 增加5g氯化钠和5g水后,溶质的质量分数为:100%≈8.2%
25.(1)14%
(2)30%
同课章节目录
