第九单元溶液测试题—2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液测试题—2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 221.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-10 21:58:01 | ||
图片预览


文档简介
第九单元《溶液》测试题
一、单选题
1.下列有关溶液的说法正确的是
A.溶液一定是无色透明的液体 B.溶液一定是混合物
C.碘酒溶液中,溶质是乙醇 D.溶液中的溶质一定只有一种
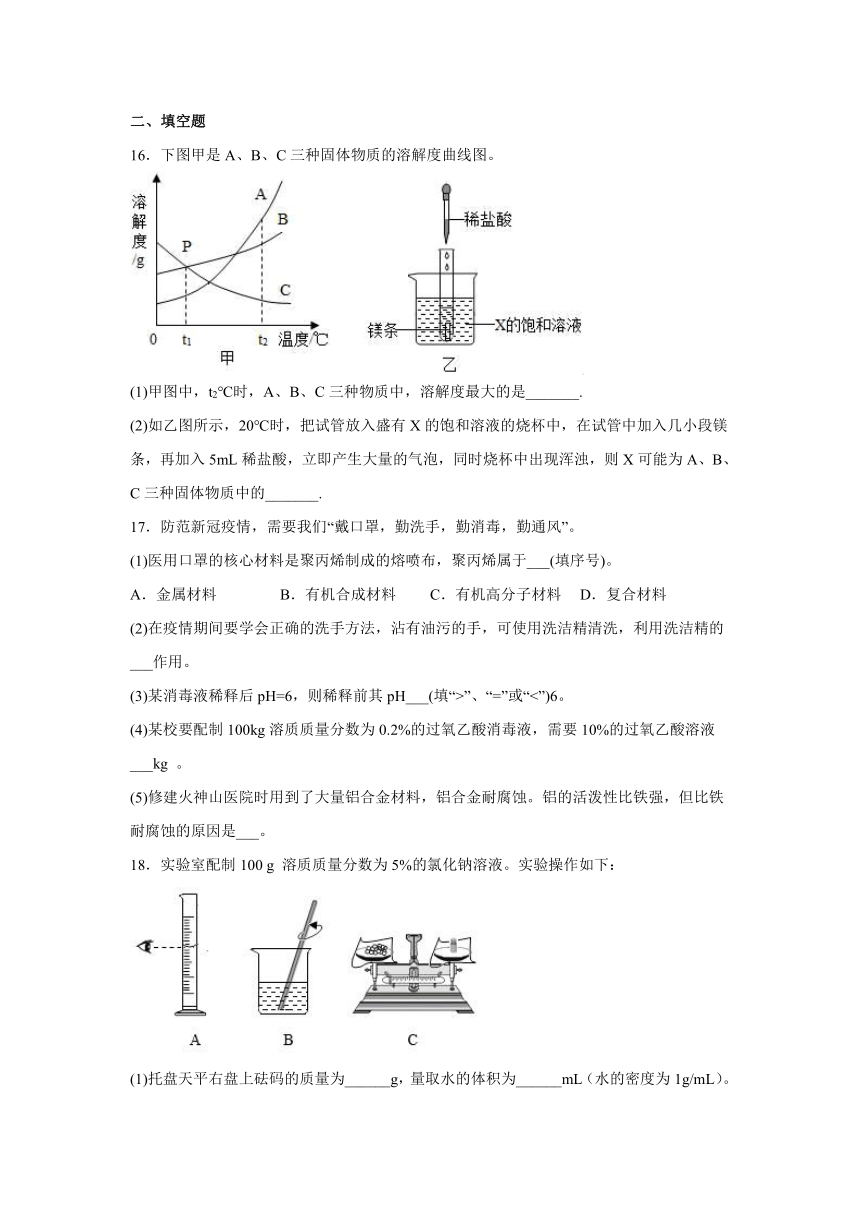
2.下列有关溶液的叙述错误的是
A.溶液都是混合物 B.溶液加水稀释前后溶质的质量不变
C.均一、稳定的液体一定是溶液 D.溶液是由两种或两种以上物质组成的
3.下列有关物质的分类说法正确的是
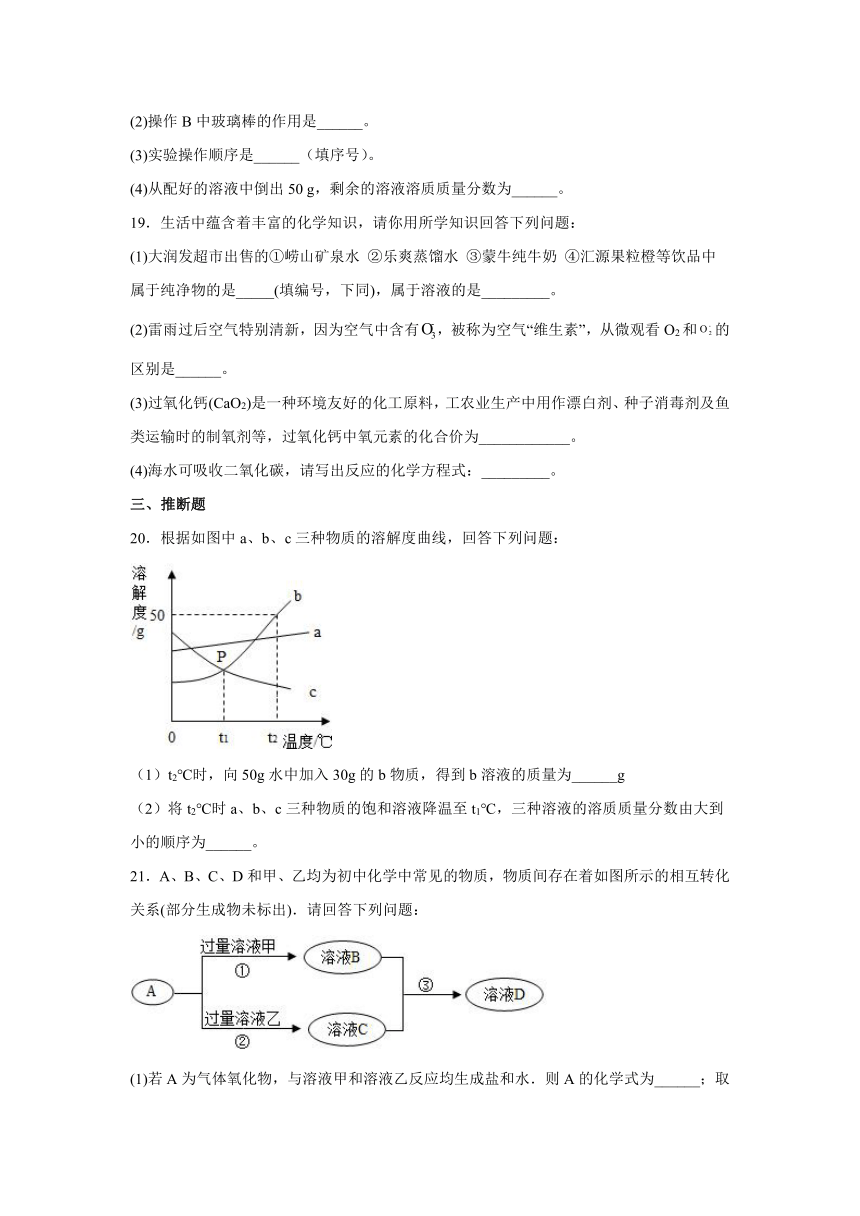
A.生铁属于单质 B.石灰水、矿泉水均属于溶液
C.高锰酸钾属于氧化物 D.四氧化三铁属于金属材料
4.下列化学知识整理完全正确的一组是
A.化学中的概念 B.化学与能源
①氧化物:含有氧元素的化合物 ②溶液:均一稳定的混合物 ①清洁能源:氢能、风能、太阳能 ②不可再生能源:煤、石油、天然气
C.化学中的顺序 D.化学与安全
①地壳中元素含量由高到低:O、Al、Si ②氯元素的化合价由高到低:HClO、Cl2、HCl ①电器着火,不能用水灭火 ②室内煤气泄露,立即打开排气扇
A.A B.B C.C D.D
5.下列物质分别加入适量水中充分搅拌,能得到溶液的是
A.粉笔灰 B.植物油 C.蔗糖 D.面粉
6.下列饮料中,不属于溶液的是
A.矿泉水 B.苏打水 C.盐汽水 D.果粒橙
7.下列物质分散在水中,能形成溶液的是
A.面粉 B.酒精 C.食用油 D.冰块
8.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A. 证明集气瓶中已集满CO2 将燃着的木条放在集气瓶口
B. 除去CuO中的少量铁粉 用磁铁吸引
C. 除去CO2中少量的CO 将混合气体通过灼热的碳层
D. 鉴别硝酸铵和氢氧化钠 取样,分别溶解在水中,比较溶液温度
A.A B.B C.C D.D
9.下列说法不正确的是
A.不饱和溶液变为饱和溶液,溶质质量分数一定变大
B.在同一化合物中,金属元素显正价,非金属元素不一定显负价
C.同种元素的原子和离子具有相同的质子数
D.由一种元素组成的物质可能是单质,一定不是化合物
10.下列说法正确的是
A.饱和溶液一定不能再溶解任何物质
B.降低温度一定能使不饱和溶液变为饱和溶液
C.利用洗洁精的乳化作用,可洗去餐具上的油污
D.硝酸钾的饱和溶液恒温蒸发部分水后,剩余溶液溶质质量分数增大
11.归纳推理是学习化学的重要方法之一。下列有关事实的推理、结论合理的是
A.煤粉比煤块燃烧更剧烈,说明可燃物与氧气接触面积越大,燃烧越剧烈
B.溶液是均一、稳定的,所以均一、稳定的液体一定是溶液
C.金刚石和石墨均是由碳元素组成的单质,所以金刚石和石墨的转化属于物理变化
D.洗洁精有乳化作用可以除去油污,所以汽油除去油污也是利用了乳化作用
12.下列说法不正确的是
A.原子概念中的“最小”是指原子在化学变化中不可再分
B.饱和溶液有可能是浓溶液,也可能是稀溶液
C.催化剂在化学反应前后本身的质量和化学性质都没有发生改变的物质
D.合金是指有两种或两种以上的金属通过一定的化学变化而合成的物质
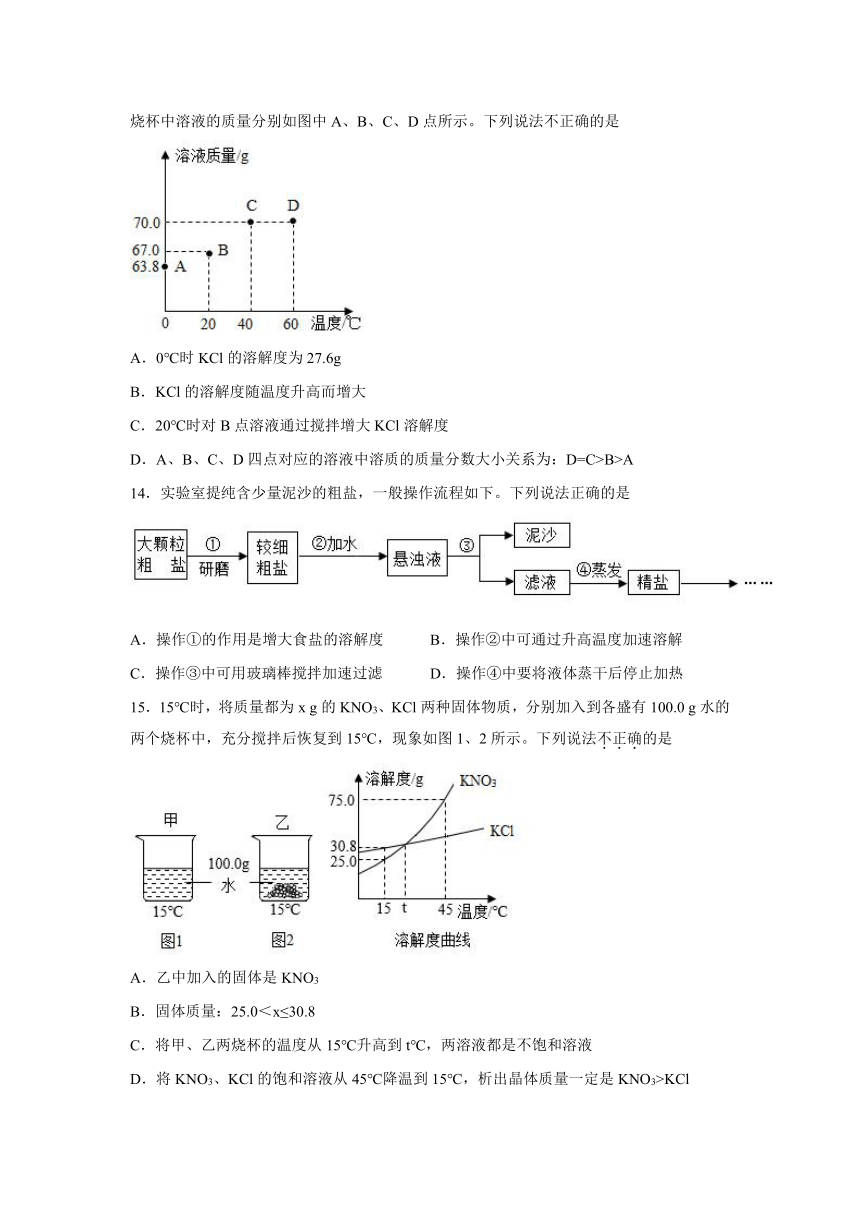
13.将20g固体物质KCl投入盛有50g水的烧杯中,搅拌,测得0℃、20℃、40℃、60℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。下列说法不正确的是
A.0℃时KCl的溶解度为27.6g
B.KCl的溶解度随温度升高而增大
C.20℃时对B点溶液通过搅拌增大KCl溶解度
D.A、B、C、D四点对应的溶液中溶质的质量分数大小关系为:D=C>B>A
14.实验室提纯含少量泥沙的粗盐,一般操作流程如下。下列说法正确的是
A.操作①的作用是增大食盐的溶解度 B.操作②中可通过升高温度加速溶解
C.操作③中可用玻璃棒搅拌加速过滤 D.操作④中要将液体蒸干后停止加热
15.15℃时,将质量都为x g的KNO3、KCl两种固体物质,分别加入到各盛有100.0 g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是
A.乙中加入的固体是KNO3
B.固体质量:25.0<x≤30.8
C.将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
D.将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
二、填空题
16.下图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是_______.
(2)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的_______.
17.防范新冠疫情,需要我们“戴口罩,勤洗手,勤消毒,勤通风”。
(1)医用口罩的核心材料是聚丙烯制成的熔喷布,聚丙烯属于___(填序号)。
A.金属材料 B.有机合成材料 C.有机高分子材料 D.复合材料
(2)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,利用洗洁精的___作用。
(3)某消毒液稀释后pH=6,则稀释前其pH___(填“>”、“=”或“<”)6。
(4)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液___kg 。
(5)修建火神山医院时用到了大量铝合金材料,铝合金耐腐蚀。铝的活泼性比铁强,但比铁耐腐蚀的原因是___。
18.实验室配制100 g 溶质质量分数为5%的氯化钠溶液。实验操作如下:
(1)托盘天平右盘上砝码的质量为______g,量取水的体积为______mL(水的密度为1g/mL)。
(2)操作B中玻璃棒的作用是______。
(3)实验操作顺序是______(填序号)。
(4)从配好的溶液中倒出50 g,剩余的溶液溶质质量分数为______。
19.生活中蕴含着丰富的化学知识,请你用所学知识回答下列问题:
(1)大润发超市出售的①崂山矿泉水 ②乐爽蒸馏水 ③蒙牛纯牛奶 ④汇源果粒橙等饮品中属于纯净物的是_____(填编号,下同),属于溶液的是_________。
(2)雷雨过后空气特别清新,因为空气中含有,被称为空气“维生素”,从微观看O2和的区别是______。
(3)过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等,过氧化钙中氧元素的化合价为____________。
(4)海水可吸收二氧化碳,请写出反应的化学方程式:_________。
三、推断题
20.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
21.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
四、实验题
22.在农业上,KNO3 常用于配制无土栽培的营养液。
(1)试计算:
①KNO3 中氮、氧两种元素的质量比为 ___________(最简整数比);
②KNO3中氮元素的质量分数为___________。(计算结果精确到 0.1%)
(2)以下是某校实验小组实验室配制一定溶质质量分数的 100g16%硝酸钾溶液请回答:
①需要水的体积为 ___________ mL;配制时应选择___________(填 10、50 或 100)mL 的量筒量取所需要的水。其中玻璃棒在此操作中的作用是___________。
②下列操作会导致所配的溶液溶质质量分数偏低的是___________ 。
A.硝酸钾固体中含有不溶于水的杂质
B.烧杯内有水
C.用量筒取水的体积时采用仰视的方法读数
D.把配好的溶液倒入试剂瓶时有部分溅出
③将上述溶液稀释成 8%的硝酸钾溶液,需要加入水的质量为___________克。
(3)如图所示,将水滴入装有氢氧化钠固体的试管中,关于烧杯中溶液说法正确的是___________
A.溶质质量不变 B.溶剂质量减少
C.溶液质量增加 D.溶质质量分数减少
23.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制 50g 6%的氯化钠溶液。回答下列问题:
(1)如图中操作有错误的是______(填数字序号)。
(2)粗盐提纯的步骤是(填名称): 溶解、______、______。
(3)操作⑥中,玻璃棒的作用是______,当观察到______时,停止加热。
(4)下列操作会使产率偏低的是______。
A.粗盐没有完全溶解 B.蒸发时有溶液溅出 C.蒸发时未完全蒸干
(5)用提纯得到的精盐配制 50g 6%的氯化钠溶液,需要氯化钠______g,蒸馏水______mL。
(6)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会______6%(填“>”“<”或“=”)。
五、计算题
24.某化工厂排放的废水中含有碳酸钾和氯化钾,十五中化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于容器中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如图。请计算:
【提示:碳酸钾与硫酸反应的化学方程式为,氯化钾不与酸反应】
(1)生成二氧化碳的质量为_________g。
(2)该废水中碳酸钾的质量分数为多少?(写出计算过程)
(3)反应后生成硫酸钾的质量为多少?
25.请你仔细分析如图所示的实验过程和提供的数据,计算反应后所得溶液中溶质的质量分数是____?
参考答案:
1.B 2.C 3.B 4.B 5.C 6.D 7.B 8.C 9.A 10.C 11.A 12.D 13.C 14.B 15.D 16.(1)A
(2)C
17.(1)BC
(2)乳化(或将油变成成小液滴分散到水中)
(3)<
(4)2
(5)铝易与氧气反应生成致密的氧化铝保护膜(保护内部不再被氧化或腐蚀)
18.(1) 5 95
(2)加速溶解
(3)CAB
(4)5%
19.(1) ② ①
(2)电子数不同
(3)-1
(4)
20. 75 a>b>c
21. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
22.(1) 7∶24
13.9%
(2) 84
100 搅拌,加速溶解 ABC 100
(3)C
23.(1)⑤
(2) 过滤 蒸发
(3) 搅拌,防止液体受热不匀发生飞溅 大部分固体析出
(4)AB
(5) 3 47
(6)<
24.(1)2.2g
(2)设生成2.2g的二氧化碳需碳酸钾的质量为x。
x=6.9g;
废水中碳酸钾的质量分数=。
答:废水中碳酸钾的质量分数13.8%。
(3)设生成2.2g的二氧化碳同时生成硫酸钾的质量为y。
y=8.7g;
答:反应后生成硫酸钾的质量为8.7g。
25.12.7%
一、单选题
1.下列有关溶液的说法正确的是
A.溶液一定是无色透明的液体 B.溶液一定是混合物
C.碘酒溶液中,溶质是乙醇 D.溶液中的溶质一定只有一种
2.下列有关溶液的叙述错误的是
A.溶液都是混合物 B.溶液加水稀释前后溶质的质量不变
C.均一、稳定的液体一定是溶液 D.溶液是由两种或两种以上物质组成的
3.下列有关物质的分类说法正确的是
A.生铁属于单质 B.石灰水、矿泉水均属于溶液
C.高锰酸钾属于氧化物 D.四氧化三铁属于金属材料
4.下列化学知识整理完全正确的一组是
A.化学中的概念 B.化学与能源
①氧化物:含有氧元素的化合物 ②溶液:均一稳定的混合物 ①清洁能源:氢能、风能、太阳能 ②不可再生能源:煤、石油、天然气
C.化学中的顺序 D.化学与安全
①地壳中元素含量由高到低:O、Al、Si ②氯元素的化合价由高到低:HClO、Cl2、HCl ①电器着火,不能用水灭火 ②室内煤气泄露,立即打开排气扇
A.A B.B C.C D.D
5.下列物质分别加入适量水中充分搅拌,能得到溶液的是
A.粉笔灰 B.植物油 C.蔗糖 D.面粉
6.下列饮料中,不属于溶液的是
A.矿泉水 B.苏打水 C.盐汽水 D.果粒橙
7.下列物质分散在水中,能形成溶液的是
A.面粉 B.酒精 C.食用油 D.冰块
8.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A. 证明集气瓶中已集满CO2 将燃着的木条放在集气瓶口
B. 除去CuO中的少量铁粉 用磁铁吸引
C. 除去CO2中少量的CO 将混合气体通过灼热的碳层
D. 鉴别硝酸铵和氢氧化钠 取样,分别溶解在水中,比较溶液温度
A.A B.B C.C D.D
9.下列说法不正确的是
A.不饱和溶液变为饱和溶液,溶质质量分数一定变大
B.在同一化合物中,金属元素显正价,非金属元素不一定显负价
C.同种元素的原子和离子具有相同的质子数
D.由一种元素组成的物质可能是单质,一定不是化合物
10.下列说法正确的是
A.饱和溶液一定不能再溶解任何物质
B.降低温度一定能使不饱和溶液变为饱和溶液
C.利用洗洁精的乳化作用,可洗去餐具上的油污
D.硝酸钾的饱和溶液恒温蒸发部分水后,剩余溶液溶质质量分数增大
11.归纳推理是学习化学的重要方法之一。下列有关事实的推理、结论合理的是
A.煤粉比煤块燃烧更剧烈,说明可燃物与氧气接触面积越大,燃烧越剧烈
B.溶液是均一、稳定的,所以均一、稳定的液体一定是溶液
C.金刚石和石墨均是由碳元素组成的单质,所以金刚石和石墨的转化属于物理变化
D.洗洁精有乳化作用可以除去油污,所以汽油除去油污也是利用了乳化作用
12.下列说法不正确的是
A.原子概念中的“最小”是指原子在化学变化中不可再分
B.饱和溶液有可能是浓溶液,也可能是稀溶液
C.催化剂在化学反应前后本身的质量和化学性质都没有发生改变的物质
D.合金是指有两种或两种以上的金属通过一定的化学变化而合成的物质
13.将20g固体物质KCl投入盛有50g水的烧杯中,搅拌,测得0℃、20℃、40℃、60℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。下列说法不正确的是
A.0℃时KCl的溶解度为27.6g
B.KCl的溶解度随温度升高而增大
C.20℃时对B点溶液通过搅拌增大KCl溶解度
D.A、B、C、D四点对应的溶液中溶质的质量分数大小关系为:D=C>B>A
14.实验室提纯含少量泥沙的粗盐,一般操作流程如下。下列说法正确的是
A.操作①的作用是增大食盐的溶解度 B.操作②中可通过升高温度加速溶解
C.操作③中可用玻璃棒搅拌加速过滤 D.操作④中要将液体蒸干后停止加热
15.15℃时,将质量都为x g的KNO3、KCl两种固体物质,分别加入到各盛有100.0 g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图1、2所示。下列说法不正确的是
A.乙中加入的固体是KNO3
B.固体质量:25.0<x≤30.8
C.将甲、乙两烧杯的温度从15℃升高到t℃,两溶液都是不饱和溶液
D.将KNO3、KCl的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
二、填空题
16.下图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是_______.
(2)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的_______.
17.防范新冠疫情,需要我们“戴口罩,勤洗手,勤消毒,勤通风”。
(1)医用口罩的核心材料是聚丙烯制成的熔喷布,聚丙烯属于___(填序号)。
A.金属材料 B.有机合成材料 C.有机高分子材料 D.复合材料
(2)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,利用洗洁精的___作用。
(3)某消毒液稀释后pH=6,则稀释前其pH___(填“>”、“=”或“<”)6。
(4)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液___kg 。
(5)修建火神山医院时用到了大量铝合金材料,铝合金耐腐蚀。铝的活泼性比铁强,但比铁耐腐蚀的原因是___。
18.实验室配制100 g 溶质质量分数为5%的氯化钠溶液。实验操作如下:
(1)托盘天平右盘上砝码的质量为______g,量取水的体积为______mL(水的密度为1g/mL)。
(2)操作B中玻璃棒的作用是______。
(3)实验操作顺序是______(填序号)。
(4)从配好的溶液中倒出50 g,剩余的溶液溶质质量分数为______。
19.生活中蕴含着丰富的化学知识,请你用所学知识回答下列问题:
(1)大润发超市出售的①崂山矿泉水 ②乐爽蒸馏水 ③蒙牛纯牛奶 ④汇源果粒橙等饮品中属于纯净物的是_____(填编号,下同),属于溶液的是_________。
(2)雷雨过后空气特别清新,因为空气中含有,被称为空气“维生素”,从微观看O2和的区别是______。
(3)过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等,过氧化钙中氧元素的化合价为____________。
(4)海水可吸收二氧化碳,请写出反应的化学方程式:_________。
三、推断题
20.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
21.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
四、实验题
22.在农业上,KNO3 常用于配制无土栽培的营养液。
(1)试计算:
①KNO3 中氮、氧两种元素的质量比为 ___________(最简整数比);
②KNO3中氮元素的质量分数为___________。(计算结果精确到 0.1%)
(2)以下是某校实验小组实验室配制一定溶质质量分数的 100g16%硝酸钾溶液请回答:
①需要水的体积为 ___________ mL;配制时应选择___________(填 10、50 或 100)mL 的量筒量取所需要的水。其中玻璃棒在此操作中的作用是___________。
②下列操作会导致所配的溶液溶质质量分数偏低的是___________ 。
A.硝酸钾固体中含有不溶于水的杂质
B.烧杯内有水
C.用量筒取水的体积时采用仰视的方法读数
D.把配好的溶液倒入试剂瓶时有部分溅出
③将上述溶液稀释成 8%的硝酸钾溶液,需要加入水的质量为___________克。
(3)如图所示,将水滴入装有氢氧化钠固体的试管中,关于烧杯中溶液说法正确的是___________
A.溶质质量不变 B.溶剂质量减少
C.溶液质量增加 D.溶质质量分数减少
23.科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制 50g 6%的氯化钠溶液。回答下列问题:
(1)如图中操作有错误的是______(填数字序号)。
(2)粗盐提纯的步骤是(填名称): 溶解、______、______。
(3)操作⑥中,玻璃棒的作用是______,当观察到______时,停止加热。
(4)下列操作会使产率偏低的是______。
A.粗盐没有完全溶解 B.蒸发时有溶液溅出 C.蒸发时未完全蒸干
(5)用提纯得到的精盐配制 50g 6%的氯化钠溶液,需要氯化钠______g,蒸馏水______mL。
(6)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会______6%(填“>”“<”或“=”)。
五、计算题
24.某化工厂排放的废水中含有碳酸钾和氯化钾,十五中化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于容器中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如图。请计算:
【提示:碳酸钾与硫酸反应的化学方程式为,氯化钾不与酸反应】
(1)生成二氧化碳的质量为_________g。
(2)该废水中碳酸钾的质量分数为多少?(写出计算过程)
(3)反应后生成硫酸钾的质量为多少?
25.请你仔细分析如图所示的实验过程和提供的数据,计算反应后所得溶液中溶质的质量分数是____?
参考答案:
1.B 2.C 3.B 4.B 5.C 6.D 7.B 8.C 9.A 10.C 11.A 12.D 13.C 14.B 15.D 16.(1)A
(2)C
17.(1)BC
(2)乳化(或将油变成成小液滴分散到水中)
(3)<
(4)2
(5)铝易与氧气反应生成致密的氧化铝保护膜(保护内部不再被氧化或腐蚀)
18.(1) 5 95
(2)加速溶解
(3)CAB
(4)5%
19.(1) ② ①
(2)电子数不同
(3)-1
(4)
20. 75 a>b>c
21. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
22.(1) 7∶24
13.9%
(2) 84
100 搅拌,加速溶解 ABC 100
(3)C
23.(1)⑤
(2) 过滤 蒸发
(3) 搅拌,防止液体受热不匀发生飞溅 大部分固体析出
(4)AB
(5) 3 47
(6)<
24.(1)2.2g
(2)设生成2.2g的二氧化碳需碳酸钾的质量为x。
x=6.9g;
废水中碳酸钾的质量分数=。
答:废水中碳酸钾的质量分数13.8%。
(3)设生成2.2g的二氧化碳同时生成硫酸钾的质量为y。
y=8.7g;
答:反应后生成硫酸钾的质量为8.7g。
25.12.7%
同课章节目录
