2021-2022学年高一下学期化学人教版(2019)必修第二册6.1.1化学反应与热能课时作业 含答案
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册6.1.1化学反应与热能课时作业 含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 313.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-10 18:57:13 | ||
图片预览




文档简介
人教版高一化学必修第二册课时作业
6.1(第1课时)化学反应与热能
一、选择题(本题15小题,每小题只有一个选项符合题意)
1、下列说法正确的是 ( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常温条件下一定能发生
C.形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
2、下列说法正确的是( )
A.化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化
B.吸热反应一定是反应物总能量高于生成物总能量
C.酸与碱的中和反应属于放热反应
D.凡是需要加热的反应都是吸热反应
3、随着科学技术的发展,在太空建造巨大的集光装置会成为可能。把太阳光变成激光用于分解海水制氢气:2H2O2H2↑+O2↑。下列说法不正确的是 ( )
A.水的分解反应为放热反应
B.氢气是理想的能源
C.使用氢气作燃料有助于控制温室效应
D.在这一反应中,光能转化为化学能
4、液态储氢技术就是在常温常压下将氢气“融入”一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是 ( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
5、在含少量镁粉的试管中滴入稀盐酸,产生大量气泡,且试管壁发热。该反应为( )
A.放热反应 B.吸热反应
C.化合反应 D.复分解反应
6、下列变化过程,属于放热反应的是 ( )
①液态水变成水蒸气 ②酸碱中和反应③浓硫酸稀释 ④固体NaOH溶于水⑤H2在Cl2中燃烧 ⑥电离
A.②③④⑤ B.②③④
C.②⑤ D.①③⑤
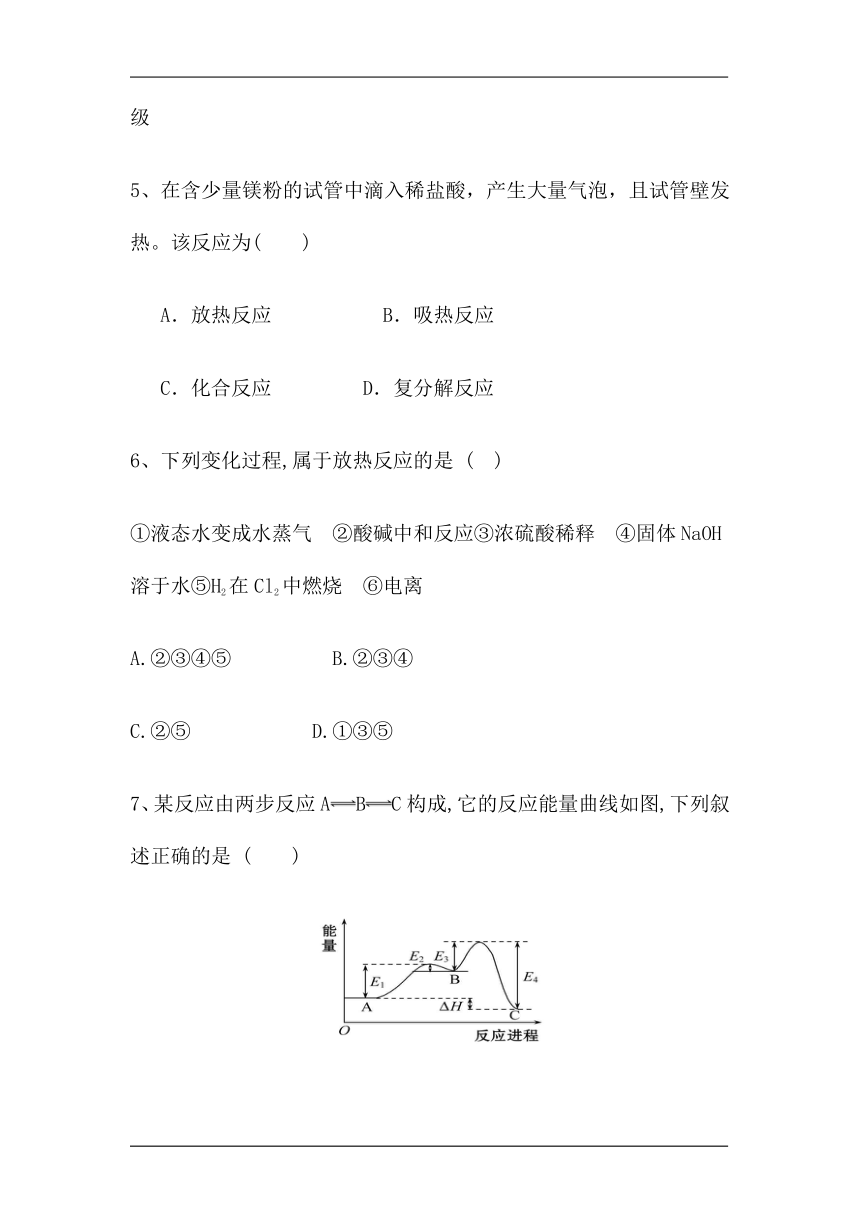
7、某反应由两步反应ABC构成,它的反应能量曲线如图,下列叙述正确的是 ( )
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.A与C的能量差为E4
D.AB反应,反应条件一定需要加热
8、下列化学反应既属于氧化还原反应又属于吸热反应的是( )
A.铝片和稀盐酸反应
B.氢氧化钡晶体和氯化铵反应
C.灼热的碳与CO2反应
D.甲烷在氧气中燃烧
9、下列反应中的能量变化如图所示的是( )
A.Al与盐酸的反应
B.Na与H2O的反应
C.NaOH与盐酸的反应
D.Ba(OH)2·8H2O与NH4Cl的反应
10、有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。观察下面图示,判断在此构想的物质循环中,太阳能最终转化为( )
A.化学能 B.热能
C.生物质能 D.电能
11、白磷、红磷是磷的两种同素异形体。某温度下1 mol白磷转化为红磷放出29.2 kJ的热量,则下列叙述正确的是 ( )
A.白磷比红磷稳定
B.红磷比白磷稳定
C.1 mol白磷比1 mol红磷含有的总能量低
D.红磷转化为白磷要放热
12、下列说法正确的是 ( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常温条件下一定能发生反应
C.形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
13、下图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是 ( )
A.反应Ⅰ是放热反应,反应Ⅱ也是放热反应
B.反应Ⅰ是放热反应,反应Ⅱ是吸热反应
C.反应Ⅰ是吸热反应,反应Ⅱ也是吸热反应
D.反应Ⅰ不需要加热,反应Ⅱ必须加热
14、如图所示,有关化学反应和能量变化的说法正确的是 ( )
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a不需要加热就一定能发生,图b一定需要加热才能发生
15、科学家利用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程及能量变化如图。下列说法中不正确的是 ( )
A.状态Ⅰ到状态Ⅱ是一个吸热过程
B.状态Ⅰ的总能量大于状态Ⅲ的总能量
C.状态Ⅱ→状态Ⅲ是新化学键形成的过程
D.在该过程中,CO分子中碳氧键断裂成C和O
二、非选择题(共5题)
16、金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
(1)等质量的金刚石和石墨完全燃烧,________(填“金刚石”或“石墨”)放出的热量更多。
(2)在通常状况下,________(填“金刚石”或“石墨”)更稳定。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为_________________________。
17、为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:
(1)上述3套装置中,不能证明“铜与浓硝酸的反应是吸热反应还是放热反应”的是 。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是 ;
②若M溶于水后观察到烧杯里产生气泡,则说明M溶于水 (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若M溶于水后观察到烧杯里的玻璃管内形成一段水柱,则M可能是 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O 4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置 (填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是 (填“吸热”或“放热”)反应。
18、为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述装置中,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”的是________(填序号)
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是______________________________________。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若观察到烧杯里的玻璃管内形成一段水柱,则说明M溶于水_________ (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”或“可能是吸热反应”),理由_____________。
②若观察到烧杯里产生气泡,则M可能是________(填一种物质的化学式)。
19、下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)。
物质 Cl2 Br2 I2 H2
能量/kJ 243 193 151 436
物质 HF HCl HBr HI
能量/kJ 568 432 366 298
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是________。
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是________。
A.HF B.HCl
C.HBr D.HI
(3)X2+H22HX(X代表Cl、Br、I)是 ______(填“吸热”或“放热”)反应。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是____________。
20、某同学设计如下三种实验方案以探究某反应是放热反应还是吸热反应。
方案一:如图甲,在小烧杯里放一些已除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1的稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图乙,在烧杯底部用熔融的蜡烛黏一块小木片,在烧杯里加入10 mL 2 mol·L-1的稀硫酸,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
方案三:如图丙,A试管中发生某化学反应,实验前U形管中的红墨水液面相平,在化学反应过程中,通过观察U形管两侧红墨水液面高低变化判断该反应是吸热反应还是放热反应。
项目 A试管里发生反应的物质 U形管里红墨水液面变化
① 氧化钙与水 左低右高
② 氢氧化钡晶体与氯化 铵晶体(充分搅拌)
③ 铝片与烧碱溶液 左低右高
④ 铜与浓硝酸 左低右高
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写出该反应的离子方程式: __________________。
(2)方案一中,温度升至最大值后又下降的原因是_____________。
(3)方案二中,小木片脱落的原因是____________________,由此得出的结论是____________________________。
(4)方案三中,如果A试管里发生的反应是放热反应,则U形管中红墨水液面高度:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为_____________________,
说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量。
答案与解析
1、A
解析:放热反应在常温下不一定能发生,如煤的燃烧, B错误。形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为放热反应,C错误;等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少,D错误。
2、C
解析:A项,因物质三态之间的转变也存在能量的变化,而物质三态之间的转变是物理变化,错误;B项,若反应中生成物总能量高于反应物总能量,则反应是吸热反应,反之是放热反应,错误;C项,中和反应都是放热反应,正确;D项,需要加热的反应不一定都是吸热反应,有的反应开始时需要加热来引发反应,但反应一旦开始,反应本身放出的能量足以维持反应的进行,就不需要再加热,这样的反应虽然开始时需要加热,但为放热反应,错误。
3、A
解析:H2O的分解需要吸收能量,属于吸热反应,且该过程中光能转化为化学能,故A错误,D正确;氢气的燃烧产物只有水,不会产生CO2,利于控制温室效应。故B、C正确。
4、A
解析:“氢油”便于储存和运输,说明它比较稳定,A错误;氢气燃烧生成水,水分解又生成氢气,故氢能源属于可再生能源,B正确;常温常压下可以将氢气“融入”“储油”中便于储存和运输,该技术实现了常温常压下储氢技术的新突破,C正确;液态储氢解决了氢能储存难、运输难的问题,有利于氢能的广泛应用,有利于发展氢能源电动机,从而带来新能源汽车的升级,D正确。
5、A
解析:Mg+2HCl===MgCl2+H2↑,此反应属于置换反应,试管壁发热,说明此反应是放热反应,故选项A正确。
6、C
解析:①液态水变成水蒸气,需要吸收热量且不是化学反应,故不符合题意;②酸碱中和反应是放热反应,故符合题意;③浓硫酸稀释放出大量的热,但不属于化学反应,故不符合题意;④固体NaOH溶于水放出大量的热,但不属于化学反应,故不符合题意;⑤燃烧是放热反应,故符合题意;⑥电离不属于化学变化,故不符合题意。
7、B
解析:根据反应能量曲线图可知,能量大小为B>A>C,故两步反应分别为吸热反应、放热反应,其中A、C的能量差为ΔH,C的能量最低,C最稳定,A、C错误,B正确;吸热反应不一定需要加热,D错误。
8、C
解析:铝片和稀盐酸反应属于放热反应,氧化还原反应,A不符合题意;氢氧化钡晶体和氯化铵反应属于吸热反应,不是氧化还原反应,B不符合题意;灼热的碳与CO2反应是吸热反应,氧化还原反应,C符合题意;甲烷在氧气中燃烧属于放热反应,氧化还原反应,D不符合题意。
9、D
解析:由能量变化图像知,该反应为吸热反应。A、B、C均为放热反应,Ba(OH)2·8H2O与NH4Cl的反应,属于吸热反应,D符合题意。
10、B
解析:理解图示的转化关系便可顺利解题。关键信息是利用太阳能使CO2、H2O、N2等重新组合,根据图示可知燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。
11、B解析: 1 mol白磷转化为红磷放出29.2 kJ的热量,则1 mol红磷含有的总能量低,故红磷比白磷稳定,其转化为白磷要吸热。
12、A
解析:放热反应在常温下不一定能发生,如煤的燃烧,B错误;形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为放热反应,C错误;等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少,D错误。
13、B
解析:若反应物总能量高于生成物总能量,则反应为放热反应,反之,为吸热反应;无论是吸热反应还是放热反应,都与反应需不需要加热无关。
14、C
解析:图a中反应物总能量高于生成物总能量,则表示的是放热反应的能量变化,A错误;图b中反应物总能量低于生成物总能量,能量越低越稳定,则反应物比生成物稳定,B错误;图b中反应物总能量低于生成物总能量,属于吸热反应,可以表示氯化铵固体与氢氧化钡晶体反应的能量变化,C正确;反应条件与反应是放热反应还是吸热反应没有关系,D错误。
15、D
解析:状态Ⅰ的能量小于状态Ⅱ,所以状态Ⅰ→状态Ⅱ是吸热过程,故A正确;根据图知,状态Ⅰ的总能量大于状态Ⅲ的总能量,故B正确;状态Ⅱ到状态Ⅲ放出能量且CO和O生成二氧化碳,所以是新化学键形成过程,故C正确;由图可知不存在CO的断键过程,故D错误。
16、 解析:(1)由图象分析可知,金刚石能量高于石墨,等量金刚石和石墨完全燃烧生成二氧化碳时金刚石放热多;
(2)图象分析金刚石能量高于石墨,能量越低越稳定,所以石墨更稳定;
(3)12 g石墨物质的量为1 mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44 g,若生成一氧化碳质量为28 g,生成气体36 g,28 g<36 g<44 g,判断生成的气体为一氧化碳和二氧化碳的混合气体,设一氧化碳物质的量为x,二氧化碳物质的量为1 mol-x,28 g·mol-1×x+44 g·mol-1×(1 mol-x)=36 g,x=0.5 mol,二氧化碳物质的量为0.5 mol;依据图象分析,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ·mol-1×0.5 mol+110.5 kJ·mol-1×0.5 mol=252.0 kJ,12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为252.0 kJ。
答案:(1)金刚石
(2)石墨
(3)252.0 kJ
17、 答案:(1)Ⅲ
(2)左端液柱降低,右端液柱升高 放热
(3)①产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱 ②可能是放热反应 ③NH4NO3(答案合理即可)
(4)Ⅰ或Ⅱ 放热
解析:(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅲ不能证明铜与浓硝酸的反应是放热反应还是吸热反应。
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高。
(3)①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放出的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱。②若M溶于水后观察到烧杯里产生气泡,说明M溶于水放出热量,由于放热反应一定属于化学变化,而有热量放出的不一定为化学变化,如氢氧化钠溶于水放热,但不是化学反应,所以可能是放热反应。③若M溶于水后观察到烧杯里的玻璃管内形成一段水柱,说明装置中气体的压强减小,则M可能是硝酸铵,硝酸铵溶于水吸收热量。
(4)方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是放热反应。
18、答案:(1)Ⅲ
(2)左端液柱升高,右端液柱降低
(3)①可能是吸热反应 某些物质溶于水吸热,但不是发生化学反应 ②NaOH、CaO等
解析:(1)Ⅲ的漏斗不封闭,不会形成压强差,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”。 (2)氢氧化钡晶体与氯化铵的反应为吸热反应,反应开始,锥形瓶内温度降低,压强减小,大气压将“U”形管中的红墨水往左边挤压,出现左端液柱升高,右端液柱降低的现象。(3)①烧杯里的玻璃管内形成一段水柱,说明M与水相遇吸热。某些物质溶解于水吸热,如硝酸铵,某些物质与水反应吸热,如盐类水解。②若观察到烧杯里产生气泡,说明M与水相遇放热,可能是某些物质溶解于水放热,如NaOH,也可能是某些物质与水反应放热,如CaO。
19、解析:(1)~(2)破坏1 mol物质中的化学键所消耗的能量越大,则物质越稳定,所具有的能量越低。(3)~(4)以氯元素为例计算:断开1 mol Cl—Cl键和1 mol H—H键需吸收的能量为243 kJ+436 kJ=679 kJ,而形成2 mol H—Cl键放出的能量为2×432 kJ=864 kJ,所以在Cl2+H22HCl反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2+H22HBr、I2+H22HI反应中分别放出103 kJ、9 kJ 的热量。
答案:(1)A
(2)A
(3)放热
(4)Cl2
20、解析:(1)金属与酸的反应是放热反应,因此铝片与稀硫酸的反应是放热反应,该反应的离子方程式为2Al+6H+===2Al3++3H2↑。
(2)方案一中,温度升至最大值后又下降的原因可能是反应完全后,热量向空气中传递,烧杯里物质的温度降低。
(3)方案二中,反应放出的热量使蜡烛熔化,小木片脱落。
(4)方案三中,如果A试管里发生的反应是放热反应,锥形瓶中气体的压强增大,U形管中红墨水液面左边低于右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热反应,如果放置较长时间,热量散失,装置中气体的压强与外界压强相等,U形管中红墨水液面左右相平。
(6)方案三中的实验②属于吸热反应,U形管中红墨水液面左高右低。
答案:(1)放热 2Al+6H+===2Al3++3H2↑
(2)反应完全后,热量向空气中传递,烧杯里物质的温度降低
(3)蜡烛受热熔化 氢氧化钠与硫酸反应放热
(4)低于
(5)放热 红墨水液面左右相平
(6)红墨水液面左高右低 小于
6.1(第1课时)化学反应与热能
一、选择题(本题15小题,每小题只有一个选项符合题意)
1、下列说法正确的是 ( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常温条件下一定能发生
C.形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
2、下列说法正确的是( )
A.化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化
B.吸热反应一定是反应物总能量高于生成物总能量
C.酸与碱的中和反应属于放热反应
D.凡是需要加热的反应都是吸热反应
3、随着科学技术的发展,在太空建造巨大的集光装置会成为可能。把太阳光变成激光用于分解海水制氢气:2H2O2H2↑+O2↑。下列说法不正确的是 ( )
A.水的分解反应为放热反应
B.氢气是理想的能源
C.使用氢气作燃料有助于控制温室效应
D.在这一反应中,光能转化为化学能
4、液态储氢技术就是在常温常压下将氢气“融入”一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是 ( )
A.“氢油”不稳定
B.氢能源属于可再生能源
C.该技术实现了常温常压下储氢技术的新突破
D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
5、在含少量镁粉的试管中滴入稀盐酸,产生大量气泡,且试管壁发热。该反应为( )
A.放热反应 B.吸热反应
C.化合反应 D.复分解反应
6、下列变化过程,属于放热反应的是 ( )
①液态水变成水蒸气 ②酸碱中和反应③浓硫酸稀释 ④固体NaOH溶于水⑤H2在Cl2中燃烧 ⑥电离
A.②③④⑤ B.②③④
C.②⑤ D.①③⑤
7、某反应由两步反应ABC构成,它的反应能量曲线如图,下列叙述正确的是 ( )
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.A与C的能量差为E4
D.AB反应,反应条件一定需要加热
8、下列化学反应既属于氧化还原反应又属于吸热反应的是( )
A.铝片和稀盐酸反应
B.氢氧化钡晶体和氯化铵反应
C.灼热的碳与CO2反应
D.甲烷在氧气中燃烧
9、下列反应中的能量变化如图所示的是( )
A.Al与盐酸的反应
B.Na与H2O的反应
C.NaOH与盐酸的反应
D.Ba(OH)2·8H2O与NH4Cl的反应
10、有专家指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。观察下面图示,判断在此构想的物质循环中,太阳能最终转化为( )
A.化学能 B.热能
C.生物质能 D.电能
11、白磷、红磷是磷的两种同素异形体。某温度下1 mol白磷转化为红磷放出29.2 kJ的热量,则下列叙述正确的是 ( )
A.白磷比红磷稳定
B.红磷比白磷稳定
C.1 mol白磷比1 mol红磷含有的总能量低
D.红磷转化为白磷要放热
12、下列说法正确的是 ( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常温条件下一定能发生反应
C.形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应
D.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
13、下图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是 ( )
A.反应Ⅰ是放热反应,反应Ⅱ也是放热反应
B.反应Ⅰ是放热反应,反应Ⅱ是吸热反应
C.反应Ⅰ是吸热反应,反应Ⅱ也是吸热反应
D.反应Ⅰ不需要加热,反应Ⅱ必须加热
14、如图所示,有关化学反应和能量变化的说法正确的是 ( )
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a不需要加热就一定能发生,图b一定需要加热才能发生
15、科学家利用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程及能量变化如图。下列说法中不正确的是 ( )
A.状态Ⅰ到状态Ⅱ是一个吸热过程
B.状态Ⅰ的总能量大于状态Ⅲ的总能量
C.状态Ⅱ→状态Ⅲ是新化学键形成的过程
D.在该过程中,CO分子中碳氧键断裂成C和O
二、非选择题(共5题)
16、金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。
(1)等质量的金刚石和石墨完全燃烧,________(填“金刚石”或“石墨”)放出的热量更多。
(2)在通常状况下,________(填“金刚石”或“石墨”)更稳定。
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为_________________________。
17、为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:
(1)上述3套装置中,不能证明“铜与浓硝酸的反应是吸热反应还是放热反应”的是 。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是 ;
②若M溶于水后观察到烧杯里产生气泡,则说明M溶于水 (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若M溶于水后观察到烧杯里的玻璃管内形成一段水柱,则M可能是 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O 4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置 (填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是 (填“吸热”或“放热”)反应。
18、为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)上述装置中,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”的是________(填序号)
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡晶体与氯化铵固体搅拌反应,U形管中可观察到的现象是______________________________________。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若观察到烧杯里的玻璃管内形成一段水柱,则说明M溶于水_________ (填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”或“可能是吸热反应”),理由_____________。
②若观察到烧杯里产生气泡,则M可能是________(填一种物质的化学式)。
19、下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)。
物质 Cl2 Br2 I2 H2
能量/kJ 243 193 151 436
物质 HF HCl HBr HI
能量/kJ 568 432 366 298
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是________。
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是________。
A.HF B.HCl
C.HBr D.HI
(3)X2+H22HX(X代表Cl、Br、I)是 ______(填“吸热”或“放热”)反应。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是____________。
20、某同学设计如下三种实验方案以探究某反应是放热反应还是吸热反应。
方案一:如图甲,在小烧杯里放一些已除去氧化铝保护膜的铝片,然后向烧杯里加入10 mL 2 mol·L-1的稀硫酸,再插入一支温度计,温度计的温度由20 ℃逐渐升至75 ℃,随后,温度逐渐下降至30 ℃,最终停留在20 ℃。
方案二:如图乙,在烧杯底部用熔融的蜡烛黏一块小木片,在烧杯里加入10 mL 2 mol·L-1的稀硫酸,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来。
方案三:如图丙,A试管中发生某化学反应,实验前U形管中的红墨水液面相平,在化学反应过程中,通过观察U形管两侧红墨水液面高低变化判断该反应是吸热反应还是放热反应。
项目 A试管里发生反应的物质 U形管里红墨水液面变化
① 氧化钙与水 左低右高
② 氢氧化钡晶体与氯化 铵晶体(充分搅拌)
③ 铝片与烧碱溶液 左低右高
④ 铜与浓硝酸 左低右高
根据上述实验回答相关问题:
(1)铝片与稀硫酸的反应是________(填“吸热”或“放热”)反应,写出该反应的离子方程式: __________________。
(2)方案一中,温度升至最大值后又下降的原因是_____________。
(3)方案二中,小木片脱落的原因是____________________,由此得出的结论是____________________________。
(4)方案三中,如果A试管里发生的反应是放热反应,则U形管中红墨水液面高度:左边________(填“高于”“低于”或“等于”)右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是________(填“吸热”或“放热”)反应,如果放置较长时间,可观察到U形管里的现象是______________。
(6)方案三实验②的U形管中的现象为_____________________,
说明反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量。
答案与解析
1、A
解析:放热反应在常温下不一定能发生,如煤的燃烧, B错误。形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为放热反应,C错误;等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少,D错误。
2、C
解析:A项,因物质三态之间的转变也存在能量的变化,而物质三态之间的转变是物理变化,错误;B项,若反应中生成物总能量高于反应物总能量,则反应是吸热反应,反之是放热反应,错误;C项,中和反应都是放热反应,正确;D项,需要加热的反应不一定都是吸热反应,有的反应开始时需要加热来引发反应,但反应一旦开始,反应本身放出的能量足以维持反应的进行,就不需要再加热,这样的反应虽然开始时需要加热,但为放热反应,错误。
3、A
解析:H2O的分解需要吸收能量,属于吸热反应,且该过程中光能转化为化学能,故A错误,D正确;氢气的燃烧产物只有水,不会产生CO2,利于控制温室效应。故B、C正确。
4、A
解析:“氢油”便于储存和运输,说明它比较稳定,A错误;氢气燃烧生成水,水分解又生成氢气,故氢能源属于可再生能源,B正确;常温常压下可以将氢气“融入”“储油”中便于储存和运输,该技术实现了常温常压下储氢技术的新突破,C正确;液态储氢解决了氢能储存难、运输难的问题,有利于氢能的广泛应用,有利于发展氢能源电动机,从而带来新能源汽车的升级,D正确。
5、A
解析:Mg+2HCl===MgCl2+H2↑,此反应属于置换反应,试管壁发热,说明此反应是放热反应,故选项A正确。
6、C
解析:①液态水变成水蒸气,需要吸收热量且不是化学反应,故不符合题意;②酸碱中和反应是放热反应,故符合题意;③浓硫酸稀释放出大量的热,但不属于化学反应,故不符合题意;④固体NaOH溶于水放出大量的热,但不属于化学反应,故不符合题意;⑤燃烧是放热反应,故符合题意;⑥电离不属于化学变化,故不符合题意。
7、B
解析:根据反应能量曲线图可知,能量大小为B>A>C,故两步反应分别为吸热反应、放热反应,其中A、C的能量差为ΔH,C的能量最低,C最稳定,A、C错误,B正确;吸热反应不一定需要加热,D错误。
8、C
解析:铝片和稀盐酸反应属于放热反应,氧化还原反应,A不符合题意;氢氧化钡晶体和氯化铵反应属于吸热反应,不是氧化还原反应,B不符合题意;灼热的碳与CO2反应是吸热反应,氧化还原反应,C符合题意;甲烷在氧气中燃烧属于放热反应,氧化还原反应,D不符合题意。
9、D
解析:由能量变化图像知,该反应为吸热反应。A、B、C均为放热反应,Ba(OH)2·8H2O与NH4Cl的反应,属于吸热反应,D符合题意。
10、B
解析:理解图示的转化关系便可顺利解题。关键信息是利用太阳能使CO2、H2O、N2等重新组合,根据图示可知燃料燃烧后转化为燃烧产物并放出热量,燃烧产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能。
11、B解析: 1 mol白磷转化为红磷放出29.2 kJ的热量,则1 mol红磷含有的总能量低,故红磷比白磷稳定,其转化为白磷要吸热。
12、A
解析:放热反应在常温下不一定能发生,如煤的燃烧,B错误;形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为放热反应,C错误;等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少,D错误。
13、B
解析:若反应物总能量高于生成物总能量,则反应为放热反应,反之,为吸热反应;无论是吸热反应还是放热反应,都与反应需不需要加热无关。
14、C
解析:图a中反应物总能量高于生成物总能量,则表示的是放热反应的能量变化,A错误;图b中反应物总能量低于生成物总能量,能量越低越稳定,则反应物比生成物稳定,B错误;图b中反应物总能量低于生成物总能量,属于吸热反应,可以表示氯化铵固体与氢氧化钡晶体反应的能量变化,C正确;反应条件与反应是放热反应还是吸热反应没有关系,D错误。
15、D
解析:状态Ⅰ的能量小于状态Ⅱ,所以状态Ⅰ→状态Ⅱ是吸热过程,故A正确;根据图知,状态Ⅰ的总能量大于状态Ⅲ的总能量,故B正确;状态Ⅱ到状态Ⅲ放出能量且CO和O生成二氧化碳,所以是新化学键形成过程,故C正确;由图可知不存在CO的断键过程,故D错误。
16、 解析:(1)由图象分析可知,金刚石能量高于石墨,等量金刚石和石墨完全燃烧生成二氧化碳时金刚石放热多;
(2)图象分析金刚石能量高于石墨,能量越低越稳定,所以石墨更稳定;
(3)12 g石墨物质的量为1 mol,在一定量空气中燃烧,依据元素守恒,若生成二氧化碳质量为44 g,若生成一氧化碳质量为28 g,生成气体36 g,28 g<36 g<44 g,判断生成的气体为一氧化碳和二氧化碳的混合气体,设一氧化碳物质的量为x,二氧化碳物质的量为1 mol-x,28 g·mol-1×x+44 g·mol-1×(1 mol-x)=36 g,x=0.5 mol,二氧化碳物质的量为0.5 mol;依据图象分析,生成二氧化碳和一氧化碳混合气体放出热量=393.5 kJ·mol-1×0.5 mol+110.5 kJ·mol-1×0.5 mol=252.0 kJ,12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为252.0 kJ。
答案:(1)金刚石
(2)石墨
(3)252.0 kJ
17、 答案:(1)Ⅲ
(2)左端液柱降低,右端液柱升高 放热
(3)①产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱 ②可能是放热反应 ③NH4NO3(答案合理即可)
(4)Ⅰ或Ⅱ 放热
解析:(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅲ不能证明铜与浓硝酸的反应是放热反应还是吸热反应。
(2)氢氧化钡与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高。
(3)①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放出的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱。②若M溶于水后观察到烧杯里产生气泡,说明M溶于水放出热量,由于放热反应一定属于化学变化,而有热量放出的不一定为化学变化,如氢氧化钠溶于水放热,但不是化学反应,所以可能是放热反应。③若M溶于水后观察到烧杯里的玻璃管内形成一段水柱,说明装置中气体的压强减小,则M可能是硝酸铵,硝酸铵溶于水吸收热量。
(4)方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是放热反应。
18、答案:(1)Ⅲ
(2)左端液柱升高,右端液柱降低
(3)①可能是吸热反应 某些物质溶于水吸热,但不是发生化学反应 ②NaOH、CaO等
解析:(1)Ⅲ的漏斗不封闭,不会形成压强差,不能证明“锌和稀硫酸反应是吸热反应还是放热反应”。 (2)氢氧化钡晶体与氯化铵的反应为吸热反应,反应开始,锥形瓶内温度降低,压强减小,大气压将“U”形管中的红墨水往左边挤压,出现左端液柱升高,右端液柱降低的现象。(3)①烧杯里的玻璃管内形成一段水柱,说明M与水相遇吸热。某些物质溶解于水吸热,如硝酸铵,某些物质与水反应吸热,如盐类水解。②若观察到烧杯里产生气泡,说明M与水相遇放热,可能是某些物质溶解于水放热,如NaOH,也可能是某些物质与水反应放热,如CaO。
19、解析:(1)~(2)破坏1 mol物质中的化学键所消耗的能量越大,则物质越稳定,所具有的能量越低。(3)~(4)以氯元素为例计算:断开1 mol Cl—Cl键和1 mol H—H键需吸收的能量为243 kJ+436 kJ=679 kJ,而形成2 mol H—Cl键放出的能量为2×432 kJ=864 kJ,所以在Cl2+H22HCl反应中放出864 kJ-679 kJ=185 kJ的热量,同理可计算在Br2+H22HBr、I2+H22HI反应中分别放出103 kJ、9 kJ 的热量。
答案:(1)A
(2)A
(3)放热
(4)Cl2
20、解析:(1)金属与酸的反应是放热反应,因此铝片与稀硫酸的反应是放热反应,该反应的离子方程式为2Al+6H+===2Al3++3H2↑。
(2)方案一中,温度升至最大值后又下降的原因可能是反应完全后,热量向空气中传递,烧杯里物质的温度降低。
(3)方案二中,反应放出的热量使蜡烛熔化,小木片脱落。
(4)方案三中,如果A试管里发生的反应是放热反应,锥形瓶中气体的压强增大,U形管中红墨水液面左边低于右边。
(5)由方案三的现象得出结论:①③④组物质发生的反应都是放热反应,如果放置较长时间,热量散失,装置中气体的压强与外界压强相等,U形管中红墨水液面左右相平。
(6)方案三中的实验②属于吸热反应,U形管中红墨水液面左高右低。
答案:(1)放热 2Al+6H+===2Al3++3H2↑
(2)反应完全后,热量向空气中传递,烧杯里物质的温度降低
(3)蜡烛受热熔化 氢氧化钠与硫酸反应放热
(4)低于
(5)放热 红墨水液面左右相平
(6)红墨水液面左高右低 小于
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
