第十单元课题1 常见的酸和碱课件(共45张PPT)
文档属性
| 名称 | 第十单元课题1 常见的酸和碱课件(共45张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-12 21:37:55 | ||
图片预览








文档简介
(共45张PPT)
课题1 常见的酸和碱
调味品食醋有酸味,就是因为食醋中含有醋酸;一些水果有酸味、是因为水果中含有各种果酸。
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴,印染等。
石灰水中含有的氢氧化钙,清洁剂中含有的氢氧化钠,它们都属于碱。
如何区分酸和碱呢?
酸碱指示剂:紫色石蕊溶液、无色酚酞溶液
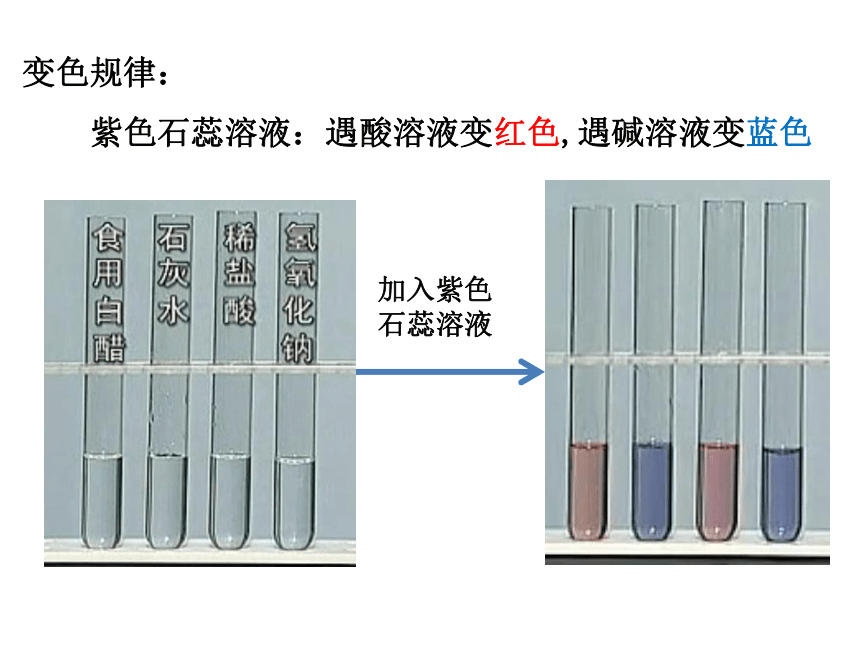
变色规律:
紫色石蕊溶液:遇酸溶液变红色,遇碱溶液变蓝色
加入紫色石蕊溶液
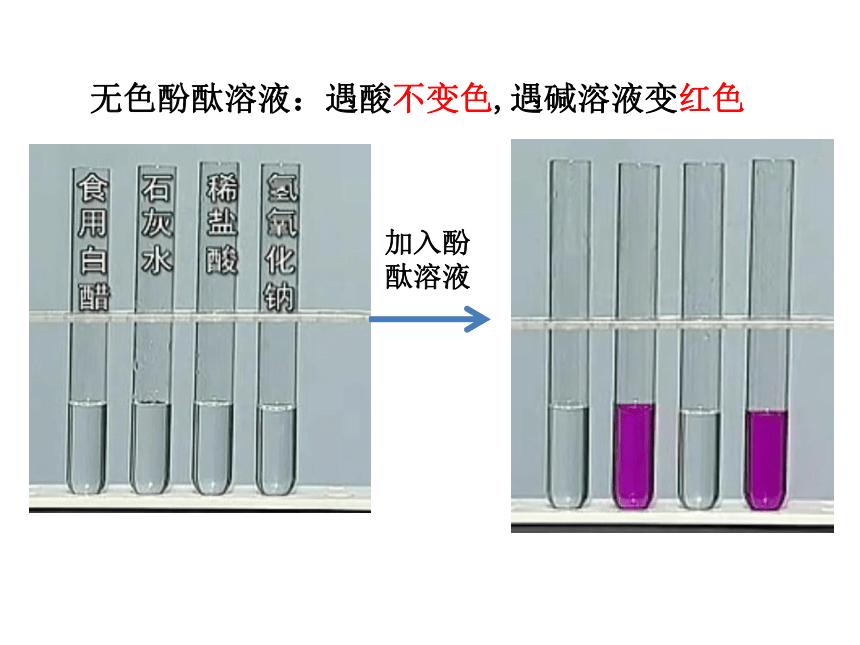
加入酚酞溶液
无色酚酞溶液:遇酸不变色,遇碱溶液变红色
二、常见的酸
1、常见的酸
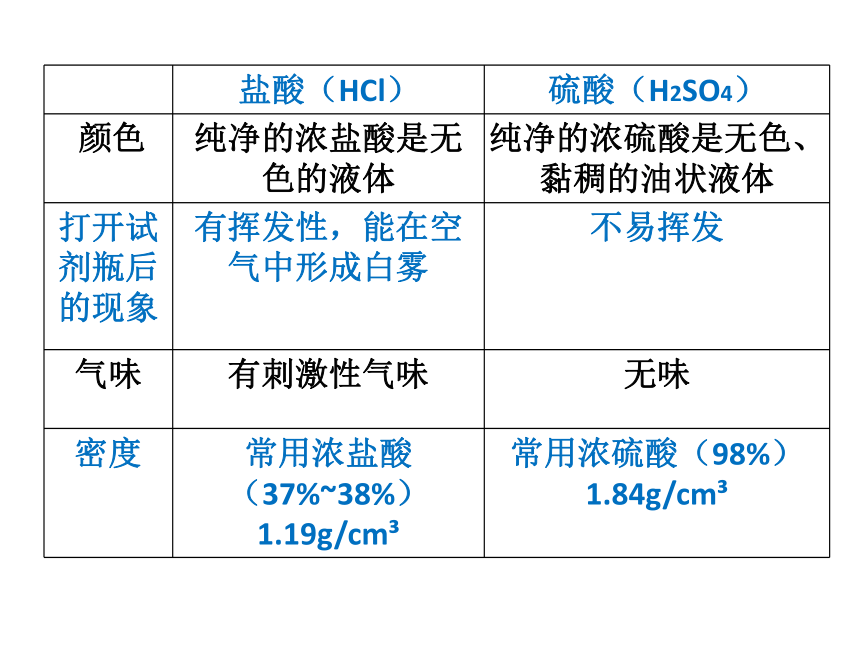
实验室常用的酸有盐酸和硫酸
盐酸(HCl) 硫酸(H2SO4)
颜色 纯净的浓盐酸是无色的液体 纯净的浓硫酸是无色、黏稠的油状液体
打开试剂瓶后的现象 有挥发性,能在空气中形成白雾 不易挥发
气味 有刺激性气味 无味
密度 常用浓盐酸(37%~38%)1.19g/cm 常用浓硫酸(98%)1.84g/cm
用 途
盐 酸
HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸
H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它作干燥剂。
在实验室和化工生产中常用的酸还有硝酸、醋酸等。
HNO3
CH3COOH
2、浓硫酸的腐蚀性
浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。所以,使用浓硫酸时应十分小心。
浓硫酸的腐蚀性是因为它具有脱水作用——能将物质中的氢、氧元素按水的组成比夺取的作用。
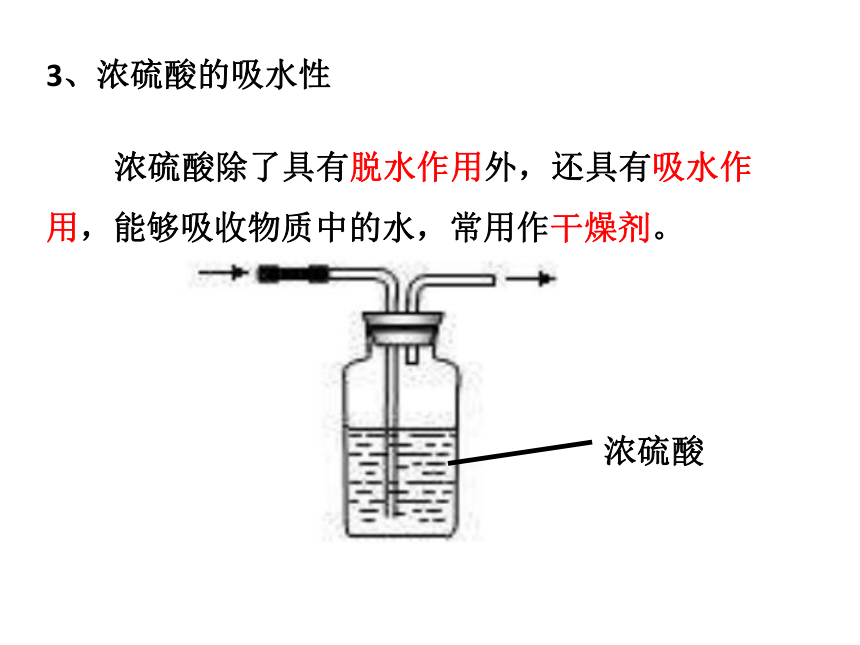
3、浓硫酸的吸水性
浓硫酸
浓硫酸除了具有脱水作用外,还具有吸水作用,能够吸收物质中的水,常用作干燥剂。
4、浓硫酸的稀释
如果将水注入浓硫酸,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出的热量能使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的。
如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
三、酸的化学性质
1、酸能使酸碱指示剂发生颜色变化
盐酸 硫酸
滴加
紫色石蕊溶液
盐酸 硫酸
盐酸 硫酸
滴加
无色酚酞溶液
盐酸 硫酸
酸能使酸碱指示剂显示不同的颜色——使紫色石蕊变红,无法使酚酞溶液变色
2、酸与活泼金属反应生成氢气和金属化合物
金属 + 酸 ==== 金属化合物 + 氢气
3、酸能与某些金属氧化物反应,生成金属化合物和水
铁锈的主要成分是?
氧化铁(Fe2O3)
加入
稀盐酸
铁锈消失,铁钉变得光亮,无色溶液变黄
加入
稀硫酸
铁锈消失,铁钉变得光亮,无色溶液变黄
金属氧化物 + 酸 === 金属化合物 + 水
酸能与某些金属氧化物反应,生成金属化合物和水
四、常见的碱
1、氢氧化钠
苛性钠、火碱、烧碱
氢氧化钠有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
氢氧化钠暴露在空气中容易吸收水分,表明潮湿并逐渐溶解,这种现象叫做潮解。
氢氧化钠溶解于水时会放出热。
氢氧化钠可用做某些气体的干燥剂。
2、氢氧化钙
熟石灰
消石灰
CaO + H2O = Ca(OH)2
生石灰 熟石灰
反应过程中放出大量的热。
氢氧化钙的制备
工业上通过高温煅烧石灰石生产生石灰:
氧化钙俗称生石灰,具有吸水性,常用作干燥剂。
CaCO3 CaO+CO2↑
氢氧化钙微溶于水,其水溶液俗称石灰水;
过滤
装瓶
氢氧化钙无法完全溶解,呈浑浊状态
当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆。
俗称 苛性钠、火碱、烧碱
(强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热,溶液有涩味和滑腻感。 微溶于水
(溶液俗称石灰水)
其他 易潮解
(作干燥剂) 可由生石灰加水制得(放热)
CaO+H2O=Ca(OH)2
用途 化工原料:广泛用于肥皂、石油、造纸、纺织、印染等工业。 砌砖、抹墙;制氢氧化钠、制漂白粉;降低土壤酸性;制波尔多液。
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
除氢氧化钠( NaOH ) 、氢氧化钙( Ca(OH)2 )外,常用的碱还有氢氧化钾( KOH )、氢氧化钡
【 Ba(OH)2 】 、氨水( NH3·H2O )等。
常见的碱
五、碱的化学性质
氢氧 氢氧
化钠 化钙
滴加
紫色石蕊溶液
氢氧 氢氧
化钠 化钙
1、碱与酸碱指示剂作用
氢氧 氢氧
化钠 化钙
滴加
无色酚酞溶液
氢氧 氢氧
化钠 化钙
碱能使酸碱指示剂显示不同的颜色——使紫色石蕊溶液变蓝色,使酚酞溶液变红色。
2、碱能与某些非金属氧化物反应生成金属化合物和水
CO2
试管中会出现什么现象?
澄清石灰水变浑浊
试管中发生了什么反应?
Ca(OH)2 + CO2 === CaCO3 ↓ + H2O
2NaOH + CO2 === Na2CO3 + H2O
碱 + 非金属 === 金属 + 水
氧化物 化合物
根据碱的化学性质,写出三氧化硫与氢氧化钠反应的化学方程式
NaOH + SO3 ===
碱 + 非金属 === 金属 + 水
氧化物 化合物
Na2SO4 + H2O
2
2NaOH + CO2 === Na2CO3 + H2O
Ca(OH)2 + CO2 === CaCO3 ↓ + H2O
六、溶液的导电性
稀盐酸、稀硫酸、氢氧化钠和氢氧化钠能导电,蒸馏水和乙醇不导电。这说明,在盐酸、硫酸、氢氧化钠溶液和氢氧化钙溶液中存在带电的粒子。
酸是指在水溶液中能解离出氢离子和酸根离子的物质
碱是指在水溶液中能解离出氢氧根和金属离子的物质
写出下列酸碱在水中解离出的离子
思考: ①②③ ④的作用分别是什么?
① ② ③
④
气体
①的作用是检验气体中是否含有二氧化碳
②的作用是吸收气体中的二氧化碳
③的作用是吸收气体中的水
④的作用是检验气体中是否含有水,如果有水 无水硫酸铜会变蓝色
1、(1)醋酸 、柠檬酸 、盐酸 、
氢氧化钙 、氢氧化钠
(2)吸收水分、潮解 、CO2 、
Na2CO3 、密封
2、(1)B (2) C
3、分别取1~2mL未知液于试管中,向试管中通入CO2,出现白色沉淀的原溶液是石灰水,没有变化的原溶液时氢氧化钠溶液。
课后习题
4、生石灰可以与水反应,所以可以做干燥剂,反应的化学反应式为:。
打开的干燥剂吸水后变为Ca(OH)2,还可继续与空气中的CO2反应,生成块状的碳酸钙,反应的化学方程式为:
Ca(OH)2+CO2=CaCO3↓+H2O
5、石灰浆含有Ca(OH)2,干燥的过程中与CO2反应,生成难溶于水的碳酸钙,就变硬了,反应的化学方程式为:
Ca(OH)2+CO2=CaCO3↓+H2O
6、
解:设可生产FeSO4的质量是x。
9.8t ×20% = 1.96t
98 152
1.96t x
98 1.96t
152 x ,解得x= 3.04t
答:可生成FeSO4的质量是3.04t
课题1 常见的酸和碱
调味品食醋有酸味,就是因为食醋中含有醋酸;一些水果有酸味、是因为水果中含有各种果酸。
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴,印染等。
石灰水中含有的氢氧化钙,清洁剂中含有的氢氧化钠,它们都属于碱。
如何区分酸和碱呢?
酸碱指示剂:紫色石蕊溶液、无色酚酞溶液
变色规律:
紫色石蕊溶液:遇酸溶液变红色,遇碱溶液变蓝色
加入紫色石蕊溶液
加入酚酞溶液
无色酚酞溶液:遇酸不变色,遇碱溶液变红色
二、常见的酸
1、常见的酸
实验室常用的酸有盐酸和硫酸
盐酸(HCl) 硫酸(H2SO4)
颜色 纯净的浓盐酸是无色的液体 纯净的浓硫酸是无色、黏稠的油状液体
打开试剂瓶后的现象 有挥发性,能在空气中形成白雾 不易挥发
气味 有刺激性气味 无味
密度 常用浓盐酸(37%~38%)1.19g/cm 常用浓硫酸(98%)1.84g/cm
用 途
盐 酸
HCl 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。
硫 酸
H2SO4 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它作干燥剂。
在实验室和化工生产中常用的酸还有硝酸、醋酸等。
HNO3
CH3COOH
2、浓硫酸的腐蚀性
浓硫酸有强烈的腐蚀性。它能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。所以,使用浓硫酸时应十分小心。
浓硫酸的腐蚀性是因为它具有脱水作用——能将物质中的氢、氧元素按水的组成比夺取的作用。
3、浓硫酸的吸水性
浓硫酸
浓硫酸除了具有脱水作用外,还具有吸水作用,能够吸收物质中的水,常用作干燥剂。
4、浓硫酸的稀释
如果将水注入浓硫酸,由于水的密度较小,水会浮在浓硫酸上面,溶解时放出的热量能使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的。
如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
三、酸的化学性质
1、酸能使酸碱指示剂发生颜色变化
盐酸 硫酸
滴加
紫色石蕊溶液
盐酸 硫酸
盐酸 硫酸
滴加
无色酚酞溶液
盐酸 硫酸
酸能使酸碱指示剂显示不同的颜色——使紫色石蕊变红,无法使酚酞溶液变色
2、酸与活泼金属反应生成氢气和金属化合物
金属 + 酸 ==== 金属化合物 + 氢气
3、酸能与某些金属氧化物反应,生成金属化合物和水
铁锈的主要成分是?
氧化铁(Fe2O3)
加入
稀盐酸
铁锈消失,铁钉变得光亮,无色溶液变黄
加入
稀硫酸
铁锈消失,铁钉变得光亮,无色溶液变黄
金属氧化物 + 酸 === 金属化合物 + 水
酸能与某些金属氧化物反应,生成金属化合物和水
四、常见的碱
1、氢氧化钠
苛性钠、火碱、烧碱
氢氧化钠有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
氢氧化钠暴露在空气中容易吸收水分,表明潮湿并逐渐溶解,这种现象叫做潮解。
氢氧化钠溶解于水时会放出热。
氢氧化钠可用做某些气体的干燥剂。
2、氢氧化钙
熟石灰
消石灰
CaO + H2O = Ca(OH)2
生石灰 熟石灰
反应过程中放出大量的热。
氢氧化钙的制备
工业上通过高温煅烧石灰石生产生石灰:
氧化钙俗称生石灰,具有吸水性,常用作干燥剂。
CaCO3 CaO+CO2↑
氢氧化钙微溶于水,其水溶液俗称石灰水;
过滤
装瓶
氢氧化钙无法完全溶解,呈浑浊状态
当石灰水中存在较多未溶解的熟石灰时,就称为石灰乳或石灰浆。
俗称 苛性钠、火碱、烧碱
(强腐蚀性) 熟石灰、消石灰
(有腐蚀性)
颜色、状态 白色固体 白色粉末
溶解性 极易溶于水,放出大量热,溶液有涩味和滑腻感。 微溶于水
(溶液俗称石灰水)
其他 易潮解
(作干燥剂) 可由生石灰加水制得(放热)
CaO+H2O=Ca(OH)2
用途 化工原料:广泛用于肥皂、石油、造纸、纺织、印染等工业。 砌砖、抹墙;制氢氧化钠、制漂白粉;降低土壤酸性;制波尔多液。
氢氧化钠和氢氧化钙的物理性质和用途
物质
性质
氢氧化钠
氢氧化钙
除氢氧化钠( NaOH ) 、氢氧化钙( Ca(OH)2 )外,常用的碱还有氢氧化钾( KOH )、氢氧化钡
【 Ba(OH)2 】 、氨水( NH3·H2O )等。
常见的碱
五、碱的化学性质
氢氧 氢氧
化钠 化钙
滴加
紫色石蕊溶液
氢氧 氢氧
化钠 化钙
1、碱与酸碱指示剂作用
氢氧 氢氧
化钠 化钙
滴加
无色酚酞溶液
氢氧 氢氧
化钠 化钙
碱能使酸碱指示剂显示不同的颜色——使紫色石蕊溶液变蓝色,使酚酞溶液变红色。
2、碱能与某些非金属氧化物反应生成金属化合物和水
CO2
试管中会出现什么现象?
澄清石灰水变浑浊
试管中发生了什么反应?
Ca(OH)2 + CO2 === CaCO3 ↓ + H2O
2NaOH + CO2 === Na2CO3 + H2O
碱 + 非金属 === 金属 + 水
氧化物 化合物
根据碱的化学性质,写出三氧化硫与氢氧化钠反应的化学方程式
NaOH + SO3 ===
碱 + 非金属 === 金属 + 水
氧化物 化合物
Na2SO4 + H2O
2
2NaOH + CO2 === Na2CO3 + H2O
Ca(OH)2 + CO2 === CaCO3 ↓ + H2O
六、溶液的导电性
稀盐酸、稀硫酸、氢氧化钠和氢氧化钠能导电,蒸馏水和乙醇不导电。这说明,在盐酸、硫酸、氢氧化钠溶液和氢氧化钙溶液中存在带电的粒子。
酸是指在水溶液中能解离出氢离子和酸根离子的物质
碱是指在水溶液中能解离出氢氧根和金属离子的物质
写出下列酸碱在水中解离出的离子
思考: ①②③ ④的作用分别是什么?
① ② ③
④
气体
①的作用是检验气体中是否含有二氧化碳
②的作用是吸收气体中的二氧化碳
③的作用是吸收气体中的水
④的作用是检验气体中是否含有水,如果有水 无水硫酸铜会变蓝色
1、(1)醋酸 、柠檬酸 、盐酸 、
氢氧化钙 、氢氧化钠
(2)吸收水分、潮解 、CO2 、
Na2CO3 、密封
2、(1)B (2) C
3、分别取1~2mL未知液于试管中,向试管中通入CO2,出现白色沉淀的原溶液是石灰水,没有变化的原溶液时氢氧化钠溶液。
课后习题
4、生石灰可以与水反应,所以可以做干燥剂,反应的化学反应式为:。
打开的干燥剂吸水后变为Ca(OH)2,还可继续与空气中的CO2反应,生成块状的碳酸钙,反应的化学方程式为:
Ca(OH)2+CO2=CaCO3↓+H2O
5、石灰浆含有Ca(OH)2,干燥的过程中与CO2反应,生成难溶于水的碳酸钙,就变硬了,反应的化学方程式为:
Ca(OH)2+CO2=CaCO3↓+H2O
6、
解:设可生产FeSO4的质量是x。
9.8t ×20% = 1.96t
98 152
1.96t x
98 1.96t
152 x ,解得x= 3.04t
答:可生成FeSO4的质量是3.04t
同课章节目录
