第十单元 课题2 酸和碱的中和反应课件(共28张PPT)
文档属性
| 名称 | 第十单元 课题2 酸和碱的中和反应课件(共28张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-12 21:47:06 | ||
图片预览







文档简介
(共28张PPT)
课题2 酸和碱的中和反应
酸有相似的化学性质,碱也有相似的化学性质,那么,酸和碱能否发生反应呢?
一、中和反应
滴加
酚酞试液
为什么溶液会变红?
氢氧化钠
溶液
因为碱能使酚酞变红
思考:
如果烧杯中的氢氧化钠消失了,会发生什么现象?
如果烧杯中的酚酞消失了,又会发生什么现象?
边滴加稀盐酸
边用玻璃棒搅拌
溶液变回无色,说明溶液中什么没了?
假设1:氢氧化钠没了
假设2:酚酞没了
思考:如何验证假设1和假设2?
1、取烧杯中少量溶液于试管中,滴入酚酞,如果变红说明溶液中有氢氧化钠,反之没有。
2、取烧杯中少量溶液于试管中,滴入氢氧化钠,如果变红说明溶液中有酚酞,反之没有。
取少量液体于
玻璃片上
并放在火焰上烘干
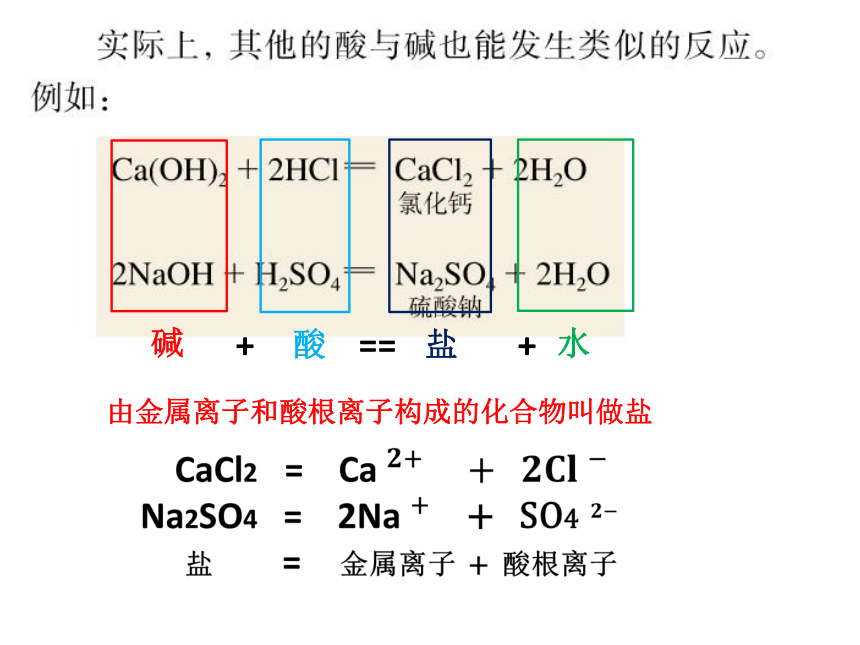
在上述的实验中,发生了如下的反应,生成了氯化钠和水:
碱
酸
盐
水
由金属离子和酸根离子构成的化合物叫做盐
+ == +
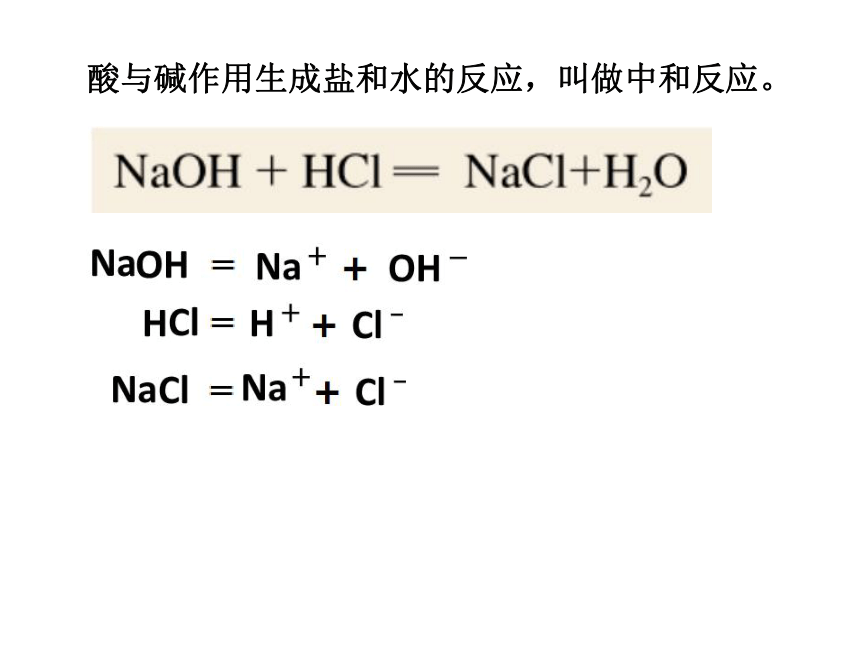
酸与碱作用生成盐和水的反应,叫做中和反应。
中和反应的本质是氢氧根与氢离子反应生成水
1.改变土壤的酸碱性
二、中和反应在实际中的应用
2.处理工厂的废水
试写出胃康—U治胃酸过多的原理。
主要成分氢氧化铝
3HCl+Al(OH)3====AlCl3+3H2O
3.用于医药
4、被蚊虫叮咬后,可以涂一些含有碱性物质的溶液,可以减轻痛痒
1.溶液的酸碱性如何来试验?
2.溶液酸碱性的强弱程度如何来表示呢?
想一想
pH
pH的范围通常在0~14之间
pH=7时,溶液呈中性
pH<7时,溶液呈酸性
pH>7时,溶液呈碱性
三、溶液酸碱度的表示法——pH
测定pH最简便的方法:用pH试纸
测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液滴在pH试纸上,把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
标准比色卡
pH试纸
(1)化工生产中许多反应必须在一定pH的溶液里才能进行;
(2)在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
(3)测定雨水的pH,可以了解空气的污染情况,正常雨水pH≈5.6,pH < 5.6的降雨成为酸雨;
(4)测定人体内或排出的液体的pH,可以了解人体的健康情况。
了解溶液的酸碱度有重要的意义
人体内的一些液体和排泄物的正常pH范围
血浆 7.35 ~ 7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
乳汁 6.6 ~ 7.6
胆汁 7.1 ~ 7.3
胰液 7.5 ~ 8.0
尿液 4.7 ~ 8.4
粪便 4.6 ~ 8.4
四、酸溶液与酸性溶液、碱溶液与碱性溶液
酸溶液:溶质为酸的溶液;
酸性溶液:pH<7的溶液。
碱溶液:溶质为碱的溶液;
碱性溶液:pH>7的溶液。
碳酸钠溶液不是碱溶液,是碱性溶液
氯化铁溶液不是酸溶液,是酸性溶液
五、实验10-8中烧杯里溶液的pH变化
1、烧杯中发生的化学反应:
2、烧杯中溶液的溶质变化
①反应前:
②反应中:
③反应后:
NaOH
NaOH
HCl
NaCl
、HCl
向NaOH溶液中滴加HCl溶液:
(1)滴加HCl前,溶液中的溶质为______,pH___7,溶液显___性;
(2) 滴加少量HCl,溶液中的溶质为__________,pH___7,溶液显___性;
(3) 滴加的HCl与NaOH恰好完全反应,溶液中的溶质为_____,pH___7,溶液显___性;
(4)滴加过量的HCl,溶液中的溶质为_________,pH 7,溶液显 性,
>
碱
NaOH、NaCl
=
中
>
酸
碱
NaCl
NaOH
NaCl、HCl
<
向NaOH溶液中滴加HCl溶液:
(1)当滴入HCl溶液不足时,pH 7,溶液显 性, 有 剩余。
(2)当滴入HCl溶液与NaOH溶液恰好完全反应时,
pH 7,溶液显 性。
(3)当滴入HCl溶液过量时,pH 7,溶液显 性,
氢氧化钠有剩余。
>
碱
NaOH
=
中
<
酸
1、
(1)酸、红、碱、红
(2)pH试纸、玻璃棒、pH试纸、标准比色卡
③先将含有盐酸的废液倒入废液缸中,加碱溶液中和、
(3)①Al(OH)3 + 3HCl===AlCl3 + 3H2O
②稀盐酸、Mg(OH)2+2HCl=MgCl2+2H2O
酸、 碱 、 中和
课后习题
2、A
3、
方法一:取少量河水样品与试管中,滴加2~3滴酚酞溶液,若溶液变红,则说明河水已被碱性溶液污染
方法二:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取河水样品滴到pH试纸上,把试纸显示的颜色的颜色与标准比色卡比较,若读出该溶液的pH > 7,则说明河水已被碱性溶液污染。
治理措施:向被污染呈碱性的河水中加入适量的酸性溶液中和。
4、
(1)雨水是酸雨,在测定期间酸性增强
(2)造成酸雨的原因主要是SO2,来自硫酸厂的废气和燃煤过程中产生SO2,SO2与水和氧气作用后可以生成H2SO4,使雨水产生酸性。可采取的措施是将SO2用碱性溶液吸收掉,减少SO2排放。
5、
解:设这一定量石油产品中含有H2SO4的质量是x。
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 40g×15%
98 x
80 40g×15% ,解得 x=7.35g
答:这一定量石油产品中含有H2SO4的质量是7.35g
课题2 酸和碱的中和反应
酸有相似的化学性质,碱也有相似的化学性质,那么,酸和碱能否发生反应呢?
一、中和反应
滴加
酚酞试液
为什么溶液会变红?
氢氧化钠
溶液
因为碱能使酚酞变红
思考:
如果烧杯中的氢氧化钠消失了,会发生什么现象?
如果烧杯中的酚酞消失了,又会发生什么现象?
边滴加稀盐酸
边用玻璃棒搅拌
溶液变回无色,说明溶液中什么没了?
假设1:氢氧化钠没了
假设2:酚酞没了
思考:如何验证假设1和假设2?
1、取烧杯中少量溶液于试管中,滴入酚酞,如果变红说明溶液中有氢氧化钠,反之没有。
2、取烧杯中少量溶液于试管中,滴入氢氧化钠,如果变红说明溶液中有酚酞,反之没有。
取少量液体于
玻璃片上
并放在火焰上烘干
在上述的实验中,发生了如下的反应,生成了氯化钠和水:
碱
酸
盐
水
由金属离子和酸根离子构成的化合物叫做盐
+ == +
酸与碱作用生成盐和水的反应,叫做中和反应。
中和反应的本质是氢氧根与氢离子反应生成水
1.改变土壤的酸碱性
二、中和反应在实际中的应用
2.处理工厂的废水
试写出胃康—U治胃酸过多的原理。
主要成分氢氧化铝
3HCl+Al(OH)3====AlCl3+3H2O
3.用于医药
4、被蚊虫叮咬后,可以涂一些含有碱性物质的溶液,可以减轻痛痒
1.溶液的酸碱性如何来试验?
2.溶液酸碱性的强弱程度如何来表示呢?
想一想
pH
pH的范围通常在0~14之间
pH=7时,溶液呈中性
pH<7时,溶液呈酸性
pH>7时,溶液呈碱性
三、溶液酸碱度的表示法——pH
测定pH最简便的方法:用pH试纸
测定时,在玻璃片或白瓷板上放一片pH试纸,用玻璃棒蘸取待测溶液滴在pH试纸上,把试纸显示的颜色跟标准比色卡对照,即可得出溶液的pH。
标准比色卡
pH试纸
(1)化工生产中许多反应必须在一定pH的溶液里才能进行;
(2)在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
(3)测定雨水的pH,可以了解空气的污染情况,正常雨水pH≈5.6,pH < 5.6的降雨成为酸雨;
(4)测定人体内或排出的液体的pH,可以了解人体的健康情况。
了解溶液的酸碱度有重要的意义
人体内的一些液体和排泄物的正常pH范围
血浆 7.35 ~ 7.45
唾液 6.6 ~ 7.1
胃液 0.9 ~ 1.5
乳汁 6.6 ~ 7.6
胆汁 7.1 ~ 7.3
胰液 7.5 ~ 8.0
尿液 4.7 ~ 8.4
粪便 4.6 ~ 8.4
四、酸溶液与酸性溶液、碱溶液与碱性溶液
酸溶液:溶质为酸的溶液;
酸性溶液:pH<7的溶液。
碱溶液:溶质为碱的溶液;
碱性溶液:pH>7的溶液。
碳酸钠溶液不是碱溶液,是碱性溶液
氯化铁溶液不是酸溶液,是酸性溶液
五、实验10-8中烧杯里溶液的pH变化
1、烧杯中发生的化学反应:
2、烧杯中溶液的溶质变化
①反应前:
②反应中:
③反应后:
NaOH
NaOH
HCl
NaCl
、HCl
向NaOH溶液中滴加HCl溶液:
(1)滴加HCl前,溶液中的溶质为______,pH___7,溶液显___性;
(2) 滴加少量HCl,溶液中的溶质为__________,pH___7,溶液显___性;
(3) 滴加的HCl与NaOH恰好完全反应,溶液中的溶质为_____,pH___7,溶液显___性;
(4)滴加过量的HCl,溶液中的溶质为_________,pH 7,溶液显 性,
>
碱
NaOH、NaCl
=
中
>
酸
碱
NaCl
NaOH
NaCl、HCl
<
向NaOH溶液中滴加HCl溶液:
(1)当滴入HCl溶液不足时,pH 7,溶液显 性, 有 剩余。
(2)当滴入HCl溶液与NaOH溶液恰好完全反应时,
pH 7,溶液显 性。
(3)当滴入HCl溶液过量时,pH 7,溶液显 性,
氢氧化钠有剩余。
>
碱
NaOH
=
中
<
酸
1、
(1)酸、红、碱、红
(2)pH试纸、玻璃棒、pH试纸、标准比色卡
③先将含有盐酸的废液倒入废液缸中,加碱溶液中和、
(3)①Al(OH)3 + 3HCl===AlCl3 + 3H2O
②稀盐酸、Mg(OH)2+2HCl=MgCl2+2H2O
酸、 碱 、 中和
课后习题
2、A
3、
方法一:取少量河水样品与试管中,滴加2~3滴酚酞溶液,若溶液变红,则说明河水已被碱性溶液污染
方法二:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒蘸取河水样品滴到pH试纸上,把试纸显示的颜色的颜色与标准比色卡比较,若读出该溶液的pH > 7,则说明河水已被碱性溶液污染。
治理措施:向被污染呈碱性的河水中加入适量的酸性溶液中和。
4、
(1)雨水是酸雨,在测定期间酸性增强
(2)造成酸雨的原因主要是SO2,来自硫酸厂的废气和燃煤过程中产生SO2,SO2与水和氧气作用后可以生成H2SO4,使雨水产生酸性。可采取的措施是将SO2用碱性溶液吸收掉,减少SO2排放。
5、
解:设这一定量石油产品中含有H2SO4的质量是x。
H2SO4+2NaOH=Na2SO4+2H2O
98 80
x 40g×15%
98 x
80 40g×15% ,解得 x=7.35g
答:这一定量石油产品中含有H2SO4的质量是7.35g
同课章节目录
