〖卷09〗人教九年级化学下册同步高效作业本:9.3 溶液的浓度(含解析)
文档属性
| 名称 | 〖卷09〗人教九年级化学下册同步高效作业本:9.3 溶液的浓度(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-09 19:10:20 | ||
图片预览

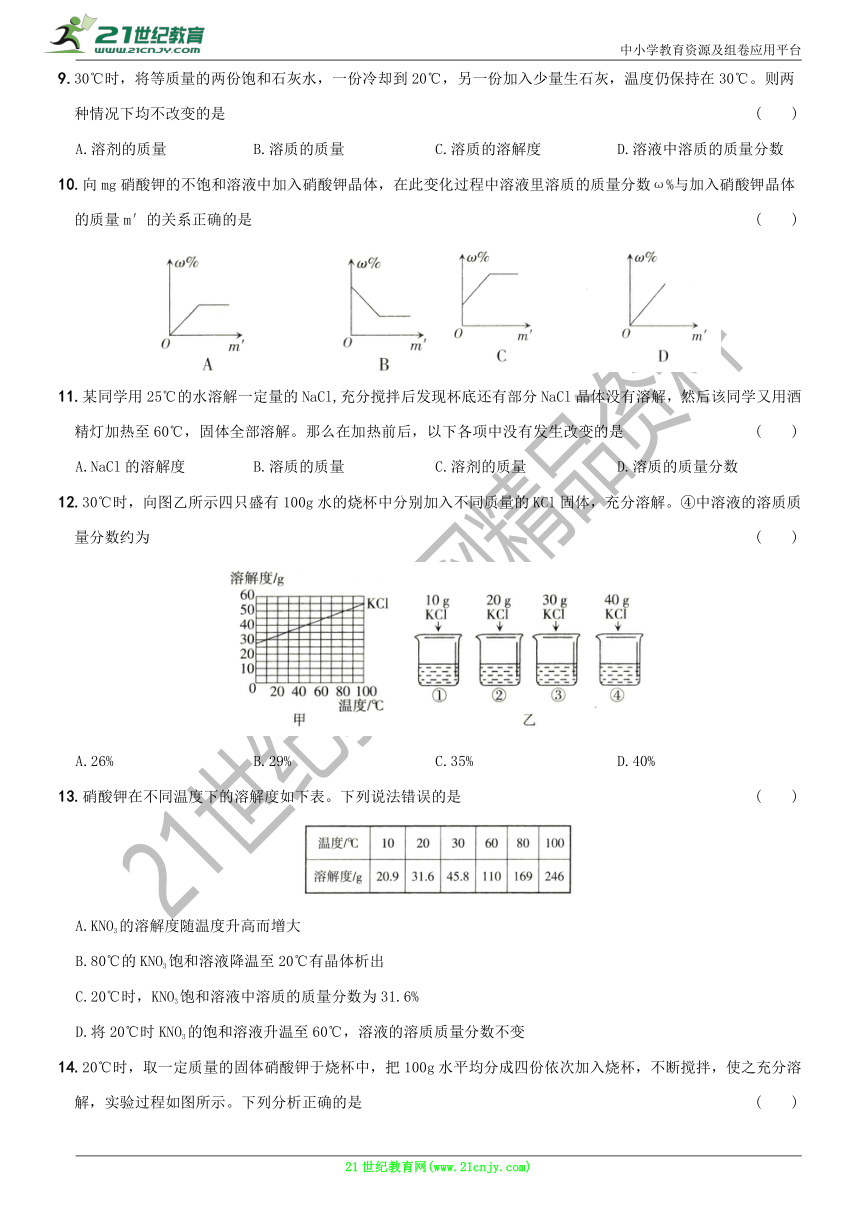



文档简介
中小学教育资源及组卷应用平台
第九单元 溶液
课题3 溶液的浓度(含2课时)
第1课时 溶质的质量分数
基础达标练
知识点1 溶质质量分数的含义及基本计算
1.农业生产中常用溶质质量分数为16%的氯化钠溶液来选种。下列对该溶液的理解正确的是 ( )
A.溶液中含氯化钠16g B.溶液质量为100g C.每100g溶液中含氯化钠16g D.每100g水中含氯化钠16g
2.向100g10%的NaOH溶液中加入12.5gNaOH固体,完全溶解后,所得溶液中溶质的质量分数为 ( )
A.12.5% B.20% C.22.5% D.25%
3.下列条件下的氢氧化钙溶液,溶质质量分数最大的是 ( )
A.30℃的不饱和溶液 B.30℃的饱和溶液 C.90℃的不饱和溶液 D.90℃的饱和溶液
4.现有一杯20℃的硝酸钾饱和溶液,下列方法中能改变其溶质质量分数的是 ( )
A.加入一定量的固体硝酸钾 B.恒温蒸发部分水
C.将温度升高到60℃ D.加入一定量的水
5.已知20℃时氯化钠的溶解度是36g,则20℃时氯化钠饱和溶液中溶质的质量分数为________________(列出计算式),________(填“大于”或“小于”)36%。
知识点2 溶液的稀释
6.在100g溶质质量分数为10%的氯化钠溶液中加入100g水,则所得溶液中 ( )
A.溶剂质量不变 B.溶剂质量增加一倍 C.溶质的质量分数变为原来的一半 D.溶液质量不变
7.若要将50g溶质质量分数为20%的氯化钠溶液稀释成溶质质量分数为10%的氯化钠溶液,需加入的水的质量为 ( )
A.25g B.40g C.50g D.100g
8.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂。
(1)常用的医用消毒剂双氧水的溶质质量分数是5%,5%的含义是每100g________中含115g。
(2)明明配制了5%的双氧水600g,600g溶液中溶质为g,溶剂为________g.
(3)明明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为________.
(4)若要用明明配制的双氧水配制质量分数为4%的双氧水,需要加入水的质量为________g.
重点提升练
9.30℃时,将等质量的两份饱和石灰水,一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃。则两种情况下均不改变的是 ( )
A.溶剂的质量 B.溶质的质量 C.溶质的溶解度 D.溶液中溶质的质量分数
10.向mg硝酸钾的不饱和溶液中加入硝酸钾晶体,在此变化过程中溶液里溶质的质量分数ω%与加入硝酸钾晶体的质量m′的关系正确的是 ( )
11.某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解,然后该同学又用酒精灯加热至60℃,固体全部溶解。那么在加热前后,以下各项中没有发生改变的是 ( )
A.NaCl的溶解度 B.溶质的质量 C.溶剂的质量 D.溶质的质量分数
12.30℃时,向图乙所示四只盛有100g水的烧杯中分别加入不同质量的KCl固体,充分溶解。④中溶液的溶质质量分数约为 ( )
A.26% B.29% C.35% D.40%
13.硝酸钾在不同温度下的溶解度如下表。下列说法错误的是 ( )
A.KNO3的溶解度随温度升高而增大
B.80℃的KNO3饱和溶液降温至20℃有晶体析出
C.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
D.将20℃时KNO3的饱和溶液升温至60℃,溶液的溶质质量分数不变
14.20℃时,取一定质量的固体硝酸钾于烧杯中,把100g水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是 ( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液 B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液中溶质的质量分数变大 D.丙→丁过程中,硝酸钾溶液中溶质的质量分数变大
15.某温度下,在100g溶质质量分数为20%的KNO3不饱和溶液甲中加入10g KNO3固体,恰好得到饱和溶液乙。下列说法正确的是 ( )
A.该温度下,KNO3的溶解度为30g B.乙溶液中溶质的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液 D.升高温度,甲、乙两溶液中溶质的质量分数都增大
16.欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品。KNO3、NaCl的溶解度曲线如图所示。
(1)从KNO3和NaCl的溶解度曲线图中可得到的一条信息是________________________________________。
50℃时,将85.5g固体药品溶于100g水中,得到的是KNO3的________(填“饱和”或“不饱和”)溶液。将KNO3提纯的方法是________________________。
(2)小红提出,一定量20℃时31.6%的KNO3溶液可通过稀释配制成5%的溶液。你认为是否可行?________(填“可行”或“不可行”)。
核心素养练
17.“84”消毒液常用于消毒,其有效成分是次氯酸钠(NaClO)。某品牌的“84”消毒液的部分说明如下所示:
“84”消毒液 产品特点:主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.19%~6.9%。 餐具消毒:用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 注意事项: ①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如洁厕类清洁产品)同时使用。
(1)喷洒“84”消毒液后,室内充满刺激性气味,主要体现的分子的性质是________________________________。
(2)依据“84”消毒液的部分说明,将有效氯的质量分数为6.0%的“84”消毒液与水按质量比为1:________进行稀释,即可用于餐具消毒。若量取水时仰视读数,则配制的溶液中溶质的质量分数________(填“偏大”“偏小”或“无影响”)。
★防错小贴士★
1.溶液具有均一性,溶液中各部分溶质的质量分数相等。[详见第8(3)题]
2.溶液稀释前后溶质的质量不变。[详见第8(4)、17(2)题]
3.饱和溶液中溶质的质量分数= ×100%。(详见第5、13题)
第2课时 溶质质量分数与化学方程式的综合计算
基础达标练
知识点 涉及化学反应的溶质质量分数的计算
1.某同学量取40mL溶质质量分数为20%的盐酸(密度为1.1g/mL)与大理石充分反应制取二氧化碳,试计算生成二氧化碳的质量。(计算结果精确至0.1g)
2.在一次实验课上,同学们取50g过氧化氢溶液与2g二氧化锰混合制取氧气,充分反应后,测得剩余液体的质量是48.4g。请计算该过氧化氢溶液中溶质的质量分数。
3.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20mL(密度为1.1g/mL)的该盐酸与大理石充分反应,共用去含碳酸钙85%的大理石7.1g。计算:该浓盐酸中溶质的质量分数。
4.某研究性学习小组为测定铜锌合金中铜的质量分数,进行了如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示。计算:稀硫酸中溶质的质量分数。
重点提升练
5.化学兴趣小组的同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不能与酸反应,高温时不分解)。为了测定该石灰石的纯度,兴趣小组的同学取30g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸200g等分4次加入,每次充分反应后,经过滤、干燥后称量,剩余固体的质量见下表:
请回答下列问题:
(1)石灰石样品中所含杂质的质量为________g.
(2)第一次实验中产生二氧化碳的质量是多少?(写出计算过程)
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
6.农业生产中常用一定溶质质量分数的氯化钠溶液进行
选种。实验小组取该氯化钠溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。(提示:氯化钠溶液与硝酸银溶液反应的化学方程式为NaCl+AgNO=AgCl↓+NaNO3)
计算:该氯化钠溶液中溶质的质量分数。
7.化学兴趣小组的同学欲测定某铁粉与碳粉混合物中铁的质量分数,进行了如图所示的实验。
请计算:
(1)混合物中铁的质量为________g.
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸中溶质的质量分数。
8.某同学在实验室中用氯酸钾与二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收利用,实验操作及数据记录如下。
(1)最后得到的滤渣应是________________(填化学式)。
(2)得到氧气的质量是________g。
(3)计算滤液中溶质的质量分数。
9.某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀硫酸测定废水中氢氧化钾的含量,反应的化学方程式为2KOH+H2SO4=K2SO4+2H2O(废水中其他杂质不与稀硫酸反应)。试计算:
(1)现有溶质质量分数为98%的浓硫酸(密度为1.84g/mL)50mL,如要制成质量分数为2%的稀硫酸,需要加水多少毫升?
(2)取20g废水于容器中,逐滴加入2%的稀硫酸,至恰好完全反应时,消耗稀硫酸9.8g,求废水中氢氧化钾的质量分数。
核心素养练
10.漂白液是家庭常用的洗涤剂。工业上常用氢氧化钠溶液吸收氯气来制漂白液,反应的化学方程式是Cl2+2NaOH=NaClO+NaCl+H2O。现向氢氧化钠溶液中通入氯气,恰好完全反应,得到含次氯酸钠(NaClO)5%的漂白液1490g。请计算:
(1)已知含次氯酸钠0.05%的漂白液用于家居消毒效果最佳。现取5g制得的漂白液,为了达到最佳的消毒效果,需加入水的质量为________g。
(2)氢氧化钠溶液中溶质的质量。
★防错小贴士★
根据化学方程式进行计算时,需要把液体的体积换算成质量,溶液质量=溶液体积×溶液密度。(详见第3、9题)
《参考答案及解析》
课题3 溶液的浓度
第1课时 溶质的质量分数
1.C
[解析]溶质的质量分数作为表示溶液组成的一种方法,通常用百分数表示,含义是在100份质量的溶液中溶质所占的比例。
2.B
[解析]所得溶液中溶质的质量分数为×100%=20%。
3.B
[解析]氢氧化钙的溶解度随温度的升高而减小,溶质质量分数最大的是较低温度下的饱和溶液。
4.D
[解析]向饱和的硝酸钾溶液中加硝酸钾固体是不能溶解的;恒温蒸发水时,溶质和溶剂都减少,溶液依然饱和;将温度升高时,溶质和溶剂的量均没有变化。因此,A、B、C项的做法均不能改变溶质的质量分数。加入水时,溶质的质量不变,溶液的质量增大,所以溶质的质量分数变小。
5.×100% 小于
[解析]饱和溶液中溶质的质量分数为×100%。
6.C
[解析]加入100g水后所得溶液中溶剂的质量增加了100g,则溶液质量增加了100g,而溶质质量不变,所以溶质的质量分数变为原来的一半。
7.C
[解析]要将溶质质量分数变为原来的一半,需加入的水的质量应与原溶液的质量相等。
8.(1)双氧水 H2O2(或过氧化氢)
(2)30 570
(3)5%
(4)150
[解析]
(2)溶质质量为600g×5%=30g,溶剂质量为600g-30g=570g
(3)溶液具有均一性,所以剩下的溶液中溶质的质量分数不变,仍然是5%。
(4)根据溶液稀释前后溶质的质量不变,设需要加入水的质量为x,则600g×5%=(600g+x)×4%,x=150g,需要加入水的质量为150g
9.D
[解析]氢氧化钙的溶解度随温度的升高而减小,冷却后溶剂的质量、溶质的质量均不发生改变,溶解度变大,溶液中溶质的质量分数不变。饱和石灰水中加入少量生石灰,生石灰与水反应,溶剂的质量会变小,而温度仍保持在30℃,则溶解度不变,所以溶液中溶质的质量变小,溶质的质量分数不变。
10.C
[解析]向硝酸钾的不饱和溶液中加入硝酸钾晶体后,溶质的质量增大,溶质的质量分数增大,待溶液达到饱和后溶质的质量分数不再变化。溶质的质量分数的起点在纵轴上,不在原点。
11.C
[解析]_将NaCl的饱和溶液升温后溶剂的质量一定不变。
12.A
[解析]由溶解度曲线知,30℃时,KCl的溶解度约为35g,所以加入的40gKCl不能完全溶解,故④中溶液的溶质质量分数为×100%≈26%。
13.C
[解析]由硝酸钾的溶解度数据可知,硝酸钾的溶解度随温度的升高而增大,故A正确;硝酸钾的溶解度随温度的降低而减小,所以降温会使饱和溶液析出溶质,故B正确;20℃时,硝酸钾的溶解度是31.6g,饱和溶液中溶质的质量分数为×100%~24%,故C错误;将20℃时KNO3的饱和溶液升温至60℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液中溶质的质量分数不变,故D正确。
14.B
[解析]由题图可知,20℃时,甲烧杯中硝酸钾固体有剩余,故甲烧杯中硝酸钾溶液是饱和溶液,故A错误;丙烧杯中的固体硝酸钾已完全溶解,而丁烧杯又加入了25g水,所以,可以推断出丁烧杯中的硝酸钾溶液是不饱和溶液,故B正确;由题图可知,20℃时,乙为饱和溶液,乙→丙过程中,加入25g水,固体全部溶解,丙烧杯中可能是饱和溶液,也可能是不饱和溶液,若丙为饱和溶液,则乙→丙过程中,硝酸钾溶液中溶质的质量分数不变,若丙为不饱和溶液,则乙→丙过程中,硝酸钾溶液中溶质的质量分数变小,故C错误;丙→丁的过程中,溶质不变,溶剂增加,硝酸钾溶液中溶质的质量分数变小,故D错误。
15.C
[解析]某温度下,在100g20%的KNO3不饱和溶液中加入10gKNO3固体,恰好得到饱和溶液乙,此时,溶液中溶质的质量为100g×20%+10g=30g,溶剂的质量为100g-100g×20%=80g,即80g水中溶解30gKNO3,溶液达到饱和,100g水中溶解37.5gKNO3,溶液达到饱和,该温度下,KNO3的溶解度为37.5g,故A错误;乙溶液中溶质的质量分数为×100%≈27%,故B错误;降低温度,KNO的溶解度减小,可以使甲溶液变成饱和溶液,故正确;升高温度,KNO3的溶解度增大,但甲、乙溶液的组成均没有发生改变,溶质的质量分数不变,故D错误。
16.(1)20℃时KNO3的溶解度为31.6g(合理即可) 不饱和降温结晶(或冷却热的饱和溶液)
(2)不可行
[解析]
(1)50℃时,将85.5g固体药品溶于100g水中,由于85.5g固体中含有KNO3和NaCl2所以得到的是KNO3的不饱和溶液。
(2)20℃时,KNO3饱和溶液中溶质的质量分数为×100%~24%,所以不会出现20℃时31.6%的KNO3溶液。
17.(1)分子在不断运动
(2)149 偏小
[解析]
(2)设加入水的质量为m,有效氯的质量分数为6.0%的“84”消毒液的质量为x,则x×6.0%=(m+x)×0.04%,m=149x,所以有效氯的质量分数为6.0%的“84”消毒液的质量与水的质量比为x:m=x:149x=1:149。仰视读数时,实际量取水的体积变大,使配制的溶液中溶质的质量分数偏小。
第2课时 溶质质量分数与化学方程式的综合计算
1.解:盐酸中溶质的质量为1.1g/mL×40mL×20%=8.8g。
设生成二氧化碳的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
8.8g x
= x≈5.3g
答:生成二氧化碳的质量为5.3g
2.解:生成氧气的质量为50g-48.4g=1.6g。
设该过氧化氢溶液中溶质的质量为x。
2H2O22H2O+O2↑
68 32
x 1.6g
= x=3.4g
×100%=6.8%
答:该过氧化氢溶液中溶质的质量分数为6.8%。
3.解:设该浓盐酸中溶质的质量为x。
CaCO3 + 2HCl=CaCl2+H2O+CO2↑
100 73
7.1g×85% x
= x=4.4g
该浓盐酸中溶质的质量分数为×100%=20%
答:该浓盐酸中溶质的质量分数为20%。
4.解:由题图可知,当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气。
设参加反应的稀硫酸的质量为x。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.1g
= x=4.9g
稀硫酸中溶质的质量分数为4×100%=24.5%
答:稀硫酸中溶质的质量分数为24.5%。
5.(1)6
解:(2)第一次实验消耗石灰石样品中碳酸钙的质量为30g20g=10g.第一次消耗稀盐酸的质量为200g4=50g.
设第一次消耗的50g稀盐酸中氯化氢的质量为x,生成二氧化碳的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g x y
= x=7.3g
= y=4.4g
(3)所用稀盐酸中溶质的质量分数为×100%=14.6%
答:(2)第一次实验中产生二氧化碳的质量为4.4g;
(3)所用稀盐酸中溶质的质量分数是14.6%。
[解析]
(1)由表中的数据可知,第三次与第四次反应后剩余固体质量相等,说明第三次时碳酸钙已完全反应,剩余的固体为杂质,所以杂质的质量为6g.
6.解:设36g氯化钠溶液中溶质的质量为x。
NaCl+AgNO3=AgCl↓+NaNO
58.5 143.5
x 14.35g
= x=5.85g
该氯化钠溶液中溶质的质量分数为×100%=16.25%
答:该氯化钠溶液中溶质的质量分数为16.25%。
7.(1)5.6
(2)解:设稀硫酸中溶质的质量为x。
Fe + H2SO4=FeSO4+H2↑
56 98
5.6g x
= x=9.8g
所用稀硫酸中溶质的质量分数为×100%=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
8.(1)MnO2
(2)4.8
(3)解:设生成氯化钾的质量为x。
2KClO32KCl + 3O2↑
149 96
x 4.8g
= x=7.45g
滤液中溶质的质量分数为×100%=14.9%
答:滤液中溶质的质量分数为14.9%。
[解析]
(2)氯酸钾与二氧化锰均为固体,反应后氯化钾为固体,氧气为气体,所以反应前后固体的质量差即为生成的氧气的质量,则氧气的质量为15.5g-10.7g=4.8g.
9.(1)解:设需要加水的质量为x。
50mL×1.84g/mL×98%=(50mL×1.84g/mL+x)×2% x=4416g
需加水的体积为=4416mL
答:需加水的体积为4416mL。
(2)解:设参加反应的氢氧化钾的质量为y
2KOH + H2SO4=K2SO4+2H2O
112 98
y 9.8g×2%
= y=0.224g
废水中氢氧化钾的质量分数为×100%=1.12%
答:废水中氢氧化钾的质量分数为1.12%。
10.(1)495
(2)解:反应后次氯酸钠的质量是1490g×5%=74.5g
设参加反应的氢氧化钠的质量为y
Cl2+2NaOH=NaClO+NaCl+H2O
80 74.5
y 74.5g
= y=80g
答:氢氧化钠溶液中溶质的质量为80g
[解析]
(1)设需加入水的质量为x,根据溶液稀释前后溶质的质量不变可知,(5g+x)×0.05%=5g×5%,则x=495g。
21世纪教育网(www.21cnjy.com)
第九单元 溶液
课题3 溶液的浓度(含2课时)
第1课时 溶质的质量分数
基础达标练
知识点1 溶质质量分数的含义及基本计算
1.农业生产中常用溶质质量分数为16%的氯化钠溶液来选种。下列对该溶液的理解正确的是 ( )
A.溶液中含氯化钠16g B.溶液质量为100g C.每100g溶液中含氯化钠16g D.每100g水中含氯化钠16g
2.向100g10%的NaOH溶液中加入12.5gNaOH固体,完全溶解后,所得溶液中溶质的质量分数为 ( )
A.12.5% B.20% C.22.5% D.25%
3.下列条件下的氢氧化钙溶液,溶质质量分数最大的是 ( )
A.30℃的不饱和溶液 B.30℃的饱和溶液 C.90℃的不饱和溶液 D.90℃的饱和溶液
4.现有一杯20℃的硝酸钾饱和溶液,下列方法中能改变其溶质质量分数的是 ( )
A.加入一定量的固体硝酸钾 B.恒温蒸发部分水
C.将温度升高到60℃ D.加入一定量的水
5.已知20℃时氯化钠的溶解度是36g,则20℃时氯化钠饱和溶液中溶质的质量分数为________________(列出计算式),________(填“大于”或“小于”)36%。
知识点2 溶液的稀释
6.在100g溶质质量分数为10%的氯化钠溶液中加入100g水,则所得溶液中 ( )
A.溶剂质量不变 B.溶剂质量增加一倍 C.溶质的质量分数变为原来的一半 D.溶液质量不变
7.若要将50g溶质质量分数为20%的氯化钠溶液稀释成溶质质量分数为10%的氯化钠溶液,需加入的水的质量为 ( )
A.25g B.40g C.50g D.100g
8.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂。
(1)常用的医用消毒剂双氧水的溶质质量分数是5%,5%的含义是每100g________中含115g。
(2)明明配制了5%的双氧水600g,600g溶液中溶质为g,溶剂为________g.
(3)明明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为________.
(4)若要用明明配制的双氧水配制质量分数为4%的双氧水,需要加入水的质量为________g.
重点提升练
9.30℃时,将等质量的两份饱和石灰水,一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃。则两种情况下均不改变的是 ( )
A.溶剂的质量 B.溶质的质量 C.溶质的溶解度 D.溶液中溶质的质量分数
10.向mg硝酸钾的不饱和溶液中加入硝酸钾晶体,在此变化过程中溶液里溶质的质量分数ω%与加入硝酸钾晶体的质量m′的关系正确的是 ( )
11.某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解,然后该同学又用酒精灯加热至60℃,固体全部溶解。那么在加热前后,以下各项中没有发生改变的是 ( )
A.NaCl的溶解度 B.溶质的质量 C.溶剂的质量 D.溶质的质量分数
12.30℃时,向图乙所示四只盛有100g水的烧杯中分别加入不同质量的KCl固体,充分溶解。④中溶液的溶质质量分数约为 ( )
A.26% B.29% C.35% D.40%
13.硝酸钾在不同温度下的溶解度如下表。下列说法错误的是 ( )
A.KNO3的溶解度随温度升高而增大
B.80℃的KNO3饱和溶液降温至20℃有晶体析出
C.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
D.将20℃时KNO3的饱和溶液升温至60℃,溶液的溶质质量分数不变
14.20℃时,取一定质量的固体硝酸钾于烧杯中,把100g水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是 ( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液 B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液中溶质的质量分数变大 D.丙→丁过程中,硝酸钾溶液中溶质的质量分数变大
15.某温度下,在100g溶质质量分数为20%的KNO3不饱和溶液甲中加入10g KNO3固体,恰好得到饱和溶液乙。下列说法正确的是 ( )
A.该温度下,KNO3的溶解度为30g B.乙溶液中溶质的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液 D.升高温度,甲、乙两溶液中溶质的质量分数都增大
16.欲配制一定溶质质量分数的KNO3溶液,现实验室只有含少量NaCl的KNO3固体药品。KNO3、NaCl的溶解度曲线如图所示。
(1)从KNO3和NaCl的溶解度曲线图中可得到的一条信息是________________________________________。
50℃时,将85.5g固体药品溶于100g水中,得到的是KNO3的________(填“饱和”或“不饱和”)溶液。将KNO3提纯的方法是________________________。
(2)小红提出,一定量20℃时31.6%的KNO3溶液可通过稀释配制成5%的溶液。你认为是否可行?________(填“可行”或“不可行”)。
核心素养练
17.“84”消毒液常用于消毒,其有效成分是次氯酸钠(NaClO)。某品牌的“84”消毒液的部分说明如下所示:
“84”消毒液 产品特点:主要成分为次氯酸钠(NaClO),有效氯的质量分数为5.19%~6.9%。 餐具消毒:用有效氯的质量分数为0.04%的消毒液浸泡,20min后用生活饮用水冲净。 注意事项: ①外用消毒剂,须稀释后使用。 ②不得将本产品与酸性产品(如洁厕类清洁产品)同时使用。
(1)喷洒“84”消毒液后,室内充满刺激性气味,主要体现的分子的性质是________________________________。
(2)依据“84”消毒液的部分说明,将有效氯的质量分数为6.0%的“84”消毒液与水按质量比为1:________进行稀释,即可用于餐具消毒。若量取水时仰视读数,则配制的溶液中溶质的质量分数________(填“偏大”“偏小”或“无影响”)。
★防错小贴士★
1.溶液具有均一性,溶液中各部分溶质的质量分数相等。[详见第8(3)题]
2.溶液稀释前后溶质的质量不变。[详见第8(4)、17(2)题]
3.饱和溶液中溶质的质量分数= ×100%。(详见第5、13题)
第2课时 溶质质量分数与化学方程式的综合计算
基础达标练
知识点 涉及化学反应的溶质质量分数的计算
1.某同学量取40mL溶质质量分数为20%的盐酸(密度为1.1g/mL)与大理石充分反应制取二氧化碳,试计算生成二氧化碳的质量。(计算结果精确至0.1g)
2.在一次实验课上,同学们取50g过氧化氢溶液与2g二氧化锰混合制取氧气,充分反应后,测得剩余液体的质量是48.4g。请计算该过氧化氢溶液中溶质的质量分数。
3.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取20mL(密度为1.1g/mL)的该盐酸与大理石充分反应,共用去含碳酸钙85%的大理石7.1g。计算:该浓盐酸中溶质的质量分数。
4.某研究性学习小组为测定铜锌合金中铜的质量分数,进行了如下实验:取合金10g,向其中不断加入稀硫酸,产生的气体与所加稀硫酸的质量关系如图所示。计算:稀硫酸中溶质的质量分数。
重点提升练
5.化学兴趣小组的同学在综合实践活动中了解到,某石灰厂有一批石灰石原料,其中含有的杂质是二氧化硅(二氧化硅不溶于水,不能与酸反应,高温时不分解)。为了测定该石灰石的纯度,兴趣小组的同学取30g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸200g等分4次加入,每次充分反应后,经过滤、干燥后称量,剩余固体的质量见下表:
请回答下列问题:
(1)石灰石样品中所含杂质的质量为________g.
(2)第一次实验中产生二氧化碳的质量是多少?(写出计算过程)
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
6.农业生产中常用一定溶质质量分数的氯化钠溶液进行
选种。实验小组取该氯化钠溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。(提示:氯化钠溶液与硝酸银溶液反应的化学方程式为NaCl+AgNO=AgCl↓+NaNO3)
计算:该氯化钠溶液中溶质的质量分数。
7.化学兴趣小组的同学欲测定某铁粉与碳粉混合物中铁的质量分数,进行了如图所示的实验。
请计算:
(1)混合物中铁的质量为________g.
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸中溶质的质量分数。
8.某同学在实验室中用氯酸钾与二氧化锰的混合物制取氧气,并对反应后固体剩余物进行回收利用,实验操作及数据记录如下。
(1)最后得到的滤渣应是________________(填化学式)。
(2)得到氧气的质量是________g。
(3)计算滤液中溶质的质量分数。
9.某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀硫酸测定废水中氢氧化钾的含量,反应的化学方程式为2KOH+H2SO4=K2SO4+2H2O(废水中其他杂质不与稀硫酸反应)。试计算:
(1)现有溶质质量分数为98%的浓硫酸(密度为1.84g/mL)50mL,如要制成质量分数为2%的稀硫酸,需要加水多少毫升?
(2)取20g废水于容器中,逐滴加入2%的稀硫酸,至恰好完全反应时,消耗稀硫酸9.8g,求废水中氢氧化钾的质量分数。
核心素养练
10.漂白液是家庭常用的洗涤剂。工业上常用氢氧化钠溶液吸收氯气来制漂白液,反应的化学方程式是Cl2+2NaOH=NaClO+NaCl+H2O。现向氢氧化钠溶液中通入氯气,恰好完全反应,得到含次氯酸钠(NaClO)5%的漂白液1490g。请计算:
(1)已知含次氯酸钠0.05%的漂白液用于家居消毒效果最佳。现取5g制得的漂白液,为了达到最佳的消毒效果,需加入水的质量为________g。
(2)氢氧化钠溶液中溶质的质量。
★防错小贴士★
根据化学方程式进行计算时,需要把液体的体积换算成质量,溶液质量=溶液体积×溶液密度。(详见第3、9题)
《参考答案及解析》
课题3 溶液的浓度
第1课时 溶质的质量分数
1.C
[解析]溶质的质量分数作为表示溶液组成的一种方法,通常用百分数表示,含义是在100份质量的溶液中溶质所占的比例。
2.B
[解析]所得溶液中溶质的质量分数为×100%=20%。
3.B
[解析]氢氧化钙的溶解度随温度的升高而减小,溶质质量分数最大的是较低温度下的饱和溶液。
4.D
[解析]向饱和的硝酸钾溶液中加硝酸钾固体是不能溶解的;恒温蒸发水时,溶质和溶剂都减少,溶液依然饱和;将温度升高时,溶质和溶剂的量均没有变化。因此,A、B、C项的做法均不能改变溶质的质量分数。加入水时,溶质的质量不变,溶液的质量增大,所以溶质的质量分数变小。
5.×100% 小于
[解析]饱和溶液中溶质的质量分数为×100%。
6.C
[解析]加入100g水后所得溶液中溶剂的质量增加了100g,则溶液质量增加了100g,而溶质质量不变,所以溶质的质量分数变为原来的一半。
7.C
[解析]要将溶质质量分数变为原来的一半,需加入的水的质量应与原溶液的质量相等。
8.(1)双氧水 H2O2(或过氧化氢)
(2)30 570
(3)5%
(4)150
[解析]
(2)溶质质量为600g×5%=30g,溶剂质量为600g-30g=570g
(3)溶液具有均一性,所以剩下的溶液中溶质的质量分数不变,仍然是5%。
(4)根据溶液稀释前后溶质的质量不变,设需要加入水的质量为x,则600g×5%=(600g+x)×4%,x=150g,需要加入水的质量为150g
9.D
[解析]氢氧化钙的溶解度随温度的升高而减小,冷却后溶剂的质量、溶质的质量均不发生改变,溶解度变大,溶液中溶质的质量分数不变。饱和石灰水中加入少量生石灰,生石灰与水反应,溶剂的质量会变小,而温度仍保持在30℃,则溶解度不变,所以溶液中溶质的质量变小,溶质的质量分数不变。
10.C
[解析]向硝酸钾的不饱和溶液中加入硝酸钾晶体后,溶质的质量增大,溶质的质量分数增大,待溶液达到饱和后溶质的质量分数不再变化。溶质的质量分数的起点在纵轴上,不在原点。
11.C
[解析]_将NaCl的饱和溶液升温后溶剂的质量一定不变。
12.A
[解析]由溶解度曲线知,30℃时,KCl的溶解度约为35g,所以加入的40gKCl不能完全溶解,故④中溶液的溶质质量分数为×100%≈26%。
13.C
[解析]由硝酸钾的溶解度数据可知,硝酸钾的溶解度随温度的升高而增大,故A正确;硝酸钾的溶解度随温度的降低而减小,所以降温会使饱和溶液析出溶质,故B正确;20℃时,硝酸钾的溶解度是31.6g,饱和溶液中溶质的质量分数为×100%~24%,故C错误;将20℃时KNO3的饱和溶液升温至60℃,溶解度增大,不会析出晶体,溶剂质量也不变,所以溶液中溶质的质量分数不变,故D正确。
14.B
[解析]由题图可知,20℃时,甲烧杯中硝酸钾固体有剩余,故甲烧杯中硝酸钾溶液是饱和溶液,故A错误;丙烧杯中的固体硝酸钾已完全溶解,而丁烧杯又加入了25g水,所以,可以推断出丁烧杯中的硝酸钾溶液是不饱和溶液,故B正确;由题图可知,20℃时,乙为饱和溶液,乙→丙过程中,加入25g水,固体全部溶解,丙烧杯中可能是饱和溶液,也可能是不饱和溶液,若丙为饱和溶液,则乙→丙过程中,硝酸钾溶液中溶质的质量分数不变,若丙为不饱和溶液,则乙→丙过程中,硝酸钾溶液中溶质的质量分数变小,故C错误;丙→丁的过程中,溶质不变,溶剂增加,硝酸钾溶液中溶质的质量分数变小,故D错误。
15.C
[解析]某温度下,在100g20%的KNO3不饱和溶液中加入10gKNO3固体,恰好得到饱和溶液乙,此时,溶液中溶质的质量为100g×20%+10g=30g,溶剂的质量为100g-100g×20%=80g,即80g水中溶解30gKNO3,溶液达到饱和,100g水中溶解37.5gKNO3,溶液达到饱和,该温度下,KNO3的溶解度为37.5g,故A错误;乙溶液中溶质的质量分数为×100%≈27%,故B错误;降低温度,KNO的溶解度减小,可以使甲溶液变成饱和溶液,故正确;升高温度,KNO3的溶解度增大,但甲、乙溶液的组成均没有发生改变,溶质的质量分数不变,故D错误。
16.(1)20℃时KNO3的溶解度为31.6g(合理即可) 不饱和降温结晶(或冷却热的饱和溶液)
(2)不可行
[解析]
(1)50℃时,将85.5g固体药品溶于100g水中,由于85.5g固体中含有KNO3和NaCl2所以得到的是KNO3的不饱和溶液。
(2)20℃时,KNO3饱和溶液中溶质的质量分数为×100%~24%,所以不会出现20℃时31.6%的KNO3溶液。
17.(1)分子在不断运动
(2)149 偏小
[解析]
(2)设加入水的质量为m,有效氯的质量分数为6.0%的“84”消毒液的质量为x,则x×6.0%=(m+x)×0.04%,m=149x,所以有效氯的质量分数为6.0%的“84”消毒液的质量与水的质量比为x:m=x:149x=1:149。仰视读数时,实际量取水的体积变大,使配制的溶液中溶质的质量分数偏小。
第2课时 溶质质量分数与化学方程式的综合计算
1.解:盐酸中溶质的质量为1.1g/mL×40mL×20%=8.8g。
设生成二氧化碳的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
8.8g x
= x≈5.3g
答:生成二氧化碳的质量为5.3g
2.解:生成氧气的质量为50g-48.4g=1.6g。
设该过氧化氢溶液中溶质的质量为x。
2H2O22H2O+O2↑
68 32
x 1.6g
= x=3.4g
×100%=6.8%
答:该过氧化氢溶液中溶质的质量分数为6.8%。
3.解:设该浓盐酸中溶质的质量为x。
CaCO3 + 2HCl=CaCl2+H2O+CO2↑
100 73
7.1g×85% x
= x=4.4g
该浓盐酸中溶质的质量分数为×100%=20%
答:该浓盐酸中溶质的质量分数为20%。
4.解:由题图可知,当加入20g稀硫酸时,合金中的锌恰好反应完全,产生0.1g氢气。
设参加反应的稀硫酸的质量为x。
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.1g
= x=4.9g
稀硫酸中溶质的质量分数为4×100%=24.5%
答:稀硫酸中溶质的质量分数为24.5%。
5.(1)6
解:(2)第一次实验消耗石灰石样品中碳酸钙的质量为30g20g=10g.第一次消耗稀盐酸的质量为200g4=50g.
设第一次消耗的50g稀盐酸中氯化氢的质量为x,生成二氧化碳的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g x y
= x=7.3g
= y=4.4g
(3)所用稀盐酸中溶质的质量分数为×100%=14.6%
答:(2)第一次实验中产生二氧化碳的质量为4.4g;
(3)所用稀盐酸中溶质的质量分数是14.6%。
[解析]
(1)由表中的数据可知,第三次与第四次反应后剩余固体质量相等,说明第三次时碳酸钙已完全反应,剩余的固体为杂质,所以杂质的质量为6g.
6.解:设36g氯化钠溶液中溶质的质量为x。
NaCl+AgNO3=AgCl↓+NaNO
58.5 143.5
x 14.35g
= x=5.85g
该氯化钠溶液中溶质的质量分数为×100%=16.25%
答:该氯化钠溶液中溶质的质量分数为16.25%。
7.(1)5.6
(2)解:设稀硫酸中溶质的质量为x。
Fe + H2SO4=FeSO4+H2↑
56 98
5.6g x
= x=9.8g
所用稀硫酸中溶质的质量分数为×100%=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
8.(1)MnO2
(2)4.8
(3)解:设生成氯化钾的质量为x。
2KClO32KCl + 3O2↑
149 96
x 4.8g
= x=7.45g
滤液中溶质的质量分数为×100%=14.9%
答:滤液中溶质的质量分数为14.9%。
[解析]
(2)氯酸钾与二氧化锰均为固体,反应后氯化钾为固体,氧气为气体,所以反应前后固体的质量差即为生成的氧气的质量,则氧气的质量为15.5g-10.7g=4.8g.
9.(1)解:设需要加水的质量为x。
50mL×1.84g/mL×98%=(50mL×1.84g/mL+x)×2% x=4416g
需加水的体积为=4416mL
答:需加水的体积为4416mL。
(2)解:设参加反应的氢氧化钾的质量为y
2KOH + H2SO4=K2SO4+2H2O
112 98
y 9.8g×2%
= y=0.224g
废水中氢氧化钾的质量分数为×100%=1.12%
答:废水中氢氧化钾的质量分数为1.12%。
10.(1)495
(2)解:反应后次氯酸钠的质量是1490g×5%=74.5g
设参加反应的氢氧化钠的质量为y
Cl2+2NaOH=NaClO+NaCl+H2O
80 74.5
y 74.5g
= y=80g
答:氢氧化钠溶液中溶质的质量为80g
[解析]
(1)设需加入水的质量为x,根据溶液稀释前后溶质的质量不变可知,(5g+x)×0.05%=5g×5%,则x=495g。
21世纪教育网(www.21cnjy.com)
同课章节目录
