浙江省永嘉县楠江中学2012-2013学年高二上学期期中考试化学(文)试题(无答案)
文档属性
| 名称 | 浙江省永嘉县楠江中学2012-2013学年高二上学期期中考试化学(文)试题(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 118.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-27 13:32:19 | ||
图片预览

文档简介
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1、Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是 ( )
A.Na2CO3是碱 B.Na2CO3是盐 C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
2、下列反应进行分类时,既属于氧化还原反应又属于化合反应的是 ( )
A.Zn+H2SO4=ZnSO4+H2↑ B.2KClO32KCl+3O2↑
C.S+O2SO2 D.CH4+2O2CO2+2H2O
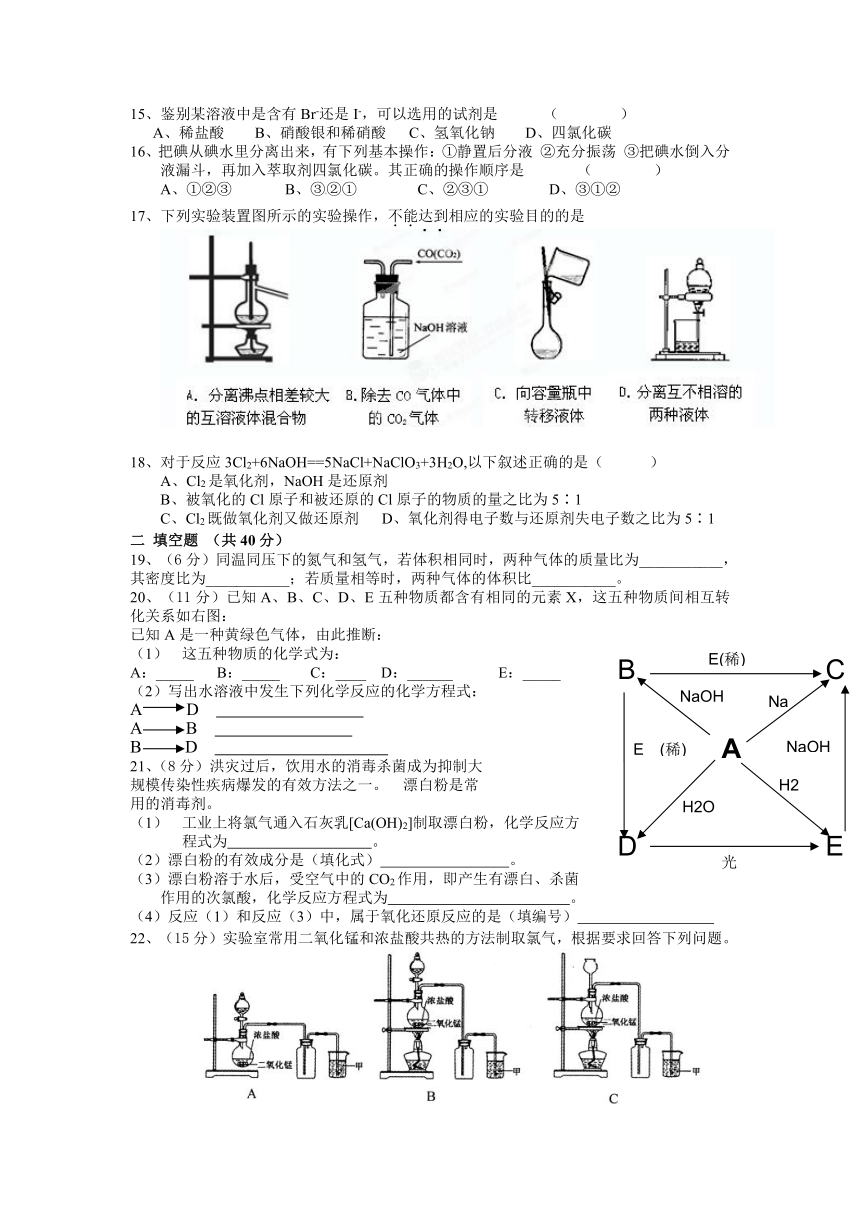
3、某加碘食盐包装袋上标有“忌高温蒸炒”,由此判断下列说法中正确的是( )
A.此食盐是纯净物 B.所加含碘物质受热易分解
C.食盐中加入了碘单质 D.加碘食盐难溶与水
4、用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105 Pa, 64g SO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O 含有的分子数为0.5NA
5、224mL某气体在标准状况下的质量为0.32g,该气体的摩尔质量约为 ( )
A.32g·mol-1 B.64 C.64g·mol-1 D.64g
6、将30mL 0.5mol/L NaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质量浓度为( )
A.0.03mol/L B.0.3mol/L C.0.05mol/L D. 0.04mol/L
7、配制一定物质的量浓度的KOH溶液时,下列操作对实验结果没有影响的( )
A.容量瓶中原有少量蒸馏B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中;
C.定容时观察液面俯视 D.定容时观察液面仰视
8、下列括号中的物质是除去杂质所需的药品,其中错误的是 ( )
A.NaCl中有杂质Na2SO4(氯化钡) B.FeSO4中有杂质CuSO4(铁粉)
C.SO2中有少量HCl气体(氢氧化钠溶液) D.CO2中有少量CO(灼热的氧化铜)
9、只用一种试剂就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3、三种溶液,应选用( )
A.BaCl2 B.HCl C.NaOH D.Ba(OH)2
10、下列叙述正确的是( )
A.用铂丝蘸取某白色晶体,放在无色的灯焰上灼烧,火焰呈黄色, 说明该固体一定只含有钠盐
B.某溶液中加入NaOH溶液并加热,将湿润的红色石蕊试纸置于管口检验,若观察到红色石蕊试纸变蓝,说明原溶液中一定有NH4+
C.某溶液中加入AgNO3溶液后再加入足量稀硝酸,仍有沉淀,则原溶液中一定有Cl-
D.某溶液中加入BaCl2溶液,再加入足量稀HNO3仍有白色沉淀,则溶液中一定有SO42-
11、有关电解质的说法正确的是 ( )
A.NaOH固体溶于水后能导电,所以NaOH是电解质B.CO2水溶液的能够导电,所以CO2是电解质
C.液态的铜导电性很好,所以铜是电解质 D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
12、溶液.胶体和浊液这三种分散系的根本区别是 ( )
A.是否大量分子或离子的集合体 B.分散质粒子直径的大小
C.是否能通过滤纸或半透膜 D.是否均一.稳定.透明
13、.某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则下列表示R原子的符号中,正确的是 ( )
A. abR B. a+ba+2R C. a+b-2a+2R D. a+b-2a-2R
14、自来水可以用氯气消毒,某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质的是 ( )
A NaOH B KI C AgNO3 D FeCl3
15、鉴别某溶液中是含有Br-还是I-,可以选用的试剂是 ( )
A、稀盐酸 B、硝酸银和稀硝酸 C、氢氧化钠 D、四氯化碳
16、把碘从碘水里分离出来,有下列基本操作:①静置后分液 ②充分振荡 ③把碘水倒入分液漏斗,再加入萃取剂四氯化碳。其正确的操作顺序是 ( )
A、①②③ B、③②① C、②③① D、③①②
17、下列实验装置图所示的实验操作,不能达到相应的实验目的的是
18、对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A、Cl2是氧化剂,NaOH是还原剂
B、被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C、Cl2既做氧化剂又做还原剂 D、氧化剂得电子数与还原剂失电子数之比为5∶1
二 填空题 (共40分)
19、(6分)同温同压下的氮气和氢气,若体积相同时,两种气体的质量比为___________,其密度比为___________;若质量相等时,两种气体的体积比___________。
20、(11分)已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如右图:
已知A是一种黄绿色气体,由此推断:
这五种物质的化学式为:
A:_____ B:_____ C:____ D:______ E:_____
(2)写出水溶液中发生下列化学反应的化学方程式:
A D
A B
B D
21、(8分)洪灾过后,饮用水的消毒杀菌成为抑制大
规模传染性疾病爆发的有效方法之一。 漂白粉是常
用的消毒剂。
工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)
22、(15分)实验室常用二氧化锰和浓盐酸共热的方法制取氯气,根据要求回答下列问题。
(1)A、B、C三套装置中,应选用的装置是____________(选填“A”、“B”、“C”);
(2)为了防止氯气污染环境,图中所示的溶液甲为___ ____。
(3)要制得纯净干燥的氯气,需要在气体发生装置和收集装置间增加净化装置,请将右边提供仪器的导管接口按次序连接:(用字母表示)
气体发生装置→ → → → →收集装置。
(4)请写出实验室制氯气的化学方程式并标出电子转移的方向和数目:
(5)浓硫酸的作用: ,饱和食盐水的作用:
三 计算题:(6分)
23、工业上通过电解饱和的食盐水来制取氯气。现取500ml含NaCl为11.7g的饱和食盐水进行电解,
在标准状况下制得Cl2多少升?
所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
楠江中学2012第一学期期中考试高二化学(文)答题卷
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
二、填空题(共40分)
19、(6分)
20、(11分)(1)这五种物质的化学式为:
A:________ B:________ C:________ D:________ E:________
(2)写出水溶液中发生下列化学反应的化学方程式:
A→D:
A→B:
B→D:
21、(8分)(1)化学反应方程式为
(2)漂白粉的有效成分是(填化学式)
(3)化学反应方程式为:
(4)属于氧化还原反应的是(填编号)
22、(15分)(1) (2)
(3)气体发生装置→ → → → →收集装置。
(4)请写出实验室制氯气的化学方程式并标出电子转移的方向和数目
。
(5)
三、计算题(6分)
1、Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是 ( )
A.Na2CO3是碱 B.Na2CO3是盐 C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
2、下列反应进行分类时,既属于氧化还原反应又属于化合反应的是 ( )
A.Zn+H2SO4=ZnSO4+H2↑ B.2KClO32KCl+3O2↑
C.S+O2SO2 D.CH4+2O2CO2+2H2O
3、某加碘食盐包装袋上标有“忌高温蒸炒”,由此判断下列说法中正确的是( )
A.此食盐是纯净物 B.所加含碘物质受热易分解
C.食盐中加入了碘单质 D.加碘食盐难溶与水
4、用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.25℃,1.01×105 Pa, 64g SO2中含有的原子数为3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O 含有的分子数为0.5NA
5、224mL某气体在标准状况下的质量为0.32g,该气体的摩尔质量约为 ( )
A.32g·mol-1 B.64 C.64g·mol-1 D.64g
6、将30mL 0.5mol/L NaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质量浓度为( )
A.0.03mol/L B.0.3mol/L C.0.05mol/L D. 0.04mol/L
7、配制一定物质的量浓度的KOH溶液时,下列操作对实验结果没有影响的( )
A.容量瓶中原有少量蒸馏B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中;
C.定容时观察液面俯视 D.定容时观察液面仰视
8、下列括号中的物质是除去杂质所需的药品,其中错误的是 ( )
A.NaCl中有杂质Na2SO4(氯化钡) B.FeSO4中有杂质CuSO4(铁粉)
C.SO2中有少量HCl气体(氢氧化钠溶液) D.CO2中有少量CO(灼热的氧化铜)
9、只用一种试剂就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3、三种溶液,应选用( )
A.BaCl2 B.HCl C.NaOH D.Ba(OH)2
10、下列叙述正确的是( )
A.用铂丝蘸取某白色晶体,放在无色的灯焰上灼烧,火焰呈黄色, 说明该固体一定只含有钠盐
B.某溶液中加入NaOH溶液并加热,将湿润的红色石蕊试纸置于管口检验,若观察到红色石蕊试纸变蓝,说明原溶液中一定有NH4+
C.某溶液中加入AgNO3溶液后再加入足量稀硝酸,仍有沉淀,则原溶液中一定有Cl-
D.某溶液中加入BaCl2溶液,再加入足量稀HNO3仍有白色沉淀,则溶液中一定有SO42-
11、有关电解质的说法正确的是 ( )
A.NaOH固体溶于水后能导电,所以NaOH是电解质B.CO2水溶液的能够导电,所以CO2是电解质
C.液态的铜导电性很好,所以铜是电解质 D.FeCl3溶液能够导电,所以FeCl3溶液是电解质
12、溶液.胶体和浊液这三种分散系的根本区别是 ( )
A.是否大量分子或离子的集合体 B.分散质粒子直径的大小
C.是否能通过滤纸或半透膜 D.是否均一.稳定.透明
13、.某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则下列表示R原子的符号中,正确的是 ( )
A. abR B. a+ba+2R C. a+b-2a+2R D. a+b-2a-2R
14、自来水可以用氯气消毒,某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质的是 ( )
A NaOH B KI C AgNO3 D FeCl3
15、鉴别某溶液中是含有Br-还是I-,可以选用的试剂是 ( )
A、稀盐酸 B、硝酸银和稀硝酸 C、氢氧化钠 D、四氯化碳
16、把碘从碘水里分离出来,有下列基本操作:①静置后分液 ②充分振荡 ③把碘水倒入分液漏斗,再加入萃取剂四氯化碳。其正确的操作顺序是 ( )
A、①②③ B、③②① C、②③① D、③①②
17、下列实验装置图所示的实验操作,不能达到相应的实验目的的是
18、对于反应3Cl2+6NaOH==5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A、Cl2是氧化剂,NaOH是还原剂
B、被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C、Cl2既做氧化剂又做还原剂 D、氧化剂得电子数与还原剂失电子数之比为5∶1
二 填空题 (共40分)
19、(6分)同温同压下的氮气和氢气,若体积相同时,两种气体的质量比为___________,其密度比为___________;若质量相等时,两种气体的体积比___________。
20、(11分)已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如右图:
已知A是一种黄绿色气体,由此推断:
这五种物质的化学式为:
A:_____ B:_____ C:____ D:______ E:_____
(2)写出水溶液中发生下列化学反应的化学方程式:
A D
A B
B D
21、(8分)洪灾过后,饮用水的消毒杀菌成为抑制大
规模传染性疾病爆发的有效方法之一。 漂白粉是常
用的消毒剂。
工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)
22、(15分)实验室常用二氧化锰和浓盐酸共热的方法制取氯气,根据要求回答下列问题。
(1)A、B、C三套装置中,应选用的装置是____________(选填“A”、“B”、“C”);
(2)为了防止氯气污染环境,图中所示的溶液甲为___ ____。
(3)要制得纯净干燥的氯气,需要在气体发生装置和收集装置间增加净化装置,请将右边提供仪器的导管接口按次序连接:(用字母表示)
气体发生装置→ → → → →收集装置。
(4)请写出实验室制氯气的化学方程式并标出电子转移的方向和数目:
(5)浓硫酸的作用: ,饱和食盐水的作用:
三 计算题:(6分)
23、工业上通过电解饱和的食盐水来制取氯气。现取500ml含NaCl为11.7g的饱和食盐水进行电解,
在标准状况下制得Cl2多少升?
所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
楠江中学2012第一学期期中考试高二化学(文)答题卷
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
二、填空题(共40分)
19、(6分)
20、(11分)(1)这五种物质的化学式为:
A:________ B:________ C:________ D:________ E:________
(2)写出水溶液中发生下列化学反应的化学方程式:
A→D:
A→B:
B→D:
21、(8分)(1)化学反应方程式为
(2)漂白粉的有效成分是(填化学式)
(3)化学反应方程式为:
(4)属于氧化还原反应的是(填编号)
22、(15分)(1) (2)
(3)气体发生装置→ → → → →收集装置。
(4)请写出实验室制氯气的化学方程式并标出电子转移的方向和数目
。
(5)
三、计算题(6分)
同课章节目录
