第九单元溶液测试题-2021-2022学年九年级化学人教版下册 (word版 含答案)
文档属性
| 名称 | 第九单元溶液测试题-2021-2022学年九年级化学人教版下册 (word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 209.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 13:01:45 | ||
图片预览




文档简介
第九单元《溶液》测试题
一、单选题
1.把少量下列物质分别放入水中,充分搅拌,可以得到有色溶液的是
A.面粉 B.蔗糖 C.汽油 D.高锰酸钾
2.如下图所示是硝酸钾和氯化钠的溶解度曲线,下列叙述正确的是
A.KNO3和NaCl的溶解度相等
B.NaCl的溶解度受温度影响更大
C.将A点的KNO3溶液转化为B点的该溶液可采取增加溶剂
D.60℃时,NaCl溶液和KNO3溶液的溶质质量分数可能相等
3.逻辑推理是化学学习中常用的思维方法,下列推理正确的是
A.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
B.饱和溶液不一定是浓溶液,但浓溶液一定是饱和溶液
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是活泼金属
4.如图是利用海水提取粗盐的过程(温度不变),有关说法正确的是
A.氯化钠在海水中以分子的形式存在 B.①为蒸发池,②为结晶池
C.①中氧化钠的质量分数逐渐减小 D.母液是氯化钠的不饱和溶液
5.如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是
A.温度大于t1℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲的饱和溶液中溶质的质量分数为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃,将50g甲物质放入100g水中,可得到溶质的质量分数为23.1%
6.要除去下列各组物质中的少量的杂质,所选实验方案正确的是
物质 杂质 实验方案
A CO2 CO 点燃混合气体
B N2 O2 将点燃的蜡烛放入集气瓶内
C KCl KClO3 加入少量MnO2,加热
D KNO3 NaCl 加适量水溶解,蒸发浓缩,降温结晶,过滤
A.A B.B C.C D.D
7.下列关于溶液说法正确的是
A.将不饱和溶液变为饱和溶液,溶质质量分数一定增大
B.降低温度溶液中一定能析出溶质
C.无色透明的液体不一定都是溶液
D.溶液的体积为溶质和溶剂体积之和
8.下列说法正确的是
A.2gH2跟32gO2完全反应,可得到34gH2O
B.用含Fe2O385%的赤铁矿160t,理论上可生产100t含杂质4.8%的生铁
C.等质量镁和锌分别与足量盐酸完全反应,镁产生的H2多说明镁金属活动性比锌强
D.10g固体A与90g水混合,固体完全消失,所得溶液中溶质质量分数一定为10%
9.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A. 证明集气瓶中已集满CO2 将燃着的木条放在集气瓶口
B. 除去CuO中的少量铁粉 用磁铁吸引
C. 除去CO2中少量的CO 将混合气体通过灼热的碳层
D. 鉴别硝酸铵和氢氧化钠 取样,分别溶解在水中,比较溶液温度
A.A B.B C.C D.D
10.下列有关溶液的叙述正确的是
A.一杯食盐水,下部分比上部分咸
B.温度一定时,析出硝酸钾晶体的溶液未必是硝酸钾的饱和溶液
C.物质溶于水时,常使溶液的温度发生改变
D.75%的医用酒精消毒液,溶剂是酒精
11.下列叙述正确的是
A.用高锰酸钾制取O2后,应先熄灭酒精灯再从水中取出导气管
B.光亮铁片放入硫酸铜溶液中,溶液颜色变为蓝色
C.硝酸铵溶解于水,水的温度会升高
D.在空气中加热铜丝,铜丝表面会变黑
12.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是
A.甲的溶解度随着温度的升高而增大
B.t1°C时,甲和乙的溶解度相等
C.t2°C时,30g的甲溶于在50g的水中,得到80g的溶液
D.升高温度可以将乙的不饱和溶液转化为饱和溶液
13.下列实验方案设计合理的是
实验目的 实验方案
A 鉴别碳粉和二氧化锰粉末 观察颜色
B 除去铁粉中少量的铜粉 加入稀硫酸
C 鉴别硝酸铵固体和氧化钙固体 取样后,加水溶解,测温度
D 除去CO2中少量的CO 点燃
A.A B.B C.C D.D
14.下列图像正确的是
A.红磷与氧气在密闭容器中燃烧,各物质的质量随时间的变化
B.向铁粉中不断加入稀硫酸
C.向室温下的饱和石灰水中加入少量氧化钙
D.向等质量的镁、铝中,分别加入等浓度的稀硫酸至过量
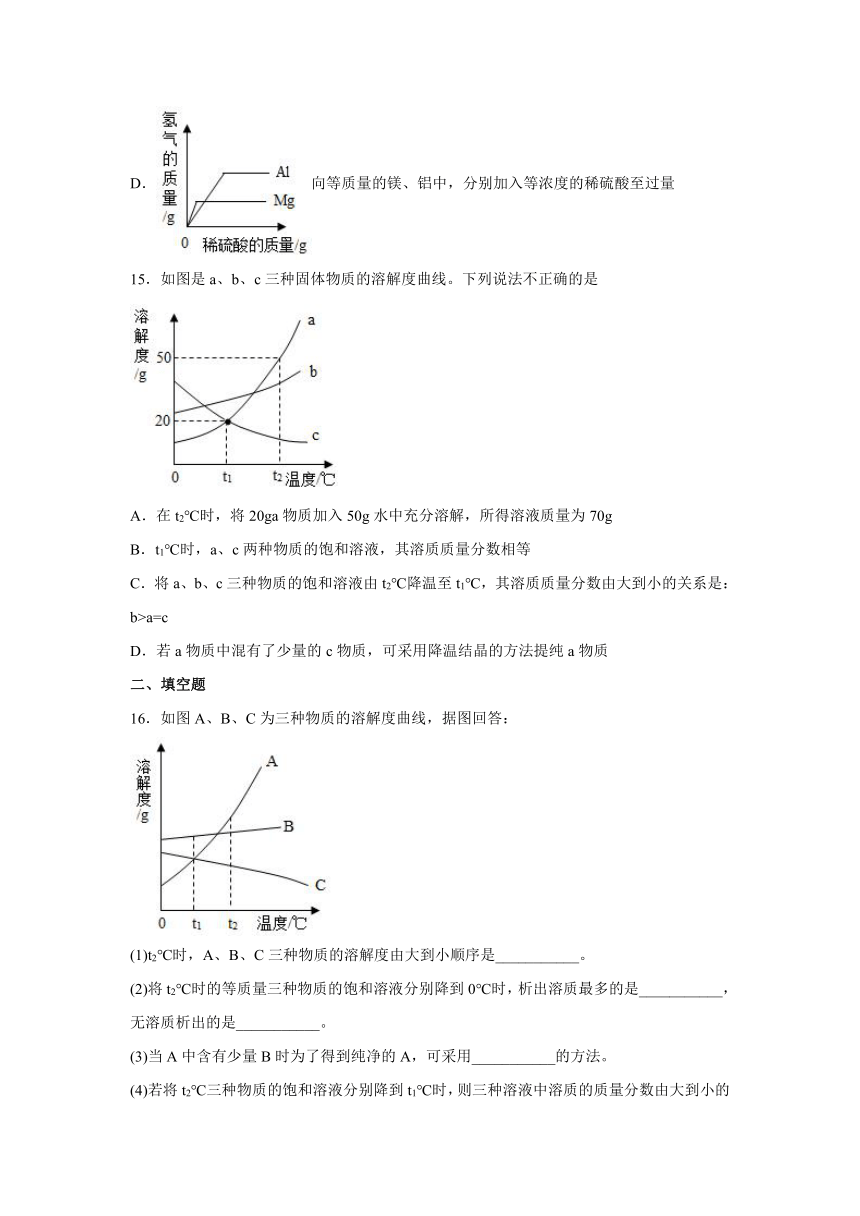
15.如图是a、b、c三种固体物质的溶解度曲线。下列说法不正确的是
A.在t2℃时,将20ga物质加入50g水中充分溶解,所得溶液质量为70g
B.t1℃时,a、c两种物质的饱和溶液,其溶质质量分数相等
C.将a、b、c三种物质的饱和溶液由t2℃降温至t1℃,其溶质质量分数由大到小的关系是:b>a=c
D.若a物质中混有了少量的c物质,可采用降温结晶的方法提纯a物质
二、填空题
16.如图A、B、C为三种物质的溶解度曲线,据图回答:
(1)t2℃时,A、B、C三种物质的溶解度由大到小顺序是___________。
(2)将t2℃时的等质量三种物质的饱和溶液分别降到0℃时,析出溶质最多的是___________,无溶质析出的是___________。
(3)当A中含有少量B时为了得到纯净的A,可采用___________的方法。
(4)若将t2℃三种物质的饱和溶液分别降到t1℃时,则三种溶液中溶质的质量分数由大到小的顺序是___________。
17.化学无处不在,化学是应用最广泛的学科之一。
(1)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是______;
(2)在厨房用水洗涤餐具时,通常在水里加些洗涤剂,这样就可以很容易的除去餐具上的油污,这是因为洗涤剂具有______作用。
(3)0.9%的生理盐水广泛用于医疗救护,若要配制500g生理盐水需氯化钠的质量为______。
(4)废水中若氨氮含量过高,直接排放会导致水体富营养化。次氯酸(HC1O)可除去废水中的NH3,其反应为:,X的化学式为______。
(5)金属材料因锈蚀而报废。铁生锈的条件是______;把铁制成不锈钢可有效的防止铁生锈,不锈钢的硬度______(填“大于”或“小于”)纯铁。
18.下图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是_______.
(2)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的_______.
19.我国将力争于 2030 年前达到峰值,2060 年前实现碳中和。
(1)大气中 CO2 的产生主要来自化石燃料的燃烧,化石燃料属于______(填“可再生”或“不可再生”)能源。
(2)控制 CO2 的排放,目的是为减缓______效应。
(3)加压水洗法可捕集 CO2,是因为压强增大时 CO2 在水中的溶解度______(填“增大”或“减小”)。
(4)我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(化学式为 CH3OH) 和水。
I、该反应的化学方程式为______。
II、甲醇由______种元素组成,2mol 甲醇分子中约含______个氧原子(用科学计数法表示)。
20.溶液是生产生活中常用的物质。
温度(℃) 20 30 40 60 80 100
溶解度(g/100g水) 氯化钠 36.0 36.3 36.6 37.3 38.4 39.8
硝酸钾 31.6 45.8 63.9 110 169 246
(1)为配制100g、15%的氯化钠溶液,需称取氯化钠_______g。
(2)20℃时,分别配制等质量的氯化钠、硝酸钾的饱和溶液,所需水量较多的物质是_____。
(3)60℃时,50g饱和硝酸钾溶液中,溶质与溶剂的质量比为_______。
(4)某固体混合物含244gKNO3、36.3gNaCl。为得到尽可能多且纯度较高的硝酸钾,设计如下实验:在该固体中加入100g水,加热至100℃,固体全部溶解后,再_______。(请将操作步骤补充完整)
三、推断题
21.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
22.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
23.某兴趣小组为探究可燃物的燃烧条件,设计了以下实验。甲乙均为软塑料瓶改装的气体发生装置,无纺布包内放有一定量的固体试剂,丙中放有左右两处大小相等、质量相等的红磷,且与热源距离相同。
(1)甲中无纺布包内为二氧化锰,其下端溶液中溶质为___________乙中制的气体不可燃,也不助燃,乙中反应方程式为___________
(2)①通过对软塑料瓶的捏放瓶身,可随时控制反应的___________
②为了探究可燃物的燃烧条件,请选择相应的序号进行排序___________(每个序号只选一次)。
a.捏压甲一段时间 b.捏压乙一段时间c.使瓶复原d.加热仪器丁
③丙中燃烧时的现象是___________
24.学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,配制150g质量分数为10%的氢氧化钠溶液的操作过程如下:
(1)用上述图示序号表示配制该溶液的正确操作顺序________。
(2)图①中玻璃棒搅拌的目的是___________。
(3)配制过程中需称取_________g氢氧化钠固体。
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填字母)。
A.用量筒量取水时俯视读数 B.配制溶液的烧杯用少量蒸馏水润洗
C.氢氧化钠固体不纯 D.转移已配好的溶液时,有少量溶液溅出
(5)用上述配制好的氢氧化钠溶液(密度约为1.1g/cm3)配制50g溶质质量分数为3%的氢氧化钠溶液,需要量取10%的氢氧化钠溶液_________mL(结果精确到0.1)。
五、计算题
25.黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中锌的含量,现将10g黄铜样品,与一定质量的稀硫酸恰好完全反应,所得物质总质量103.5g,同时生成氢气0.2g,试计算:
(1)该黄铜样品中锌的质量为 g;
(2)恰好完全反应后所得溶液中溶质的质量分数。
26.取Cu-Zn合金10g,将该合金放入烧杯中,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与产生气体的质量关系如图所示。
请计算:
(1)计算合金中铜的质量分数。
(2)计算反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
参考答案:
1.D 2.D 3.A 4.B 5.B 6.D 7.C 8.B 9.C 10.C 11.D 12.C 13.C 14.C 15.C 16.(1)A>B>C
(2) A C
(3)降温结晶
(4)B>A>C
17.(1)为燃烧提供充足的氧气
(2)乳化
(3)4.5g
(4)N2
(5) 与水和氧气同时接触 大于
18.(1)A
(2)C
19.(1)不可再生
(2)温室
(3)增大
(4) 三 1.204×1024
20.(1)15
(2)硝酸钾
(3)11:10
(4)趁热过滤,将滤液降温至20℃,再过滤
21. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
22. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
23.(1) H2O2##过氧化氢
(2) 可控制反应的发生或停止 bdca 左端红磷燃烧,右端红磷后燃烧,产生大量的白烟,放出大量的热
24.(1)④③②①
(2)加快氢氧化钠固体的溶解速率
(3)15
(4)BC
(5)13.6
25.(1)6.5
解:设参加反应的锌的质量为x,生成硫酸锌的质量为y。
x=6.5g
y=16.1g
答:该黄铜样品中锌的质量为6.5g。
(2)16.1%
恰好完全反应后所得溶液中溶质的质量分数为×100%=16.1%。
答:恰好完全反应后所得溶液中溶质的质量分数为16.1%。
26.(1)解:设铜锌合金中锌的质量为x,生成硫酸锌的质量为y。
所以合金中铜的质量分数为
(2)反应后所得溶液的溶质质量分数为
答:合金中铜的质量分数为35%,反应后所得溶液的溶质质量分数为15.1%。
一、单选题
1.把少量下列物质分别放入水中,充分搅拌,可以得到有色溶液的是
A.面粉 B.蔗糖 C.汽油 D.高锰酸钾
2.如下图所示是硝酸钾和氯化钠的溶解度曲线,下列叙述正确的是
A.KNO3和NaCl的溶解度相等
B.NaCl的溶解度受温度影响更大
C.将A点的KNO3溶液转化为B点的该溶液可采取增加溶剂
D.60℃时,NaCl溶液和KNO3溶液的溶质质量分数可能相等
3.逻辑推理是化学学习中常用的思维方法,下列推理正确的是
A.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
B.饱和溶液不一定是浓溶液,但浓溶液一定是饱和溶液
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是活泼金属
4.如图是利用海水提取粗盐的过程(温度不变),有关说法正确的是
A.氯化钠在海水中以分子的形式存在 B.①为蒸发池,②为结晶池
C.①中氧化钠的质量分数逐渐减小 D.母液是氯化钠的不饱和溶液
5.如图为甲、乙两物质的溶解度曲线,下列有关说法中不正确的是
A.温度大于t1℃时,甲的溶解度大于乙的溶解度
B.t1℃时,甲的饱和溶液中溶质的质量分数为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃,将50g甲物质放入100g水中,可得到溶质的质量分数为23.1%
6.要除去下列各组物质中的少量的杂质,所选实验方案正确的是
物质 杂质 实验方案
A CO2 CO 点燃混合气体
B N2 O2 将点燃的蜡烛放入集气瓶内
C KCl KClO3 加入少量MnO2,加热
D KNO3 NaCl 加适量水溶解,蒸发浓缩,降温结晶,过滤
A.A B.B C.C D.D
7.下列关于溶液说法正确的是
A.将不饱和溶液变为饱和溶液,溶质质量分数一定增大
B.降低温度溶液中一定能析出溶质
C.无色透明的液体不一定都是溶液
D.溶液的体积为溶质和溶剂体积之和
8.下列说法正确的是
A.2gH2跟32gO2完全反应,可得到34gH2O
B.用含Fe2O385%的赤铁矿160t,理论上可生产100t含杂质4.8%的生铁
C.等质量镁和锌分别与足量盐酸完全反应,镁产生的H2多说明镁金属活动性比锌强
D.10g固体A与90g水混合,固体完全消失,所得溶液中溶质质量分数一定为10%
9.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A. 证明集气瓶中已集满CO2 将燃着的木条放在集气瓶口
B. 除去CuO中的少量铁粉 用磁铁吸引
C. 除去CO2中少量的CO 将混合气体通过灼热的碳层
D. 鉴别硝酸铵和氢氧化钠 取样,分别溶解在水中,比较溶液温度
A.A B.B C.C D.D
10.下列有关溶液的叙述正确的是
A.一杯食盐水,下部分比上部分咸
B.温度一定时,析出硝酸钾晶体的溶液未必是硝酸钾的饱和溶液
C.物质溶于水时,常使溶液的温度发生改变
D.75%的医用酒精消毒液,溶剂是酒精
11.下列叙述正确的是
A.用高锰酸钾制取O2后,应先熄灭酒精灯再从水中取出导气管
B.光亮铁片放入硫酸铜溶液中,溶液颜色变为蓝色
C.硝酸铵溶解于水,水的温度会升高
D.在空气中加热铜丝,铜丝表面会变黑
12.甲、乙两种物质的溶解度曲线如图所示。下列说法错误的是
A.甲的溶解度随着温度的升高而增大
B.t1°C时,甲和乙的溶解度相等
C.t2°C时,30g的甲溶于在50g的水中,得到80g的溶液
D.升高温度可以将乙的不饱和溶液转化为饱和溶液
13.下列实验方案设计合理的是
实验目的 实验方案
A 鉴别碳粉和二氧化锰粉末 观察颜色
B 除去铁粉中少量的铜粉 加入稀硫酸
C 鉴别硝酸铵固体和氧化钙固体 取样后,加水溶解,测温度
D 除去CO2中少量的CO 点燃
A.A B.B C.C D.D
14.下列图像正确的是
A.红磷与氧气在密闭容器中燃烧,各物质的质量随时间的变化
B.向铁粉中不断加入稀硫酸
C.向室温下的饱和石灰水中加入少量氧化钙
D.向等质量的镁、铝中,分别加入等浓度的稀硫酸至过量
15.如图是a、b、c三种固体物质的溶解度曲线。下列说法不正确的是
A.在t2℃时,将20ga物质加入50g水中充分溶解,所得溶液质量为70g
B.t1℃时,a、c两种物质的饱和溶液,其溶质质量分数相等
C.将a、b、c三种物质的饱和溶液由t2℃降温至t1℃,其溶质质量分数由大到小的关系是:b>a=c
D.若a物质中混有了少量的c物质,可采用降温结晶的方法提纯a物质
二、填空题
16.如图A、B、C为三种物质的溶解度曲线,据图回答:
(1)t2℃时,A、B、C三种物质的溶解度由大到小顺序是___________。
(2)将t2℃时的等质量三种物质的饱和溶液分别降到0℃时,析出溶质最多的是___________,无溶质析出的是___________。
(3)当A中含有少量B时为了得到纯净的A,可采用___________的方法。
(4)若将t2℃三种物质的饱和溶液分别降到t1℃时,则三种溶液中溶质的质量分数由大到小的顺序是___________。
17.化学无处不在,化学是应用最广泛的学科之一。
(1)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是______;
(2)在厨房用水洗涤餐具时,通常在水里加些洗涤剂,这样就可以很容易的除去餐具上的油污,这是因为洗涤剂具有______作用。
(3)0.9%的生理盐水广泛用于医疗救护,若要配制500g生理盐水需氯化钠的质量为______。
(4)废水中若氨氮含量过高,直接排放会导致水体富营养化。次氯酸(HC1O)可除去废水中的NH3,其反应为:,X的化学式为______。
(5)金属材料因锈蚀而报废。铁生锈的条件是______;把铁制成不锈钢可有效的防止铁生锈,不锈钢的硬度______(填“大于”或“小于”)纯铁。
18.下图甲是A、B、C三种固体物质的溶解度曲线图。
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是_______.
(2)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的_______.
19.我国将力争于 2030 年前达到峰值,2060 年前实现碳中和。
(1)大气中 CO2 的产生主要来自化石燃料的燃烧,化石燃料属于______(填“可再生”或“不可再生”)能源。
(2)控制 CO2 的排放,目的是为减缓______效应。
(3)加压水洗法可捕集 CO2,是因为压强增大时 CO2 在水中的溶解度______(填“增大”或“减小”)。
(4)我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(化学式为 CH3OH) 和水。
I、该反应的化学方程式为______。
II、甲醇由______种元素组成,2mol 甲醇分子中约含______个氧原子(用科学计数法表示)。
20.溶液是生产生活中常用的物质。
温度(℃) 20 30 40 60 80 100
溶解度(g/100g水) 氯化钠 36.0 36.3 36.6 37.3 38.4 39.8
硝酸钾 31.6 45.8 63.9 110 169 246
(1)为配制100g、15%的氯化钠溶液,需称取氯化钠_______g。
(2)20℃时,分别配制等质量的氯化钠、硝酸钾的饱和溶液,所需水量较多的物质是_____。
(3)60℃时,50g饱和硝酸钾溶液中,溶质与溶剂的质量比为_______。
(4)某固体混合物含244gKNO3、36.3gNaCl。为得到尽可能多且纯度较高的硝酸钾,设计如下实验:在该固体中加入100g水,加热至100℃,固体全部溶解后,再_______。(请将操作步骤补充完整)
三、推断题
21.A、B、C、D和甲、乙均为初中化学中常见的物质,物质间存在着如图所示的相互转化关系(部分生成物未标出).请回答下列问题:
(1)若A为气体氧化物,与溶液甲和溶液乙反应均生成盐和水.则A的化学式为______;取溶液D少量于试管中,加入碳酸钠溶液,有白色沉淀生成,则溶液D中溶质为______(写化学式);③反应的化学方程式为______.
(2)若向一定质量的碳酸钠溶液中加入足量的氯化钙溶液,所得沉淀质量等于原碳酸钠溶液质量的,则原碳酸钠溶液中溶质的质量分数为______.
22.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
23.某兴趣小组为探究可燃物的燃烧条件,设计了以下实验。甲乙均为软塑料瓶改装的气体发生装置,无纺布包内放有一定量的固体试剂,丙中放有左右两处大小相等、质量相等的红磷,且与热源距离相同。
(1)甲中无纺布包内为二氧化锰,其下端溶液中溶质为___________乙中制的气体不可燃,也不助燃,乙中反应方程式为___________
(2)①通过对软塑料瓶的捏放瓶身,可随时控制反应的___________
②为了探究可燃物的燃烧条件,请选择相应的序号进行排序___________(每个序号只选一次)。
a.捏压甲一段时间 b.捏压乙一段时间c.使瓶复原d.加热仪器丁
③丙中燃烧时的现象是___________
24.学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,配制150g质量分数为10%的氢氧化钠溶液的操作过程如下:
(1)用上述图示序号表示配制该溶液的正确操作顺序________。
(2)图①中玻璃棒搅拌的目的是___________。
(3)配制过程中需称取_________g氢氧化钠固体。
(4)经检验,该同学配制的溶液溶质质量分数偏小,可能的原因是 (填字母)。
A.用量筒量取水时俯视读数 B.配制溶液的烧杯用少量蒸馏水润洗
C.氢氧化钠固体不纯 D.转移已配好的溶液时,有少量溶液溅出
(5)用上述配制好的氢氧化钠溶液(密度约为1.1g/cm3)配制50g溶质质量分数为3%的氢氧化钠溶液,需要量取10%的氢氧化钠溶液_________mL(结果精确到0.1)。
五、计算题
25.黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中锌的含量,现将10g黄铜样品,与一定质量的稀硫酸恰好完全反应,所得物质总质量103.5g,同时生成氢气0.2g,试计算:
(1)该黄铜样品中锌的质量为 g;
(2)恰好完全反应后所得溶液中溶质的质量分数。
26.取Cu-Zn合金10g,将该合金放入烧杯中,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与产生气体的质量关系如图所示。
请计算:
(1)计算合金中铜的质量分数。
(2)计算反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
参考答案:
1.D 2.D 3.A 4.B 5.B 6.D 7.C 8.B 9.C 10.C 11.D 12.C 13.C 14.C 15.C 16.(1)A>B>C
(2) A C
(3)降温结晶
(4)B>A>C
17.(1)为燃烧提供充足的氧气
(2)乳化
(3)4.5g
(4)N2
(5) 与水和氧气同时接触 大于
18.(1)A
(2)C
19.(1)不可再生
(2)温室
(3)增大
(4) 三 1.204×1024
20.(1)15
(2)硝酸钾
(3)11:10
(4)趁热过滤,将滤液降温至20℃,再过滤
21. CO2 NaOH、Ca(OH)2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 53%
22. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
23.(1) H2O2##过氧化氢
(2) 可控制反应的发生或停止 bdca 左端红磷燃烧,右端红磷后燃烧,产生大量的白烟,放出大量的热
24.(1)④③②①
(2)加快氢氧化钠固体的溶解速率
(3)15
(4)BC
(5)13.6
25.(1)6.5
解:设参加反应的锌的质量为x,生成硫酸锌的质量为y。
x=6.5g
y=16.1g
答:该黄铜样品中锌的质量为6.5g。
(2)16.1%
恰好完全反应后所得溶液中溶质的质量分数为×100%=16.1%。
答:恰好完全反应后所得溶液中溶质的质量分数为16.1%。
26.(1)解:设铜锌合金中锌的质量为x,生成硫酸锌的质量为y。
所以合金中铜的质量分数为
(2)反应后所得溶液的溶质质量分数为
答:合金中铜的质量分数为35%,反应后所得溶液的溶质质量分数为15.1%。
同课章节目录
