11.1 复分解反应的应用 复习课件(38张PPT)——人教版九年级下册
文档属性
| 名称 | 11.1 复分解反应的应用 复习课件(38张PPT)——人教版九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 14:05:30 | ||
图片预览









文档简介
(共38张PPT)
第十一单元 盐 化肥
课题1 复分解反应的应用
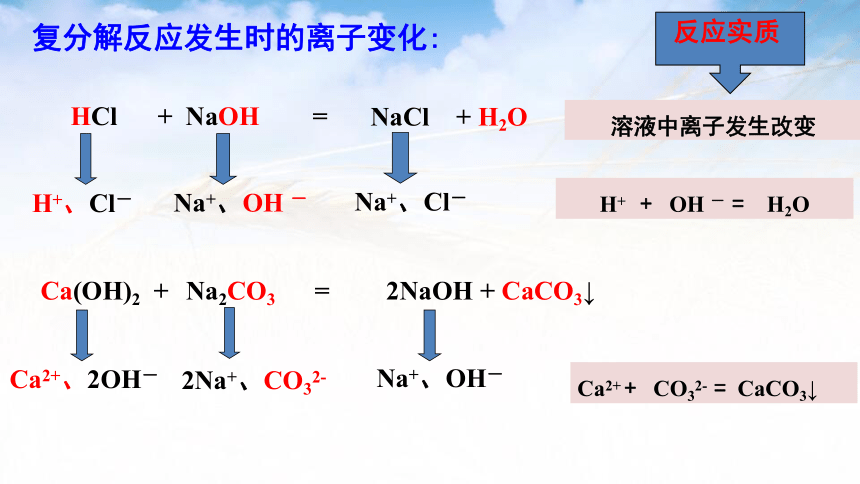
Ca(OH)2 + Na2CO3 =
H+、Cl-
Na+、OH -
Na+、Cl-
溶液中离子发生改变
HCl + NaOH =
NaCl + H2O
复分解反应发生时的离子变化:
2NaOH + CaCO3↓
Ca2+、2OH-
2Na+、CO32-
Na+、OH-
反应实质
H+ + OH - = H2O
Ca2+ + CO32- = CaCO3↓
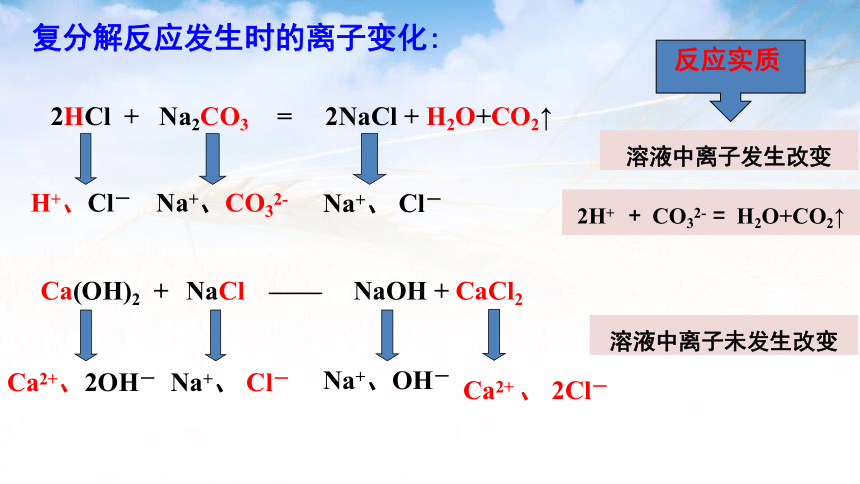
Ca(OH)2 + NaCl ——
H+、Cl-
Na+、CO32-
Na+、 Cl-
溶液中离子发生改变
2HCl + Na2CO3 = 2NaCl + H2O+CO2↑
复分解反应发生时的离子变化:
NaOH + CaCl2
Ca2+、2OH-
Na+、 Cl-
Na+、OH-
反应实质
2H+ + CO32- = H2O+CO2↑
Ca2+ 、 2Cl-
溶液中离子未发生改变
例:HCl + NaOH= NaCl+ H2O,则说明HCl 和 NaOH不能共存
该反应的实质为:H+ + OH - = H2O,则说明H+ 和 OH -不能共存
Ca2+ + CO32- = CaCO3↓
2HCl +Na2CO3 =2NaCl + H2O+CO2↑
Ca(OH)2+ Na2CO3 = 2NaOH + CaCO3↓
2H+ + CO32- = H2O+CO2↑
复分解反应及其应用—离子共存
溶液中溶质能共存的含义是相互间不反应,不能共存是因为相互间能反应生成沉淀或气体或水。
在水溶液中,离子结合生成沉淀、水或气体则不能大量共存。
1.离子间反应生成水,不能共存: H+与OH-
2.离子间反应生成气体,不能共存:
H+与CO32-、HCO3-; NH4+与OH-
3.离子间反应生成沉淀,不能共存:
①OH-与Cu2+ ②OH-与Fe3+ ③OH-与Mg2+ ④OH-与Al3+
⑤CO32-与Ca2+ ⑥CO32-与Ba2+ ⑦Cl-与Ag+ ⑧SO42- 与Ba2+
NH4+ + OH - = H2O+ NH3 ↑
H+ + HCO3- = H2O+CO2↑
B
A、2H+ + CO32- = H2O+CO2↑
C、Cu2+ + 2OH- = Cu(OH)2↓
D、Ag+ + Cl- = AgCl↓
Ca2+ + CO32- = CaCO3↓
D
3.在pH=2的无色溶液中,下列离子能大量共存的是( )
A.Ba2+ HCO3﹣ SO42﹣
B.Ag+ Mg2+ NO3﹣
C.K+ OH﹣ CO32﹣
D.NH4+ Fe2+ Cl﹣
B
H +
H+
H+
H +
蓝色溶液(含Cu2+的盐溶液):
CuCl2溶液 Cu(NO3)2溶液 CuSO4溶液
浅绿色溶液(含Fe2+的盐溶液):
FeCl2溶液 Fe (NO3)2溶液 FeSO4溶液
黄色溶液(含Fe3+的盐溶液):
FeCl3溶液 Fe (NO3)3溶液 Fe2(SO4)3溶液
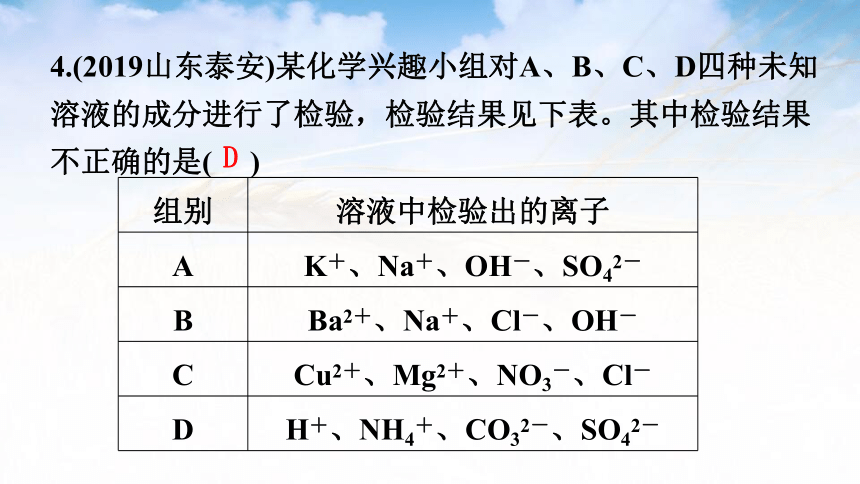
组别 溶液中检验出的离子
A K+、Na+、OH-、SO42-
B Ba2+、Na+、Cl-、OH-
C Cu2+、Mg2+、NO3-、Cl-
D H+、NH4+、CO32-、SO42-
4.(2019山东泰安)某化学兴趣小组对A、B、C、D四种未知
溶液的成分进行了检验,检验结果见下表。其中检验结果
不正确的是( )
D
C
甲:
乙:
OH-
Cu2+、Fe3+、Ag+
Cl-
NO3-
K+
课 后 作 业
D
D
D
D
C
D
D
D
BaSO4↓
HCl
Na2SO4
3KOH
沉淀
气体
除杂原则:不增、不减、易分离
(1)杂不增:在除去杂质的同时,不能产生新的杂质。
(2)主不减:所选试剂不能与被提纯物质(主要成分)反应。
(3)易分离:除杂后生成的产物的状态与被提纯物质的状态
要不同,方便除去。
复分解反应及其应用—除杂
例:除去氯化钠溶液中的少量碳酸钠
分析:NaCl( Na2CO3 )
Na+、CO32-
Na+、Cl-
杂质离子
酸碱盐之间的除杂,其实质为离子的除杂。
Ca2+ + CO32- = CaCO3↓
2H+ + CO32- = H2O+CO2↑
Ba2+ + CO32- = BaCO3↓
除杂试剂选择:HCl或 CaCl2或 BaCl2
2HCl +Na2CO3 =2NaCl + H2O+CO2↑
CaCl2+ Na2CO3 = 2NaCl + CaCO3↓
BaCl2+ Na2CO3 = 2NaCl + BaCO3↓
不能,会生成新杂质NaOH。 Ca(OH)2+ Na2CO3 = 2NaOH + CaCO3↓
思考:能否选择Ca(OH)2除杂?
1.选择合适的试剂除去括号中的杂质:
① NaNO3 (NaCl):
② NaCl (Na2SO4):
③ NaCl (NaOH):
④ NaCl (CuSO4):
CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓
NaCl +AgNO3 =AgCl↓ + NaNO3
2NaOH + MgCl2 = Mg(OH)2↓+ 2NaCl
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
加适量AgNO3溶液
加适量BaCl2溶液
加适量MgCl2溶液
加适量Ba(OH)2溶液
离子 检验方法 实验现象
H+ ①取少量试剂滴加紫色石蕊溶液 紫色石蕊溶液变红
②用玻璃棒蘸取少量溶液滴在pH试纸上 与标准比色卡对照,pH<7
③取少量试剂加入活泼金属(镁条/锌粒等) 有气泡产生
④取少量试剂加入金属氧化物(氧化铁/氧化铜等) 固体溶解,溶液变为黄色/蓝色
⑤取少量试剂加入碱(氢氧化铁/氢氧化铜等) 固体溶解,溶液变为黄色/蓝色
复分解反应及其应用—离子检验
常见离子 检验方法 实验现象
OH- ①取少量试剂滴加紫色石蕊溶液(无色酚酞溶液) 变蓝色(红色)
②用玻璃棒蘸取少量溶液滴在pH试纸上 与标准比色卡对照,
pH>7
③取少量试剂加入可溶性铜盐 (或铁盐) 有蓝色絮状沉淀生成
(有红褐色沉淀生成)
CO32- 取少量试剂滴加稀盐酸(或稀硫酸),再将生成的气体通入澄清石灰水中 澄清石灰水变浑浊
2.下列每组中的两种固体物质,只用水作试剂,不能将其鉴别出来的是( )
A.CuSO4、KNO3
B.KCl、NaCl
C.AgCl、NaNO3
D.NH4NO3、NaCl
B
A
B
5.有四种澄清透明的溶液:①MgCl2溶液 ②Cu(NO3)2溶液 ③K2SO4溶液 ④KOH溶液。不用其他试剂就可进行鉴别,鉴别出来的先后顺序是( )
A、④①②③ B、②④①③
C、③②①④ D、②①③④
B
C
课 后 作 业
B
A
B
(3)NaOH[Ca(OH)2]:
_________________________________________;
Ca(NO3)2
Ba(NO3)2
第十一单元 盐 化肥
课题1 复分解反应的应用
Ca(OH)2 + Na2CO3 =
H+、Cl-
Na+、OH -
Na+、Cl-
溶液中离子发生改变
HCl + NaOH =
NaCl + H2O
复分解反应发生时的离子变化:
2NaOH + CaCO3↓
Ca2+、2OH-
2Na+、CO32-
Na+、OH-
反应实质
H+ + OH - = H2O
Ca2+ + CO32- = CaCO3↓
Ca(OH)2 + NaCl ——
H+、Cl-
Na+、CO32-
Na+、 Cl-
溶液中离子发生改变
2HCl + Na2CO3 = 2NaCl + H2O+CO2↑
复分解反应发生时的离子变化:
NaOH + CaCl2
Ca2+、2OH-
Na+、 Cl-
Na+、OH-
反应实质
2H+ + CO32- = H2O+CO2↑
Ca2+ 、 2Cl-
溶液中离子未发生改变
例:HCl + NaOH= NaCl+ H2O,则说明HCl 和 NaOH不能共存
该反应的实质为:H+ + OH - = H2O,则说明H+ 和 OH -不能共存
Ca2+ + CO32- = CaCO3↓
2HCl +Na2CO3 =2NaCl + H2O+CO2↑
Ca(OH)2+ Na2CO3 = 2NaOH + CaCO3↓
2H+ + CO32- = H2O+CO2↑
复分解反应及其应用—离子共存
溶液中溶质能共存的含义是相互间不反应,不能共存是因为相互间能反应生成沉淀或气体或水。
在水溶液中,离子结合生成沉淀、水或气体则不能大量共存。
1.离子间反应生成水,不能共存: H+与OH-
2.离子间反应生成气体,不能共存:
H+与CO32-、HCO3-; NH4+与OH-
3.离子间反应生成沉淀,不能共存:
①OH-与Cu2+ ②OH-与Fe3+ ③OH-与Mg2+ ④OH-与Al3+
⑤CO32-与Ca2+ ⑥CO32-与Ba2+ ⑦Cl-与Ag+ ⑧SO42- 与Ba2+
NH4+ + OH - = H2O+ NH3 ↑
H+ + HCO3- = H2O+CO2↑
B
A、2H+ + CO32- = H2O+CO2↑
C、Cu2+ + 2OH- = Cu(OH)2↓
D、Ag+ + Cl- = AgCl↓
Ca2+ + CO32- = CaCO3↓
D
3.在pH=2的无色溶液中,下列离子能大量共存的是( )
A.Ba2+ HCO3﹣ SO42﹣
B.Ag+ Mg2+ NO3﹣
C.K+ OH﹣ CO32﹣
D.NH4+ Fe2+ Cl﹣
B
H +
H+
H+
H +
蓝色溶液(含Cu2+的盐溶液):
CuCl2溶液 Cu(NO3)2溶液 CuSO4溶液
浅绿色溶液(含Fe2+的盐溶液):
FeCl2溶液 Fe (NO3)2溶液 FeSO4溶液
黄色溶液(含Fe3+的盐溶液):
FeCl3溶液 Fe (NO3)3溶液 Fe2(SO4)3溶液
组别 溶液中检验出的离子
A K+、Na+、OH-、SO42-
B Ba2+、Na+、Cl-、OH-
C Cu2+、Mg2+、NO3-、Cl-
D H+、NH4+、CO32-、SO42-
4.(2019山东泰安)某化学兴趣小组对A、B、C、D四种未知
溶液的成分进行了检验,检验结果见下表。其中检验结果
不正确的是( )
D
C
甲:
乙:
OH-
Cu2+、Fe3+、Ag+
Cl-
NO3-
K+
课 后 作 业
D
D
D
D
C
D
D
D
BaSO4↓
HCl
Na2SO4
3KOH
沉淀
气体
除杂原则:不增、不减、易分离
(1)杂不增:在除去杂质的同时,不能产生新的杂质。
(2)主不减:所选试剂不能与被提纯物质(主要成分)反应。
(3)易分离:除杂后生成的产物的状态与被提纯物质的状态
要不同,方便除去。
复分解反应及其应用—除杂
例:除去氯化钠溶液中的少量碳酸钠
分析:NaCl( Na2CO3 )
Na+、CO32-
Na+、Cl-
杂质离子
酸碱盐之间的除杂,其实质为离子的除杂。
Ca2+ + CO32- = CaCO3↓
2H+ + CO32- = H2O+CO2↑
Ba2+ + CO32- = BaCO3↓
除杂试剂选择:HCl或 CaCl2或 BaCl2
2HCl +Na2CO3 =2NaCl + H2O+CO2↑
CaCl2+ Na2CO3 = 2NaCl + CaCO3↓
BaCl2+ Na2CO3 = 2NaCl + BaCO3↓
不能,会生成新杂质NaOH。 Ca(OH)2+ Na2CO3 = 2NaOH + CaCO3↓
思考:能否选择Ca(OH)2除杂?
1.选择合适的试剂除去括号中的杂质:
① NaNO3 (NaCl):
② NaCl (Na2SO4):
③ NaCl (NaOH):
④ NaCl (CuSO4):
CuSO4 + Ba(OH)2 = BaSO4↓+ Cu(OH)2↓
NaCl +AgNO3 =AgCl↓ + NaNO3
2NaOH + MgCl2 = Mg(OH)2↓+ 2NaCl
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
加适量AgNO3溶液
加适量BaCl2溶液
加适量MgCl2溶液
加适量Ba(OH)2溶液
离子 检验方法 实验现象
H+ ①取少量试剂滴加紫色石蕊溶液 紫色石蕊溶液变红
②用玻璃棒蘸取少量溶液滴在pH试纸上 与标准比色卡对照,pH<7
③取少量试剂加入活泼金属(镁条/锌粒等) 有气泡产生
④取少量试剂加入金属氧化物(氧化铁/氧化铜等) 固体溶解,溶液变为黄色/蓝色
⑤取少量试剂加入碱(氢氧化铁/氢氧化铜等) 固体溶解,溶液变为黄色/蓝色
复分解反应及其应用—离子检验
常见离子 检验方法 实验现象
OH- ①取少量试剂滴加紫色石蕊溶液(无色酚酞溶液) 变蓝色(红色)
②用玻璃棒蘸取少量溶液滴在pH试纸上 与标准比色卡对照,
pH>7
③取少量试剂加入可溶性铜盐 (或铁盐) 有蓝色絮状沉淀生成
(有红褐色沉淀生成)
CO32- 取少量试剂滴加稀盐酸(或稀硫酸),再将生成的气体通入澄清石灰水中 澄清石灰水变浑浊
2.下列每组中的两种固体物质,只用水作试剂,不能将其鉴别出来的是( )
A.CuSO4、KNO3
B.KCl、NaCl
C.AgCl、NaNO3
D.NH4NO3、NaCl
B
A
B
5.有四种澄清透明的溶液:①MgCl2溶液 ②Cu(NO3)2溶液 ③K2SO4溶液 ④KOH溶液。不用其他试剂就可进行鉴别,鉴别出来的先后顺序是( )
A、④①②③ B、②④①③
C、③②①④ D、②①③④
B
C
课 后 作 业
B
A
B
(3)NaOH[Ca(OH)2]:
_________________________________________;
Ca(NO3)2
Ba(NO3)2
同课章节目录
