2021-2022学年下学期高中化学鲁科版(2019)选择性必修2第3章第2节几种简单的晶体结构模型——提升训练(word 含解析)
文档属性
| 名称 | 2021-2022学年下学期高中化学鲁科版(2019)选择性必修2第3章第2节几种简单的晶体结构模型——提升训练(word 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 462.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-12 21:57:50 | ||
图片预览




文档简介
第3章不同聚集状态的物质与性质第2节几种简单的晶体结构模型——提升训练2021-2022学年高中化学鲁科版(2019)选择性必修2
一、选择题(共16题)
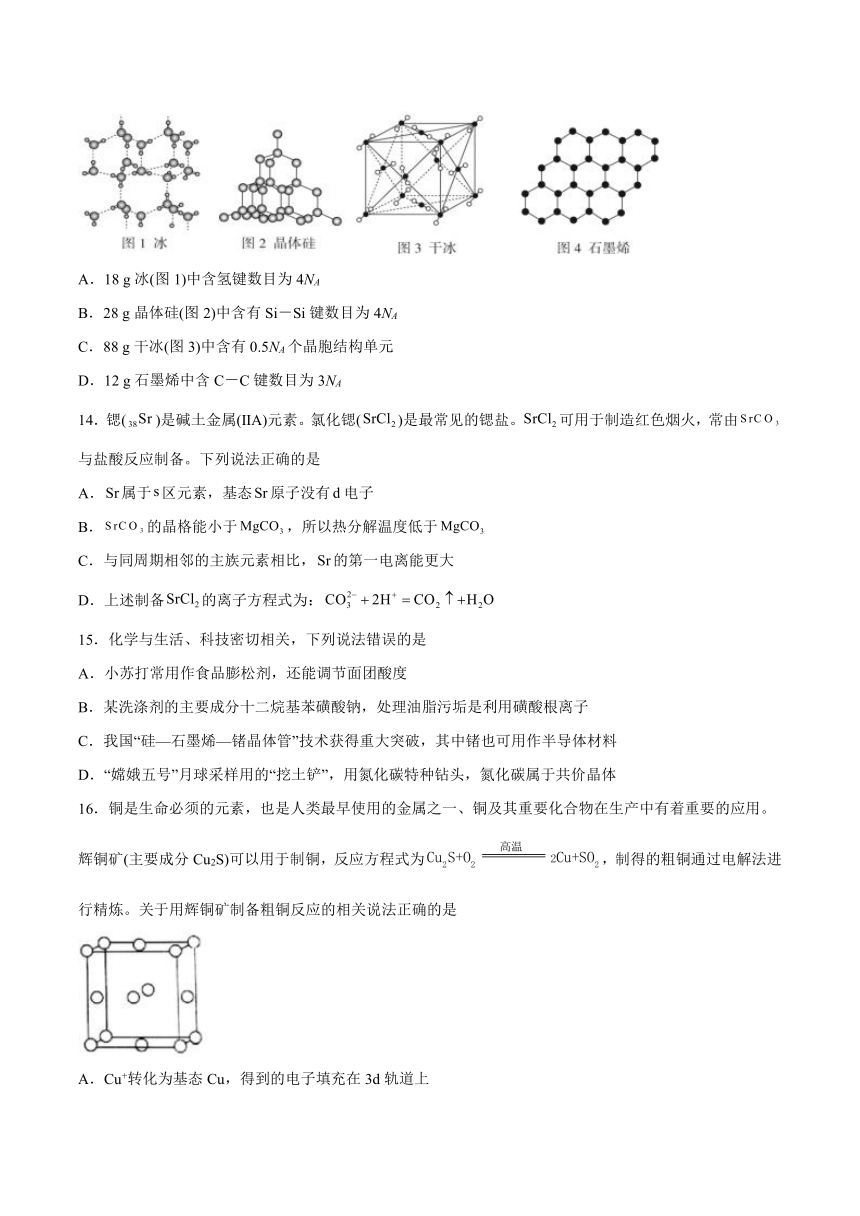
1.下列说法中,不正确的是
A.晶体中原子呈周期性有序排列,有自范性
B.金属晶体导电是因为在外加电场作用下金属产生了自由电子,电子定向移动产生了电流
C.MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
D.乳酸[CH3CH(OH)COOH]分子中有1个手性碳原子
2.下列大小关系正确的是
A.离子键:NaCl<NaBr B.硬度:MgO>CaO
C.熔点:NaI>NaBr D.熔沸点:CO2>NaCl
3.下列相关比较中,正确的是
A.分解温度:MgCO3>CaCO3> BaCO3 B.熔点:Na>Mg>Al
C.微粒半径:r(Cl-)>r(O2-)>r(Na+) D.热稳定性:H2O>H2S> HCl
4.下列物质性质的变化规律与分子间作用力有关的是
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.HF、HC1、HBr、HI的热稳定性依次减弱
D.金刚石的硬度大于硅,其熔沸点也高于硅
5.类比是学习化学的一种很重要的方法。下列类比合理的是
A.NaCl固体与浓硫酸可以制备HCl,则CaF2固体与浓硫酸可以制备HF
B.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
C.Na在空气中燃烧生成Na2O2,则Li在空气中燃烧生成Li2O2
D.Ca(HCO3)2溶解度大于CaCO3,则NaHCO3溶解度大于Na2CO3
6.下列各物质熔点由高到低的顺序正确的是
①MgO②NaCl③KBr④HCl⑤H2O
A.①②③⑤④ B.①②③④⑤ C.④⑤①②③ D.③②①④⑤
7.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,晶胞参数a=b=c,α=β=γ,下列有关说法正确的是
A.该晶体属于离子晶体,晶体的化学式为BaO
B.该晶体中化学键类型只有离子键
C.该晶体晶胞结构与ZnS相似
D.填入Ba2+堆积产生的八面体空隙,填隙率100%
8.下列有关物质结构与性质的因果关系论述中,错误的是
A.因为键能,所以的热稳定性强于
B.因为的孤电子对数多于,所以的键角小于
C.因为的非羟基氧数目多于,所以酸性强于
D.因为半径大于,所以中阳离子的配位数比中的大
9.下列叙述不正确的是
A.Li2S晶胞结构如图1,S2-的配位数是8
B.某镍白铜合金的立方晶胞结构如图2,晶胞中铜原子与镍原子的数量比为3:1
C.氯化钠晶胞如图3,离钠离子最近的钠离子有6个
D.铜与氧元素形成的晶胞如图4,晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为()
10.冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子。下图是18-冠-6与钾离子以配位键结合形成的超分子结构示意图。下列说法错误的是
A.冠醚与碱金属离子之间的配位键属于共价键
B.中心原子K+的配位数为6
C.冠醚与碱金属离子形成配合物得到的晶体里还有阴离子
D.这类配合物晶体是分子晶体
11.短周期元素W、X、Y、Z的原子序数依次增大,浙江大学研究团队以(硅酸盐,a、b为系数)为载体,利用Au-Pb纳米颗粒催化气态单质W2、X2合成W2X2,其原理如图所示。下列说法错误的是
A.地壳中元素含量:X>Z>Y B.简单离子半径:Y>X
C.Y2X3和ZX2均具有较高熔点 D.W与X形成的化合物可能含非极性键
12.类推的思维方法在化学学习与研究中可能会产生错误的结论。因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.常温下为液态,常温下也为液态
B.金刚石中键的键长为,中键的键长为,所以的熔点高于金刚石
C.熔点较高,熔点也较高
D.从、、为正四面体结构,可推测、也为正四面体结构
13.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(图1)中含氢键数目为4NA
B.28 g晶体硅(图2)中含有Si-Si键数目为4NA
C.88 g干冰(图3)中含有0.5NA个晶胞结构单元
D.12 g石墨烯中含C-C键数目为3NA
14.锶()是碱土金属(ⅡA)元素。氯化锶()是最常见的锶盐。可用于制造红色烟火,常由与盐酸反应制备。下列说法正确的是
A.属于区元素,基态原子没有电子
B.的晶格能小于,所以热分解温度低于
C.与同周期相邻的主族元素相比,的第一电离能更大
D.上述制备的离子方程式为:
15.化学与生活、科技密切相关,下列说法错误的是
A.小苏打常用作食品膨松剂,还能调节面团酸度
B.某洗涤剂的主要成分十二烷基苯磺酸钠,处理油脂污垢是利用磺酸根离子
C.我国“硅—石墨烯—锗晶体管”技术获得重大突破,其中锗也可用作半导体材料
D.“嫦娥五号”月球采样用的“挖土铲”,用氮化碳特种钻头,氮化碳属于共价晶体
16.铜是生命必须的元素,也是人类最早使用的金属之一、铜及其重要化合物在生产中有着重要的应用。辉铜矿(主要成分Cu2S)可以用于制铜,反应方程式为,制得的粗铜通过电解法进行精炼。关于用辉铜矿制备粗铜反应的相关说法正确的是
A.Cu+转化为基态Cu,得到的电子填充在3d轨道上
B.O2和SO2都是非极性分子
C.Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有8个Cu+
D.标准状况下,每有22.4 LO2参与反应,转移电子4 mol
二、综合题(共6题)
17.氨是重要的化工原料,用途很广。
合成氨工厂常用醋酸二氨合铜由和构成溶液吸收对氨合成催化剂有毒害的CO气体。
醋酸二氨合铜所含的元素中,第一电离能最大的是 ______ 填元素名称。
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______ 填标号。
离子晶体 分子晶体原子晶体 金属晶体
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种不含。
气体与相遇立即生成一种白色晶体:。
和分子的空间构型分别为 ______ 、 ______ 。
晶体中,B原子的杂化轨道类型为 ______ 。
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为的物质。该物质易溶于水,在水溶液中以和两种正四面体构型的离子存在。遇碱生成一种形似白磷的分子。
下列相关说法中,正确的是 ______ 填序号。
是的同分异构体
分解生成,形成了4mol 键
白磷的沸点比高,原因是键键能比键大
白磷的化学性质比活泼,说明P的非金属性比N强
画出的结构标明其中的配位键: ______ 。
18.碳、硅及其化合物是一类重要物质。自然界的矿物.岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000-3000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,SiO2易在地壳________(填“深”、“浅”)处沉积。
(2)如果上述反应的平衡常数K值变大,该反应____________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为________。
(5)合成氮化碳是一种与金刚石类似的晶体,该晶体中微粒间的作用力是_______,预测氮化碳的硬度比金刚石的_________(选填“大”、“小”、“不确定”)。
(6)SiH4是________(极性或非极性)分子,与CH4相比,沸点高的是________(化学式),用有关化学原理解释该事实:__________。
19.氧、碳等非金属元素形成的物质种类繁多、性状各异。
(1)氧、氟、氮三种元素都可形成简单离子,它们的离子半径最小的是___________(填离子符号),硅元素在元素周期表中的位置是___________。CO2和SiO2是同一主族元素的最高正价氧化物,常温下CO2为气体,SiO2为高熔点固体。请分析原因:___________。
(2)比较硫和氯性质的强弱。热稳定性H2S___________HCl(选填“<”、“>”或“=”,下同);酸性:HClO4___________H2SO4。用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:___________。
(3)红酒中添加一定量的SO2 可以防止酒液氧化,这利用了SO2 的___________性。若将SO2气体通入H2S水溶液中直至过量,下列表示溶液的pH随通入SO2气体体积变化的示意图正确的是___________(填序号)。
已知NaHSO3溶液呈酸性,而HSO既能电离又能水解。则在NaHSO3溶液中c(H2SO3)___________c(SO)(选填“<”、“>”或“=”) 。
(4)亚硫酸钠和碘酸钾在酸性条件下反应生成硫酸钠、硫酸钾、碘和水,写该反应方程式________________。
20.(1)用质谱仪检测氟化氢气体时,谱图中出现质荷比(相对分子质量)为40的峰,原因是___________。
(2)的熔点(2054℃)比(190℃)熔点高很多的原因是___________。
21.根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号___________。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是___________。
(3)NH的立体结构为:___________,SO2的立体结构为:___________。
(4)周期表中最活泼的非金属元素原子的轨道表示式为___________ 。
(5)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为___________。
(6) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是___________。
(7)写出HCN的电子式___________,该分子中σ键和π 键的比为___________。
(8)比较NCl3和 PCl3键角大小并解释其原因___________。
(9)向硫酸铜溶液中加入氨水,先生成蓝色沉淀,续滴加氨水,沉淀溶解生成蓝色溶液,写出生成的配离子的结构式___________,1mol该配离子中含有的σ键数目为___________。
22.某元素原子的电子排布式为,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第___周期第____族,处于元素周期表的____区。
(2)比较下列离子结合氢离子的能力:___(填“>”、“<”、“=”),并用离子方程式说明___。
(3)比较沸点高低:正丁烷__异丁烷(填“>”、“<”、“=”),请从结构角度分析原因____。
(4)写出电子式___,该分子的空间构型__(填“是”或“否”)为平面形。
(5)的空间构型为____;的空间构型为____,硫原子的杂化方式为____。
试卷第页,共页
参考答案:
1.B
【解析】
【详解】
A.晶体中原子呈周期性有序排列而非晶体中原子排列无序;晶体自范性的本质是:晶体中粒子微观空间里呈现周期性的有序排列的宏观表象,A正确;
B.金属晶体导电是在外加电场作用下,金属中含有的自由电子变为定向移动而形成电流,而不是在外加电场力作用下才产生的自由移动的电子,B错误;
C.MgO的晶格能远比NaCl大,这是由于MgO中离子所带的电荷数比NaCl多,而离子半径却比NaCl的小,C正确;
D.手性碳原子是连接4个不同的原子或原子团的碳原子。乳酸[CH3CH(OH)COOH]分子中与-CH3、-OH、-COOH、H原子连接的C原子为手性碳原子,因此乳酸分子中含有1个手性碳原子,D正确;
故合理选项是B。
2.B
【解析】
【分析】
【详解】
A.离子半径Cl-<Br-,离子半径越小,形成离子键越大:NaCl>NaBr,选项A错误;
B.离子半径Mg2+<Ca2+,离子半径越小,晶格能越大,硬度越大,硬度:MgO>CaO,选项B正确;
C.离子半径I->Br-,离子半径越小,晶格能越大,离子晶体的熔点越高,熔点:NaI<NaBr,选项C错误;
D.CO2为分子晶体,NaCl为离子晶体,离子晶体的熔沸点大于分子晶体的熔沸点,选项D错误;
答案选B。
3.C
【解析】
【详解】
A.当阳离子所带电荷相同时,阳离子半径越大,其结合氧离子能力就越弱,对应的碳酸盐受热分解温度就越高,则碳酸盐的分解温度:MgCO3<CaCO3<BaCO3,A错误,
B.金属晶体中离子半径越小,离子的电荷越多,金属的熔点越高,则熔点由高到低:Al>Mg>Na,B错误;
C.Cl-具有三个电子层,O2-、Na+具有相同的电子排布,核电荷数越大半径越小,电子层数越多半径越大,故微粒半径:r(Cl-)>r(O2-)>r(Na+),C正确;
D.简单气态氢化物的热稳定性与元素非金属性一致, 已知非金属性比O>Cl>S,故H2O> HCl > H2S,D错误;
故答案为:C。
4.A
【解析】
【详解】
A.F2、Cl2、Br2、I2均为分子晶体,随着相对分子质量增大,分子间作用力增大,故它们的熔沸点逐渐升高与分子间作用力有关,A符合题意;
B.NaF、NaCl、NaBr、NaI均为离子晶体,由于离子半径F-<Cl-<Br-<I-,其离子键的晶格能依次减小,故它们的熔点依次降低与分子间作用力无关,B不合题意;
C.HF、HC1、HBr、HI的热稳定性依次减弱与它们的共价键的键能有关,与其分子间作用力无关,C不合题意;
D.金刚石和晶体硅均为共价晶体(原子晶体),金刚石的硬度大于硅,其熔沸点也高于硅是由于金刚石中的C-C共价键的键能比晶体硅中Si-Si键的键能大,与分子间作用力无关,D不合题意;
故答案为:A。
5.A
【解析】
【详解】
A.浓硫酸难挥发,氯化氢、HF易挥发,NaCl固体与浓硫酸可以制备HCl,则CaF2固体与浓硫酸可以制备HF,故A正确;
B.晶体中有阴离子,必有阳离子,但晶体中有阳离子,不一定必有阴离子,例如金属晶体中只有阳离子没有阴离子,故B错误;
C.锂活泼性弱于钠,在空气中燃烧生成氧化锂,故C错误;
D.一般难溶性的碳酸盐的溶解度小于相应的碳酸氢盐,如Ca(HCO3)2的溶解度大于CaCO3,而可溶性的碳酸盐的溶解度大于相应的碳酸氢盐,如Na2CO3溶解度大于NaHCO3,故D错误;
故选A。
6.A
【解析】
【分析】
【详解】
一般情况下,离子晶体的熔点高于分子晶体,离子晶体的晶格能越大,熔点越高,分子晶体中分子间作用力越大,熔点越高,氧化镁、氯化钠和溴化钾都为离子晶体,晶体的晶格能依次减小,熔点依次降低,氯化氢和水都是分子晶体,水分子间能形成氢键,分子间的作用力强于氯化氢,水分子的熔点高于氯化氢,则熔点由高到低的顺序为氧化镁、氯化钠、溴化钾、水、氯化氢,故选A。
7.D
【解析】
【详解】
A.晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8× +6×=4,位于晶胞的边上和体心位置,共含有的个数为12×+1=4,该氧化物为BaO2,A错误;
B.中O和O之间为非极性共价键,B错误;
C.由晶胞结构可知,离子配位数为6,与NaCl结构相似,C错误;
D.位于体心和棱心,均处在Ba2+堆积产生的八面体空隙内,因此填隙率为100%,D正确;
故选D。
8.D
【解析】
【分析】
【详解】
A.化学键的键能越大,物质的化学性质越稳定,故因为键能,所以的热稳定性强于,A正确;
B.由于电子对之间的排斥作用是:孤电子对对孤电子对>孤电子对对成键电子对>成键电子对对成键电子对,H2O中O周围有对孤电子对,而SO3中S原子周围没有孤电子对,因为的孤电子对数多于,所以的键角小于,B正确;
C.同一元素的含氧酸的酸性随非羟基氧原子的数目增多而增强,因为的非羟基氧数目多于,所以酸性强于,C正确;
D.离子晶体中离子的配位数主要与阴、阳离子的半径比值大小和离子所带的电荷数有关,而与那一种离子半径的绝对大小无关,因为半径大于,所以中阳离子的配位数比中的大,二者无因果关系,D错误;
故答案为:D。
9.C
【解析】
【详解】
A.Li+与S2-的个数比为2:1,则Li+与S2-的配位数之比为1:2,由Li2S的晶胞结构可知,Li+的配位数为4,则S2-的配位数是8,A正确;
B.用“均摊法”,晶胞中Ni原子的个数为8×=1,Cu原子的个数为6×=3,则晶胞中铜原子与镍原子的数量比为3:1,B正确;
C.以1个顶点Na+为研究对象,在图示晶胞中离其最近的Na+为位于面心上的3个Na+,由于顶点Na+为8个晶胞共有,面心Na+为2个晶胞共有,则氯化钠晶胞中离钠离子最近的钠离子有=12个,C错误;
D.晶胞中Cu均匀地分散在立方体内部,由晶胞可知Cu位于体对角线上、与体心O的距离为体对角线的,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为(),D正确;
答案选C。
10.D
【解析】
【详解】
A.配位键是共价键的一种类型,是由一方提供空轨道,另一方提供孤电子对形成的共用电子对,故冠醚与碱金属离子之间的配位键属于共价键,A正确;
B.由图可知,中心原子K+周围形成了6个配位键,故其的配位数为6,B正确;
C.由题干信息可知冠醚是皇冠状的分子,则冠醚与碱金属离子形成配合物是一个配位阳离子,故所得到的晶体里还有阴离子,C正确;
D.由C项分析可知,该类化合物配合物晶体是由阴、阳离子组成的,故属于是离子晶体,D错误;
故答案为:D。
11.B
【解析】
【分析】
根据四种元素形成的化合物结构的特点,该物质是盐,表示成氧化物形式,应该为硅酸盐。结合元素原子序数大小关系及气态单质、合成,可知:W是H,X是O,Y是,Z是元素,然后根据元素周期律及物质性质分析解答。
【详解】
A.在地壳中各种元素的含量由多到少的顺序为:O、、、、、等,X是O,Y是,Z是,可见地壳中元素含量:,A不符合题意;
B.半径大于,故B符合题意;
C.是,是,这两种物质均属于共价晶体,具有较高的熔点,C不符合题意;
D.W是H,X是O,二者形成的化合物中只含有极性键键;在化合物中既含有极性键键,也含有非极性键键,故D不符合题意;
故选B。
12.D
【解析】
【分析】
【详解】
A.由于水分子间形成氢键,所以H2O常温下为液态,而H2S分子间没有氢键,所以H2S常温下为气态,A错误;
B.金刚石为原子晶体,C60为分子晶体,分子晶体的熔点一般低于原子晶体,故C60的熔点低于金刚石,与键长没有关系,B错误;
C.属于离子化合物,熔点较高,属于分子晶体,熔点较低,C错误;
D.从、、为正面体结构, 与相似,与相似,所以可推测、也为正四面体结构,D正确;
故选D。
13.C
【解析】
【分析】
【详解】
A.由图可知,每个水分子与4个水分子形成4个氢键,每个水分子形成的氢键数目为4×=2个,则18 g冰中含氢键数目为×2×NA mol—1=2NA,故A错误;
B.由图可知,晶体硅中每个硅原子与4个硅原子形成4个硅硅键,每个硅原子形成的硅硅键数目为4×=2个,则28 g冰中含氢键数目为×2×NA mol—1=2NA,故B错误;
C.由晶胞结构可知,晶胞中含有二氧化碳的个数为8×+6×=4,则88 g干冰中含有的晶胞结构单元为××NA mol—1=0.5NA,故C正确;
D.由图可知,石墨烯中每个碳原子与3个碳原子形成碳碳键,每个碳原子形成的碳碳键数目为3×=1.5个,则12 g石墨烯中含碳碳键数目为×1.5×NA mol—1=1.5NA,故D错误;
故选C。
14.C
【解析】
【详解】
A.为38号元素,是碱土金属(ⅡA)元素,核外电子排布为1s22s22p63s23p63d104s24p65s2,基态原子有电子,故A错误;
B.使离子晶体变为气态正离子和气态负离子所吸收的能量叫晶格能,主要影响因素是离子电荷,电荷越高,晶格能越大。其次就是离子半径,离子半径越小,晶格能越大。与分解后,分别生成氧化锶和氧化镁,而氧化镁比氧化锶更稳定,镁离子半径小,晶格能大,所以碳酸镁更容易分解而生成较稳定的氧化镁,故B错误;
C.同周期元素第一电离能从左到右有增大的趋势,所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。当外围电子在能量相等的轨道上形成全空、半满、或全满结构时,原子的能量较低,元素的第一电离能较大,锶核外电子排布为1s22s22p63s23p63d104s24p65s2,的第一电离能更大,故C正确;
D.是难溶物,离子方程式中不能拆,故D错误;
故答案:C。
15.B
【解析】
【详解】
A.碳酸氢钠俗名小苏打,显碱性能调节面团酸度,常用作食品膨松剂,故A正确;
B.十二烷基苯磺酸钠是乳化剂,使油脂乳化而溶于水,故B错误;
C.硅和锗是优良的半导体材料,故C正确;
D.氮化碳指的是一种硬度可以和金刚石相媲美的共价化合物,氮化碳属于共价晶体,故D正确;
故答案为B
16.C
【解析】
【分析】
【详解】
A.Cu+核外电子排布式是1s22s22p63s23p63d10,Cu+转化为基态Cu,得到的电子填充在4s轨道上,A错误;
B.SO2是由极性键构成的非极性分子,B错误;
C.Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有S2-数目为:8×=4,则其中所含Cu+ 数目为8个,C正确;
D.在该反应中Cu元素化合价由+1价变为0价,O元素化合价由0价变为-2价,化合价共降低1×2+2×2=6;S元素化合价由-2价变为+4价,化合价升高6价,标准状况下,每有22.4 LO2参与反应,反应的O2的物质的量是1 mol,转移电子是物质的量是6 mol,D错误;
故合理选项是C。
17. 氮 b、c、d 4 正三角形 三角锥型 b
【解析】
【详解】
非金属性越强,第一电离能越大,但是最外层电子排布处于全满或半满状态时较稳定,不易失电子,第一电离能较大,醋酸二氨合铜所含的元素有Cu、O、C、H、N,由于N原子的2p能级为半满状态,第一电离能较大,所以第一电离能最大的是N;
故答案为:氮;
醋酸二氨合铜所含元素组成的单质,有铜属于金属晶体,金刚石属于原子晶体,氮气、氧气和氢气属于分子晶体;
故答案为:b、c、d;
的外围电子排布为,只有1个未成对电子,第4周期元素中,基态原子含有一个未成对电子的元素有K、Sc、Ga、Br,共有4种元素;
故答案为:4;
中B的价层电子对数为,没有孤电子对,分子的空间构型为正三角形,分子中N原子的价层电子对数为,含有一对孤电子对,空间构型为三角锥型;
故答案为:正三角形;三角锥型;
晶体中,B原子的价层电子对数为4,则杂化类型为杂化;
故答案为:;
分子式相同结构不同的化合物互称同分异构体,与都是N元素的单质,属于同素异形体,故a错误;
一个中含有2个 键,分解生成,形成了4molπ键,故b正确;
结构相似的分子晶体,相对分子质量越大,熔沸点越高,白磷的相对分子质量比大,故白磷的沸点比N4高,与键能无关,故c错误;
同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比活泼,与共价键稳定性有关,故d错误;
故答案为:b;
中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则的结构图为;
故答案为:。
18. SiF4 浅 ad bc 0.0001mol/(L min) 共价键 大 非极性 SiH4 这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4
【解析】
【详解】
(1) 由热化学方程式SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ可知,该反应的正反应是气体减少的放热反应,在地壳深处压强大,平衡正向移动,容易有SiF4气体逸出,在地壳浅处压强小,平衡逆向移动,所以SiO2易在地壳浅处沉积;
(2) SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ为放热反应,如果上述反应的平衡常数K值变大,则一定是降低温度,降低温度时,该反应向正反应方向移动,随着反应的正向进行,逆反应速率先减小后增大,所以ad正确;
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时:
a.反应达到平衡时,正逆反应速率相等,满足 v正(HF)= 2v逆(H2O)关系,a错误;
b.反应达到平衡时,正逆反应速率相等,则无论是正反应速率还是逆反应速率,一定有v(H2O)=2v(SiF4),b正确;
c.反应达到平衡时,各组分的质量保持不变,则达到平衡时,SiO2的质量保持不变,c正确;
d.化学平衡状态为动态平衡,正逆反应速率均不为0,d错误;
答案选bc;
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,则容器内气体质量增加0.12g/L×2.0L=0.24g,根据质量守恒定律可知,0.24g为SiO2的质量,SiO2的物质的量为:=0.004mol,同一时间段内消耗HF的物质的量为0.004mol×4=0.016mol,在这段时间内HF的平均反应速率为v(HF)== 0.0001mol/(L min);
(5)合成氮化碳是一种与金刚石类似的晶体,金刚石是原子晶体,则合成氮化碳晶体也是原子晶体,该晶体中微粒间的作用力是共价键,因氮原子的半径小于碳原子的半径,氮元素的非金属性大于碳元素的非金属性,所以N-C键的键能大于C-C键的键能,则氮化碳的硬度比金刚石的大;
(6)SiH4是中Si原子价层电子对数为4,不含孤电子对,所以SiH4是非极性分子;SiH4与CH4这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4,则沸点高的是SiH4。
19. F- 第三周期第ⅣA族 CO2为分子晶体,SiO2为共价晶体,共价键的强度大于分子间作用力 < > Cl2+S2-=S↓+2Cl- 还原 ③ < 5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O
【解析】
【分析】
【详解】
(1)O2-、F-、N3-的核外电子数相同,F-的核电荷数最大,半径最小;Si为14号元素,位于第三周期第ⅣA族;CO2为分子晶体,SiO2为共价晶体,共价键的强度远大于分子间作用力,常温下CO2为气体,SiO2为高熔点固体;
(2)同周期主族元素自左至右非金属性增强,所以非金属性SH2SO4;非金属性越强,单质的氧化性更强,根据反应Cl2+S2-=S↓+2Cl-可知氧化性Cl2>S,则非金属性Cl>S;
(3)红酒中添加一定量的SO2 可以防止酒液氧化,利用了SO2的还原性;H2S水溶液中存在H2S的电离而显酸性,起始pH<7,将SO2气体通入H2S水溶液中时先发生2H2S+SO2= S↓+H2O,该过程中H2S的浓度不断减小,酸性减弱,pH增大,当完全反应发生SO2+H2O=H2SO3,H2SO3电离使溶液酸性增强,pH减小,当SO2不再溶解后,pH不变,H2SO3的酸性强于H2S的,所以最终pH要比初始小,所以图③符合;HSO的电离使溶液显酸性,HSO的水解使溶液显碱性,而NaHSO3溶液呈酸性,说明电离程度更大,H2SO3由水解产生,SO由水解产生,则c(H2SO3)(4)根据所给反应物和生成物可知该过程中Na2SO3被KIO3氧化生成Na2SO4,KIO3被还原生成I2,根据电子守恒可知Na2SO3和KIO3的系数比应为5:2,再结合元素守恒可得化学方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O。
20. 两个氟化氢分子通过氢键形成二聚体() 是离子晶体,是分子晶体。离子键的作用力远大于分子间作用力
【解析】
【分析】
【详解】
(1)质谱检测氟化氢气体时,出现质荷比为40的峰,说明可能为两分子的HF结合在一起,由于HF分子中存在可以形成氢键的F原子,故这种结合为以氢键形式结合的二聚体(),故答案为:两个氟化氢分子通过氢键形成二聚体();
(2)Al2O3是离子晶体,AlCl3是分子晶体,离子键远大于范德华力,所以Al2O3的熔点高很多,故答案为:Al2O3是离子晶体,AlCl3是分子晶体,离子键远大于分子间作用力。
21. 硒 正四面体形 V形 分子晶体 1s22s22p63s2 1:1 NCl3键角大,因为氮原子的半径比磷原子小,而N得电负性比P大,导致N-Cl键之间的斥力大于P-Cl键。 16NA
【解析】
【分析】
【详解】
(1)含有8个质子,10个中子的原子为氧元素的原子,化学符号为。
(2)原子的外围电子排布是4s24p4,说明该元素为34号,该元素的名称是硒。
(3)NH的立体结构为正四面体结构,SO2分子中S原子价层电子对个数为3、且含有一个孤电子对,该分子的立体结构为V形。
(4)周期表中最活泼的非金属元素为氟元素,原核外有9个电子,轨道表示式为。
(5)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为分子晶体。
(6) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,说明电子排布为1s22s22p63s2。
(7)写出HCN的电子式为,该分子单键就是σ键,一个三键中有一个σ键和两个π键,所以σ键和π 键的比为1:1。
(8) 原子半径大小影响键角大小,NCl3键角大,因为氮原子的半径比磷原子小,而N得电负性比P大,导致N-Cl键之间的斥力大于P-Cl键。
(9)向硫酸铜溶液中加入氨水,先生成蓝色沉淀,为氢氧化铜,续滴加氨水,沉淀溶解生成蓝色溶液,生成四氨合铜离子,配离子的结构式为,1mol该配离子中每个氨气有3个键,氨气和铜离子之间有4个键,所以1mol该配离子含有的σ键数目为(3×4+4)NA=16 NA。
22. 四 IIIA p < > 异丁烷有支链,分子之间的距离较大,分子间作用力较弱 否 三角锥形 正四面体形 sp3
【解析】
【分析】
【详解】
(1)元素原子的电子排布式为,该元素为Ga元素,位于元素周期表第四周期IIIA族,处于元素周期表的p区;
(2)可以与醋酸反应生成二氧化碳和水,酸性:,所以结合氢离子的能力<,离子方程式为;
(3)异丁烷有支链,分子之间的距离较大,分子间作用力较弱,所以沸点:正丁烷>异丁烷;
(4)的电子式为;可以看作NH3上的一个H被NH2取代,N原子为sp3杂化,含有1对孤电子对,故其空间构型不是平面形;
(5)中心原子的价层电子对数为,含有1对孤电子对,故其空间构型为三角锥形;中心原子的价层电子对数为,中心原子为sp3杂化,其空间构型为正四面体形。
一、选择题(共16题)
1.下列说法中,不正确的是
A.晶体中原子呈周期性有序排列,有自范性
B.金属晶体导电是因为在外加电场作用下金属产生了自由电子,电子定向移动产生了电流
C.MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
D.乳酸[CH3CH(OH)COOH]分子中有1个手性碳原子
2.下列大小关系正确的是
A.离子键:NaCl<NaBr B.硬度:MgO>CaO
C.熔点:NaI>NaBr D.熔沸点:CO2>NaCl
3.下列相关比较中,正确的是
A.分解温度:MgCO3>CaCO3> BaCO3 B.熔点:Na>Mg>Al
C.微粒半径:r(Cl-)>r(O2-)>r(Na+) D.热稳定性:H2O>H2S> HCl
4.下列物质性质的变化规律与分子间作用力有关的是
A.F2、Cl2、Br2、I2的熔沸点逐渐升高
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.HF、HC1、HBr、HI的热稳定性依次减弱
D.金刚石的硬度大于硅,其熔沸点也高于硅
5.类比是学习化学的一种很重要的方法。下列类比合理的是
A.NaCl固体与浓硫酸可以制备HCl,则CaF2固体与浓硫酸可以制备HF
B.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
C.Na在空气中燃烧生成Na2O2,则Li在空气中燃烧生成Li2O2
D.Ca(HCO3)2溶解度大于CaCO3,则NaHCO3溶解度大于Na2CO3
6.下列各物质熔点由高到低的顺序正确的是
①MgO②NaCl③KBr④HCl⑤H2O
A.①②③⑤④ B.①②③④⑤ C.④⑤①②③ D.③②①④⑤
7.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,晶胞参数a=b=c,α=β=γ,下列有关说法正确的是
A.该晶体属于离子晶体,晶体的化学式为BaO
B.该晶体中化学键类型只有离子键
C.该晶体晶胞结构与ZnS相似
D.填入Ba2+堆积产生的八面体空隙,填隙率100%
8.下列有关物质结构与性质的因果关系论述中,错误的是
A.因为键能,所以的热稳定性强于
B.因为的孤电子对数多于,所以的键角小于
C.因为的非羟基氧数目多于,所以酸性强于
D.因为半径大于,所以中阳离子的配位数比中的大
9.下列叙述不正确的是
A.Li2S晶胞结构如图1,S2-的配位数是8
B.某镍白铜合金的立方晶胞结构如图2,晶胞中铜原子与镍原子的数量比为3:1
C.氯化钠晶胞如图3,离钠离子最近的钠离子有6个
D.铜与氧元素形成的晶胞如图4,晶胞中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为()
10.冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子。下图是18-冠-6与钾离子以配位键结合形成的超分子结构示意图。下列说法错误的是
A.冠醚与碱金属离子之间的配位键属于共价键
B.中心原子K+的配位数为6
C.冠醚与碱金属离子形成配合物得到的晶体里还有阴离子
D.这类配合物晶体是分子晶体
11.短周期元素W、X、Y、Z的原子序数依次增大,浙江大学研究团队以(硅酸盐,a、b为系数)为载体,利用Au-Pb纳米颗粒催化气态单质W2、X2合成W2X2,其原理如图所示。下列说法错误的是
A.地壳中元素含量:X>Z>Y B.简单离子半径:Y>X
C.Y2X3和ZX2均具有较高熔点 D.W与X形成的化合物可能含非极性键
12.类推的思维方法在化学学习与研究中可能会产生错误的结论。因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.常温下为液态,常温下也为液态
B.金刚石中键的键长为,中键的键长为,所以的熔点高于金刚石
C.熔点较高,熔点也较高
D.从、、为正四面体结构,可推测、也为正四面体结构
13.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(图1)中含氢键数目为4NA
B.28 g晶体硅(图2)中含有Si-Si键数目为4NA
C.88 g干冰(图3)中含有0.5NA个晶胞结构单元
D.12 g石墨烯中含C-C键数目为3NA
14.锶()是碱土金属(ⅡA)元素。氯化锶()是最常见的锶盐。可用于制造红色烟火,常由与盐酸反应制备。下列说法正确的是
A.属于区元素,基态原子没有电子
B.的晶格能小于,所以热分解温度低于
C.与同周期相邻的主族元素相比,的第一电离能更大
D.上述制备的离子方程式为:
15.化学与生活、科技密切相关,下列说法错误的是
A.小苏打常用作食品膨松剂,还能调节面团酸度
B.某洗涤剂的主要成分十二烷基苯磺酸钠,处理油脂污垢是利用磺酸根离子
C.我国“硅—石墨烯—锗晶体管”技术获得重大突破,其中锗也可用作半导体材料
D.“嫦娥五号”月球采样用的“挖土铲”,用氮化碳特种钻头,氮化碳属于共价晶体
16.铜是生命必须的元素,也是人类最早使用的金属之一、铜及其重要化合物在生产中有着重要的应用。辉铜矿(主要成分Cu2S)可以用于制铜,反应方程式为,制得的粗铜通过电解法进行精炼。关于用辉铜矿制备粗铜反应的相关说法正确的是
A.Cu+转化为基态Cu,得到的电子填充在3d轨道上
B.O2和SO2都是非极性分子
C.Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有8个Cu+
D.标准状况下,每有22.4 LO2参与反应,转移电子4 mol
二、综合题(共6题)
17.氨是重要的化工原料,用途很广。
合成氨工厂常用醋酸二氨合铜由和构成溶液吸收对氨合成催化剂有毒害的CO气体。
醋酸二氨合铜所含的元素中,第一电离能最大的是 ______ 填元素名称。
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______ 填标号。
离子晶体 分子晶体原子晶体 金属晶体
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种不含。
气体与相遇立即生成一种白色晶体:。
和分子的空间构型分别为 ______ 、 ______ 。
晶体中,B原子的杂化轨道类型为 ______ 。
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为的物质。该物质易溶于水,在水溶液中以和两种正四面体构型的离子存在。遇碱生成一种形似白磷的分子。
下列相关说法中,正确的是 ______ 填序号。
是的同分异构体
分解生成,形成了4mol 键
白磷的沸点比高,原因是键键能比键大
白磷的化学性质比活泼,说明P的非金属性比N强
画出的结构标明其中的配位键: ______ 。
18.碳、硅及其化合物是一类重要物质。自然界的矿物.岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000-3000kPa,在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,SiO2易在地壳________(填“深”、“浅”)处沉积。
(2)如果上述反应的平衡常数K值变大,该反应____________(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,在这段时间内HF的平均反应速率为________。
(5)合成氮化碳是一种与金刚石类似的晶体,该晶体中微粒间的作用力是_______,预测氮化碳的硬度比金刚石的_________(选填“大”、“小”、“不确定”)。
(6)SiH4是________(极性或非极性)分子,与CH4相比,沸点高的是________(化学式),用有关化学原理解释该事实:__________。
19.氧、碳等非金属元素形成的物质种类繁多、性状各异。
(1)氧、氟、氮三种元素都可形成简单离子,它们的离子半径最小的是___________(填离子符号),硅元素在元素周期表中的位置是___________。CO2和SiO2是同一主族元素的最高正价氧化物,常温下CO2为气体,SiO2为高熔点固体。请分析原因:___________。
(2)比较硫和氯性质的强弱。热稳定性H2S___________HCl(选填“<”、“>”或“=”,下同);酸性:HClO4___________H2SO4。用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:___________。
(3)红酒中添加一定量的SO2 可以防止酒液氧化,这利用了SO2 的___________性。若将SO2气体通入H2S水溶液中直至过量,下列表示溶液的pH随通入SO2气体体积变化的示意图正确的是___________(填序号)。
已知NaHSO3溶液呈酸性,而HSO既能电离又能水解。则在NaHSO3溶液中c(H2SO3)___________c(SO)(选填“<”、“>”或“=”) 。
(4)亚硫酸钠和碘酸钾在酸性条件下反应生成硫酸钠、硫酸钾、碘和水,写该反应方程式________________。
20.(1)用质谱仪检测氟化氢气体时,谱图中出现质荷比(相对分子质量)为40的峰,原因是___________。
(2)的熔点(2054℃)比(190℃)熔点高很多的原因是___________。
21.根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号___________。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是___________。
(3)NH的立体结构为:___________,SO2的立体结构为:___________。
(4)周期表中最活泼的非金属元素原子的轨道表示式为___________ 。
(5)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为___________。
(6) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是___________。
(7)写出HCN的电子式___________,该分子中σ键和π 键的比为___________。
(8)比较NCl3和 PCl3键角大小并解释其原因___________。
(9)向硫酸铜溶液中加入氨水,先生成蓝色沉淀,续滴加氨水,沉淀溶解生成蓝色溶液,写出生成的配离子的结构式___________,1mol该配离子中含有的σ键数目为___________。
22.某元素原子的电子排布式为,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第___周期第____族,处于元素周期表的____区。
(2)比较下列离子结合氢离子的能力:___(填“>”、“<”、“=”),并用离子方程式说明___。
(3)比较沸点高低:正丁烷__异丁烷(填“>”、“<”、“=”),请从结构角度分析原因____。
(4)写出电子式___,该分子的空间构型__(填“是”或“否”)为平面形。
(5)的空间构型为____;的空间构型为____,硫原子的杂化方式为____。
试卷第页,共页
参考答案:
1.B
【解析】
【详解】
A.晶体中原子呈周期性有序排列而非晶体中原子排列无序;晶体自范性的本质是:晶体中粒子微观空间里呈现周期性的有序排列的宏观表象,A正确;
B.金属晶体导电是在外加电场作用下,金属中含有的自由电子变为定向移动而形成电流,而不是在外加电场力作用下才产生的自由移动的电子,B错误;
C.MgO的晶格能远比NaCl大,这是由于MgO中离子所带的电荷数比NaCl多,而离子半径却比NaCl的小,C正确;
D.手性碳原子是连接4个不同的原子或原子团的碳原子。乳酸[CH3CH(OH)COOH]分子中与-CH3、-OH、-COOH、H原子连接的C原子为手性碳原子,因此乳酸分子中含有1个手性碳原子,D正确;
故合理选项是B。
2.B
【解析】
【分析】
【详解】
A.离子半径Cl-<Br-,离子半径越小,形成离子键越大:NaCl>NaBr,选项A错误;
B.离子半径Mg2+<Ca2+,离子半径越小,晶格能越大,硬度越大,硬度:MgO>CaO,选项B正确;
C.离子半径I->Br-,离子半径越小,晶格能越大,离子晶体的熔点越高,熔点:NaI<NaBr,选项C错误;
D.CO2为分子晶体,NaCl为离子晶体,离子晶体的熔沸点大于分子晶体的熔沸点,选项D错误;
答案选B。
3.C
【解析】
【详解】
A.当阳离子所带电荷相同时,阳离子半径越大,其结合氧离子能力就越弱,对应的碳酸盐受热分解温度就越高,则碳酸盐的分解温度:MgCO3<CaCO3<BaCO3,A错误,
B.金属晶体中离子半径越小,离子的电荷越多,金属的熔点越高,则熔点由高到低:Al>Mg>Na,B错误;
C.Cl-具有三个电子层,O2-、Na+具有相同的电子排布,核电荷数越大半径越小,电子层数越多半径越大,故微粒半径:r(Cl-)>r(O2-)>r(Na+),C正确;
D.简单气态氢化物的热稳定性与元素非金属性一致, 已知非金属性比O>Cl>S,故H2O> HCl > H2S,D错误;
故答案为:C。
4.A
【解析】
【详解】
A.F2、Cl2、Br2、I2均为分子晶体,随着相对分子质量增大,分子间作用力增大,故它们的熔沸点逐渐升高与分子间作用力有关,A符合题意;
B.NaF、NaCl、NaBr、NaI均为离子晶体,由于离子半径F-<Cl-<Br-<I-,其离子键的晶格能依次减小,故它们的熔点依次降低与分子间作用力无关,B不合题意;
C.HF、HC1、HBr、HI的热稳定性依次减弱与它们的共价键的键能有关,与其分子间作用力无关,C不合题意;
D.金刚石和晶体硅均为共价晶体(原子晶体),金刚石的硬度大于硅,其熔沸点也高于硅是由于金刚石中的C-C共价键的键能比晶体硅中Si-Si键的键能大,与分子间作用力无关,D不合题意;
故答案为:A。
5.A
【解析】
【详解】
A.浓硫酸难挥发,氯化氢、HF易挥发,NaCl固体与浓硫酸可以制备HCl,则CaF2固体与浓硫酸可以制备HF,故A正确;
B.晶体中有阴离子,必有阳离子,但晶体中有阳离子,不一定必有阴离子,例如金属晶体中只有阳离子没有阴离子,故B错误;
C.锂活泼性弱于钠,在空气中燃烧生成氧化锂,故C错误;
D.一般难溶性的碳酸盐的溶解度小于相应的碳酸氢盐,如Ca(HCO3)2的溶解度大于CaCO3,而可溶性的碳酸盐的溶解度大于相应的碳酸氢盐,如Na2CO3溶解度大于NaHCO3,故D错误;
故选A。
6.A
【解析】
【分析】
【详解】
一般情况下,离子晶体的熔点高于分子晶体,离子晶体的晶格能越大,熔点越高,分子晶体中分子间作用力越大,熔点越高,氧化镁、氯化钠和溴化钾都为离子晶体,晶体的晶格能依次减小,熔点依次降低,氯化氢和水都是分子晶体,水分子间能形成氢键,分子间的作用力强于氯化氢,水分子的熔点高于氯化氢,则熔点由高到低的顺序为氧化镁、氯化钠、溴化钾、水、氯化氢,故选A。
7.D
【解析】
【详解】
A.晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8× +6×=4,位于晶胞的边上和体心位置,共含有的个数为12×+1=4,该氧化物为BaO2,A错误;
B.中O和O之间为非极性共价键,B错误;
C.由晶胞结构可知,离子配位数为6,与NaCl结构相似,C错误;
D.位于体心和棱心,均处在Ba2+堆积产生的八面体空隙内,因此填隙率为100%,D正确;
故选D。
8.D
【解析】
【分析】
【详解】
A.化学键的键能越大,物质的化学性质越稳定,故因为键能,所以的热稳定性强于,A正确;
B.由于电子对之间的排斥作用是:孤电子对对孤电子对>孤电子对对成键电子对>成键电子对对成键电子对,H2O中O周围有对孤电子对,而SO3中S原子周围没有孤电子对,因为的孤电子对数多于,所以的键角小于,B正确;
C.同一元素的含氧酸的酸性随非羟基氧原子的数目增多而增强,因为的非羟基氧数目多于,所以酸性强于,C正确;
D.离子晶体中离子的配位数主要与阴、阳离子的半径比值大小和离子所带的电荷数有关,而与那一种离子半径的绝对大小无关,因为半径大于,所以中阳离子的配位数比中的大,二者无因果关系,D错误;
故答案为:D。
9.C
【解析】
【详解】
A.Li+与S2-的个数比为2:1,则Li+与S2-的配位数之比为1:2,由Li2S的晶胞结构可知,Li+的配位数为4,则S2-的配位数是8,A正确;
B.用“均摊法”,晶胞中Ni原子的个数为8×=1,Cu原子的个数为6×=3,则晶胞中铜原子与镍原子的数量比为3:1,B正确;
C.以1个顶点Na+为研究对象,在图示晶胞中离其最近的Na+为位于面心上的3个Na+,由于顶点Na+为8个晶胞共有,面心Na+为2个晶胞共有,则氯化钠晶胞中离钠离子最近的钠离子有=12个,C错误;
D.晶胞中Cu均匀地分散在立方体内部,由晶胞可知Cu位于体对角线上、与体心O的距离为体对角线的,a、b的坐标参数依次为(0,0,0)、(),则d的坐标参数为(),D正确;
答案选C。
10.D
【解析】
【详解】
A.配位键是共价键的一种类型,是由一方提供空轨道,另一方提供孤电子对形成的共用电子对,故冠醚与碱金属离子之间的配位键属于共价键,A正确;
B.由图可知,中心原子K+周围形成了6个配位键,故其的配位数为6,B正确;
C.由题干信息可知冠醚是皇冠状的分子,则冠醚与碱金属离子形成配合物是一个配位阳离子,故所得到的晶体里还有阴离子,C正确;
D.由C项分析可知,该类化合物配合物晶体是由阴、阳离子组成的,故属于是离子晶体,D错误;
故答案为:D。
11.B
【解析】
【分析】
根据四种元素形成的化合物结构的特点,该物质是盐,表示成氧化物形式,应该为硅酸盐。结合元素原子序数大小关系及气态单质、合成,可知:W是H,X是O,Y是,Z是元素,然后根据元素周期律及物质性质分析解答。
【详解】
A.在地壳中各种元素的含量由多到少的顺序为:O、、、、、等,X是O,Y是,Z是,可见地壳中元素含量:,A不符合题意;
B.半径大于,故B符合题意;
C.是,是,这两种物质均属于共价晶体,具有较高的熔点,C不符合题意;
D.W是H,X是O,二者形成的化合物中只含有极性键键;在化合物中既含有极性键键,也含有非极性键键,故D不符合题意;
故选B。
12.D
【解析】
【分析】
【详解】
A.由于水分子间形成氢键,所以H2O常温下为液态,而H2S分子间没有氢键,所以H2S常温下为气态,A错误;
B.金刚石为原子晶体,C60为分子晶体,分子晶体的熔点一般低于原子晶体,故C60的熔点低于金刚石,与键长没有关系,B错误;
C.属于离子化合物,熔点较高,属于分子晶体,熔点较低,C错误;
D.从、、为正面体结构, 与相似,与相似,所以可推测、也为正四面体结构,D正确;
故选D。
13.C
【解析】
【分析】
【详解】
A.由图可知,每个水分子与4个水分子形成4个氢键,每个水分子形成的氢键数目为4×=2个,则18 g冰中含氢键数目为×2×NA mol—1=2NA,故A错误;
B.由图可知,晶体硅中每个硅原子与4个硅原子形成4个硅硅键,每个硅原子形成的硅硅键数目为4×=2个,则28 g冰中含氢键数目为×2×NA mol—1=2NA,故B错误;
C.由晶胞结构可知,晶胞中含有二氧化碳的个数为8×+6×=4,则88 g干冰中含有的晶胞结构单元为××NA mol—1=0.5NA,故C正确;
D.由图可知,石墨烯中每个碳原子与3个碳原子形成碳碳键,每个碳原子形成的碳碳键数目为3×=1.5个,则12 g石墨烯中含碳碳键数目为×1.5×NA mol—1=1.5NA,故D错误;
故选C。
14.C
【解析】
【详解】
A.为38号元素,是碱土金属(ⅡA)元素,核外电子排布为1s22s22p63s23p63d104s24p65s2,基态原子有电子,故A错误;
B.使离子晶体变为气态正离子和气态负离子所吸收的能量叫晶格能,主要影响因素是离子电荷,电荷越高,晶格能越大。其次就是离子半径,离子半径越小,晶格能越大。与分解后,分别生成氧化锶和氧化镁,而氧化镁比氧化锶更稳定,镁离子半径小,晶格能大,所以碳酸镁更容易分解而生成较稳定的氧化镁,故B错误;
C.同周期元素第一电离能从左到右有增大的趋势,所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。当外围电子在能量相等的轨道上形成全空、半满、或全满结构时,原子的能量较低,元素的第一电离能较大,锶核外电子排布为1s22s22p63s23p63d104s24p65s2,的第一电离能更大,故C正确;
D.是难溶物,离子方程式中不能拆,故D错误;
故答案:C。
15.B
【解析】
【详解】
A.碳酸氢钠俗名小苏打,显碱性能调节面团酸度,常用作食品膨松剂,故A正确;
B.十二烷基苯磺酸钠是乳化剂,使油脂乳化而溶于水,故B错误;
C.硅和锗是优良的半导体材料,故C正确;
D.氮化碳指的是一种硬度可以和金刚石相媲美的共价化合物,氮化碳属于共价晶体,故D正确;
故答案为B
16.C
【解析】
【分析】
【详解】
A.Cu+核外电子排布式是1s22s22p63s23p63d10,Cu+转化为基态Cu,得到的电子填充在4s轨道上,A错误;
B.SO2是由极性键构成的非极性分子,B错误;
C.Cu2S晶胞中S2-位置如图所示,则一个晶胞中含有S2-数目为:8×=4,则其中所含Cu+ 数目为8个,C正确;
D.在该反应中Cu元素化合价由+1价变为0价,O元素化合价由0价变为-2价,化合价共降低1×2+2×2=6;S元素化合价由-2价变为+4价,化合价升高6价,标准状况下,每有22.4 LO2参与反应,反应的O2的物质的量是1 mol,转移电子是物质的量是6 mol,D错误;
故合理选项是C。
17. 氮 b、c、d 4 正三角形 三角锥型 b
【解析】
【详解】
非金属性越强,第一电离能越大,但是最外层电子排布处于全满或半满状态时较稳定,不易失电子,第一电离能较大,醋酸二氨合铜所含的元素有Cu、O、C、H、N,由于N原子的2p能级为半满状态,第一电离能较大,所以第一电离能最大的是N;
故答案为:氮;
醋酸二氨合铜所含元素组成的单质,有铜属于金属晶体,金刚石属于原子晶体,氮气、氧气和氢气属于分子晶体;
故答案为:b、c、d;
的外围电子排布为,只有1个未成对电子,第4周期元素中,基态原子含有一个未成对电子的元素有K、Sc、Ga、Br,共有4种元素;
故答案为:4;
中B的价层电子对数为,没有孤电子对,分子的空间构型为正三角形,分子中N原子的价层电子对数为,含有一对孤电子对,空间构型为三角锥型;
故答案为:正三角形;三角锥型;
晶体中,B原子的价层电子对数为4,则杂化类型为杂化;
故答案为:;
分子式相同结构不同的化合物互称同分异构体,与都是N元素的单质,属于同素异形体,故a错误;
一个中含有2个 键,分解生成,形成了4molπ键,故b正确;
结构相似的分子晶体,相对分子质量越大,熔沸点越高,白磷的相对分子质量比大,故白磷的沸点比N4高,与键能无关,故c错误;
同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比活泼,与共价键稳定性有关,故d错误;
故答案为:b;
中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则的结构图为;
故答案为:。
18. SiF4 浅 ad bc 0.0001mol/(L min) 共价键 大 非极性 SiH4 这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4
【解析】
【详解】
(1) 由热化学方程式SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ可知,该反应的正反应是气体减少的放热反应,在地壳深处压强大,平衡正向移动,容易有SiF4气体逸出,在地壳浅处压强小,平衡逆向移动,所以SiO2易在地壳浅处沉积;
(2) SiO2(s)+4HF(g)SiF4(g)+2H2O(g)+148.9kJ为放热反应,如果上述反应的平衡常数K值变大,则一定是降低温度,降低温度时,该反应向正反应方向移动,随着反应的正向进行,逆反应速率先减小后增大,所以ad正确;
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时:
a.反应达到平衡时,正逆反应速率相等,满足 v正(HF)= 2v逆(H2O)关系,a错误;
b.反应达到平衡时,正逆反应速率相等,则无论是正反应速率还是逆反应速率,一定有v(H2O)=2v(SiF4),b正确;
c.反应达到平衡时,各组分的质量保持不变,则达到平衡时,SiO2的质量保持不变,c正确;
d.化学平衡状态为动态平衡,正逆反应速率均不为0,d错误;
答案选bc;
(4)若反应的容器容积为2.0L,反应时间80min,容器内气体的密度增大了0.12g/L,则容器内气体质量增加0.12g/L×2.0L=0.24g,根据质量守恒定律可知,0.24g为SiO2的质量,SiO2的物质的量为:=0.004mol,同一时间段内消耗HF的物质的量为0.004mol×4=0.016mol,在这段时间内HF的平均反应速率为v(HF)== 0.0001mol/(L min);
(5)合成氮化碳是一种与金刚石类似的晶体,金刚石是原子晶体,则合成氮化碳晶体也是原子晶体,该晶体中微粒间的作用力是共价键,因氮原子的半径小于碳原子的半径,氮元素的非金属性大于碳元素的非金属性,所以N-C键的键能大于C-C键的键能,则氮化碳的硬度比金刚石的大;
(6)SiH4是中Si原子价层电子对数为4,不含孤电子对,所以SiH4是非极性分子;SiH4与CH4这两种化合物的晶体类型都是分子晶体,分子晶体的沸点随相对分子质量的增大而增大,SiH4的相对分子质量大于CH4,则沸点高的是SiH4。
19. F- 第三周期第ⅣA族 CO2为分子晶体,SiO2为共价晶体,共价键的强度大于分子间作用力 < > Cl2+S2-=S↓+2Cl- 还原 ③ < 5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O
【解析】
【分析】
【详解】
(1)O2-、F-、N3-的核外电子数相同,F-的核电荷数最大,半径最小;Si为14号元素,位于第三周期第ⅣA族;CO2为分子晶体,SiO2为共价晶体,共价键的强度远大于分子间作用力,常温下CO2为气体,SiO2为高熔点固体;
(2)同周期主族元素自左至右非金属性增强,所以非金属性S
(3)红酒中添加一定量的SO2 可以防止酒液氧化,利用了SO2的还原性;H2S水溶液中存在H2S的电离而显酸性,起始pH<7,将SO2气体通入H2S水溶液中时先发生2H2S+SO2= S↓+H2O,该过程中H2S的浓度不断减小,酸性减弱,pH增大,当完全反应发生SO2+H2O=H2SO3,H2SO3电离使溶液酸性增强,pH减小,当SO2不再溶解后,pH不变,H2SO3的酸性强于H2S的,所以最终pH要比初始小,所以图③符合;HSO的电离使溶液显酸性,HSO的水解使溶液显碱性,而NaHSO3溶液呈酸性,说明电离程度更大,H2SO3由水解产生,SO由水解产生,则c(H2SO3)
20. 两个氟化氢分子通过氢键形成二聚体() 是离子晶体,是分子晶体。离子键的作用力远大于分子间作用力
【解析】
【分析】
【详解】
(1)质谱检测氟化氢气体时,出现质荷比为40的峰,说明可能为两分子的HF结合在一起,由于HF分子中存在可以形成氢键的F原子,故这种结合为以氢键形式结合的二聚体(),故答案为:两个氟化氢分子通过氢键形成二聚体();
(2)Al2O3是离子晶体,AlCl3是分子晶体,离子键远大于范德华力,所以Al2O3的熔点高很多,故答案为:Al2O3是离子晶体,AlCl3是分子晶体,离子键远大于分子间作用力。
21. 硒 正四面体形 V形 分子晶体 1s22s22p63s2 1:1 NCl3键角大,因为氮原子的半径比磷原子小,而N得电负性比P大,导致N-Cl键之间的斥力大于P-Cl键。 16NA
【解析】
【分析】
【详解】
(1)含有8个质子,10个中子的原子为氧元素的原子,化学符号为。
(2)原子的外围电子排布是4s24p4,说明该元素为34号,该元素的名称是硒。
(3)NH的立体结构为正四面体结构,SO2分子中S原子价层电子对个数为3、且含有一个孤电子对,该分子的立体结构为V形。
(4)周期表中最活泼的非金属元素为氟元素,原核外有9个电子,轨道表示式为。
(5)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为分子晶体。
(6) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,说明电子排布为1s22s22p63s2。
(7)写出HCN的电子式为,该分子单键就是σ键,一个三键中有一个σ键和两个π键,所以σ键和π 键的比为1:1。
(8) 原子半径大小影响键角大小,NCl3键角大,因为氮原子的半径比磷原子小,而N得电负性比P大,导致N-Cl键之间的斥力大于P-Cl键。
(9)向硫酸铜溶液中加入氨水,先生成蓝色沉淀,为氢氧化铜,续滴加氨水,沉淀溶解生成蓝色溶液,生成四氨合铜离子,配离子的结构式为,1mol该配离子中每个氨气有3个键,氨气和铜离子之间有4个键,所以1mol该配离子含有的σ键数目为(3×4+4)NA=16 NA。
22. 四 IIIA p < > 异丁烷有支链,分子之间的距离较大,分子间作用力较弱 否 三角锥形 正四面体形 sp3
【解析】
【分析】
【详解】
(1)元素原子的电子排布式为,该元素为Ga元素,位于元素周期表第四周期IIIA族,处于元素周期表的p区;
(2)可以与醋酸反应生成二氧化碳和水,酸性:,所以结合氢离子的能力<,离子方程式为;
(3)异丁烷有支链,分子之间的距离较大,分子间作用力较弱,所以沸点:正丁烷>异丁烷;
(4)的电子式为;可以看作NH3上的一个H被NH2取代,N原子为sp3杂化,含有1对孤电子对,故其空间构型不是平面形;
(5)中心原子的价层电子对数为,含有1对孤电子对,故其空间构型为三角锥形;中心原子的价层电子对数为,中心原子为sp3杂化,其空间构型为正四面体形。
