2021-2022学年高一下学期化学人教版(2019)必修第二册第五章第二节 硝酸和酸雨的及时防治巩固练习(word 含解析)
文档属性
| 名称 | 2021-2022学年高一下学期化学人教版(2019)必修第二册第五章第二节 硝酸和酸雨的及时防治巩固练习(word 含解析) | 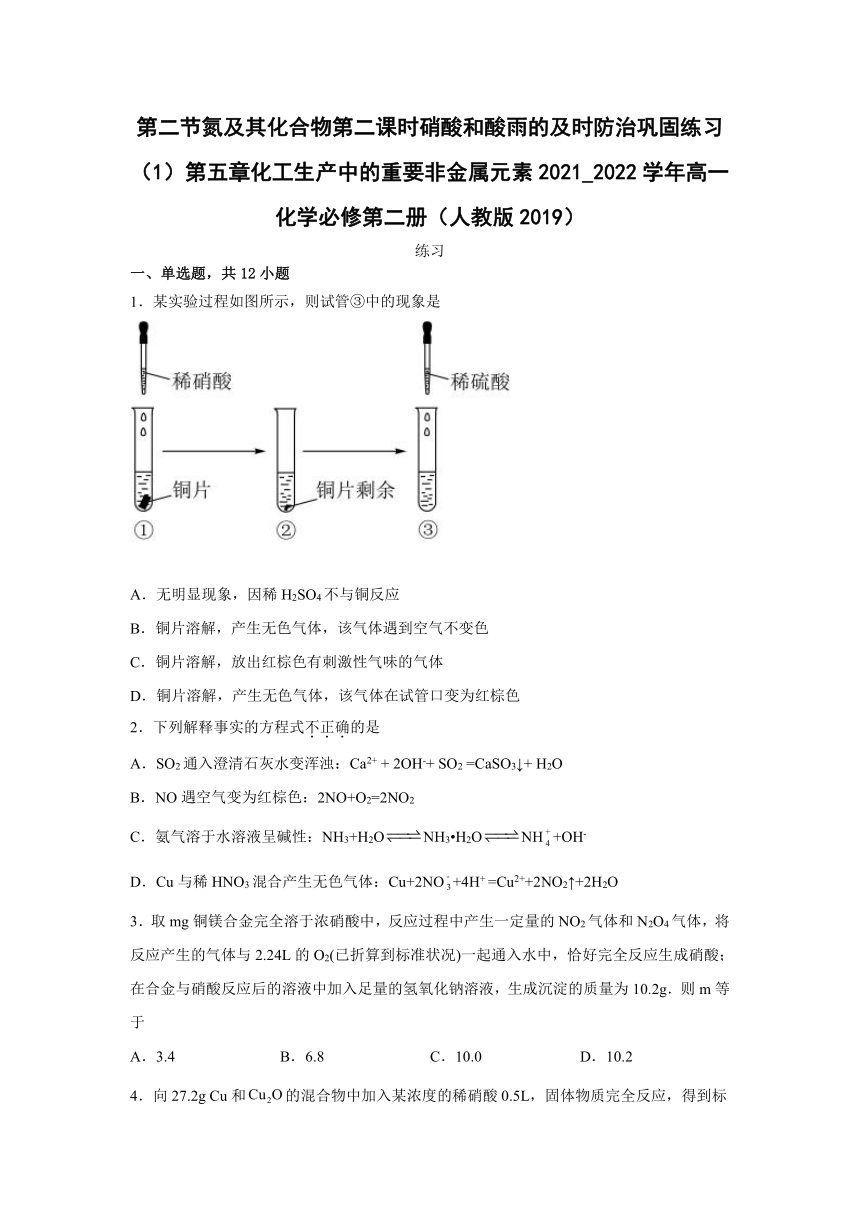 | |
| 格式 | docx | ||
| 文件大小 | 452.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 12:57:36 | ||
图片预览




文档简介
第二节氮及其化合物第二课时硝酸和酸雨的及时防治巩固练习(1)第五章化工生产中的重要非金属元素2021_2022学年高一化学必修第二册(人教版2019)
练习
一、单选题,共12小题
1.某实验过程如图所示,则试管③中的现象是
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
2.下列解释事实的方程式不正确的是
A.SO2通入澄清石灰水变浑浊:Ca2+ + 2OH-+ SO2 =CaSO3↓+ H2O
B.NO遇空气变为红棕色:2NO+O2=2NO2
C.氨气溶于水溶液呈碱性:NH3+H2ONH3 H2ONH+OH-
D.Cu与稀HNO3混合产生无色气体:Cu+2NO+4H+ =Cu2++2NO2↑+2H2O
3.取mg铜镁合金完全溶于浓硝酸中,反应过程中产生一定量的NO2气体和N2O4气体,将反应产生的气体与2.24L的O2(已折算到标准状况)一起通入水中,恰好完全反应生成硝酸;在合金与硝酸反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为10.2g.则m等于
A.3.4 B.6.8 C.10.0 D.10.2
4.向27.2g Cu和的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,得到标准状况下8.96L NO和的混合气体及溶液。在所得溶液中加入1.0的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是
A.Cu与的物质的量之比为2:1
B.硝酸的物质的量浓度为2.4
C.Cu、与硝酸反应后剩余为0.2mol
D.标况下,产生的体积为6.72L
5.下列事实与硝酸性质的对应关系错误的是
A.打开浓硝酸的试剂瓶,瓶口有白雾——挥发性
B.用棕色试剂瓶保存浓硝酸——不稳定性
C.稀硝酸使紫色石蕊试液变红——酸性
D.稀硝酸使黑色氧化铜固体溶解——强氧化性
6.下列说法正确的是
A.浓硝酸见光或受热易分解,必须保存在棕色瓶中
B.浓硝酸和铜反应有红棕色气体产生,只表现氧化性
C.浓硫酸具有吸水性,能使蔗糖碳化
D.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸
7.已知某溶液中存在较多的H+ 、SO、NO,则该溶液中还可能大量存在的离子组是
A.Mg2+、Fe2+、Cl- B.Na+、NH、Cl-
C.K+、S2-、Mg2+ D.Cu2+、I-、Na+
8.下列实验现象和对应解释(或结论)都正确的是
现象 解释(或结论)
A 浓硝酸在光照下颜色变黄 浓硝酸不稳定
B 浓硫酸能使小木条变黑 浓硫酸具有吸水性
C 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中含有SO
D Cl2和SO2均可使含有酚酞的NaOH溶液褪色 Cl2和SO2均具有漂白性
A.A B.B C.C D.D
9.下列各组离子一定能大量共存的是
A.在无色溶液中:、、、
B.在含大量的溶液中:、、、
C.在强酸性溶液中:、、、I-
D.室温下,的溶液中:、、、
10.自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是
A.上图中,酸雨的含硫成分只有,由溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将通入稀溶液中得到S胶体,该反应中氧化剂:还原剂=2:1
11.铜和镁的合金完全溶于足量的硝酸后,再加入过量的NaOH溶液,生成沉淀,则合金与硝酸反应时,放出的气体可能是( )
A.
B.和
C.
D.、和
12.将19.2g的铜屑投入到400 mL浓度均为0.5mol/L HNO3和H2SO4的混合溶液中,溶液增加的质量为
A.4.5 g B.9.9 g C.13.2 g D.14.7 g
二、填空题,共3小题
13.下列事实体现了硝酸的什么性质?写出有关反应的化学方程式或离子方程式。
(1)浓硝酸应存放于棕色试剂瓶中:浓硝酸具有______;反应的化学方程式为___________。
(2)银片溶于热的稀硝酸:硝酸具有________;反应的化学方程式为____________。
(3)石灰石和稀硝酸混合反应制取CO2:硝酸具有_______;反应的离子方程式为__________。
(4)红热的木炭投入浓硝酸中产生红棕色的气体:浓硝酸具有________;反应的化学方程式为____________。
14.将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为13.44L。请回答:
(1)铜与浓硝酸反应的离子反应方程式为:____。
(2)NO的物质的量为_____mol。
(3)待产生的气体全部释放后,向溶液加入100mLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____mol/L。
15.硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而变化,总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为、稀硝酸的还原产物为。实验室常用与浓反应制取,用与稀反应制取。
(1)请写出实验室中用与稀反应制取的化学方程式并用双线桥标明电子的转移方向及数目:________________________________。
(2)与适量的浓反应,铜全部作用后,共收集到气体(标准状况),反应中消耗的的物质的量是________(填序号)。产生的气体是________,其物质的量之比是________。
A. B. C. D.
(3)实际上硝酸不仅可被还原为或,浓度更低时硝酸还可以被还原为、或等,请将下列3种物质:、和分别填入下面对应的横线上,并配平该反应的化学方程式。______________________________
三、实验题,共2小题
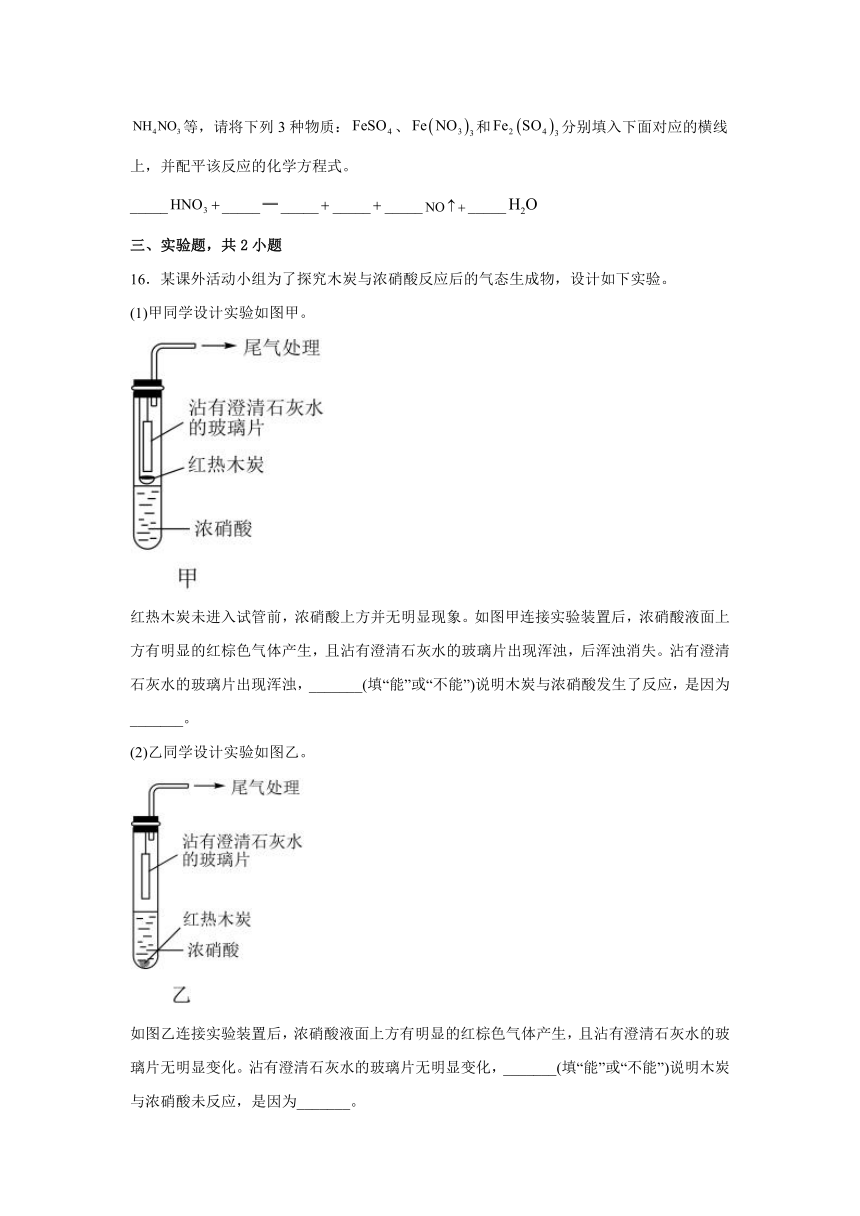
16.某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
红热木炭未进入试管前,浓硝酸上方并无明显现象。如图甲连接实验装置后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。沾有澄清石灰水的玻璃片出现浑浊,_______(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为_______。
(2)乙同学设计实验如图乙。
如图乙连接实验装置后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,_______(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为_______。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾溶液能将NO、NO2氧化成,被还原为Mn2+。
①如图连接装置后,需进行的实验操作为_______;加热木炭与浓硝酸前需先通一段时间N2,目的为_______。
②装置A中木炭与浓硝酸反应的化学方程式为_______。
③能证明木炭被氧化的实验现象为_______。
④装置D中发生反应的离子方程式为_______。
17.甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器A中盛有足量的一定浓度的硝酸,试管B中盛有3.2g铜。
①在铜与硝酸的反应中,硝酸所表现出的化学性质主要有___________。
②仪器C中收集的气体主要是___________(填化学式)。
③待试管B中的铜反应完全后,如果向B中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是___________g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用和含有的稀硝酸进行实验,若两种物质恰好反应都无剩余,且只被还原成NO,反应结束后溶液中含有和。
①反应结束后的溶液中的物质的量的取值范围是___________(用含a的代数式表示)。
②若反应结束后的溶液中、的物质的量之比,则为___________。
试卷第页,共页
参考答案:
1.D
【解析】
【分析】
【详解】
管①中铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的无色气体NO不稳定,被氧气氧化生成红棕色气体NO2,同时Cu片溶解,所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色,故选D。
答案选D。
2.D
【解析】
【分析】
【详解】
A.SO2通入澄清石灰水中生成亚硫酸钙而变浑浊:Ca2+ + 2OH-+ SO2=CaSO3↓+ H2O,A正确;
B.NO遇空气被氧化为二氧化氮而变为红棕色:2NO+O2=2NO2,B正确;
C.氨气溶于水生成一水合氨,一水合氨电离出氢氧根离子溶液呈碱性:NH3+H2ONH3 H2ONH+OH-,C正确;
D.Cu与稀HNO3混合产生无色气体NO:3Cu+2NO+8H+=3Cu2++2NO↑+4H2O,D错误;
答案选D。
3.A
【解析】
【分析】
【详解】
根据原子守恒知,m=10.2g-m(OH-),而OH-的物质的量等于镁、铜失去电子的物质的量,等于浓HNO3得电子的物质的量,等于氮氧化物失电子的物质的量,等于氧气锝电子的物质的量,即n(OH-)=(2.24L/22.4L/mol)×4=0.4mol,所以m=10.2g-0.4mol×17g·mol-1=3.4g,故A正确。
故选A。
4.B
【解析】
【详解】
A.设27.2g Cu和的混合物中Cu物质的量为xmol,物质的量为ymol,加入氢氧化钠呈中性,金属离子已完全沉淀,沉淀质量为39.2g,根据铜守恒建立关系,64x+144y=27.2,98(x+2y)=39.2,解得x=0.2,y=0.1,因此Cu与的物质的量之比为2:1,故A正确;
B.标准状况下8.96L NO和即物质的量为0.4mol,溶液加NaOH溶液至中性,得到n()=0.4mol+ n()=0.4mol+1.0×1.0L=1.4mol,则硝酸的物质的量浓度为2.8,故B错误;
C.标准状况下8.96L NO和即物质的量为0.4mol,根据氮元素守恒得到消耗的硝酸物质的量n()=0.4mol+2×(0.2+0.1×2)mol=1.2mol,根据B选项得到总的硝酸物质的量为1.4mol,因此Cu、与硝酸反应后剩余为0.2mol,故C正确;
D.标准状况下8.96L NO和即物质的量为0.4mol,设NO物质的量为amol,物质的量为bmol,根据得失电子守恒得到x+y=0.4mol,3x+y=0.2mol×2+0.1mol×2×1,解得x=0.1,y=0.3,因此标况下,产生的体积为6.72L,故D正确。
综上所述,答案为B。
5.D
【解析】
【分析】
【详解】
A.浓硝酸具有挥发性,所以打开浓硝酸的试剂瓶,瓶口有白雾,故A正确;
B.浓硝酸具有不稳定性,见光分解,应保存在棕色瓶中,故B正确;
C.稀硝酸具有酸性使紫色石蕊试液变红,故C正确;
D.硝酸具有酸性,能够与黑色氧化铜反应,生成硝酸铜和水,不属于氧化还原反应,与氧化性无关,故D错误;
故答案: D。
6.A
【解析】
【分析】
【详解】
A.硝酸见光分解,4HNO34NO2↑+2H2O+O2↑,所以需要在棕色瓶中保存,A正确;
B.浓硝酸和铜反应,4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,硝酸既表现氧化性也表现酸性,B错误;
C.浓硫酸具有脱水性,可以使蔗糖碳化,C错误;
D.常温下,浓硫酸遇Fe、Al后,在Fe、Al的表面迅速生成一层致密的氧化膜,发生了反应,D错误;
故选A。
7.B
【解析】
【分析】
【详解】
A.H+ 、NO共存的溶液氧化性较强,Fe2+被氧化为Fe3+,A错误;
B.Na+、NH、Cl-与H+ 、SO、NO均不反应可大量共存,B正确;
C.H+ 、NO共存的溶液氧化性较强,S2-被氧化为单质硫,不能大量共存,C错误;
D.H+ 、NO共存的溶液氧化性较强,I-被氧化为碘单质,D错误;
答案选B。
8.A
【解析】
【分析】
【详解】
A.浓硝酸不稳定,见光分解生成二氧化氮,二氧化氮溶于浓硝酸颜色变黄,故A正确;
B.由于浓硫酸具有脱水性,所以浓硫酸能使小木条变黑,故B错误;
C.硝酸能把SO氧化为SO,向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,则溶液中可能含有SO或SO,还可能是原溶液中含有Ag+离子,故C错误;
D.Cl2没有漂白性,SO2使含有酚酞的NaOH溶液褪色,体现SO2是酸性氧化物的性质,故D错误;
选A。
9.B
【解析】
【详解】
A. 在无色溶液中:、生成碳酸亚铁沉淀,不能大量共存,故A不符;
B. 在含大量的溶液中:、、、之间不反应,能大量共存,故B符合;
C. 在强酸性溶液中:、I-发生氧化还原反应生成亚铁离子和碘,不能大量共存,故C不符;
D. 室温下,的溶液中:、、发生氧化还原反应生成硝酸铁和NO,不能大量共存,故D不符;
故选B。
10.C
【解析】
【详解】
A.酸雨的含硫成分有硫酸和亚硫酸,故A错误;
B.芒硝是失水后生成,体现了浓硫酸的吸水性,浓硫酸的脱水是指无水去“H”“O”形成水的过程,故B错误;
C.黄铁矿燃烧产生和氧化铁,其中尾气是,与空气混合后通入碳酸钙生成硫酸钙,可用来制备石膏,故C正确;
D.与的反应为:,该反应中氧化剂是,还原剂是,比值为,故D错误;
故选C。
11.B
【解析】
【分析】
分析题意可知:。即金属失去电子的物质的量=参加反应的的物质的量得到电子的物质的量,参加反应的的物质的量为,即可直接找出得到电子的物质的量为。
【详解】
A. 转移电子的物质的量为,A不符合题意;
B. 可以看成,则转移电子的物质的量为,B符合题意;
C. 转移电子的物质的量为,C不符合题意;
D. 可以看成,则转移电子的物质的量为,D不符合题意;
答案选B。
12.B
【解析】
【详解】
Cu与稀硫酸、稀硝酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O,据题可知Cu的物质的量==0.3mol,氢离子的物质的量是0.4×(0.5+1.0 ) =0.6mol,硝酸根离子的物质的量是0.4×0.5 =0.2mol,所以氢离子不足,当转移0.45mol的电子时参加反应的Cu的物质的量==0.225mol,产生NO的物质的量==0.15mol,参加反应的Cu的质量是0.225×64=14.4g,生成NO的质量是0.15×30 =4.5g,所以溶液增重14.4-4.5=9.9g,故B正确;答案选B。
13. 不稳定性(或见光易分解的性质) 强氧化性和酸性 (稀) 酸性 强氧化性
【解析】
【分析】
(1)浓硝酸见光易分解,据此作答;
(2)稀硝酸具有强氧化性和酸性,据此作答;
(3)石灰石和稀硝酸混合反应制取CO2体现硝酸的酸性,据此作答;
(4)红热的木炭投入浓硝酸中产生红棕色的气体,体现浓硝酸的强氧化性。
【详解】
(1)浓硝酸见光易分解,方程式为:,故答案为:不稳定性(或见光易分解的性质);;
(2)稀硝酸具有强氧化性和酸性,与银反应的方程式为:(稀),故答案为:强氧化性和酸性;(稀);
(3)石灰石和稀硝酸混合反应制取CO2体现硝酸的酸性,离子方程式为:,故答案为:酸;;
(4)红热的木炭投入浓硝酸中产生红棕色的气体,体现浓硝酸的强氧化性,方程式为:,故答案为:强氧化性;。
14. Cu+4H++2=Cu2++2NO2↑+2H2O 0.2 (6+a)
【解析】
【分析】
【详解】
(1) 铜与浓硝酸反应生成,根据得失电子守恒和电荷守恒可知反应的离子方程式为:Cu+4H++2=Cu2++2NO2↑+2H2O
(2)32g铜的物质的量,混合气体的物质的量为,设NO和NO2的物质的量分别为x、y,由电子、原子守恒可知,,解得x=0.2mol,y=0.4mol,则NO的物质的量为0.2mol,NO2的物质的量为0.4mol,所以答案为0.2;
(3)恰好使溶液中的Cu2+全部转化成沉淀,此时溶质为NaNO3,溶液中的N原子与Na+数目相等,产生的气体含有的N原子为0.6mol,由N原子守恒可知,原硝酸的物质的量为0.6mol+100a×10-3mol=(0.6+0.1a)mol,则原硝酸溶液的浓度为 =(6+a)mol/L,所以答案为:(6+a)。
15. D 和 1:1 4 1 2
【解析】
【详解】
(1)与稀反应生成硝酸铜、一氧化氮和水,反应的化学方程式为(稀),用双线桥法表示电子的转移方向及数目为,故答案为:;
(2)由题意可知,由铜原子个数守恒可得,由可知,被还原的硝酸的物质的量为,表现酸性的硝酸的物质的量为,故反应共消耗硝酸的物质的量为,则D正确;反应消耗的物质的量是,失去电子,若还原产物全部为,则其物质的量为,若还原产物全部为,则其物质的量为,,则产生的气体为和;设物质的量为,则物质的量为,根据得失电子守恒,可得,解得,,故二者的物质的量之比为1:1,故答案为:D;和;1:1;
(3)所给物质中,中氮元素化合价位于最高价,具有氧化性,能将氧化为、,对应还原产物为,根据得失电子守恒原子守恒,可得发生的反应为,故答案为:4;3;;;1;2。
16. 不能 红热木炭与空气中的氧气反应也能生成二氧化碳,使澄清石灰水变浑浊 不能 挥发出的硝酸和生成的NO2都能与石灰水反应 检查装置气密性 将装置中的空气排尽 C中澄清石灰水变浑浊
【解析】
【详解】
(1) 红热木炭与空气中的氧气反应也能生成二氧化碳,所以沾有澄清石灰水的玻璃片出现浑浊,不能证明木炭与浓硝酸发生了反应,故答案为:不能;红热木炭与空气中的氧气反应也能生成二氧化碳,使澄清石灰水变浑浊;
(2) 挥发出的硝酸和生成的NO2都能与石灰水反应消耗石灰水,所以沾有澄清石灰水的玻璃片无明显变化,不能证明木炭与浓硝酸未反应,故答案为:不能;挥发出的硝酸和生成的NO2都能与石灰水反应;
(3)①涉及气体制备的实验要检查装置气密性,所以连接装置后,需进行的实验操作为检查装置气密性;为防止空气对实验产生干扰,加热木炭与浓硝酸前需先通一段时间N2,将装置中的空气排尽,故答案为:检查装置气密性;将装置中的空气排尽;
②木炭与浓硝酸反应生成二氧化碳、二氧化氮和水,反应的化学方程式为,故答案为:;
③若澄清石灰水变浑浊,可证明木炭被氧化为二氧化碳,所以能证明木炭被氧化的实验现象为C中澄清石灰水变浑浊,故答案为:C中澄清石灰水变浑浊;
④装置D中NO被氧化为,被还原为Mn2+,发生反应的离子方程式为,故答案为:。
17. 酸性和强氧化性 NO 4.9
【解析】
【分析】
【详解】
(1)①反应中部分N元素的化合价未变化,生成硝酸铜,硝酸表现出酸性,部分N元素的化合价降低,生成氮的氧化物,硝酸表现出强氧化性;
②若硝酸为稀硝酸,生成的气体为NO,若硝酸为浓硝酸,则进入仪器C的气体为NO2,NO2与水反应生成NO,所以仪器C中收集到的气体主要是NO;
③3.2g铜的物质的量为=0.05mol,向B中加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.05mol,故m[Cu(OH)2]=0.05mol×98g mol 1=4.9g。
(2)铁与稀硝酸间的反应可能为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。
①全部生成Fe3+时,溶液中N的物质的量最多,故N的物质的量最多为3amol,全部生成Fe2+时,溶液中N的物质的量最少,故N的物质的量最少为2amol,由于溶液中同时含有Fe3+和,故2amol②n(Fe3+):n(Fe2+)=3:1,则n(Fe3+)=amol、n(Fe2+)=amol,故溶液中n(N)= =3n(Fe3+)+2n(Fe2+)=amol×3+amol×2=amol,由氮原子守恒可知,n(NO)=bmol amol,根据得失电子守恒有:a mol×3+a mol×2=(b a)mol×(5 2),整理得=。
试卷第页,共页
练习
一、单选题,共12小题
1.某实验过程如图所示,则试管③中的现象是
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
2.下列解释事实的方程式不正确的是
A.SO2通入澄清石灰水变浑浊:Ca2+ + 2OH-+ SO2 =CaSO3↓+ H2O
B.NO遇空气变为红棕色:2NO+O2=2NO2
C.氨气溶于水溶液呈碱性:NH3+H2ONH3 H2ONH+OH-
D.Cu与稀HNO3混合产生无色气体:Cu+2NO+4H+ =Cu2++2NO2↑+2H2O
3.取mg铜镁合金完全溶于浓硝酸中,反应过程中产生一定量的NO2气体和N2O4气体,将反应产生的气体与2.24L的O2(已折算到标准状况)一起通入水中,恰好完全反应生成硝酸;在合金与硝酸反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为10.2g.则m等于
A.3.4 B.6.8 C.10.0 D.10.2
4.向27.2g Cu和的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,得到标准状况下8.96L NO和的混合气体及溶液。在所得溶液中加入1.0的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列有关说法不正确的是
A.Cu与的物质的量之比为2:1
B.硝酸的物质的量浓度为2.4
C.Cu、与硝酸反应后剩余为0.2mol
D.标况下,产生的体积为6.72L
5.下列事实与硝酸性质的对应关系错误的是
A.打开浓硝酸的试剂瓶,瓶口有白雾——挥发性
B.用棕色试剂瓶保存浓硝酸——不稳定性
C.稀硝酸使紫色石蕊试液变红——酸性
D.稀硝酸使黑色氧化铜固体溶解——强氧化性
6.下列说法正确的是
A.浓硝酸见光或受热易分解,必须保存在棕色瓶中
B.浓硝酸和铜反应有红棕色气体产生,只表现氧化性
C.浓硫酸具有吸水性,能使蔗糖碳化
D.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸
7.已知某溶液中存在较多的H+ 、SO、NO,则该溶液中还可能大量存在的离子组是
A.Mg2+、Fe2+、Cl- B.Na+、NH、Cl-
C.K+、S2-、Mg2+ D.Cu2+、I-、Na+
8.下列实验现象和对应解释(或结论)都正确的是
现象 解释(或结论)
A 浓硝酸在光照下颜色变黄 浓硝酸不稳定
B 浓硫酸能使小木条变黑 浓硫酸具有吸水性
C 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中含有SO
D Cl2和SO2均可使含有酚酞的NaOH溶液褪色 Cl2和SO2均具有漂白性
A.A B.B C.C D.D
9.下列各组离子一定能大量共存的是
A.在无色溶液中:、、、
B.在含大量的溶液中:、、、
C.在强酸性溶液中:、、、I-
D.室温下,的溶液中:、、、
10.自然界中不同价态硫元素之间的转化如图所示,下列说法正确的是
A.上图中,酸雨的含硫成分只有,由溶于水生成
B.芒硝在浓硫酸中失水的过程体现了浓硫酸的脱水性
C.黄铁矿燃烧产生的尾气,与空气混合后通入碳酸钙的浆状物,可用来制备石膏
D.凝聚法是将通入稀溶液中得到S胶体,该反应中氧化剂:还原剂=2:1
11.铜和镁的合金完全溶于足量的硝酸后,再加入过量的NaOH溶液,生成沉淀,则合金与硝酸反应时,放出的气体可能是( )
A.
B.和
C.
D.、和
12.将19.2g的铜屑投入到400 mL浓度均为0.5mol/L HNO3和H2SO4的混合溶液中,溶液增加的质量为
A.4.5 g B.9.9 g C.13.2 g D.14.7 g
二、填空题,共3小题
13.下列事实体现了硝酸的什么性质?写出有关反应的化学方程式或离子方程式。
(1)浓硝酸应存放于棕色试剂瓶中:浓硝酸具有______;反应的化学方程式为___________。
(2)银片溶于热的稀硝酸:硝酸具有________;反应的化学方程式为____________。
(3)石灰石和稀硝酸混合反应制取CO2:硝酸具有_______;反应的离子方程式为__________。
(4)红热的木炭投入浓硝酸中产生红棕色的气体:浓硝酸具有________;反应的化学方程式为____________。
14.将32g铜与100mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为13.44L。请回答:
(1)铜与浓硝酸反应的离子反应方程式为:____。
(2)NO的物质的量为_____mol。
(3)待产生的气体全部释放后,向溶液加入100mLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____mol/L。
15.硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而变化,总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为、稀硝酸的还原产物为。实验室常用与浓反应制取,用与稀反应制取。
(1)请写出实验室中用与稀反应制取的化学方程式并用双线桥标明电子的转移方向及数目:________________________________。
(2)与适量的浓反应,铜全部作用后,共收集到气体(标准状况),反应中消耗的的物质的量是________(填序号)。产生的气体是________,其物质的量之比是________。
A. B. C. D.
(3)实际上硝酸不仅可被还原为或,浓度更低时硝酸还可以被还原为、或等,请将下列3种物质:、和分别填入下面对应的横线上,并配平该反应的化学方程式。______________________________
三、实验题,共2小题
16.某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
红热木炭未进入试管前,浓硝酸上方并无明显现象。如图甲连接实验装置后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。沾有澄清石灰水的玻璃片出现浑浊,_______(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为_______。
(2)乙同学设计实验如图乙。
如图乙连接实验装置后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,_______(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为_______。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾溶液能将NO、NO2氧化成,被还原为Mn2+。
①如图连接装置后,需进行的实验操作为_______;加热木炭与浓硝酸前需先通一段时间N2,目的为_______。
②装置A中木炭与浓硝酸反应的化学方程式为_______。
③能证明木炭被氧化的实验现象为_______。
④装置D中发生反应的离子方程式为_______。
17.甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器A中盛有足量的一定浓度的硝酸,试管B中盛有3.2g铜。
①在铜与硝酸的反应中,硝酸所表现出的化学性质主要有___________。
②仪器C中收集的气体主要是___________(填化学式)。
③待试管B中的铜反应完全后,如果向B中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是___________g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用和含有的稀硝酸进行实验,若两种物质恰好反应都无剩余,且只被还原成NO,反应结束后溶液中含有和。
①反应结束后的溶液中的物质的量的取值范围是___________(用含a的代数式表示)。
②若反应结束后的溶液中、的物质的量之比,则为___________。
试卷第页,共页
参考答案:
1.D
【解析】
【分析】
【详解】
管①中铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的无色气体NO不稳定,被氧气氧化生成红棕色气体NO2,同时Cu片溶解,所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色,故选D。
答案选D。
2.D
【解析】
【分析】
【详解】
A.SO2通入澄清石灰水中生成亚硫酸钙而变浑浊:Ca2+ + 2OH-+ SO2=CaSO3↓+ H2O,A正确;
B.NO遇空气被氧化为二氧化氮而变为红棕色:2NO+O2=2NO2,B正确;
C.氨气溶于水生成一水合氨,一水合氨电离出氢氧根离子溶液呈碱性:NH3+H2ONH3 H2ONH+OH-,C正确;
D.Cu与稀HNO3混合产生无色气体NO:3Cu+2NO+8H+=3Cu2++2NO↑+4H2O,D错误;
答案选D。
3.A
【解析】
【分析】
【详解】
根据原子守恒知,m=10.2g-m(OH-),而OH-的物质的量等于镁、铜失去电子的物质的量,等于浓HNO3得电子的物质的量,等于氮氧化物失电子的物质的量,等于氧气锝电子的物质的量,即n(OH-)=(2.24L/22.4L/mol)×4=0.4mol,所以m=10.2g-0.4mol×17g·mol-1=3.4g,故A正确。
故选A。
4.B
【解析】
【详解】
A.设27.2g Cu和的混合物中Cu物质的量为xmol,物质的量为ymol,加入氢氧化钠呈中性,金属离子已完全沉淀,沉淀质量为39.2g,根据铜守恒建立关系,64x+144y=27.2,98(x+2y)=39.2,解得x=0.2,y=0.1,因此Cu与的物质的量之比为2:1,故A正确;
B.标准状况下8.96L NO和即物质的量为0.4mol,溶液加NaOH溶液至中性,得到n()=0.4mol+ n()=0.4mol+1.0×1.0L=1.4mol,则硝酸的物质的量浓度为2.8,故B错误;
C.标准状况下8.96L NO和即物质的量为0.4mol,根据氮元素守恒得到消耗的硝酸物质的量n()=0.4mol+2×(0.2+0.1×2)mol=1.2mol,根据B选项得到总的硝酸物质的量为1.4mol,因此Cu、与硝酸反应后剩余为0.2mol,故C正确;
D.标准状况下8.96L NO和即物质的量为0.4mol,设NO物质的量为amol,物质的量为bmol,根据得失电子守恒得到x+y=0.4mol,3x+y=0.2mol×2+0.1mol×2×1,解得x=0.1,y=0.3,因此标况下,产生的体积为6.72L,故D正确。
综上所述,答案为B。
5.D
【解析】
【分析】
【详解】
A.浓硝酸具有挥发性,所以打开浓硝酸的试剂瓶,瓶口有白雾,故A正确;
B.浓硝酸具有不稳定性,见光分解,应保存在棕色瓶中,故B正确;
C.稀硝酸具有酸性使紫色石蕊试液变红,故C正确;
D.硝酸具有酸性,能够与黑色氧化铜反应,生成硝酸铜和水,不属于氧化还原反应,与氧化性无关,故D错误;
故答案: D。
6.A
【解析】
【分析】
【详解】
A.硝酸见光分解,4HNO34NO2↑+2H2O+O2↑,所以需要在棕色瓶中保存,A正确;
B.浓硝酸和铜反应,4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,硝酸既表现氧化性也表现酸性,B错误;
C.浓硫酸具有脱水性,可以使蔗糖碳化,C错误;
D.常温下,浓硫酸遇Fe、Al后,在Fe、Al的表面迅速生成一层致密的氧化膜,发生了反应,D错误;
故选A。
7.B
【解析】
【分析】
【详解】
A.H+ 、NO共存的溶液氧化性较强,Fe2+被氧化为Fe3+,A错误;
B.Na+、NH、Cl-与H+ 、SO、NO均不反应可大量共存,B正确;
C.H+ 、NO共存的溶液氧化性较强,S2-被氧化为单质硫,不能大量共存,C错误;
D.H+ 、NO共存的溶液氧化性较强,I-被氧化为碘单质,D错误;
答案选B。
8.A
【解析】
【分析】
【详解】
A.浓硝酸不稳定,见光分解生成二氧化氮,二氧化氮溶于浓硝酸颜色变黄,故A正确;
B.由于浓硫酸具有脱水性,所以浓硫酸能使小木条变黑,故B错误;
C.硝酸能把SO氧化为SO,向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,则溶液中可能含有SO或SO,还可能是原溶液中含有Ag+离子,故C错误;
D.Cl2没有漂白性,SO2使含有酚酞的NaOH溶液褪色,体现SO2是酸性氧化物的性质,故D错误;
选A。
9.B
【解析】
【详解】
A. 在无色溶液中:、生成碳酸亚铁沉淀,不能大量共存,故A不符;
B. 在含大量的溶液中:、、、之间不反应,能大量共存,故B符合;
C. 在强酸性溶液中:、I-发生氧化还原反应生成亚铁离子和碘,不能大量共存,故C不符;
D. 室温下,的溶液中:、、发生氧化还原反应生成硝酸铁和NO,不能大量共存,故D不符;
故选B。
10.C
【解析】
【详解】
A.酸雨的含硫成分有硫酸和亚硫酸,故A错误;
B.芒硝是失水后生成,体现了浓硫酸的吸水性,浓硫酸的脱水是指无水去“H”“O”形成水的过程,故B错误;
C.黄铁矿燃烧产生和氧化铁,其中尾气是,与空气混合后通入碳酸钙生成硫酸钙,可用来制备石膏,故C正确;
D.与的反应为:,该反应中氧化剂是,还原剂是,比值为,故D错误;
故选C。
11.B
【解析】
【分析】
分析题意可知:。即金属失去电子的物质的量=参加反应的的物质的量得到电子的物质的量,参加反应的的物质的量为,即可直接找出得到电子的物质的量为。
【详解】
A. 转移电子的物质的量为,A不符合题意;
B. 可以看成,则转移电子的物质的量为,B符合题意;
C. 转移电子的物质的量为,C不符合题意;
D. 可以看成,则转移电子的物质的量为,D不符合题意;
答案选B。
12.B
【解析】
【详解】
Cu与稀硫酸、稀硝酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O,据题可知Cu的物质的量==0.3mol,氢离子的物质的量是0.4×(0.5+1.0 ) =0.6mol,硝酸根离子的物质的量是0.4×0.5 =0.2mol,所以氢离子不足,当转移0.45mol的电子时参加反应的Cu的物质的量==0.225mol,产生NO的物质的量==0.15mol,参加反应的Cu的质量是0.225×64=14.4g,生成NO的质量是0.15×30 =4.5g,所以溶液增重14.4-4.5=9.9g,故B正确;答案选B。
13. 不稳定性(或见光易分解的性质) 强氧化性和酸性 (稀) 酸性 强氧化性
【解析】
【分析】
(1)浓硝酸见光易分解,据此作答;
(2)稀硝酸具有强氧化性和酸性,据此作答;
(3)石灰石和稀硝酸混合反应制取CO2体现硝酸的酸性,据此作答;
(4)红热的木炭投入浓硝酸中产生红棕色的气体,体现浓硝酸的强氧化性。
【详解】
(1)浓硝酸见光易分解,方程式为:,故答案为:不稳定性(或见光易分解的性质);;
(2)稀硝酸具有强氧化性和酸性,与银反应的方程式为:(稀),故答案为:强氧化性和酸性;(稀);
(3)石灰石和稀硝酸混合反应制取CO2体现硝酸的酸性,离子方程式为:,故答案为:酸;;
(4)红热的木炭投入浓硝酸中产生红棕色的气体,体现浓硝酸的强氧化性,方程式为:,故答案为:强氧化性;。
14. Cu+4H++2=Cu2++2NO2↑+2H2O 0.2 (6+a)
【解析】
【分析】
【详解】
(1) 铜与浓硝酸反应生成,根据得失电子守恒和电荷守恒可知反应的离子方程式为:Cu+4H++2=Cu2++2NO2↑+2H2O
(2)32g铜的物质的量,混合气体的物质的量为,设NO和NO2的物质的量分别为x、y,由电子、原子守恒可知,,解得x=0.2mol,y=0.4mol,则NO的物质的量为0.2mol,NO2的物质的量为0.4mol,所以答案为0.2;
(3)恰好使溶液中的Cu2+全部转化成沉淀,此时溶质为NaNO3,溶液中的N原子与Na+数目相等,产生的气体含有的N原子为0.6mol,由N原子守恒可知,原硝酸的物质的量为0.6mol+100a×10-3mol=(0.6+0.1a)mol,则原硝酸溶液的浓度为 =(6+a)mol/L,所以答案为:(6+a)。
15. D 和 1:1 4 1 2
【解析】
【详解】
(1)与稀反应生成硝酸铜、一氧化氮和水,反应的化学方程式为(稀),用双线桥法表示电子的转移方向及数目为,故答案为:;
(2)由题意可知,由铜原子个数守恒可得,由可知,被还原的硝酸的物质的量为,表现酸性的硝酸的物质的量为,故反应共消耗硝酸的物质的量为,则D正确;反应消耗的物质的量是,失去电子,若还原产物全部为,则其物质的量为,若还原产物全部为,则其物质的量为,,则产生的气体为和;设物质的量为,则物质的量为,根据得失电子守恒,可得,解得,,故二者的物质的量之比为1:1,故答案为:D;和;1:1;
(3)所给物质中,中氮元素化合价位于最高价,具有氧化性,能将氧化为、,对应还原产物为,根据得失电子守恒原子守恒,可得发生的反应为,故答案为:4;3;;;1;2。
16. 不能 红热木炭与空气中的氧气反应也能生成二氧化碳,使澄清石灰水变浑浊 不能 挥发出的硝酸和生成的NO2都能与石灰水反应 检查装置气密性 将装置中的空气排尽 C中澄清石灰水变浑浊
【解析】
【详解】
(1) 红热木炭与空气中的氧气反应也能生成二氧化碳,所以沾有澄清石灰水的玻璃片出现浑浊,不能证明木炭与浓硝酸发生了反应,故答案为:不能;红热木炭与空气中的氧气反应也能生成二氧化碳,使澄清石灰水变浑浊;
(2) 挥发出的硝酸和生成的NO2都能与石灰水反应消耗石灰水,所以沾有澄清石灰水的玻璃片无明显变化,不能证明木炭与浓硝酸未反应,故答案为:不能;挥发出的硝酸和生成的NO2都能与石灰水反应;
(3)①涉及气体制备的实验要检查装置气密性,所以连接装置后,需进行的实验操作为检查装置气密性;为防止空气对实验产生干扰,加热木炭与浓硝酸前需先通一段时间N2,将装置中的空气排尽,故答案为:检查装置气密性;将装置中的空气排尽;
②木炭与浓硝酸反应生成二氧化碳、二氧化氮和水,反应的化学方程式为,故答案为:;
③若澄清石灰水变浑浊,可证明木炭被氧化为二氧化碳,所以能证明木炭被氧化的实验现象为C中澄清石灰水变浑浊,故答案为:C中澄清石灰水变浑浊;
④装置D中NO被氧化为,被还原为Mn2+,发生反应的离子方程式为,故答案为:。
17. 酸性和强氧化性 NO 4.9
【解析】
【分析】
【详解】
(1)①反应中部分N元素的化合价未变化,生成硝酸铜,硝酸表现出酸性,部分N元素的化合价降低,生成氮的氧化物,硝酸表现出强氧化性;
②若硝酸为稀硝酸,生成的气体为NO,若硝酸为浓硝酸,则进入仪器C的气体为NO2,NO2与水反应生成NO,所以仪器C中收集到的气体主要是NO;
③3.2g铜的物质的量为=0.05mol,向B中加入足量氢氧化钠溶液,铜离子完全转化为氢氧化铜沉淀,根据铜原子守恒可知n[Cu(OH)2]=n(Cu)=0.05mol,故m[Cu(OH)2]=0.05mol×98g mol 1=4.9g。
(2)铁与稀硝酸间的反应可能为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。
①全部生成Fe3+时,溶液中N的物质的量最多,故N的物质的量最多为3amol,全部生成Fe2+时,溶液中N的物质的量最少,故N的物质的量最少为2amol,由于溶液中同时含有Fe3+和,故2amol
试卷第页,共页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
