2021-2022学年高二化学人教版(2019)选择性必修3第二章烃第一节烷烃 提升训练 (word 含解析)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修3第二章烃第一节烷烃 提升训练 (word 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 329.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 12:58:13 | ||
图片预览




文档简介
第二章烃第一节烷烃——提升训练2021-2022学年高中化学人教版(2019)选择性必修3
一、选择题(共16题)
1.设NA为阿伏加德罗常数的值。下列说法正确的是
A.46g C2H6O完全燃烧,断裂的共价键数为8NA
B.12g金刚石中含有C-C键的个数为NA
C.16g甲烷与足量C12在光照条件下反应,生成四氯甲烷的分子数为NA
D.32g S8()与S6()的混合物中所含共价键数为2NA
2.下列叙述正确的是
A.通式为CnH2n+2的烃不一定是烷烃
B.C2H4和C4H8一定互为同系物
C.燃烧后生成CO2和H2O的有机物一定是烃
D.与球棍模型相比,空间充填模型更能反映出有机物的真实结构
3.下列分子式只表示一种物质的是
A.C4H10 B.C5H12 C.C3H7Cl D.CH2Cl2
4.下列表述正确的是
A.N表示的是质子数为7、核外电子数为8的核素
B.甲烷的分子式和结构简式均为CH4
C.NH和OH-互为等电子体
D.苯的同系物C9H12的键线式可表示为
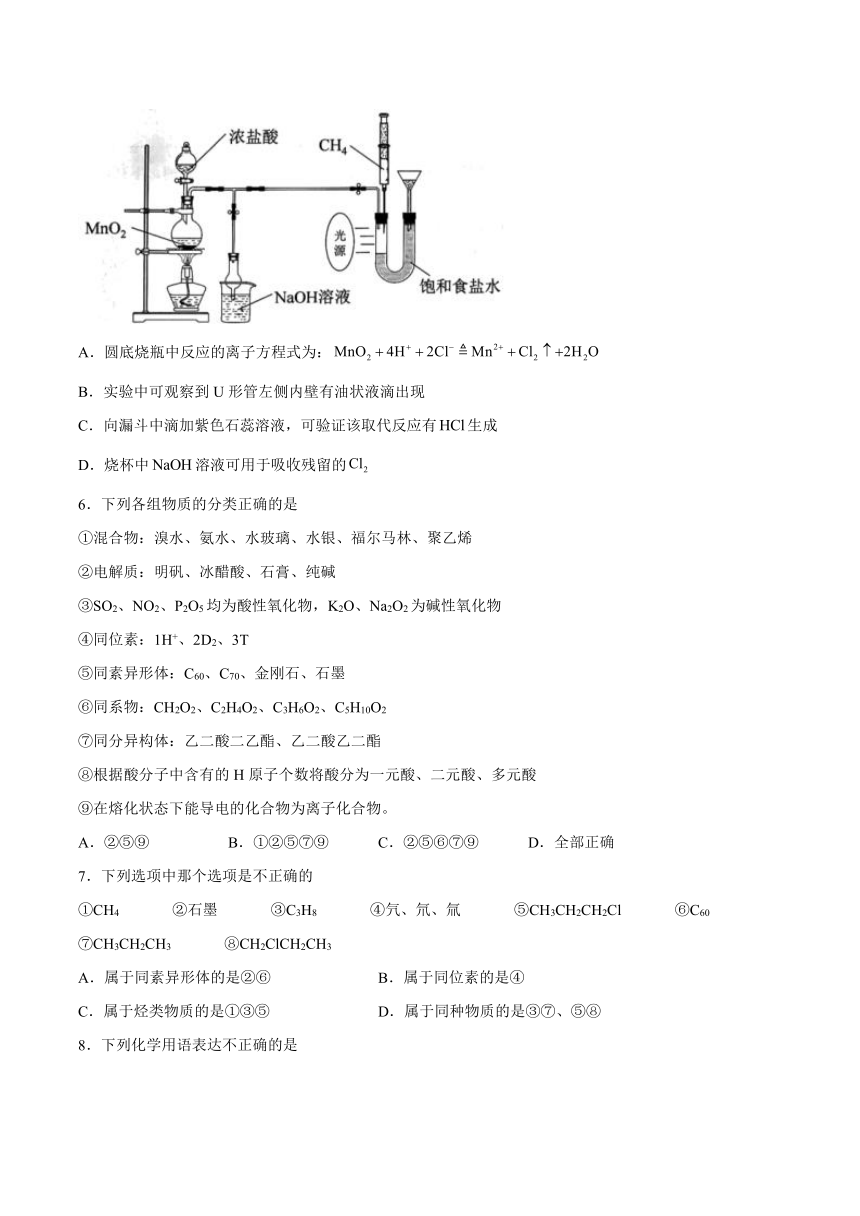
5.用如下装置在实验室探究和的取代反应(部分夹持装置省略)。下列说法错误的是
A.圆底烧瓶中反应的离子方程式为:
B.实验中可观察到U形管左侧内壁有油状液滴出现
C.向漏斗中滴加紫色石蕊溶液,可验证该取代反应有生成
D.烧杯中溶液可用于吸收残留的
6.下列各组物质的分类正确的是
①混合物:溴水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③SO2、NO2、P2O5均为酸性氧化物,K2O、Na2O2为碱性氧化物
④同位素:1H+、2D2、3T
⑤同素异形体:C60、C70、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C5H10O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物。
A.②⑤⑨ B.①②⑤⑦⑨ C.②⑤⑥⑦⑨ D.全部正确
7.下列选项中那个选项是不正确的
①CH4 ②石墨 ③C3H8 ④氕、氘、氚 ⑤CH3CH2CH2Cl ⑥C60 ⑦CH3CH2CH3 ⑧CH2ClCH2CH3
A.属于同素异形体的是②⑥ B.属于同位素的是④
C.属于烃类物质的是①③⑤ D.属于同种物质的是③⑦、⑤⑧
8.下列化学用语表达不正确的是
①丙烷的球棍模型 ②与C8H6互为同分异构体
③C3H8与C4H10一定互为同系物 ④丙烯的结构简式为CH2CHCH3
A.①④ B.②③ C.②④ D.③④
9.下列关于和这两种物质的叙述正确的是
A.互为同系物 B.均可属醇类 C.均可属酚类 D.均可属羧酸类
10.下列说法不正确的是________
A.所有碳氢化合物中,甲烷中碳的质量分数最低
B.所有烷烃中,甲烷的沸点最低
C.甲烷分子中最多有4个原子共平面
D.甲烷、乙烷和丙烷都能在光照下与氯气发生取代反应
11.下列说法错误的是
A.干冰是二氧化碳固体,干冰晶体中二氧化碳的配位数是12
B.新戊烷[]分子中5个碳原子形成的空间构型是为正四面体形
C.分子中不含环状结构且每个原子均满足8电子稳定结构,分子中键和键的个数比为
D.分子晶体中,共价键的键能越大,熔、沸点越高
12.X、Y、Z和W是四种短周期主族元素,原子序数依次增大,X、Z同主族,Y的单质与冷水不反应,可以在二氧化碳中燃烧,X、Z、W可以构成一种物质M(如图所示),下列说法正确的是
A.利用Y在空气中燃烧可以引发甲烷与氯气的取代反应
B.W和第三周期离子半径最小的元素形成共价化合物,属于弱电解质
C.海水中提取Y生产流程如下:海水Y
D.将M和AlCl3 6H2O混合加热,可得无水氯化铝
13.某烷烃的相对分子质量为114,则该烷烃的同分异构体中,主链有5个碳原子的结构有
A.3种 B.4种 C.5种 D.6种
14.若NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A.18gD2O含有的质子数与中子数均为NA
B.17g羟基(—OH)中含有的电子数为10NA
C.标准状况下,0.56L丙烷中含有共价键的数目为0.2NA
D.14gC2H4和C3H6的混合物中含有的氢原子总数为2NA
15.设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,5.6 L F2和C2H6的混合物中含有电子的数目为4.5NA
B.0.1 mol H2C2O4与足量酸性KMnO4溶液充分反应,转移电子数为0.1NA
C.标准状况下,11.2 L三氯甲烷中含有氯原子的数目为1.5NA
D.标准状况下,CH4与2.24 LCl2恰好完全反应,生成物中气体分子的数目为0.2NA
16.若NA为阿伏伽德罗常数,下列说法正确的是
A.1mol甲基碳正离子(CH)所含质子总数为8NA
B.标准状况下,22.4 LCHCl3含有的分子数为NA
C.加热条件下,56gFe与足量浓硝酸充分反应,转移的电子数为3NA
D.在一定条件下,2molSO2和1molO2充分反应后,容器中的分子总数小于2NA
二、综合题(共5题)
17.完成下列各题:
(1)烃 A 的结构简式为,用系统命名法命名烃A:_________________________________________。
(2)某烃的分子式为 C5H12,核磁共振氢谱图中显示三个峰,则该烃的一氯代物有_______种,该烃的结构简式为 ______________________ 。
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式是 ___________________________________________,反应类型为___________________,反应②的反应类型为 ____________________。
(4)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构如下:
下列各物质:
A . B .
C. D .
E.
与麻黄素互为同分异构体的是 ___________ (填字母,下同),互为同系物的是 ______。
(5)多氯代甲烷作为溶剂,其中分子结构为正四面体的是 ____________。工业上分离这些多卤代甲烷的方法是 _________________。
18.CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为________。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_______。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式________(质子交换膜只允许H+通过)。
(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____左右。
②CH4与CO2可直接转化成乙酸的原子利用率为_____。
(5)碳正离子(例如:、、(CH3)3C+等)是有机反应中间体,碳正离子是由CH4在“超强酸”中获得一个H+而得到,而失去H2可得。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为________。
(6)CH4与Cl2在光照条件下可发生反应。
①实验室中用如图所示的装置进行实验。
在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是______
A.B. C. D.
②CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见图。有关说法不正确的是_____(填序号)
A.Cl·是Cl2在光照下化学键断裂生成的,该过程可表示为:
B.反应过程一定无CH3CH3生成
C.图示过程放出热量
D.CH4转化为CH3Cl,C-H键发生了断裂
19.I.如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间。
(1)假设甲烷与氯气充分反应,且只产生一种有机物,请写出化学方程式___。
(2)经过几个小时的反应后,U形管右端的玻璃管中水柱变化是___。
A.升高B.降低C.不变D.无法确定
(3)试解释U形管右端的玻璃管中水柱变化的原因___。
Ⅱ.(4)相对分子质量为72的烷烃的分子式是___,它可能的结构有___种。
20.有A、B、C三种烃,已知:
①B完全燃烧的产物n(CO2)∶n(H2O)=2∶3;
②C为饱和链烃,通常状况下呈气态,其二氯代物有3种;
③A是B分子中的氢原子全部被甲基取代的产物。
请完成下列问题:
(1)B的最简式为_______,分子式为_______,其二溴代物有_______种。
(2)C的3种二氯代物的结构简式为_______、_______、_______。
(3)A的结构简式为_______。
21.如图所示表示页岩气中某些烃分子的结构模型:
(1)有机化合物乙的名称为_______,有机化合物甲与有机化合物乙互为_______。
(2)有机化合物甲的二氯取代物有_______种;请你根据甲烷分子的空间结构推测,有机化合物乙中最多有_______个C原子在同一平面内。
(3)有机化合物甲和乙的沸点:甲_______(填“>”“=”或“<”)乙,1mol甲和乙的混合气体完全燃烧消耗O2的物质的量为_______mol。
试卷第页,共页
参考答案:
1.A
【解析】
【分析】
【详解】
A.分子式为C2H6O的物质为乙醇 或甲醚,都是1mol含8mol共价键,46g就是1mol,完全燃烧,断裂的共价键数为8NA,故A正确;
B.12g金刚石中含有1molC,金刚石中,每个碳原子与其他4个碳原子形成四个共价键,每个碳原子形成的C-C键的个数 ,所以1molC原子形成的共价键为2mol,含有的共价键数为2NA,故B错误;
C. 16g甲烷与足量C12在光照条件下反应,生成四种有机物,所以生成四氯甲烷的分子数为小于NA,故C错误;
D.假设是32g S8()所含的共价键为,假设是32gS6() 所含共价键数为 ,所以混合物中中所含共价键数为NA,故D错误;
故答案为:A
2.D
【解析】
【分析】
【详解】
A.通式为CnH2n+2的烃一定是烷烃,A错误;
B.C2H4和C4H8的结构不一定相似,二者不一定互为同系物,B错误;
C.燃烧后生成CO2和H2O的有机物不一定是烃,例如乙醇完全燃烧生成CO2和H2O,C错误;
D.空间充填模型表示每个原子的容积和分子实际形状的致密的分子模型,与球棍模型相比,空间充填模型更能反映出有机物的真实结构,D正确;
答案选D。
3.D
【解析】
【详解】
A.分子式是C4H10的物质可以表示CH3CH2CH2CH3、 ,因此C4H10不能只表示一种物质,A不符合题意;
B.分子式是C5H12的物质可以表示CH3CH2CH2CH2CH3、、,因此C5H12不能只表示一种物质,B不符合题意;
C.分子式C3H7Cl表示的物质可以是CH3CH2CH2Cl、CH3CHClCH3,因此C3H7Cl不能只表示一种物质,C不符合题意;
D.分子式CH2Cl2表示甲烷CH4分子中2个H原子被2个Cl原子取代产生的物质,由于甲烷只有一种结构,因此CH2Cl2只表示一种物质,D符合题意;
故合理选项是D。
4.B
【解析】
【分析】
【详解】
A.表示的是质子数为7、核外电子数为7、中子数为8、质量数为15的核素A错误;
B.甲烷的分子式和结构简式均为CH4,B正确;
C.虽然和均为10电子粒子,但两者的原子个数不相等,不互为等电子体,C错误;
D.所表示的芳香烃的分子式为C10H14,D错误。
故选:B。
5.C
【解析】
【分析】
【详解】
A.圆底烧瓶中是MnO2和浓盐酸发生氧化还原反应得到Cl2,反应的离子方程式为:,A正确;
B.CH4和Cl2发生取代反应得到二氯甲烷、三氯甲烷、四氯甲烷都是液体,则可观察到U形管左侧内壁有油状液滴出现,B正确;
C.漏斗中含有Cl2溶于水,反应为Cl2+H2OHCl+HClO,滴加紫色石蕊溶液变红,可能是氯气溶于水造成的,不能验证取代反应有生成,C错误;
D.Cl2可与强碱性溶液反应,则烧杯中溶液可用于吸收残留的,D正确;
故选:C。
6.A
【解析】
【分析】
【详解】
①水银(汞)属于单质,不是混合物,故①错误;
②明矾、冰醋酸、纯碱均为化合物,在水溶液中可发生电离,生成自由移动的阴阳离子,石膏在熔融状态下发生电离,所以上述物质均属于电解质,故②正确;
③NO2不为酸性氧化物,Na2O2不属于碱性氧化物,故③错误;
④D2为单质,不是元素原子,故④错误;
⑤C60、C70、金刚石、石墨,都是由碳元素组成的物理性质不同的单质,互为同素异形体,故⑤正确;
⑥同系物必须是结构相似,分子组成上相差n个CH2的物质,而CH2O2、C2H4O2、C3H6O2、C5H10O2的结构不一定相似,故⑥错误;
⑦乙二酸二乙酯和乙二酸乙二酯分子式不同,不互为同分异构体,故⑦错误;
⑧根据酸分子在水溶液中电离出氢离子的个数将酸分为一元酸、二元酸、多元酸,而不是根据分子中所含氢原子的个数划分的,故⑧错误;
⑨在熔化状态下能导电的化合物为离子化合物,离子化合物在熔化状态下导电,故⑨正确;
综上所述,②⑤⑨符合题意,A项正确;
答案选A。
7.C
【解析】
【分析】
【详解】
A.石墨、C60都是由碳元素组成的单质,石墨、C60属于同素异形体,故A正确;
B.氕、氘、氚是质子数相同、中子数不同的原子,氕、氘、氚属于同位素,故B正确;
C.CH4、C3H8、CH3CH2CH3只含碳、氢两种元素,CH4、C3H8、CH3CH2CH3属于烃类,CH3CH2CH2Cl由碳、氢、氯三种元素组成,CH3CH2CH2Cl不属于烃,故C错误;
D.C3H8的结构简式是CH3CH2CH3,CH3CH2CH2Cl、CH2ClCH2CH3结构相同,③⑦、⑤⑧属于同种物质,故D正确;
选C。
8.C
【解析】
【分析】
【详解】
①是丙烷的球棍模型,①项正确;
②的分子式为C8H6,C8H6的结构不能确定,二者可能是同一物质,不一定是同分异构体,②项错误;
③C3H8与C4H10均为饱和烃,二者结构相似,分子组成上相差一个CH2原子团,二者互为同系物,③项正确;
④丙烯的结构简式为CH2=CHCH3,④项错误;
答案选C。
9.D
【解析】
【分析】
【详解】
的官能团为酚羟基和羧基,而的官能团为醇羟基和羧基,故两者均可属羧酸类,不是同系物关系,故D正确。
故选D。
10.C
【解析】
【详解】
A.所有碳氢化合物中,甲烷分子中H元素的含量最高,则其中碳元素的质量分数最低,A正确;
B.在烷烃中,随着分子中C原子数的增多,物质的相对分子质量逐渐增大,分子间作用力逐渐增强,因此物质的熔沸点逐渐升高,故在所有烷烃中,甲烷的沸点最低,B正确;
C.甲烷分子是正四面体结构,键角是109°28′,物质分子中最多有3个原子共平面,C错误;
D.甲烷、乙烷和丙烷分子中都含有C-H键,在光照下都能与氯气发生取代反应,产生氯代烷烃,D正确;
故合理选项是C。
11.D
【解析】
【详解】
A.顶点和面心的二氧化碳距离最近,干冰中CO2分子的配位数为12,故A正确;
B.新戊烷[]分子中5个碳原子类似甲烷中四个氢原子被四个甲烷取代,因此形成的空间构型是正四面体形,故B正确;
C.二氧化三碳(C3O2)分子中不含环状结构且每个原子均满足8电子稳定结构,其结构式为O=C=C=C=O,单键为σ键,双键含有1个σ键、1个π键,故分子中σ键与π键的个数比为1:1,故C正确;
D.分子晶体中,物质的熔沸点主要是看分子间作用力的大小,与共价键的键能无关,故D错误。
答案选D。
12.D
【解析】
【分析】
Y的单质与冷水不反应,可以在二氧化碳中燃烧可判断Y为Mg,X原子序数小于12,且能形成2个共价键,X为O,X、Z同主族,Z为S,W形成一个共价键且原子序数比硫大的主族短周期只能为氯,所以X、Y、Z、W依次是氧、镁、硫、氯,以此来解析;
【详解】
A.镁燃烧产生耀眼强光,能引发甲烷和氯气反应,但是会爆炸,一般用普通光,所以不用镁燃烧引发,A错误;
B.Cl和第三周期离子半径最小的元素Al,形成共价化合物为AlCl3,属于盐,溶于水完全电离,属于强电解质,B错误;
C.海水中加石灰乳生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,蒸发浓缩后在HCl气流中加热得到无水氯化镁,最后电解熔融氯化镁提取镁,C错误;
D.将SOCl2和AlCl3 6H2O混合加热,由于SOCl2遇水发生反应:SOCl2+H2O=SO2↑+2HCI↑,生成的SO2和HCl气体抑制AlCl3水解,则使SOCl2和AlCl3 6H2O混合可得无水的无水氯化铝,D正确;
故选D。
13.D
【解析】
【分析】
【详解】
根据烷烃的通式CnH2n+2有12n+2n+2=114,解得n=8,此烷烃是C8H18,主链5个碳,剩3个碳排在支链,可以形成一个乙基和一个甲基,也可以形成3个甲基,可以连在同一个碳上,也可以连在不同的碳原子上,用碳架结构表示,当含有一个乙基和一个甲基时有(●表示甲基可能的位置)2种结构,当含有3个甲基时有2种结构和2种结构,共6种结构,故选D。
14.D
【解析】
【分析】
【详解】
A.18 g D2O的物质的量为=0.9mol,1个D2O中含有的质子数与中子数均为10个,所以0.9molD2O中含有的质子数和中子数均为9 NA,故A错误;
B.1个羟基(—OH) 含有9个电子,17 g 羟基(1mol)中含有的电子数为9NA,故B错误;
C.1个丙烷分子(C3H8)中含有10个共价键(8个C-H键,2个C-C键),标准状况下,0.56L丙烷的物质的量为0.025mol,所以0.56L丙烷中含有共价键的数目为0.25NA,故C错误;
D.C2H4和C3H6的最简式都是CH2,14 g C2H4和C3H6的混合物可看做是14gCH2,14gCH2的物质的量为1mol,含有的氢原子总数为2NA,故D正确;
故选D。
15.A
【解析】
【分析】
【详解】
A.F2和C2H6的分子中都含有18个电子,标准状况下,5.6 L F2和C2H6的混合物的物质的量是0.25 mol,则其中含有电子的数目为0.25 mol ×18NA=4.5NA,A正确;
B.H2C2O4与足量酸性KMnO4溶液充分反应后变为CO2气体,1 molH2C2O4充分反应转移2 mol电子,则0.1 mol H2C2O4与足量酸性KMnO4溶液充分反应,转移电子数为0.2NA,B错误;
C.标准状况下三氯甲烷呈液态,不能使用气体摩尔体积进行计算,C错误;
D.在标准状况下2.24 LCl2的物质的量是0.1 mol,0.1 mol Cl2与CH4反应,首先反应产生气体CH3Cl、HCl,反应产生的CH3Cl会进一步与Cl2发生取代反应产生液态CH2Cl2、CHCl3、CCl4,取代反应产生的CH2Cl2、CHCl3、CCl4都呈液态,因此上述反应完全进行后,生成物中气体分子的数目小于0.2NA,D错误;
故合理选项是A。
16.C
【解析】
【分析】
【详解】
A. 1mol甲基碳正离子(CH)所含质子总数为9NA,A错误;
B. 标准状况下CHCl3呈液态,22.4 LCHCl3含有的分子数远大于NA,B错误;
C. 加热条件下,56gFe与足量浓硝酸充分反应生成硝酸铁、二氧化氮和水,转移的电子数为3NA,C正确;
D. SO2和O2生成三氧化硫是可逆反应,反应存在限度,在一定条件下,2molSO2和1molO2充分反应后,容器中的分子总数大于2NA、小于3NA,D错误;
答案选C。
17. 2,2,6-三甲基-4-乙基辛烷 3 CH3CH2CH2CH2CH3 H2C=CH2+Cl2→CH2ClCH2Cl 加成反应 消去反应 CD B 四氯化碳 分馏
【解析】
【详解】
(1)烃 A 的结构简式为,主链为8个碳原子,离支链最近的一端对碳原子编号,2号碳上有两个甲基,6号碳上有一个甲基,4号碳上有一个乙基,用系统命名法命名,烃A的名称为2,2,6-三甲基-4-乙基辛烷;
(2)某烃的分子式为 C5H12,核磁共振氢谱图中显示三个峰,说明分子结构中有三种不同环境的氢原子,则该烃的一氯代物有3种,该烃的结构简式为CH3CH2CH2CH2CH3;
(3)反应①为乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应的方程式为H2C=CH2+Cl2→CH2ClCH2Cl;反应②为1,2-二氯乙烷加热480~530℃生成氯乙烯,发生消去反应;
(4)分子式相同而结构不同的有机物互称为同分异构体,根据结构简式可知,麻黄素的分子式为C10H15ON,选项中A、B、C、D、E的分子式分别为C11H17ON、C9H13ON、C10H15ON、C10H15ON、C9H13ON,则与麻黄素互为同分异构体的是C、D;结构相似,类别相同,在分子组成上相差一个或多个“-CH2-”原子团的有机物互称为同系物,麻黄素结构中含有一个苯环,一个亚氨基、一个醇羟基,
A.中无醇羟基,二者结构不同,与麻黄素不互为同系物,故A不符合题意;
B.中与麻黄素所含官能团相同,分子组成上相差一个“-CH2-”原子团,与麻黄素互为同系物,故B符合题意;
C.含有酚羟基,与麻黄素所含官能团不相同,结构不相似,与麻黄素不互为同系物,故C不符合题意;
D.与麻黄素分子式相同,互为同分异构体,不互为同系物,故D不符合题意;
E.含有酚羟基,与麻黄素所含官能团不相同,结构不相似,与麻黄素不互为同系物,故E不符合题意;
答案选B;
(5)甲烷是正正四面体结构,若分子中的四个H原子全部被Cl原子取代得到CCl4,还是有极性键构成的非极性分子。由于这些多卤代甲烷都是分子晶体构成的物质,沸点不同,因此可采取分馏的方法分离。
18. 提供甲烷分解所需的能量 负极 250℃ 100% (CH3)2C=CH2 D B
【解析】
【分析】
甲烷是共价化合物,其分子内原子都达到了稳定结构,故其电子式为,甲烷燃料电池中,通入甲烷的一极是负极、甲烷失去电子发生氧化反应,电子流出沿着导线流向正极,通入氧气的一极是正极、氧气得到电子发生还原反应,电子流入正极,内电路中,阴离子向负极移动,阳离子向正极移动,据此回答;
(4)从示意图等获取信息找出温度;通过化学方程式回答原子利用率的大小;
(5)按信息找有机物的分子式、碳架,确定其结构简式;
(6)从甲烷和氯气反应的产物有哪些、结合其性质,推出反应现象;从示意图显示的信息判断说法正误,据此回答。
【详解】
(1)甲烷是共价化合物,故电子式为;
(2)甲烷分解需要热量,燃烧可提供部分能量,故答案为:提供甲烷分解所需的能量;
(3)据工作原理如图,通入气体a的一端发生氧化反应,则通入a气体即甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下生成水,正极电极反应式为:;
(4)①由图知,250℃时乙酸反应速率最大、催化效率最高,故选择250℃;
②CH4与CO2可直接转化成乙酸,则化学方程式为:,原子利用率为100%;
(5) (CH3)3C+去掉H+后生成电中性有机分子,则其分子式为C4H8,且碳架没有变化,但形成了1个碳碳双键,故结构简式为:(CH3)2C=CH2;
(6) ①CH4与Cl2在光照条件下可发生反应,在光照下反应一段时间后,因为氯气被消耗了,且有液体生成,所以混合气体的颜色变浅,量筒中液面上升,量筒内壁上出现的油状液滴,故D正确;
②A. Cl·是Cl2在光照下化学键断裂生成的,故该过程表达式正确,A正确;B.因为反应中存在CH3 间的碰撞,故生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,B错误;C.由图知,图示过程放出热量,C正确;D. CH4转化为CH3Cl过程中,有CH3 生成,过渡态中C-H键发生了断裂,D正确;故答案选B。
19. CH4+4Cl2CCl4+4HCl B 左端密封的混合气体,在反应中总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端密封的气体压强小于外界压强 C5H12 3
【解析】
【详解】
I. (1)甲烷与氯气充分反应后,生成四氯化碳和氯化氢,反应的化学方程式为CH4+4Cl2CCl4+4HCl。
(2)经过几个小时的反应后,由于总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端气柱压强变小,在气压作用下,则左端液面上升,右端玻璃管中的页面下降。故答案选B。
(3) U形管右端的玻璃管中水柱变化的原因是因为左端密封的混合气体,在反应中总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端密封的气体压强小于外界压强,故出现左端液面上升,右端玻璃管中液面下降。
Ⅱ. (4)根据烷烃的通式CnH2n+2,分子量是72的烷烃其含有的碳原子数是5,氢原子数是12,则其分子式为C5H12,其同分异构体有3种,分别是正戊烷,异戊烷,新戊烷。
20.(1) CH3 C2H6 2
(2)
(3)
【解析】
(1)
烃B完全燃烧的产物中n(CO2)∶n(H2O)=2∶3,则B的最简式为CH3,烃分子中H原子数一定为偶数,则B的分子式至少为C2H6。由于分子2个C原子最多可结合6个H原子,则分子中的H原子数已经达到饱和,故B是乙烷,分子式是C2H6。其二溴代物结构可能是CH3CHBr2,也可能是CH2Br-CH2Br,故有2中不同结构的二溴代物;
(2)
C为饱和链烃,通常状况下呈气态,其二氯代物有三种,则C中含有的C原子数≤4,甲烷的二氯代物只有1种结构;乙烷的二氯代物有2种不同结构;丙烷的二氯代物有4种不同结构;正丁烷的二氯代物有7种,异丁烷二氯代物有3种,则C为异丁烷,其二氯代物的结构简式为:、、;
(3)
根据上述分析可知B是乙烷,结构简式是CH3-CH3,甲基取代乙烷中的所有氢原子得到的物质A名称是2,2,3,3 四甲基丁烷,则A的结构简式为:。
21.(1) 异丁烷(或2-甲基丙烷) 同分异构体
(2) 6 3
(3) > 6.5
【解析】
(1)
根据有机化合物乙的空间填充模型可知,乙的结构简式为,名称为异丁烷(或2-甲基丙烷);根据有机化合物甲的球棍模型可知,甲的结构简式为CH3—CH2—CH2—CH3,有机化合物甲和乙的分子式相同,均为C4H10,而结构不同,二者互为同分异构体。
(2)
根据甲的碳骨架结构分析,甲的二氯代物有6种。根据CH4分子的空间结构示意图可知,CH4分子中最多有3个原子在同一平面内,相当于CH4分子中的3个H原子被3个—CH3取代,则有机化合物乙分子中最多有3个C原子在同一平面内。
(3)
甲和乙互为同分异构体,甲没有支链,乙有支链,因此沸点甲>乙。甲和乙的分子式均为C4H10,1molC4H10完全燃烧消耗6.5molO2。
一、选择题(共16题)
1.设NA为阿伏加德罗常数的值。下列说法正确的是
A.46g C2H6O完全燃烧,断裂的共价键数为8NA
B.12g金刚石中含有C-C键的个数为NA
C.16g甲烷与足量C12在光照条件下反应,生成四氯甲烷的分子数为NA
D.32g S8()与S6()的混合物中所含共价键数为2NA
2.下列叙述正确的是
A.通式为CnH2n+2的烃不一定是烷烃
B.C2H4和C4H8一定互为同系物
C.燃烧后生成CO2和H2O的有机物一定是烃
D.与球棍模型相比,空间充填模型更能反映出有机物的真实结构
3.下列分子式只表示一种物质的是
A.C4H10 B.C5H12 C.C3H7Cl D.CH2Cl2
4.下列表述正确的是
A.N表示的是质子数为7、核外电子数为8的核素
B.甲烷的分子式和结构简式均为CH4
C.NH和OH-互为等电子体
D.苯的同系物C9H12的键线式可表示为
5.用如下装置在实验室探究和的取代反应(部分夹持装置省略)。下列说法错误的是
A.圆底烧瓶中反应的离子方程式为:
B.实验中可观察到U形管左侧内壁有油状液滴出现
C.向漏斗中滴加紫色石蕊溶液,可验证该取代反应有生成
D.烧杯中溶液可用于吸收残留的
6.下列各组物质的分类正确的是
①混合物:溴水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③SO2、NO2、P2O5均为酸性氧化物,K2O、Na2O2为碱性氧化物
④同位素:1H+、2D2、3T
⑤同素异形体:C60、C70、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C5H10O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物。
A.②⑤⑨ B.①②⑤⑦⑨ C.②⑤⑥⑦⑨ D.全部正确
7.下列选项中那个选项是不正确的
①CH4 ②石墨 ③C3H8 ④氕、氘、氚 ⑤CH3CH2CH2Cl ⑥C60 ⑦CH3CH2CH3 ⑧CH2ClCH2CH3
A.属于同素异形体的是②⑥ B.属于同位素的是④
C.属于烃类物质的是①③⑤ D.属于同种物质的是③⑦、⑤⑧
8.下列化学用语表达不正确的是
①丙烷的球棍模型 ②与C8H6互为同分异构体
③C3H8与C4H10一定互为同系物 ④丙烯的结构简式为CH2CHCH3
A.①④ B.②③ C.②④ D.③④
9.下列关于和这两种物质的叙述正确的是
A.互为同系物 B.均可属醇类 C.均可属酚类 D.均可属羧酸类
10.下列说法不正确的是________
A.所有碳氢化合物中,甲烷中碳的质量分数最低
B.所有烷烃中,甲烷的沸点最低
C.甲烷分子中最多有4个原子共平面
D.甲烷、乙烷和丙烷都能在光照下与氯气发生取代反应
11.下列说法错误的是
A.干冰是二氧化碳固体,干冰晶体中二氧化碳的配位数是12
B.新戊烷[]分子中5个碳原子形成的空间构型是为正四面体形
C.分子中不含环状结构且每个原子均满足8电子稳定结构,分子中键和键的个数比为
D.分子晶体中,共价键的键能越大,熔、沸点越高
12.X、Y、Z和W是四种短周期主族元素,原子序数依次增大,X、Z同主族,Y的单质与冷水不反应,可以在二氧化碳中燃烧,X、Z、W可以构成一种物质M(如图所示),下列说法正确的是
A.利用Y在空气中燃烧可以引发甲烷与氯气的取代反应
B.W和第三周期离子半径最小的元素形成共价化合物,属于弱电解质
C.海水中提取Y生产流程如下:海水Y
D.将M和AlCl3 6H2O混合加热,可得无水氯化铝
13.某烷烃的相对分子质量为114,则该烷烃的同分异构体中,主链有5个碳原子的结构有
A.3种 B.4种 C.5种 D.6种
14.若NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A.18gD2O含有的质子数与中子数均为NA
B.17g羟基(—OH)中含有的电子数为10NA
C.标准状况下,0.56L丙烷中含有共价键的数目为0.2NA
D.14gC2H4和C3H6的混合物中含有的氢原子总数为2NA
15.设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,5.6 L F2和C2H6的混合物中含有电子的数目为4.5NA
B.0.1 mol H2C2O4与足量酸性KMnO4溶液充分反应,转移电子数为0.1NA
C.标准状况下,11.2 L三氯甲烷中含有氯原子的数目为1.5NA
D.标准状况下,CH4与2.24 LCl2恰好完全反应,生成物中气体分子的数目为0.2NA
16.若NA为阿伏伽德罗常数,下列说法正确的是
A.1mol甲基碳正离子(CH)所含质子总数为8NA
B.标准状况下,22.4 LCHCl3含有的分子数为NA
C.加热条件下,56gFe与足量浓硝酸充分反应,转移的电子数为3NA
D.在一定条件下,2molSO2和1molO2充分反应后,容器中的分子总数小于2NA
二、综合题(共5题)
17.完成下列各题:
(1)烃 A 的结构简式为,用系统命名法命名烃A:_________________________________________。
(2)某烃的分子式为 C5H12,核磁共振氢谱图中显示三个峰,则该烃的一氯代物有_______种,该烃的结构简式为 ______________________ 。
(3)聚氯乙烯是生活中常见的塑料。工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式是 ___________________________________________,反应类型为___________________,反应②的反应类型为 ____________________。
(4)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构如下:
下列各物质:
A . B .
C. D .
E.
与麻黄素互为同分异构体的是 ___________ (填字母,下同),互为同系物的是 ______。
(5)多氯代甲烷作为溶剂,其中分子结构为正四面体的是 ____________。工业上分离这些多卤代甲烷的方法是 _________________。
18.CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为________。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_______。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式________(质子交换膜只允许H+通过)。
(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在_____左右。
②CH4与CO2可直接转化成乙酸的原子利用率为_____。
(5)碳正离子(例如:、、(CH3)3C+等)是有机反应中间体,碳正离子是由CH4在“超强酸”中获得一个H+而得到,而失去H2可得。(CH3)3C+去掉H+后生成电中性有机分子,该分子的结构简式为________。
(6)CH4与Cl2在光照条件下可发生反应。
①实验室中用如图所示的装置进行实验。
在光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是______
A.B. C. D.
②CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见图。有关说法不正确的是_____(填序号)
A.Cl·是Cl2在光照下化学键断裂生成的,该过程可表示为:
B.反应过程一定无CH3CH3生成
C.图示过程放出热量
D.CH4转化为CH3Cl,C-H键发生了断裂
19.I.如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间。
(1)假设甲烷与氯气充分反应,且只产生一种有机物,请写出化学方程式___。
(2)经过几个小时的反应后,U形管右端的玻璃管中水柱变化是___。
A.升高B.降低C.不变D.无法确定
(3)试解释U形管右端的玻璃管中水柱变化的原因___。
Ⅱ.(4)相对分子质量为72的烷烃的分子式是___,它可能的结构有___种。
20.有A、B、C三种烃,已知:
①B完全燃烧的产物n(CO2)∶n(H2O)=2∶3;
②C为饱和链烃,通常状况下呈气态,其二氯代物有3种;
③A是B分子中的氢原子全部被甲基取代的产物。
请完成下列问题:
(1)B的最简式为_______,分子式为_______,其二溴代物有_______种。
(2)C的3种二氯代物的结构简式为_______、_______、_______。
(3)A的结构简式为_______。
21.如图所示表示页岩气中某些烃分子的结构模型:
(1)有机化合物乙的名称为_______,有机化合物甲与有机化合物乙互为_______。
(2)有机化合物甲的二氯取代物有_______种;请你根据甲烷分子的空间结构推测,有机化合物乙中最多有_______个C原子在同一平面内。
(3)有机化合物甲和乙的沸点:甲_______(填“>”“=”或“<”)乙,1mol甲和乙的混合气体完全燃烧消耗O2的物质的量为_______mol。
试卷第页,共页
参考答案:
1.A
【解析】
【分析】
【详解】
A.分子式为C2H6O的物质为乙醇 或甲醚,都是1mol含8mol共价键,46g就是1mol,完全燃烧,断裂的共价键数为8NA,故A正确;
B.12g金刚石中含有1molC,金刚石中,每个碳原子与其他4个碳原子形成四个共价键,每个碳原子形成的C-C键的个数 ,所以1molC原子形成的共价键为2mol,含有的共价键数为2NA,故B错误;
C. 16g甲烷与足量C12在光照条件下反应,生成四种有机物,所以生成四氯甲烷的分子数为小于NA,故C错误;
D.假设是32g S8()所含的共价键为,假设是32gS6() 所含共价键数为 ,所以混合物中中所含共价键数为NA,故D错误;
故答案为:A
2.D
【解析】
【分析】
【详解】
A.通式为CnH2n+2的烃一定是烷烃,A错误;
B.C2H4和C4H8的结构不一定相似,二者不一定互为同系物,B错误;
C.燃烧后生成CO2和H2O的有机物不一定是烃,例如乙醇完全燃烧生成CO2和H2O,C错误;
D.空间充填模型表示每个原子的容积和分子实际形状的致密的分子模型,与球棍模型相比,空间充填模型更能反映出有机物的真实结构,D正确;
答案选D。
3.D
【解析】
【详解】
A.分子式是C4H10的物质可以表示CH3CH2CH2CH3、 ,因此C4H10不能只表示一种物质,A不符合题意;
B.分子式是C5H12的物质可以表示CH3CH2CH2CH2CH3、、,因此C5H12不能只表示一种物质,B不符合题意;
C.分子式C3H7Cl表示的物质可以是CH3CH2CH2Cl、CH3CHClCH3,因此C3H7Cl不能只表示一种物质,C不符合题意;
D.分子式CH2Cl2表示甲烷CH4分子中2个H原子被2个Cl原子取代产生的物质,由于甲烷只有一种结构,因此CH2Cl2只表示一种物质,D符合题意;
故合理选项是D。
4.B
【解析】
【分析】
【详解】
A.表示的是质子数为7、核外电子数为7、中子数为8、质量数为15的核素A错误;
B.甲烷的分子式和结构简式均为CH4,B正确;
C.虽然和均为10电子粒子,但两者的原子个数不相等,不互为等电子体,C错误;
D.所表示的芳香烃的分子式为C10H14,D错误。
故选:B。
5.C
【解析】
【分析】
【详解】
A.圆底烧瓶中是MnO2和浓盐酸发生氧化还原反应得到Cl2,反应的离子方程式为:,A正确;
B.CH4和Cl2发生取代反应得到二氯甲烷、三氯甲烷、四氯甲烷都是液体,则可观察到U形管左侧内壁有油状液滴出现,B正确;
C.漏斗中含有Cl2溶于水,反应为Cl2+H2OHCl+HClO,滴加紫色石蕊溶液变红,可能是氯气溶于水造成的,不能验证取代反应有生成,C错误;
D.Cl2可与强碱性溶液反应,则烧杯中溶液可用于吸收残留的,D正确;
故选:C。
6.A
【解析】
【分析】
【详解】
①水银(汞)属于单质,不是混合物,故①错误;
②明矾、冰醋酸、纯碱均为化合物,在水溶液中可发生电离,生成自由移动的阴阳离子,石膏在熔融状态下发生电离,所以上述物质均属于电解质,故②正确;
③NO2不为酸性氧化物,Na2O2不属于碱性氧化物,故③错误;
④D2为单质,不是元素原子,故④错误;
⑤C60、C70、金刚石、石墨,都是由碳元素组成的物理性质不同的单质,互为同素异形体,故⑤正确;
⑥同系物必须是结构相似,分子组成上相差n个CH2的物质,而CH2O2、C2H4O2、C3H6O2、C5H10O2的结构不一定相似,故⑥错误;
⑦乙二酸二乙酯和乙二酸乙二酯分子式不同,不互为同分异构体,故⑦错误;
⑧根据酸分子在水溶液中电离出氢离子的个数将酸分为一元酸、二元酸、多元酸,而不是根据分子中所含氢原子的个数划分的,故⑧错误;
⑨在熔化状态下能导电的化合物为离子化合物,离子化合物在熔化状态下导电,故⑨正确;
综上所述,②⑤⑨符合题意,A项正确;
答案选A。
7.C
【解析】
【分析】
【详解】
A.石墨、C60都是由碳元素组成的单质,石墨、C60属于同素异形体,故A正确;
B.氕、氘、氚是质子数相同、中子数不同的原子,氕、氘、氚属于同位素,故B正确;
C.CH4、C3H8、CH3CH2CH3只含碳、氢两种元素,CH4、C3H8、CH3CH2CH3属于烃类,CH3CH2CH2Cl由碳、氢、氯三种元素组成,CH3CH2CH2Cl不属于烃,故C错误;
D.C3H8的结构简式是CH3CH2CH3,CH3CH2CH2Cl、CH2ClCH2CH3结构相同,③⑦、⑤⑧属于同种物质,故D正确;
选C。
8.C
【解析】
【分析】
【详解】
①是丙烷的球棍模型,①项正确;
②的分子式为C8H6,C8H6的结构不能确定,二者可能是同一物质,不一定是同分异构体,②项错误;
③C3H8与C4H10均为饱和烃,二者结构相似,分子组成上相差一个CH2原子团,二者互为同系物,③项正确;
④丙烯的结构简式为CH2=CHCH3,④项错误;
答案选C。
9.D
【解析】
【分析】
【详解】
的官能团为酚羟基和羧基,而的官能团为醇羟基和羧基,故两者均可属羧酸类,不是同系物关系,故D正确。
故选D。
10.C
【解析】
【详解】
A.所有碳氢化合物中,甲烷分子中H元素的含量最高,则其中碳元素的质量分数最低,A正确;
B.在烷烃中,随着分子中C原子数的增多,物质的相对分子质量逐渐增大,分子间作用力逐渐增强,因此物质的熔沸点逐渐升高,故在所有烷烃中,甲烷的沸点最低,B正确;
C.甲烷分子是正四面体结构,键角是109°28′,物质分子中最多有3个原子共平面,C错误;
D.甲烷、乙烷和丙烷分子中都含有C-H键,在光照下都能与氯气发生取代反应,产生氯代烷烃,D正确;
故合理选项是C。
11.D
【解析】
【详解】
A.顶点和面心的二氧化碳距离最近,干冰中CO2分子的配位数为12,故A正确;
B.新戊烷[]分子中5个碳原子类似甲烷中四个氢原子被四个甲烷取代,因此形成的空间构型是正四面体形,故B正确;
C.二氧化三碳(C3O2)分子中不含环状结构且每个原子均满足8电子稳定结构,其结构式为O=C=C=C=O,单键为σ键,双键含有1个σ键、1个π键,故分子中σ键与π键的个数比为1:1,故C正确;
D.分子晶体中,物质的熔沸点主要是看分子间作用力的大小,与共价键的键能无关,故D错误。
答案选D。
12.D
【解析】
【分析】
Y的单质与冷水不反应,可以在二氧化碳中燃烧可判断Y为Mg,X原子序数小于12,且能形成2个共价键,X为O,X、Z同主族,Z为S,W形成一个共价键且原子序数比硫大的主族短周期只能为氯,所以X、Y、Z、W依次是氧、镁、硫、氯,以此来解析;
【详解】
A.镁燃烧产生耀眼强光,能引发甲烷和氯气反应,但是会爆炸,一般用普通光,所以不用镁燃烧引发,A错误;
B.Cl和第三周期离子半径最小的元素Al,形成共价化合物为AlCl3,属于盐,溶于水完全电离,属于强电解质,B错误;
C.海水中加石灰乳生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁,蒸发浓缩后在HCl气流中加热得到无水氯化镁,最后电解熔融氯化镁提取镁,C错误;
D.将SOCl2和AlCl3 6H2O混合加热,由于SOCl2遇水发生反应:SOCl2+H2O=SO2↑+2HCI↑,生成的SO2和HCl气体抑制AlCl3水解,则使SOCl2和AlCl3 6H2O混合可得无水的无水氯化铝,D正确;
故选D。
13.D
【解析】
【分析】
【详解】
根据烷烃的通式CnH2n+2有12n+2n+2=114,解得n=8,此烷烃是C8H18,主链5个碳,剩3个碳排在支链,可以形成一个乙基和一个甲基,也可以形成3个甲基,可以连在同一个碳上,也可以连在不同的碳原子上,用碳架结构表示,当含有一个乙基和一个甲基时有(●表示甲基可能的位置)2种结构,当含有3个甲基时有2种结构和2种结构,共6种结构,故选D。
14.D
【解析】
【分析】
【详解】
A.18 g D2O的物质的量为=0.9mol,1个D2O中含有的质子数与中子数均为10个,所以0.9molD2O中含有的质子数和中子数均为9 NA,故A错误;
B.1个羟基(—OH) 含有9个电子,17 g 羟基(1mol)中含有的电子数为9NA,故B错误;
C.1个丙烷分子(C3H8)中含有10个共价键(8个C-H键,2个C-C键),标准状况下,0.56L丙烷的物质的量为0.025mol,所以0.56L丙烷中含有共价键的数目为0.25NA,故C错误;
D.C2H4和C3H6的最简式都是CH2,14 g C2H4和C3H6的混合物可看做是14gCH2,14gCH2的物质的量为1mol,含有的氢原子总数为2NA,故D正确;
故选D。
15.A
【解析】
【分析】
【详解】
A.F2和C2H6的分子中都含有18个电子,标准状况下,5.6 L F2和C2H6的混合物的物质的量是0.25 mol,则其中含有电子的数目为0.25 mol ×18NA=4.5NA,A正确;
B.H2C2O4与足量酸性KMnO4溶液充分反应后变为CO2气体,1 molH2C2O4充分反应转移2 mol电子,则0.1 mol H2C2O4与足量酸性KMnO4溶液充分反应,转移电子数为0.2NA,B错误;
C.标准状况下三氯甲烷呈液态,不能使用气体摩尔体积进行计算,C错误;
D.在标准状况下2.24 LCl2的物质的量是0.1 mol,0.1 mol Cl2与CH4反应,首先反应产生气体CH3Cl、HCl,反应产生的CH3Cl会进一步与Cl2发生取代反应产生液态CH2Cl2、CHCl3、CCl4,取代反应产生的CH2Cl2、CHCl3、CCl4都呈液态,因此上述反应完全进行后,生成物中气体分子的数目小于0.2NA,D错误;
故合理选项是A。
16.C
【解析】
【分析】
【详解】
A. 1mol甲基碳正离子(CH)所含质子总数为9NA,A错误;
B. 标准状况下CHCl3呈液态,22.4 LCHCl3含有的分子数远大于NA,B错误;
C. 加热条件下,56gFe与足量浓硝酸充分反应生成硝酸铁、二氧化氮和水,转移的电子数为3NA,C正确;
D. SO2和O2生成三氧化硫是可逆反应,反应存在限度,在一定条件下,2molSO2和1molO2充分反应后,容器中的分子总数大于2NA、小于3NA,D错误;
答案选C。
17. 2,2,6-三甲基-4-乙基辛烷 3 CH3CH2CH2CH2CH3 H2C=CH2+Cl2→CH2ClCH2Cl 加成反应 消去反应 CD B 四氯化碳 分馏
【解析】
【详解】
(1)烃 A 的结构简式为,主链为8个碳原子,离支链最近的一端对碳原子编号,2号碳上有两个甲基,6号碳上有一个甲基,4号碳上有一个乙基,用系统命名法命名,烃A的名称为2,2,6-三甲基-4-乙基辛烷;
(2)某烃的分子式为 C5H12,核磁共振氢谱图中显示三个峰,说明分子结构中有三种不同环境的氢原子,则该烃的一氯代物有3种,该烃的结构简式为CH3CH2CH2CH2CH3;
(3)反应①为乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应的方程式为H2C=CH2+Cl2→CH2ClCH2Cl;反应②为1,2-二氯乙烷加热480~530℃生成氯乙烯,发生消去反应;
(4)分子式相同而结构不同的有机物互称为同分异构体,根据结构简式可知,麻黄素的分子式为C10H15ON,选项中A、B、C、D、E的分子式分别为C11H17ON、C9H13ON、C10H15ON、C10H15ON、C9H13ON,则与麻黄素互为同分异构体的是C、D;结构相似,类别相同,在分子组成上相差一个或多个“-CH2-”原子团的有机物互称为同系物,麻黄素结构中含有一个苯环,一个亚氨基、一个醇羟基,
A.中无醇羟基,二者结构不同,与麻黄素不互为同系物,故A不符合题意;
B.中与麻黄素所含官能团相同,分子组成上相差一个“-CH2-”原子团,与麻黄素互为同系物,故B符合题意;
C.含有酚羟基,与麻黄素所含官能团不相同,结构不相似,与麻黄素不互为同系物,故C不符合题意;
D.与麻黄素分子式相同,互为同分异构体,不互为同系物,故D不符合题意;
E.含有酚羟基,与麻黄素所含官能团不相同,结构不相似,与麻黄素不互为同系物,故E不符合题意;
答案选B;
(5)甲烷是正正四面体结构,若分子中的四个H原子全部被Cl原子取代得到CCl4,还是有极性键构成的非极性分子。由于这些多卤代甲烷都是分子晶体构成的物质,沸点不同,因此可采取分馏的方法分离。
18. 提供甲烷分解所需的能量 负极 250℃ 100% (CH3)2C=CH2 D B
【解析】
【分析】
甲烷是共价化合物,其分子内原子都达到了稳定结构,故其电子式为,甲烷燃料电池中,通入甲烷的一极是负极、甲烷失去电子发生氧化反应,电子流出沿着导线流向正极,通入氧气的一极是正极、氧气得到电子发生还原反应,电子流入正极,内电路中,阴离子向负极移动,阳离子向正极移动,据此回答;
(4)从示意图等获取信息找出温度;通过化学方程式回答原子利用率的大小;
(5)按信息找有机物的分子式、碳架,确定其结构简式;
(6)从甲烷和氯气反应的产物有哪些、结合其性质,推出反应现象;从示意图显示的信息判断说法正误,据此回答。
【详解】
(1)甲烷是共价化合物,故电子式为;
(2)甲烷分解需要热量,燃烧可提供部分能量,故答案为:提供甲烷分解所需的能量;
(3)据工作原理如图,通入气体a的一端发生氧化反应,则通入a气体即甲烷,该极为负极,通入b为氧气,获得电子,酸性条件下生成水,正极电极反应式为:;
(4)①由图知,250℃时乙酸反应速率最大、催化效率最高,故选择250℃;
②CH4与CO2可直接转化成乙酸,则化学方程式为:,原子利用率为100%;
(5) (CH3)3C+去掉H+后生成电中性有机分子,则其分子式为C4H8,且碳架没有变化,但形成了1个碳碳双键,故结构简式为:(CH3)2C=CH2;
(6) ①CH4与Cl2在光照条件下可发生反应,在光照下反应一段时间后,因为氯气被消耗了,且有液体生成,所以混合气体的颜色变浅,量筒中液面上升,量筒内壁上出现的油状液滴,故D正确;
②A. Cl·是Cl2在光照下化学键断裂生成的,故该过程表达式正确,A正确;B.因为反应中存在CH3 间的碰撞,故生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,B错误;C.由图知,图示过程放出热量,C正确;D. CH4转化为CH3Cl过程中,有CH3 生成,过渡态中C-H键发生了断裂,D正确;故答案选B。
19. CH4+4Cl2CCl4+4HCl B 左端密封的混合气体,在反应中总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端密封的气体压强小于外界压强 C5H12 3
【解析】
【详解】
I. (1)甲烷与氯气充分反应后,生成四氯化碳和氯化氢,反应的化学方程式为CH4+4Cl2CCl4+4HCl。
(2)经过几个小时的反应后,由于总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端气柱压强变小,在气压作用下,则左端液面上升,右端玻璃管中的页面下降。故答案选B。
(3) U形管右端的玻璃管中水柱变化的原因是因为左端密封的混合气体,在反应中总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端密封的气体压强小于外界压强,故出现左端液面上升,右端玻璃管中液面下降。
Ⅱ. (4)根据烷烃的通式CnH2n+2,分子量是72的烷烃其含有的碳原子数是5,氢原子数是12,则其分子式为C5H12,其同分异构体有3种,分别是正戊烷,异戊烷,新戊烷。
20.(1) CH3 C2H6 2
(2)
(3)
【解析】
(1)
烃B完全燃烧的产物中n(CO2)∶n(H2O)=2∶3,则B的最简式为CH3,烃分子中H原子数一定为偶数,则B的分子式至少为C2H6。由于分子2个C原子最多可结合6个H原子,则分子中的H原子数已经达到饱和,故B是乙烷,分子式是C2H6。其二溴代物结构可能是CH3CHBr2,也可能是CH2Br-CH2Br,故有2中不同结构的二溴代物;
(2)
C为饱和链烃,通常状况下呈气态,其二氯代物有三种,则C中含有的C原子数≤4,甲烷的二氯代物只有1种结构;乙烷的二氯代物有2种不同结构;丙烷的二氯代物有4种不同结构;正丁烷的二氯代物有7种,异丁烷二氯代物有3种,则C为异丁烷,其二氯代物的结构简式为:、、;
(3)
根据上述分析可知B是乙烷,结构简式是CH3-CH3,甲基取代乙烷中的所有氢原子得到的物质A名称是2,2,3,3 四甲基丁烷,则A的结构简式为:。
21.(1) 异丁烷(或2-甲基丙烷) 同分异构体
(2) 6 3
(3) > 6.5
【解析】
(1)
根据有机化合物乙的空间填充模型可知,乙的结构简式为,名称为异丁烷(或2-甲基丙烷);根据有机化合物甲的球棍模型可知,甲的结构简式为CH3—CH2—CH2—CH3,有机化合物甲和乙的分子式相同,均为C4H10,而结构不同,二者互为同分异构体。
(2)
根据甲的碳骨架结构分析,甲的二氯代物有6种。根据CH4分子的空间结构示意图可知,CH4分子中最多有3个原子在同一平面内,相当于CH4分子中的3个H原子被3个—CH3取代,则有机化合物乙分子中最多有3个C原子在同一平面内。
(3)
甲和乙互为同分异构体,甲没有支链,乙有支链,因此沸点甲>乙。甲和乙的分子式均为C4H10,1molC4H10完全燃烧消耗6.5molO2。
