2.3气体的等压变化和等容变化课件(共23张PPT)
文档属性
| 名称 | 2.3气体的等压变化和等容变化课件(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2022-02-12 11:11:27 | ||
图片预览






文档简介
(共23张PPT)
横县百合完全中学
韦衍虎
18276143537
2.3气体的等压变化和等容变化
实验导入
烧瓶上通过橡胶塞连接一根玻璃管,向玻璃管中注入一段水柱。用手捂住烧瓶,会观察到水柱缓慢向外移动,这说明了什么
实验表明,温度升高时,为了保持气体的压强不变的情况下,气体的体积要随温度的升高而增大。
一、气体的等压变化
一定质量的某种气体,在压强不变时,体积随温度变化的过程叫作气体的等压变化。
0
V
T
实验表明,在V—T图像中,等压线是一条过原点的直线。
体积与温度成正比
一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
式中V1、T1和V2、T2分别表示气体在1(初态)、2(末态)两个不同状态下的体积和温度。
适用条件:压强不太大,温度不太低;气体的质量和压强都不变。
盖—吕萨克定律
V=CT
课堂练习
例1:一容器中装有某种气体,且容器上有一个小口与外界大气相通,原来容器内的温度为27℃,若把它加热到127℃,从容器中溢出的空气质量是原来质量的多少倍呢?
27℃
127℃
分析:图中容器上有一个小口,与外界大气相通,说明容器内外压强始终相同,可以看作是等压变化。
解:
27℃
127℃
初态:
T1=27+273=300K
V1=V
末态:
V2=?
等压变化,根据
代入数据得:
解得:
T2=127+273=400K
所以溢出的部分只占总体及大1/4 那质量就也是1/4。
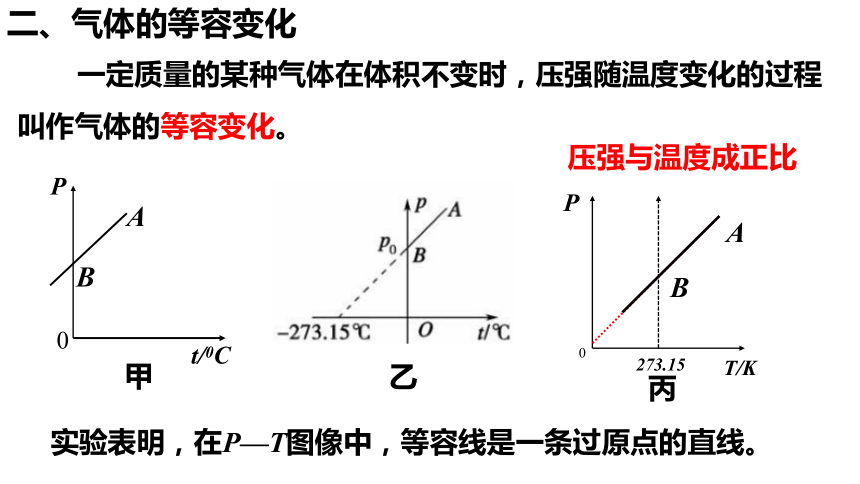
二、气体的等容变化
一定质量的某种气体在体积不变时,压强随温度变化的过程叫作气体的等容变化。
0
P
t/0C
A
B
甲
0
P
T/K
A
B
273.15
丙
压强与温度成正比
乙
实验表明,在P—T图像中,等容线是一条过原点的直线。
查理定律
一定质量的某种气体,在体积不变的情况下,压强P与热力学温度T成正比。
或
P=CT
适用条件:压强不太大,温度不太低;气体的质量和体积都不变。
式中P1、T1和P2、T2分别表示气体在1(初态)、2(末态)两个不同状态下的压强和温度。
例2:某种气体的压强为2×105Pa,体积为1m3,温度为200K。它经过等温过程后体积变为2m3。随后又经过等容过程,温度变为300K,求此时气体的压强?
课堂练习
分析:分别按等温变化和等容变化来求解。
1 2 3
等温变化过程
解:
初态:
P1=2×105Pa
V1=1m3
末态:
P2=?
V2=2m3
根据:p1V1=p2V2
代入数据得:
解得:
P2=105Pa
T1=200K
T2=200K
1 2 3
2×105×1=P2×2
1 2 3
初态:
P2=105Pa
V2=2m3
末态:
P3=?
V3=2m3
根据:
代入数据得:
解得:
P3=1.5×105Pa
T2=200K
T3=300K
等容变化过程
波意耳定律
PV=C
盖—吕萨克定律
P=CT
查理定律
V=CT
等压变化
等容变化
等温变化
适用范围:压强不太大,温度不太低时成立
思考:压强很大或温度很低时会怎么样呢?
三、理想气体
初态:
P1=P0
V1=1m3
末态:
P2=500P0
V2=?
根据:p1V1=p2V2
代入数据得:
T1=273K
T2=273K
令温度不变,压强增大
实际测量的结果:
压强很大、温度很低,结果会偏离的问题,这不就给科学研究带来了麻烦吗?
在任何温度,任何压强下都遵从气体实验定律。
理想气体:
质点:
①理想气体的内能=分子动能之和(只与温度有关)
忽略分子体积
忽略吸引排斥
忽略分子势能
②它是一种理想模型和实际气体近似
③实际气体压强不太大,温度不太低,就可以看做理想气体
四、气体实验定律的微观解释
①波意耳定律:一定质量的某种气体,在温度不变的情况下,压强P与体积V成反比
不变
V↓
分子密集程度↑
P↑
②盖—吕萨克定律:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
V↑
分子密集程度↓
T↑
P↑
压强不变
③查理定律:一定质量的某种气体,在体积不变的情况下,压强P与热力学温度T成正比。
分子密集程度不变
T↑
P↑
理想模型
质点
点电荷
+
-
单摆
弹簧振子
理想变压器
课堂练习
V
p
0
B
A
例3:如图所示,一定质量的理想气体由状态A,沿平行于纵轴的直线变化到状态B,则它的状态变化过程是( )
A.气体温度不变
B.气体的内能增加
C.气体分子的平均速率减小
D.气体分子在单位时间与器壁单位面积碰撞的次数不变
A
分析:等容升压过程,此时压强与热力学温度成正比,所以压强增大,温度应该升高。
课堂小结
一、气体的等压变化
盖—吕萨克定律:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
二、气体的等容变化
查理定律:一定质量的某种气体,在体积不变的情况下,压强P与热力学温度T成正比。
三、理想气体
在任何温度,任何压强下都遵从气体实验定律。
①理想气体的内能=分子动能之和(只与温度有关)
②它是一种理想模型和实际气体近似
③实际气体压强不太大,温度不太低,就可以看做理想气体
四、气体实验定律的微观解释
横县百合完全中学
韦衍虎
18276143537
2.3气体的等压变化和等容变化
实验导入
烧瓶上通过橡胶塞连接一根玻璃管,向玻璃管中注入一段水柱。用手捂住烧瓶,会观察到水柱缓慢向外移动,这说明了什么
实验表明,温度升高时,为了保持气体的压强不变的情况下,气体的体积要随温度的升高而增大。
一、气体的等压变化
一定质量的某种气体,在压强不变时,体积随温度变化的过程叫作气体的等压变化。
0
V
T
实验表明,在V—T图像中,等压线是一条过原点的直线。
体积与温度成正比
一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
式中V1、T1和V2、T2分别表示气体在1(初态)、2(末态)两个不同状态下的体积和温度。
适用条件:压强不太大,温度不太低;气体的质量和压强都不变。
盖—吕萨克定律
V=CT
课堂练习
例1:一容器中装有某种气体,且容器上有一个小口与外界大气相通,原来容器内的温度为27℃,若把它加热到127℃,从容器中溢出的空气质量是原来质量的多少倍呢?
27℃
127℃
分析:图中容器上有一个小口,与外界大气相通,说明容器内外压强始终相同,可以看作是等压变化。
解:
27℃
127℃
初态:
T1=27+273=300K
V1=V
末态:
V2=?
等压变化,根据
代入数据得:
解得:
T2=127+273=400K
所以溢出的部分只占总体及大1/4 那质量就也是1/4。
二、气体的等容变化
一定质量的某种气体在体积不变时,压强随温度变化的过程叫作气体的等容变化。
0
P
t/0C
A
B
甲
0
P
T/K
A
B
273.15
丙
压强与温度成正比
乙
实验表明,在P—T图像中,等容线是一条过原点的直线。
查理定律
一定质量的某种气体,在体积不变的情况下,压强P与热力学温度T成正比。
或
P=CT
适用条件:压强不太大,温度不太低;气体的质量和体积都不变。
式中P1、T1和P2、T2分别表示气体在1(初态)、2(末态)两个不同状态下的压强和温度。
例2:某种气体的压强为2×105Pa,体积为1m3,温度为200K。它经过等温过程后体积变为2m3。随后又经过等容过程,温度变为300K,求此时气体的压强?
课堂练习
分析:分别按等温变化和等容变化来求解。
1 2 3
等温变化过程
解:
初态:
P1=2×105Pa
V1=1m3
末态:
P2=?
V2=2m3
根据:p1V1=p2V2
代入数据得:
解得:
P2=105Pa
T1=200K
T2=200K
1 2 3
2×105×1=P2×2
1 2 3
初态:
P2=105Pa
V2=2m3
末态:
P3=?
V3=2m3
根据:
代入数据得:
解得:
P3=1.5×105Pa
T2=200K
T3=300K
等容变化过程
波意耳定律
PV=C
盖—吕萨克定律
P=CT
查理定律
V=CT
等压变化
等容变化
等温变化
适用范围:压强不太大,温度不太低时成立
思考:压强很大或温度很低时会怎么样呢?
三、理想气体
初态:
P1=P0
V1=1m3
末态:
P2=500P0
V2=?
根据:p1V1=p2V2
代入数据得:
T1=273K
T2=273K
令温度不变,压强增大
实际测量的结果:
压强很大、温度很低,结果会偏离的问题,这不就给科学研究带来了麻烦吗?
在任何温度,任何压强下都遵从气体实验定律。
理想气体:
质点:
①理想气体的内能=分子动能之和(只与温度有关)
忽略分子体积
忽略吸引排斥
忽略分子势能
②它是一种理想模型和实际气体近似
③实际气体压强不太大,温度不太低,就可以看做理想气体
四、气体实验定律的微观解释
①波意耳定律:一定质量的某种气体,在温度不变的情况下,压强P与体积V成反比
不变
V↓
分子密集程度↑
P↑
②盖—吕萨克定律:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
V↑
分子密集程度↓
T↑
P↑
压强不变
③查理定律:一定质量的某种气体,在体积不变的情况下,压强P与热力学温度T成正比。
分子密集程度不变
T↑
P↑
理想模型
质点
点电荷
+
-
单摆
弹簧振子
理想变压器
课堂练习
V
p
0
B
A
例3:如图所示,一定质量的理想气体由状态A,沿平行于纵轴的直线变化到状态B,则它的状态变化过程是( )
A.气体温度不变
B.气体的内能增加
C.气体分子的平均速率减小
D.气体分子在单位时间与器壁单位面积碰撞的次数不变
A
分析:等容升压过程,此时压强与热力学温度成正比,所以压强增大,温度应该升高。
课堂小结
一、气体的等压变化
盖—吕萨克定律:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
二、气体的等容变化
查理定律:一定质量的某种气体,在体积不变的情况下,压强P与热力学温度T成正比。
三、理想气体
在任何温度,任何压强下都遵从气体实验定律。
①理想气体的内能=分子动能之和(只与温度有关)
②它是一种理想模型和实际气体近似
③实际气体压强不太大,温度不太低,就可以看做理想气体
四、气体实验定律的微观解释
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
