第三单元 金属的腐蚀与防护 课件(共20张PPT)
文档属性
| 名称 | 第三单元 金属的腐蚀与防护 课件(共20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 18:00:57 | ||
图片预览






文档简介
(共20张PPT)
金属的腐蚀与防护
联想.质疑
铁生锈的现象随处可见。你有没有想过,为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?
金属阳离子
失e-
氧化反应
化学腐蚀
电化腐蚀
(常见普遍)
金属原子
3.金属腐蚀的本质:
金属的腐蚀
1.金属腐蚀:
金属表面与周围的物质发生化学反应或因电化学作用而遭到破坏,称为金属腐蚀。
2.金属腐蚀的类型:
[实验探究] 将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入下图具支试管中,观察导管中水柱变化,并思考引起变化的原因?
吸氧腐蚀
电化学腐蚀
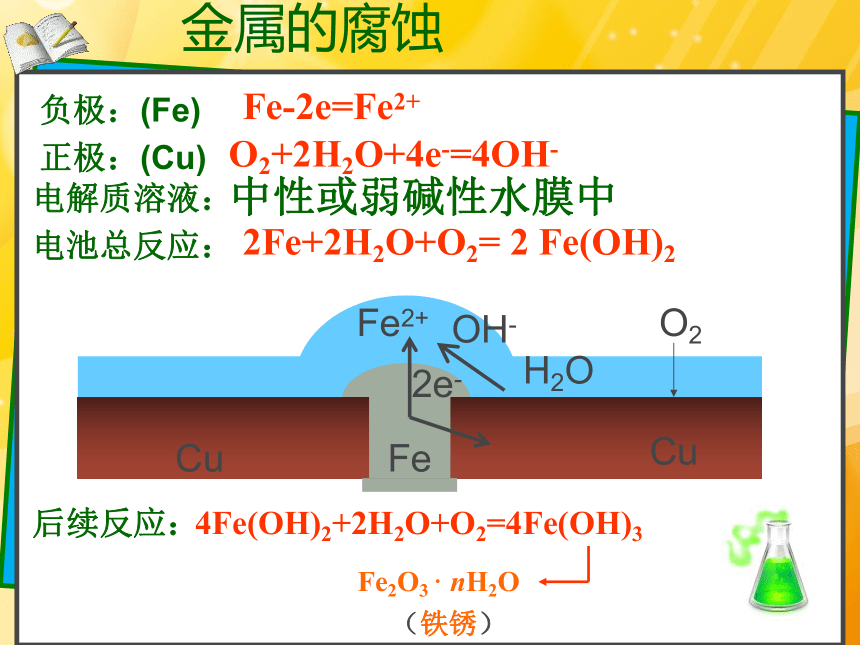
金属的腐蚀
Cu
Cu
Fe
Fe2+
2e-
OH-
H2O
O2
Fe-2e=Fe2+
负极:(Fe)
正极:(Cu)
电解质溶液:
中性或弱碱性水膜中
O2+2H2O+4e-=4OH-
2Fe+2H2O+O2= 2 Fe(OH)2
电池总反应:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
后续反应:
Fe2O3 · nH2O
(铁锈)
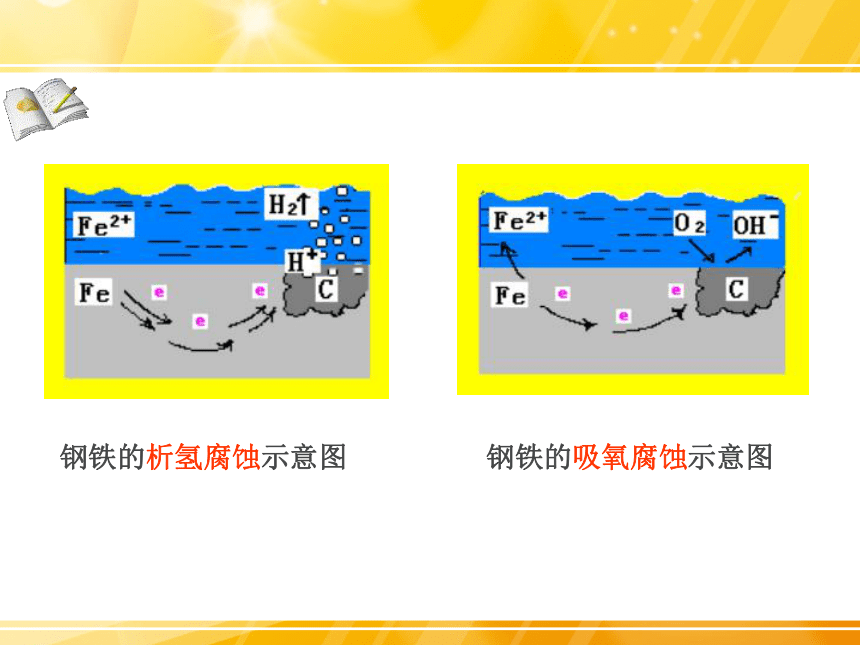
钢铁的析氢腐蚀示意图
钢铁的吸氧腐蚀示意图
钢铁的析氢腐蚀和吸氧腐蚀比较
Fe2O3 · nH2O
(铁锈)
通常两种腐蚀同时存在,但以后者更普遍。
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性。
水膜呈中性或弱酸性弱碱性。
电极反应
负极Fe(- )
Fe-2e=Fe2+
2Fe-4e=2Fe2+
正极C(+)
2H++ 2e- = H2↑
O2+2H2O+4e=4OH-
总反应:
Fe + 2 H+ == Fe2+ H2↑
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
联系
1、如图, 水槽中试管内有一枚铁钉,放置数天观察:
(1)
若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极:
若液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:负极:
正极: 。
(2)
中性或弱酸
吸氧
Fe–2e-=Fe2+
O2+2H2O+4e-=4OH-
酸
析氢
Fe–2e-=Fe2+
2H++2e-=H2↑
课堂检测
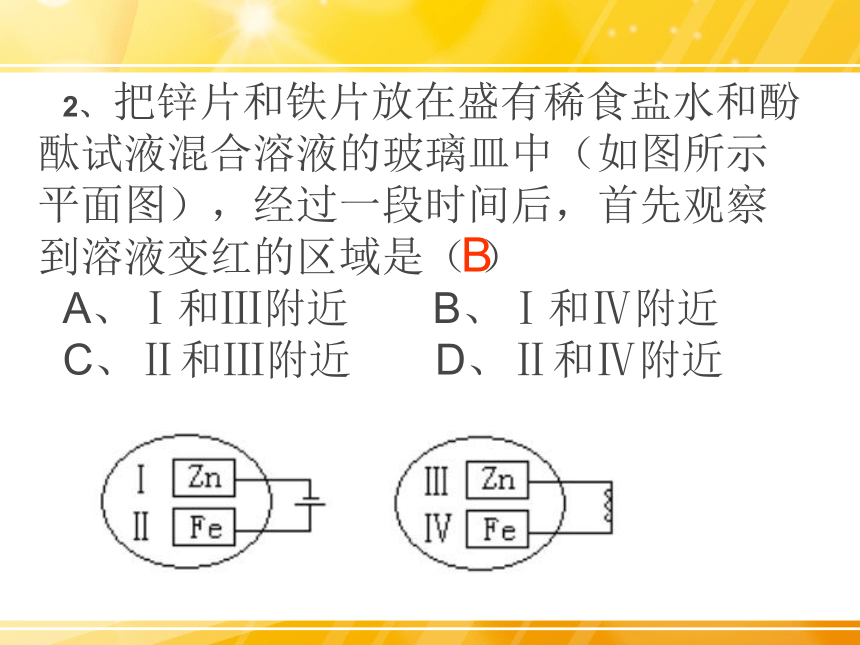
2、 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )
A、Ⅰ和Ⅲ附近 B、Ⅰ和Ⅳ附近
C、Ⅱ和Ⅲ附近 D、Ⅱ和Ⅳ附近
B
金属的防护方法
1、覆盖保护层
思考:根据金属腐蚀的原理,你能想出什么防止金属腐蚀的方法?
衣架和电线的外面包上一层塑料层
某些工具的“机械转动部位”选用油脂来防锈,为什么不能用油漆
生活中常见的一些防护措施
给链条涂上机油, 给支架烤上一层漆,将齿轮镀上一层铬并涂上机油。
健身器材刷油漆以防锈
自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr
原理 :
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。航海船只的船底四周镶嵌锌块,就是利用牺牲阳极保护法来保护船体的。
2、牺牲阳极的阴极保护法
金属的电化学防护
航海的船只的船底四周镶嵌锌块(白色),就是利用牺牲阳极的阴极保护法。
用牺牲锌块的方法来保护船身,锌块必须定期更换
锌块
金属的腐蚀与防护
牺牲阳极的阴极保护法示意图
原理 :
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
3、阴极电保护法
金属的电化学防护
废铁
N
牺牲性阳极的阴极保护法
解析:铁要被保护,可以是作原电池的正极,或者电解池的阴极,故若X为碳棒,开关K应置于N处,Fe作阴极受到保护;若X为锌,开关K置于M处,铁是作正极,锌作负极,称为牺牲阳极的阴极保护法。
课堂检测
4.下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(5) (2) (1) (3) (4)
防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀
结论 判断金属腐蚀快慢的规律
电解池→外界力量→外力无法抗拒
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
1、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀
2、对同一种金属来说,腐蚀的快慢:
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
3、活泼性不同的两金属,活泼性差别越大,活性差的腐蚀的越慢。
4、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
金属阳离子
失e-
(氧化反应)
金属腐蚀的类型
化学腐蚀
电化学腐蚀
一、金属的电化学腐蚀
金属原子
金属腐蚀的本质:
M – ne- → Mn+
— 直接反应
—原电池反应
接触到的气体或液体不同
二、金属防护的几种重要方法:
①在金属表面覆盖保护层。
②改变金属内部的组成结构,制成合金。
③电化学保护法,即将金属作为原电池的正极或电解池的阴极而受到保护。
金属的腐蚀与防护
联想.质疑
铁生锈的现象随处可见。你有没有想过,为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?
金属阳离子
失e-
氧化反应
化学腐蚀
电化腐蚀
(常见普遍)
金属原子
3.金属腐蚀的本质:
金属的腐蚀
1.金属腐蚀:
金属表面与周围的物质发生化学反应或因电化学作用而遭到破坏,称为金属腐蚀。
2.金属腐蚀的类型:
[实验探究] 将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入下图具支试管中,观察导管中水柱变化,并思考引起变化的原因?
吸氧腐蚀
电化学腐蚀
金属的腐蚀
Cu
Cu
Fe
Fe2+
2e-
OH-
H2O
O2
Fe-2e=Fe2+
负极:(Fe)
正极:(Cu)
电解质溶液:
中性或弱碱性水膜中
O2+2H2O+4e-=4OH-
2Fe+2H2O+O2= 2 Fe(OH)2
电池总反应:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
后续反应:
Fe2O3 · nH2O
(铁锈)
钢铁的析氢腐蚀示意图
钢铁的吸氧腐蚀示意图
钢铁的析氢腐蚀和吸氧腐蚀比较
Fe2O3 · nH2O
(铁锈)
通常两种腐蚀同时存在,但以后者更普遍。
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性。
水膜呈中性或弱酸性弱碱性。
电极反应
负极Fe(- )
Fe-2e=Fe2+
2Fe-4e=2Fe2+
正极C(+)
2H++ 2e- = H2↑
O2+2H2O+4e=4OH-
总反应:
Fe + 2 H+ == Fe2+ H2↑
2Fe+2H2O+O2= 2 Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
联系
1、如图, 水槽中试管内有一枚铁钉,放置数天观察:
(1)
若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极:
若液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:负极:
正极: 。
(2)
中性或弱酸
吸氧
Fe–2e-=Fe2+
O2+2H2O+4e-=4OH-
酸
析氢
Fe–2e-=Fe2+
2H++2e-=H2↑
课堂检测
2、 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )
A、Ⅰ和Ⅲ附近 B、Ⅰ和Ⅳ附近
C、Ⅱ和Ⅲ附近 D、Ⅱ和Ⅳ附近
B
金属的防护方法
1、覆盖保护层
思考:根据金属腐蚀的原理,你能想出什么防止金属腐蚀的方法?
衣架和电线的外面包上一层塑料层
某些工具的“机械转动部位”选用油脂来防锈,为什么不能用油漆
生活中常见的一些防护措施
给链条涂上机油, 给支架烤上一层漆,将齿轮镀上一层铬并涂上机油。
健身器材刷油漆以防锈
自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr
原理 :
形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。航海船只的船底四周镶嵌锌块,就是利用牺牲阳极保护法来保护船体的。
2、牺牲阳极的阴极保护法
金属的电化学防护
航海的船只的船底四周镶嵌锌块(白色),就是利用牺牲阳极的阴极保护法。
用牺牲锌块的方法来保护船身,锌块必须定期更换
锌块
金属的腐蚀与防护
牺牲阳极的阴极保护法示意图
原理 :
将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。
3、阴极电保护法
金属的电化学防护
废铁
N
牺牲性阳极的阴极保护法
解析:铁要被保护,可以是作原电池的正极,或者电解池的阴极,故若X为碳棒,开关K应置于N处,Fe作阴极受到保护;若X为锌,开关K置于M处,铁是作正极,锌作负极,称为牺牲阳极的阴极保护法。
课堂检测
4.下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(5) (2) (1) (3) (4)
防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀
结论 判断金属腐蚀快慢的规律
电解池→外界力量→外力无法抗拒
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极
1、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀
2、对同一种金属来说,腐蚀的快慢:
强电解质溶液 > 弱电解质溶液 > 非电解质溶液
3、活泼性不同的两金属,活泼性差别越大,活性差的腐蚀的越慢。
4、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
金属阳离子
失e-
(氧化反应)
金属腐蚀的类型
化学腐蚀
电化学腐蚀
一、金属的电化学腐蚀
金属原子
金属腐蚀的本质:
M – ne- → Mn+
— 直接反应
—原电池反应
接触到的气体或液体不同
二、金属防护的几种重要方法:
①在金属表面覆盖保护层。
②改变金属内部的组成结构,制成合金。
③电化学保护法,即将金属作为原电池的正极或电解池的阴极而受到保护。
