2021-2022学年下学期高二化学苏教版(2019)选择性必修1专题1第一单化学反应中的热效应课件(20张ppt)
文档属性
| 名称 | 2021-2022学年下学期高二化学苏教版(2019)选择性必修1专题1第一单化学反应中的热效应课件(20张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 151.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 21:28:13 | ||
图片预览








文档简介
(共20张PPT)
专题一 化学反应与能量变化
第一单元 化学反应中的热效应
【复习回顾】:
化学反应过程中既有物质变化,同时又总是伴随着能量的变化.在我们以前所学的化学反应中有哪些是放热反应?有哪些是吸热反应?
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应.
吸热反应:
放热反应:
多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳.
1: 焓 焓变 反应热
焓:
焓变:
在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变.
符号:
H
单位:
kJ/mol
规定:
当 H为“-”( H<0)时,为放热反应;
当 H为“+”( H>0)时,为吸热反应.
在化学反应过程中,不仅有物质的变化,同时还伴有能量的变化。
焓是与物质内能有关的物理量。
单位:kJ·mol-1,符号:H。
【知识讲解】:
2:化学反应中能量变化的原因
化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
2:化学反应中能量变化的原因
化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
3: 放热反应与吸热反应
当反应完成时,生成物释放的总能量与反应物吸收的总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“-”或ΔH<0时,为放热反应,反应体系能量降低。
(2)当ΔH为“+”或ΔH>0时,为吸热反应,反应体系能量升高。
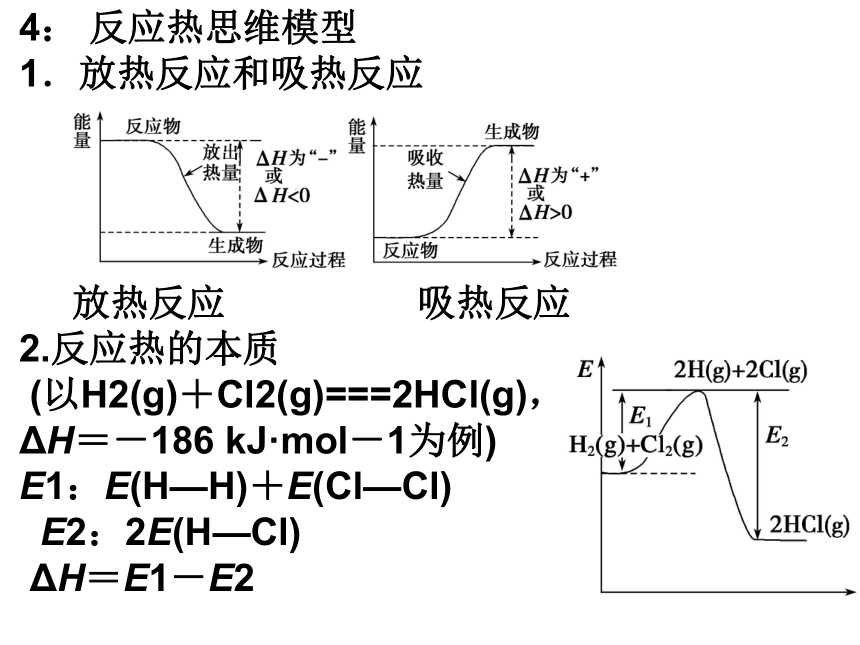
4: 反应热思维模型
1.放热反应和吸热反应
放热反应 吸热反应
2.反应热的本质
(以H2(g)+Cl2(g)===2HCl(g),
ΔH=-186 kJ·mol-1为例)
E1:E(H—H)+E(Cl—Cl)
E2:2E(H—Cl)
ΔH=E1-E2
例题精析
【例题1】已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是( )
A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应
B.水分解产生氢气和氧气时放出能量
C.相同状况下,反应2SO2+O2===2SO3是一个放热反应,则反应2SO3===2SO2+O2是一个吸热反应
D.氯化氢分解成氢气和氯气时放出能量
C
例题精析
【例题2】已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H—N键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。则NN键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1
D.896 kJ·mol-1
B
例题精析
【例题2】已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H—N键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。则NN键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1
D.896 kJ·mol-1
B
1、下列说法不正确的是( )
A.需要加热才能发生的反应不一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定条件下也能发生
课堂运用
B
2、已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1①
C(金刚石)+O2(g)=CO2(g) ΔH=-395.4 kJ·mol-1②
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高
A
A
3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
4 、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0
C
已知1mol甲烷完全燃烧生成液态水,放出的热量是889.5kJ,则需要甲烷的物质的量至少是多少?
已知 水的比热为4.18×103J/(kg ℃) ,1L 20℃的水升高到100℃要吸收多少热量?
Q=mc△t
=1kg× 4.18×103J/(kg ℃) ×80℃
=334400J=334.4kJ
(1)注明反应的温度和压强,因反应的温度和压强不同时,其 △H也不同。但中学所用的△H数据,一般都是在101kPa和25℃时的数据,可不特别注明。
书写热化学方程式注意事项
(2)注明反应物和生成物的聚集状态:气态(g)、液态(l)、固态(s)、溶液(aq)反应条件可以不写。
(3)△H的“+”与“-”一定要注明,“+”代表吸热,“-”代表放热。
(4)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的物质的量,因此,它可以是整数,也可以是简单分数。但分数不等于小数。
(5)相同的反应,化学计量数不同时,△H的数值就不同。
△H的数值一定要与物质前的化学计量数相对应。体现定量计算。
问题探究
1、简易量热计中 ,为何要使两杯口相平?填碎纸条的作用是什么?
减少热量损失
2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
问题探究
减少热量损失
3、实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?
不能。因为铜丝易导热,使热量损失较大
4、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
可以保证盐酸完全反应。使测得的热量更加准确。
问题探究
5、判断下列实验操作对中和反应反应热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
变 小
不 变
注意:测定反应热时一定要采取较好的绝热措施,动作要快,以减小实验误差。
课程小结
1、本节内容从生活出发,培养学生学习兴趣, 由简单到复杂建立学生的自信心和学习兴趣。让学生爱学习,想学习。
2.通过练习,引导学生自己总结各概念应用时的注意事项;通过视频实验来仔细观察,归纳总结出实验过程中的注意事项及误差分析,培养学生谨慎、认真的习惯。
3.本讲内容重在应用,多引导学生进行一定量的练习,以熟悉并掌握相关应用。
专题一 化学反应与能量变化
第一单元 化学反应中的热效应
【复习回顾】:
化学反应过程中既有物质变化,同时又总是伴随着能量的变化.在我们以前所学的化学反应中有哪些是放热反应?有哪些是吸热反应?
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应.
吸热反应:
放热反应:
多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳.
1: 焓 焓变 反应热
焓:
焓变:
在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变.
符号:
H
单位:
kJ/mol
规定:
当 H为“-”( H<0)时,为放热反应;
当 H为“+”( H>0)时,为吸热反应.
在化学反应过程中,不仅有物质的变化,同时还伴有能量的变化。
焓是与物质内能有关的物理量。
单位:kJ·mol-1,符号:H。
【知识讲解】:
2:化学反应中能量变化的原因
化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
2:化学反应中能量变化的原因
化学反应的本质是反应物分子中旧化学键断裂和生成物生成时新化学键形成的过程。
任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量。
ΔH=反应物分子的总键能-生成物分子的总键能。
3: 放热反应与吸热反应
当反应完成时,生成物释放的总能量与反应物吸收的总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“-”或ΔH<0时,为放热反应,反应体系能量降低。
(2)当ΔH为“+”或ΔH>0时,为吸热反应,反应体系能量升高。
4: 反应热思维模型
1.放热反应和吸热反应
放热反应 吸热反应
2.反应热的本质
(以H2(g)+Cl2(g)===2HCl(g),
ΔH=-186 kJ·mol-1为例)
E1:E(H—H)+E(Cl—Cl)
E2:2E(H—Cl)
ΔH=E1-E2
例题精析
【例题1】已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是( )
A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应
B.水分解产生氢气和氧气时放出能量
C.相同状况下,反应2SO2+O2===2SO3是一个放热反应,则反应2SO3===2SO2+O2是一个吸热反应
D.氯化氢分解成氢气和氯气时放出能量
C
例题精析
【例题2】已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H—N键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。则NN键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1
D.896 kJ·mol-1
B
例题精析
【例题2】已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H—N键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。则NN键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1
D.896 kJ·mol-1
B
1、下列说法不正确的是( )
A.需要加热才能发生的反应不一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定条件下也能发生
课堂运用
B
2、已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1①
C(金刚石)+O2(g)=CO2(g) ΔH=-395.4 kJ·mol-1②
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高
A
A
3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
4 、已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = a kJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
C
已知1mol甲烷完全燃烧生成液态水,放出的热量是889.5kJ,则需要甲烷的物质的量至少是多少?
已知 水的比热为4.18×103J/(kg ℃) ,1L 20℃的水升高到100℃要吸收多少热量?
Q=mc△t
=1kg× 4.18×103J/(kg ℃) ×80℃
=334400J=334.4kJ
(1)注明反应的温度和压强,因反应的温度和压强不同时,其 △H也不同。但中学所用的△H数据,一般都是在101kPa和25℃时的数据,可不特别注明。
书写热化学方程式注意事项
(2)注明反应物和生成物的聚集状态:气态(g)、液态(l)、固态(s)、溶液(aq)反应条件可以不写。
(3)△H的“+”与“-”一定要注明,“+”代表吸热,“-”代表放热。
(4)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的物质的量,因此,它可以是整数,也可以是简单分数。但分数不等于小数。
(5)相同的反应,化学计量数不同时,△H的数值就不同。
△H的数值一定要与物质前的化学计量数相对应。体现定量计算。
问题探究
1、简易量热计中 ,为何要使两杯口相平?填碎纸条的作用是什么?
减少热量损失
2、酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
问题探究
减少热量损失
3、实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?为什么?
不能。因为铜丝易导热,使热量损失较大
4、有人建议用50mL0.55mol/LNaOH进行上述实验,测得的中和热数值会更加准确。为什么?
可以保证盐酸完全反应。使测得的热量更加准确。
问题探究
5、判断下列实验操作对中和反应反应热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
变 小
不 变
注意:测定反应热时一定要采取较好的绝热措施,动作要快,以减小实验误差。
课程小结
1、本节内容从生活出发,培养学生学习兴趣, 由简单到复杂建立学生的自信心和学习兴趣。让学生爱学习,想学习。
2.通过练习,引导学生自己总结各概念应用时的注意事项;通过视频实验来仔细观察,归纳总结出实验过程中的注意事项及误差分析,培养学生谨慎、认真的习惯。
3.本讲内容重在应用,多引导学生进行一定量的练习,以熟悉并掌握相关应用。
