影响化学平衡的因素ppt课件
文档属性
| 名称 | 影响化学平衡的因素ppt课件 |  | |
| 格式 | zip | ||
| 文件大小 | 94.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-11-29 07:52:33 | ||
图片预览






文档简介
课件14张PPT。影响化学平衡的条件复习:
1、可逆反应有哪些特点?
2、什么叫“反应向正反应方向进行”?
3、如何理解一个可逆反应中“v正>v逆”?
4、可逆反应进行方向与正逆反应速率有何联系?如何理解?
5、化学平衡状态有哪些特征?【复习】化学平衡状态的定义:
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。化学平衡的特征:
逆
等
动
定
变——可逆反应(或可逆过程)
——V正 =V逆(不同的平衡对应不同的速率)
——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
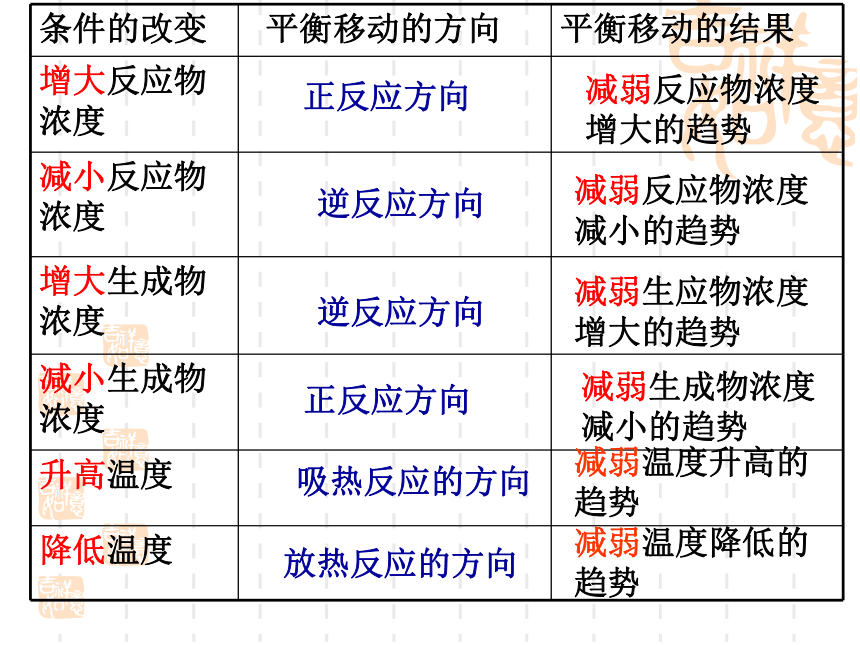
——条件改变,平衡发生改变浓度对化学平衡的影响浓度对平衡的影响实验2-5结论:
增大生成物浓度,反应向逆反应方向进行;减少生成物浓度,反应向正反应方向进行。实验2-6结论:
增大反成物浓度,反应向正反应方向进行;减少反成物浓度,反应向逆反应方向进行。 增大反应物浓度或减小生成物浓度,平衡均向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡 均向逆反应方向移动浓度对化学平衡的影响温度对化学平衡的影响现象及分析:
降温?颜色变浅?
升温?颜色变深?
反应原理:2NO2 N2O4 (正反应为放热反应) 红棕色 无色(g)(g)平衡向放热方向移动平衡向吸热方向移动正反应方向减弱反应物浓度
增大的趋势正反应方向减弱生成物浓度
减小的趋势逆反应方向逆反应方向减弱反应物浓度
减小的趋势减弱生应物浓度
增大的趋势吸热反应的方向减弱温度降低的
趋势放热反应的方向减弱温度升高的
趋势压强对化学平衡的影响2NO2(气) N2O4(气)
(2体积,红棕色)(1体积,无色)[讨论]A:当加压气体体积缩小时,混和气体颜色先变深
是由于① , 后又逐渐变浅是由于 ②
;
B:当减压气体体积增大时,混和气体颜色先变浅
是由于① , 后又逐渐变深是由于 ②
。
NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对
平衡无影响;
②平衡混合物都是固体或液体的,改变压强不能使平
衡移动;
③压强的变化必须改变混合物浓度(即容器体积有变
化)才能使平衡移动。气体体积增大的反应
方向减弱压强降低的
趋势气体体积减小的反应
方向减弱压强增大的
趋势催化剂对化学平衡的影响催化剂对化学平衡无影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。t时间(b)催化剂能缩短平衡到达的时间A练习A、a+bc+d,加压
C、a+bc+d,减压B3、在一定条件下,下列反应达到化学平衡(1)如果升高温度,平衡混合物的颜色_______
(2)如果加入一定量的氢气,平衡________________移动
(3)如果将密闭容器的体积增大,平衡____移动加深向逆反应方向不
1、可逆反应有哪些特点?
2、什么叫“反应向正反应方向进行”?
3、如何理解一个可逆反应中“v正>v逆”?
4、可逆反应进行方向与正逆反应速率有何联系?如何理解?
5、化学平衡状态有哪些特征?【复习】化学平衡状态的定义:
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。化学平衡的特征:
逆
等
动
定
变——可逆反应(或可逆过程)
——V正 =V逆(不同的平衡对应不同的速率)
——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)
——平衡时,各组分浓度、含量保持不变(恒定)
——条件改变,平衡发生改变浓度对化学平衡的影响浓度对平衡的影响实验2-5结论:
增大生成物浓度,反应向逆反应方向进行;减少生成物浓度,反应向正反应方向进行。实验2-6结论:
增大反成物浓度,反应向正反应方向进行;减少反成物浓度,反应向逆反应方向进行。 增大反应物浓度或减小生成物浓度,平衡均向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡 均向逆反应方向移动浓度对化学平衡的影响温度对化学平衡的影响现象及分析:
降温?颜色变浅?
升温?颜色变深?
反应原理:2NO2 N2O4 (正反应为放热反应) 红棕色 无色(g)(g)平衡向放热方向移动平衡向吸热方向移动正反应方向减弱反应物浓度
增大的趋势正反应方向减弱生成物浓度
减小的趋势逆反应方向逆反应方向减弱反应物浓度
减小的趋势减弱生应物浓度
增大的趋势吸热反应的方向减弱温度降低的
趋势放热反应的方向减弱温度升高的
趋势压强对化学平衡的影响2NO2(气) N2O4(气)
(2体积,红棕色)(1体积,无色)[讨论]A:当加压气体体积缩小时,混和气体颜色先变深
是由于① , 后又逐渐变浅是由于 ②
;
B:当减压气体体积增大时,混和气体颜色先变浅
是由于① , 后又逐渐变深是由于 ②
。
NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对
平衡无影响;
②平衡混合物都是固体或液体的,改变压强不能使平
衡移动;
③压强的变化必须改变混合物浓度(即容器体积有变
化)才能使平衡移动。气体体积增大的反应
方向减弱压强降低的
趋势气体体积减小的反应
方向减弱压强增大的
趋势催化剂对化学平衡的影响催化剂对化学平衡无影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。t时间(b)催化剂能缩短平衡到达的时间A练习A、a+b
C、a+b
(2)如果加入一定量的氢气,平衡________________移动
(3)如果将密闭容器的体积增大,平衡____移动加深向逆反应方向不
