2022年人教版九年级化学下册-实验活动5一定溶质质量分数的氧化钠溶液的配制(word版 含解析)
文档属性
| 名称 | 2022年人教版九年级化学下册-实验活动5一定溶质质量分数的氧化钠溶液的配制(word版 含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 629.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-15 00:00:00 | ||
图片预览




文档简介
实验活动5一定溶质质量分数的氧化钠溶液的配制
一、选择题(共16题)
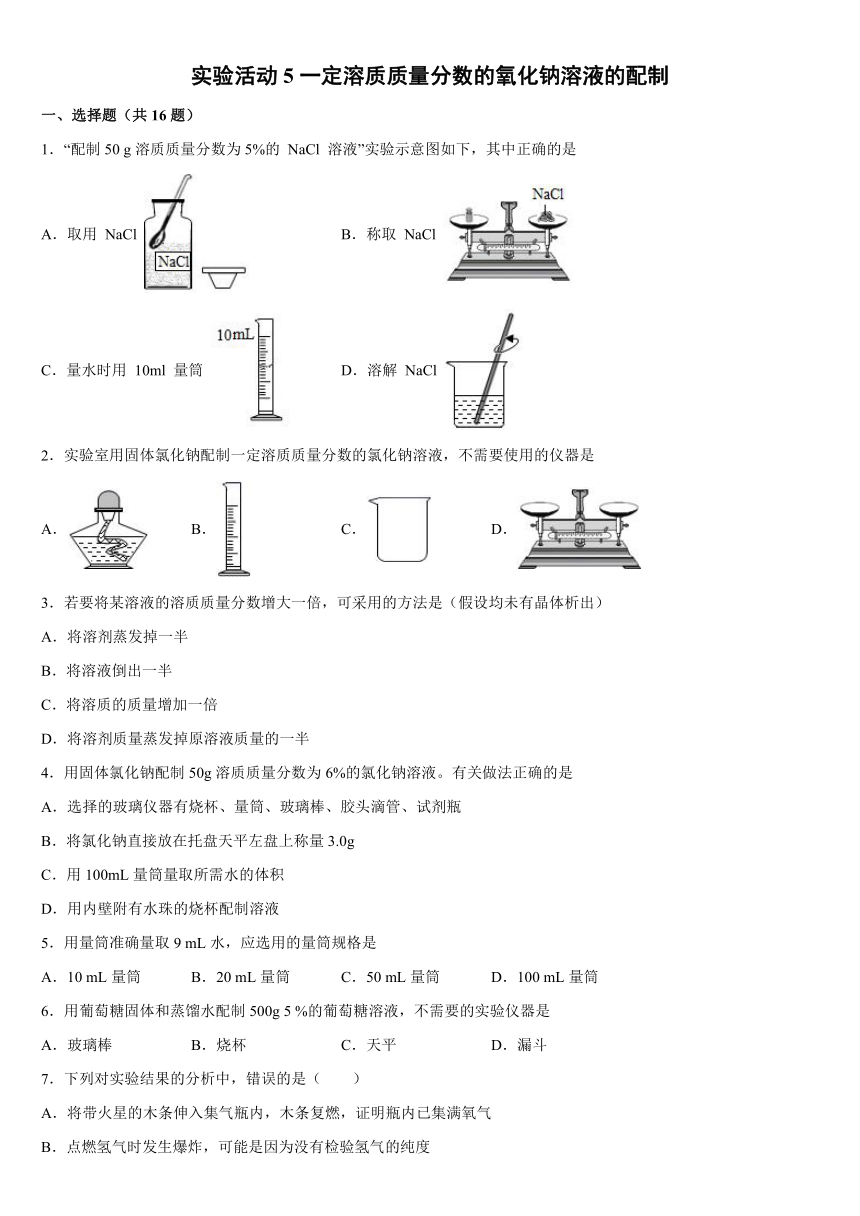
1.“配制50 g溶质质量分数为5%的 NaCl 溶液”实验示意图如下,其中正确的是
A.取用 NaCl B.称取 NaCl
C.量水时用 10ml 量筒 D.溶解 NaCl
2.实验室用固体氯化钠配制一定溶质质量分数的氯化钠溶液,不需要使用的仪器是
A. B. C. D.
3.若要将某溶液的溶质质量分数增大一倍,可采用的方法是(假设均未有晶体析出)
A.将溶剂蒸发掉一半
B.将溶液倒出一半
C.将溶质的质量增加一倍
D.将溶剂质量蒸发掉原溶液质量的一半
4.用固体氯化钠配制50g溶质质量分数为6%的氯化钠溶液。有关做法正确的是
A.选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、试剂瓶
B.将氯化钠直接放在托盘天平左盘上称量3.0g
C.用100mL量筒量取所需水的体积
D.用内壁附有水珠的烧杯配制溶液
5.用量筒准确量取9 mL水,应选用的量筒规格是
A.10 mL量筒 B.20 mL量筒 C.50 mL量筒 D.100 mL量筒
6.用葡萄糖固体和蒸馏水配制500g 5 %的葡萄糖溶液,不需要的实验仪器是
A.玻璃棒 B.烧杯 C.天平 D.漏斗
7.下列对实验结果的分析中,错误的是( )
A.将带火星的木条伸入集气瓶内,木条复燃,证明瓶内已集满氧气
B.点燃氢气时发生爆炸,可能是因为没有检验氢气的纯度
C.配制食盐溶液时,如果量取水时俯视读数,则所得溶液的溶质质量分数偏大
D.在测定空气中氧气的体积分数时,充分反应后,需将装置冷却至室温再读数,否则测量结果偏低
8.在配制75g质量分数为10%的NaCl溶液过程中,某同学进行了下列操作:①用量筒量取水时俯视读数;②把量筒中的水转移到配制溶液的烧杯中时有少许洒出;③在托盘天平的右盘放入砝码并移动游码到合适位置,左盘放入氯化钠后移动游码至天平平衡;④配制溶液的烧杯用少量蒸馏水润洗。以下叙述正确的是( )
A.以上操作除④外都有错误
B.以上操作会使所配溶液的溶质质量分数偏大的只有①
C.以上操作可能使所配溶液的溶质质量分数偏小的只有④
D.以上操作可能会使所配溶液的溶质质量分数偏大或偏小的是③
9.下图是某同学配制溶质质量分数一定的NaCl溶液的操作,其中错误的是。
A. B.
C. D.
10.下列实验不能达到实验目的的是
A.验证CO2不能支持燃烧 B.氧气的验满
C.验证质量守恒定律 D.配制5%的澄清石灰水
11.配制“溶质质量分数为5.8%的氯化钠溶液”实验活动常出现以下错误操作(以下用游码),其中导致所配溶液溶质质量分数偏高的是
A. 氯化钠放在右盘 B. 氯化钠撒出
C. 俯视读数 D. 配好的溶液装瓶时溅出
12.实验室用蔗糖配制50.0g溶质的质量分数为10%的蔗糖溶液,下列说法错误的是
A.用托盘天平称取5.0g蔗糖
B.用量程为10mL的量筒量取所需的水
C.溶解蔗糖时,使用的玻璃仪器有烧杯、玻璃棒
D.将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签
13.下列实验方法不正确的是
A.可以用铁钉和硫酸铜溶液的反应验证质量守恒定律
B.用KClO3制氧气通常加入MnO2作催化剂
C.氢气可以燃烧,在点燃氢气前一定要检验其纯度
D.配制50克5%的NaCl溶液时,把称好的固体倒入到量好水的量筒中进行溶解
14.下列实验方案错误的是
A.探究NH4NO3溶解时的温度变化
B.配制一定溶质质量分数的NaCl溶液
C.验证木炭的还原性
D.探究铁生锈的条件
15.配制10%的氯化钠溶液时,会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量水时俯视读数
B.氯化钠晶体不纯
C.将量筒中的水倒入烧杯时有水洒出
D.转移已配好的溶液时,有少量溶液溅出
16.如图实验能达成实验目的的是
A.比较呼出气体和空气中CO2 的含量
B.配制质量分数10%的NaCl溶液
C.验证质量守恒定律
D.证明蜡烛中含碳、氢元素
二、综合题
17.化学就在我们身边,生活中蕴藏着丰富的化学知识。
(1)净化水的操作有①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是__________(填序号)。净水器中经常使用活性炭,主要利用活性炭的_____________性。
(2)农业上选种需配制一定溶质质量分数的氯化钠溶液,在其他操作无错误的前提下,用量筒取水时俯视读数,则配制的溶液中溶质质量分数会_______________(选填“偏大”、“偏小”或“不变”)。
(3)实验时要处处注意安全。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是________(填序号)。
A降温到着火点以下 B隔绝氧气 C清除可燃物
18.体积比为75%的酒精溶液能有效杀灭新冠肺炎病毒,在配制过程中量取酒精时仰视读数,则得到酒精溶液的浓度___。酒精在空气中燃烧需满足的条件是_____,写出酒精燃烧的化学方程式_______。
19.分类、类比是初中化学常用的学习方法。
(1)在课本中,你学过以下四个实验:
A.探究铁生锈 B.O2 性质实验 C.探究燃烧条件 D.配制质量分数5%的NaCl溶液
其中控制变量的一组是_______(填字母),在D的实验中,配置出的质量分数大于5%,在称量NaCl或使用量筒时,错误的操作可能是_______(答一点)
(2)Mn元素有多种化合价,最高的+7价Mn元素与O元素形成的原子团是-1价的高锰酸根离子,符号为,所以高锰酸钾的化学式为KMnO4;Cl元素也有多种化合价,最高价+7价Cl元素与O元素形成的原子团为-1价的高氯酸根,则高氯酸根的离子符号是_______,高氯酸钾的化学式为_______。
20.氯化钠在工农业上具有广泛的用途。
(1)配制500mL质量分数6%的氯化钠溶液(密度1.04g/cm3),需要氯化钠的质量为_____g。
(2)用托盘天平称量所需氯化钠,托盘天平调节平衡后,接下来的操作顺序是_____。
A 在左盘纸片上加氯化钠,后在右盘纸片上加砝码和移动游码
B 在右盘纸片上加砝码和移动游码,后在左盘纸片上加氯化钠
(3)若用质量分数为6%的氯化钠溶液配制100g质量分数为4%的氯化钠溶液。
①需要6%的氯化钠溶液的质量为_____g(精确到0.1g)。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的玻璃仪器是_____。
21.南通濒江临海,海水可以晒盐,进而可制得NaOH、Na2CO3或NaHCO3等重要的化工原料。
(1)生活中,适量的NaCl摄入可以为人体补充_____元素(选填“常量”或“微量”)。
(2)在农业生产上,常用质量分数为16%的NaCl溶液选种。某同学在实验室将粗盐提纯后,称取所得精盐16g,加入盛有84mL蒸馏水的烧杯里(实验条件下,水的密度为lg mL-1),完全溶解。配制所得的NaCl溶液的浓度低于16%,可能的原因是_____。
(3)现向一定浓度的Na2CO3溶液中通入二氧化碳(已知:),恰好完全反应,得到含4.2g NaHCO3的溶液50g。试计算原Na2CO3溶液的质量______。(请在答题卡上写出完整的计算过程)
22.某实验室欲配制一定溶质质量分数的溶液,现实验室只有含少量的固体药品.
(1)如图所示为和的溶解度曲线,50℃时,将85.5g固体药品溶于100g水中,得到的是______ 的溶液(填“饱和”或“不饱和”).
(2)将提纯的方法是 ______ .
(3)小明用提纯后的固体配制100g溶质质量分数为5%的溶液,其操作步骤是:计算、 _____ 、量取、溶解.经检测,小明所配溶液中溶质质量分数偏小,其原因可能是 ______ .
①固体仍然不纯; ②溶解前,烧杯中有水;
③量取水时,俯视读数; ④装瓶时,有少量溶液洒出.
(4)将所配制的硝酸钾溶液的溶质质量分数变为3%,需加入溶质质量分数为1%的硝酸钾溶液 ______ g。
23.配制溶液是初中学生学习化学需要掌握的一项基本实验操作。
Ⅰ.20℃时将20gM固体加入到100g水中充分搅摔溶解得到溶液A后,按如图1所示进行操作(假设每一步均充分溶解)。
(1)A、B、C溶液中一定属于饱和溶液的是______(填字母序号)。
(2)图2能表示M物质溶解度曲线的是______(填“甲”或“乙”)。
(3)由图2分析,若将t1℃乙的饱和溶液升温到t2℃(水的蒸发忽略不计)时,所得溶液与原溶液对比的叙述中正确的是______(填字母序号)。
A溶质质量增加 B溶剂质量减少 C溶质质量分数减小
Ⅱ.某氯化钠样品中混有少量的碳酸氢钠,其溶解度表和提纯过程如下:
温度/℃ 0 10 20 30 40
溶解度/g NaCl 35.7 35.8 36 36.3 36.6
NaHCO3 6.9 8.2 9.6 1.1 27.0
(1)操作1的方法是______。
(2)表中“36”的含义是______。
(3)“加适量的HCl”发生反应的化学方程式为______。
(4)如果饱和溶液B有mg,则最多可得到固体NaCl______g(只需要列计算式表示)。
(5)现用溶质质量分数为18%的浓盐水来配制溶质质量分数为0.9%的生理盐水1000g,需加水______g。
参考答案
1.D
【详解】
A. 试剂瓶玻璃盖应倒置,不符合题意;
B. 使用托盘天平称量时,应遵循“左物右码”,不符合题意;
C. 需要水的体积的47.5mL,使用量筒称量液体时,应选择大而接近的,故需要50mL的量筒,不符合题意;
D. 溶解氯化钠时,使用玻璃棒搅拌加速溶解,操作正确,符合题意。
故选D。
A 3.D 4.A
5.A
【详解】
为了不造成误差,选取的量筒的量程要比量取的液体体积大,且最接近的,所以量取9mL水,应选用10mL量筒;故选:A。
6.D
【解析】
用葡萄糖固体和蒸馏水配制500g 5 %的葡萄糖溶液,需要玻璃棒搅拌,烧杯盛放,天平称量。不需要的实验仪器是D. 漏斗。
7.A
【详解】
检验氧气是否收集满,只需要将带火星的木条放在集气瓶口即可,A选项错误;可燃性气体点燃前都要检验其纯度,否则容易发生爆炸,B选项正确;量取水的体积俯视读数,会使得量取的水的体积偏小,从而使得配置的溶液的质量分数会偏大,C选项正确;测定氧气含量时,必须等装置冷却后在读数,否则瓶内的压强偏大,使得进入集气瓶中水的体积偏小,D选项正确。故选A。
8.D
【详解】
①用量筒量取水时俯视读数,读数大于所量水的实际体积,使量取水的体积偏小,所配制氯化钠溶液的质量分数偏大;
②把量筒中的水转移到配制溶液的烧杯中时有少许洒出,使溶解时所加水的体积偏小,所配制氯化钠溶液的质量分数偏大;
③在托盘天平的右盘放入砝码并移动游码到合适位置,左盘放入氯化钠后移动游码至天平平衡,会使氯化钠的质量偏大或偏小,所配制氯化钠溶液的质量分数也会随着偏大或偏小;
④配制溶液的烧杯用蒸馏水润洗,水的体积因此而偏大,所配制氯化钠溶液的质量分数偏小;
综合判断,故选D
9.B
【详解】
A、取一定量的NaCl时,瓶塞应倒放,应用药匙取用,图中所示操作正确;B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作错误;C、将水从量筒中倒入烧杯中,量筒尖嘴靠在烧杯上,图中所示操作正确;D、进行溶解操作时,应用玻璃棒搅拌,以加速氯化钠的溶解速率,图中所示操作正确。故选B。
10.D
【详解】
A、二氧化碳的密度大,且不支持燃烧,能使燃着的蜡烛熄灭,通过图示操作能够验证CO2不能支持燃烧,正确;
B、氧气具有助燃性,氧气验满时,将带火星的木条放在集气瓶口,若木条复燃,说明氧气集满,正确;
C、稀硫酸与氢氧化钠反应生成硫酸钠和水,反应前后天平保持平衡,能用来验证质量守恒定律,正确;
D、氧化钙溶于水生成氢氧化钙,氢氧化钙属于微溶物,溶解度小于1 g,不可能制得5%的澄清石灰水,错误。故选D。
11.C
【分析】
造成溶质质量分数偏高的原因有:①溶质偏多②溶剂偏少
【详解】
A.氯化钠放在右盘,砝码和食盐放反了,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,不符合题意;
B.氯化钠洒出,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,不符合题意;
C.如图,假如通过计算需要水21毫升,俯视时眼睛要通过21毫升刻度,但从图看出实际量取的水不到21毫升,水偏少,配得溶液溶质质量分数偏大,符合题意;
D.配好的溶液装瓶时溅出,溶液具有均一性,溶质质量分数不变,不符合题意。
故选C。
12.B
【详解】
A、配制50.0g 质量分数为10%蔗糖溶液,需要蔗糖的质量为50.0g×10%=5.0g 。此项正确。
B、配制50.0g 质量分数为10%蔗糖溶液,需要水的体积为45.0ml;应用50ml的量筒。此项不正确。
C、可在烧杯中溶解蔗糖,用玻璃棒搅拌以加快固体溶解,此项正确。
D、配制后的溶液状态为液态,可装入细口瓶中待用,需要盖好瓶塞并写好标签保存。此项正确。所以应选B项。
13.B 14.B
15.D
【详解】
A. 溶液的特点:均一性、稳定性、属于混合物,植物油不溶于水,二者混合后得到的不是溶液,故A错误;
B. 配制溶液需要的玻璃仪器除烧杯、量筒外还需要玻璃棒,故B错误;
C. 由于溶液是均一的,将10%的,溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,故C错误;
D. 将25gKCl溶液蒸干得到5gKCl固体,所以溶质质量是5g,溶液质量是25g,则原溶液中溶质的质量分数为20%,故D正确。
故选D。
16.B
【详解】
A、二氧化碳与氢氧化钠溶液反应无明显现象,故两集气瓶中现象相同,无法比较二氧化碳的含量,此选项错误;
B、将10g氯化钠完全溶解在90mL(90g)的水中正好可以得到10%氯化钠溶液,此选项正确;
C、盐酸与碳酸钠反应会生成二氧化碳气体,反应装置为开放体系,生成的二氧化碳会逸散到空气中,故无法用此实验来验证质量守恒定律,此选项错误;
D、在蜡烛火焰上方罩一干而冷的烧杯,烧杯内壁有小液滴生成,说明蜡烛中含有氢元素,但无法确定蜡烛中是否含有碳元素,此选项错误。
故选B。
17.② 吸附 偏大 B
【详解】
(1)①过滤只能除去难溶性杂质;②蒸馏可以除去所有杂质;③静置沉淀只能使难溶性杂质沉降,故净化程度最高的是②;
活性炭具有吸附性,可以吸附色素和异味,故净水器中经常使用活性炭,主要利用活性炭的吸附性;
(2)用量筒取水时俯视读数,读取数值大于实际数值,故量取水的体积偏小,溶液质量偏小,则配制的溶液中溶质质量分数会偏大;
(3)用完酒精灯后,必须用灯帽盖灭,这是隔绝氧气,达到熄灭火焰的目的。故选B。
18.偏大 温度达到了酒精的着火点
【详解】
用量筒量取酒精时,仰视液面,读数比实际液体体积小,会造成实际量取的酒精的体积偏大,则使溶质质量分数偏大;酒精在空气中有可燃物、和氧气,燃烧需满足的条件是温度要达到着火点;酒精燃烧生成二氧化碳和水,反应的化学方程式为:。
19.
(1) AC 量取水时,俯视读数
(2)
KClO4
【分析】
(1)
A中左边试管中铁与氧气和水接触,生锈,中间试管中,铁只与水接触,不生锈,右边试管中铁与氧气接触,不生锈,说明铁生锈需要与氧气和水接触,利用了控制变量法;
B中铁在氧气中燃烧实验,没有利用控制变量法;
C中铜片上的白磷燃烧,红磷不燃烧,说明燃烧需要温度达到着火点;铜片上的白磷燃烧,水底的白磷不燃烧,说明燃烧需要氧气,该实验利用了控制变量法;
D、用固体配制质量分数为5%的氯化钠溶液没有利用控制变量法;
故填:AC;
用量筒量取水时,俯视读数,读取数值大于实际数值,会使量取水的体积偏小,溶液质量偏小,溶质质量分数偏大;
(2)
最高价+7价Cl元素与O元素形成的原子团为-1价的高氯酸,设该离子符号为,则(+7)+(-2)x=-1,x=4,故高氯酸根的离子符号是: ;
高氯酸根离子显-1价,钾离子显+1价,故高氯酸钾的化学式为:KClO4。
【详解】
(1)配制500 mL质量分数6%的氯化钠溶液(密度1.04 g/cm3),需要氯化钠的质量为500 mL×1.04 g/cm3×6%=31.2 g。
(2)用托盘天平称量所需氯化钠,托盘天平调节平衡后,接下来的操作顺序是:先在右盘纸片上加砝码和移动游码到所要称量的质量,后在左盘纸片上加氯化钠至平衡,故选B。
(3)①若用质量分数为6%的氯化钠溶液配制100 g质量分数为4%的氯化钠溶液。需要6%的氯化钠溶液的质量为x×6%=100 g×4%,x=66.7 g。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的玻璃仪器是烧杯。
21.常量 精盐中含有杂质、利用量筒读数时仰视读数等 设反应的二氧化碳质量为x
x=1.1g
原Na2CO3溶液的质量是:50g﹣1.1g=48.9g
答:原Na2CO3溶液的质量是48.9g。
【详解】
(1)生活中,适量的NaCl摄入可以为人体补充常量元素,即补充钠元素和氯元素。
故填:常量。
(2)配制所得的NaCl溶液的浓度低于16%,可能的原因是精盐中含有杂质、利用量筒读数时仰视读数等。
故填:精盐中含有杂质、利用量筒读数时仰视读数等。
(3)见答案。
22.饱和 降温结晶 称量 ①② 100
【详解】
(1)50℃时,的溶解度是85.5g,故50℃时,将85.5g固体药品溶于100g水中,得到的是的饱和溶液。
(2)的溶解度随温度变化较大,故采用降温结晶的方法提纯。
(3)配制一定质量分数的溶液步骤:计算、称量、量取、溶解。所配溶液中溶质质量分数偏小,可能是固体的质量偏少,或水的质量偏多,
①固体仍然不纯,固体质量偏少,溶液质量分数偏小;
②溶解前,烧杯中有水,溶剂偏多,溶液质量分数偏小;
③量取水时,俯视读数,溶剂质量偏小,溶液质量分数偏大;
④装瓶时,有少量溶液洒出,不影响质量分数。故填①②。
(4)配制溶液前后溶质质量不变,设需加入溶质质量分数为1%的硝酸钾溶液质量为x, ,x=100g
23.B 甲 C 蒸发结晶 20℃时,氯化钠在100g水中最多可以溶解36g 950
【详解】
Ⅰ.(1)由图可知,B烧杯底部有未溶解的晶体,所以B溶液一定属于饱和溶液。故填:B。
(2)由图可知,B溶液底部有未溶解的晶体,当B溶液由20℃升温到30℃时,烧杯底部未溶解的晶体溶解消失,所以M物质的溶解度随着温度的升高而增大,所以曲线甲可以表示M物质的溶解度。故填:甲。
(3)A. 由图2分析,乙物质的溶解度随温度的升高而减小,若将t1℃乙的饱和溶液升温到t2℃(水的蒸发忽略不计)时,会析出晶体,所以溶质的质量会减少,故A不符合题意;
B. 水的蒸发忽略不计,所以溶剂的质量不变,故B不符合题意;
C. 根据以上分析,因为析出晶体,溶质的质量会减少,所以溶液的质量分数会减小。故C符合题意。
故选C。
Ⅱ.(1)含用少量碳酸氢钠的氯化钠样品中加适量水,会形成氯化钠和碳酸氢钠的混合溶液,再加入适量的稀盐酸至恰好完全反应,碳酸氢钠和稀盐酸反应会生成氯化钠水和二氧化碳,从而得到30摄氏度时饱和的氯化钠溶液,因为氯化钠的溶解度随温度的变化比较小,可以通过蒸发结晶得到氯化钠固体,所以操作1是蒸发结晶。故填:蒸发结晶。
(2)由表中的数据可知,20摄氏度时氯化钠的溶解度为36克,它的含义为:在20摄氏度时,氯化钠在100克水中最多可以溶解36克。故填:20℃时,氯化钠在100g水中最多可以溶解36g。
(3)根据(1)中的分析可知,溶液A是含有碳酸氢钠的氯化钠溶液,加入适量的稀盐酸,碳酸氢钠和稀盐酸恰好发生反应生成氯化钠水和二氧化碳,反应的化学方程式为。故填: 。
(4)30℃时氯化钠的溶解度为36.3g,若30℃的饱和溶液B有mg,最多可得到固体NaCl的质量可根据:溶质的质量分数= 计算,将溶解度带入式子可得,最多可得到固体NaCl的质量=。故填:。
(5)解:设需加水的质量为,根据稀释前后溶质的质量不变可得:
解得:
答:需加水的质量为950g。
一、选择题(共16题)
1.“配制50 g溶质质量分数为5%的 NaCl 溶液”实验示意图如下,其中正确的是
A.取用 NaCl B.称取 NaCl
C.量水时用 10ml 量筒 D.溶解 NaCl
2.实验室用固体氯化钠配制一定溶质质量分数的氯化钠溶液,不需要使用的仪器是
A. B. C. D.
3.若要将某溶液的溶质质量分数增大一倍,可采用的方法是(假设均未有晶体析出)
A.将溶剂蒸发掉一半
B.将溶液倒出一半
C.将溶质的质量增加一倍
D.将溶剂质量蒸发掉原溶液质量的一半
4.用固体氯化钠配制50g溶质质量分数为6%的氯化钠溶液。有关做法正确的是
A.选择的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、试剂瓶
B.将氯化钠直接放在托盘天平左盘上称量3.0g
C.用100mL量筒量取所需水的体积
D.用内壁附有水珠的烧杯配制溶液
5.用量筒准确量取9 mL水,应选用的量筒规格是
A.10 mL量筒 B.20 mL量筒 C.50 mL量筒 D.100 mL量筒
6.用葡萄糖固体和蒸馏水配制500g 5 %的葡萄糖溶液,不需要的实验仪器是
A.玻璃棒 B.烧杯 C.天平 D.漏斗
7.下列对实验结果的分析中,错误的是( )
A.将带火星的木条伸入集气瓶内,木条复燃,证明瓶内已集满氧气
B.点燃氢气时发生爆炸,可能是因为没有检验氢气的纯度
C.配制食盐溶液时,如果量取水时俯视读数,则所得溶液的溶质质量分数偏大
D.在测定空气中氧气的体积分数时,充分反应后,需将装置冷却至室温再读数,否则测量结果偏低
8.在配制75g质量分数为10%的NaCl溶液过程中,某同学进行了下列操作:①用量筒量取水时俯视读数;②把量筒中的水转移到配制溶液的烧杯中时有少许洒出;③在托盘天平的右盘放入砝码并移动游码到合适位置,左盘放入氯化钠后移动游码至天平平衡;④配制溶液的烧杯用少量蒸馏水润洗。以下叙述正确的是( )
A.以上操作除④外都有错误
B.以上操作会使所配溶液的溶质质量分数偏大的只有①
C.以上操作可能使所配溶液的溶质质量分数偏小的只有④
D.以上操作可能会使所配溶液的溶质质量分数偏大或偏小的是③
9.下图是某同学配制溶质质量分数一定的NaCl溶液的操作,其中错误的是。
A. B.
C. D.
10.下列实验不能达到实验目的的是
A.验证CO2不能支持燃烧 B.氧气的验满
C.验证质量守恒定律 D.配制5%的澄清石灰水
11.配制“溶质质量分数为5.8%的氯化钠溶液”实验活动常出现以下错误操作(以下用游码),其中导致所配溶液溶质质量分数偏高的是
A. 氯化钠放在右盘 B. 氯化钠撒出
C. 俯视读数 D. 配好的溶液装瓶时溅出
12.实验室用蔗糖配制50.0g溶质的质量分数为10%的蔗糖溶液,下列说法错误的是
A.用托盘天平称取5.0g蔗糖
B.用量程为10mL的量筒量取所需的水
C.溶解蔗糖时,使用的玻璃仪器有烧杯、玻璃棒
D.将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签
13.下列实验方法不正确的是
A.可以用铁钉和硫酸铜溶液的反应验证质量守恒定律
B.用KClO3制氧气通常加入MnO2作催化剂
C.氢气可以燃烧,在点燃氢气前一定要检验其纯度
D.配制50克5%的NaCl溶液时,把称好的固体倒入到量好水的量筒中进行溶解
14.下列实验方案错误的是
A.探究NH4NO3溶解时的温度变化
B.配制一定溶质质量分数的NaCl溶液
C.验证木炭的还原性
D.探究铁生锈的条件
15.配制10%的氯化钠溶液时,会引起溶液中氯化钠的质量分数偏小的是
A.用量筒量水时俯视读数
B.氯化钠晶体不纯
C.将量筒中的水倒入烧杯时有水洒出
D.转移已配好的溶液时,有少量溶液溅出
16.如图实验能达成实验目的的是
A.比较呼出气体和空气中CO2 的含量
B.配制质量分数10%的NaCl溶液
C.验证质量守恒定律
D.证明蜡烛中含碳、氢元素
二、综合题
17.化学就在我们身边,生活中蕴藏着丰富的化学知识。
(1)净化水的操作有①过滤②蒸馏③静置沉淀等多种,其中净化程度最高的操作是__________(填序号)。净水器中经常使用活性炭,主要利用活性炭的_____________性。
(2)农业上选种需配制一定溶质质量分数的氯化钠溶液,在其他操作无错误的前提下,用量筒取水时俯视读数,则配制的溶液中溶质质量分数会_______________(选填“偏大”、“偏小”或“不变”)。
(3)实验时要处处注意安全。用完酒精灯后,必须用灯帽盖灭,熄灭火焰的主要原理是________(填序号)。
A降温到着火点以下 B隔绝氧气 C清除可燃物
18.体积比为75%的酒精溶液能有效杀灭新冠肺炎病毒,在配制过程中量取酒精时仰视读数,则得到酒精溶液的浓度___。酒精在空气中燃烧需满足的条件是_____,写出酒精燃烧的化学方程式_______。
19.分类、类比是初中化学常用的学习方法。
(1)在课本中,你学过以下四个实验:
A.探究铁生锈 B.O2 性质实验 C.探究燃烧条件 D.配制质量分数5%的NaCl溶液
其中控制变量的一组是_______(填字母),在D的实验中,配置出的质量分数大于5%,在称量NaCl或使用量筒时,错误的操作可能是_______(答一点)
(2)Mn元素有多种化合价,最高的+7价Mn元素与O元素形成的原子团是-1价的高锰酸根离子,符号为,所以高锰酸钾的化学式为KMnO4;Cl元素也有多种化合价,最高价+7价Cl元素与O元素形成的原子团为-1价的高氯酸根,则高氯酸根的离子符号是_______,高氯酸钾的化学式为_______。
20.氯化钠在工农业上具有广泛的用途。
(1)配制500mL质量分数6%的氯化钠溶液(密度1.04g/cm3),需要氯化钠的质量为_____g。
(2)用托盘天平称量所需氯化钠,托盘天平调节平衡后,接下来的操作顺序是_____。
A 在左盘纸片上加氯化钠,后在右盘纸片上加砝码和移动游码
B 在右盘纸片上加砝码和移动游码,后在左盘纸片上加氯化钠
(3)若用质量分数为6%的氯化钠溶液配制100g质量分数为4%的氯化钠溶液。
①需要6%的氯化钠溶液的质量为_____g(精确到0.1g)。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的玻璃仪器是_____。
21.南通濒江临海,海水可以晒盐,进而可制得NaOH、Na2CO3或NaHCO3等重要的化工原料。
(1)生活中,适量的NaCl摄入可以为人体补充_____元素(选填“常量”或“微量”)。
(2)在农业生产上,常用质量分数为16%的NaCl溶液选种。某同学在实验室将粗盐提纯后,称取所得精盐16g,加入盛有84mL蒸馏水的烧杯里(实验条件下,水的密度为lg mL-1),完全溶解。配制所得的NaCl溶液的浓度低于16%,可能的原因是_____。
(3)现向一定浓度的Na2CO3溶液中通入二氧化碳(已知:),恰好完全反应,得到含4.2g NaHCO3的溶液50g。试计算原Na2CO3溶液的质量______。(请在答题卡上写出完整的计算过程)
22.某实验室欲配制一定溶质质量分数的溶液,现实验室只有含少量的固体药品.
(1)如图所示为和的溶解度曲线,50℃时,将85.5g固体药品溶于100g水中,得到的是______ 的溶液(填“饱和”或“不饱和”).
(2)将提纯的方法是 ______ .
(3)小明用提纯后的固体配制100g溶质质量分数为5%的溶液,其操作步骤是:计算、 _____ 、量取、溶解.经检测,小明所配溶液中溶质质量分数偏小,其原因可能是 ______ .
①固体仍然不纯; ②溶解前,烧杯中有水;
③量取水时,俯视读数; ④装瓶时,有少量溶液洒出.
(4)将所配制的硝酸钾溶液的溶质质量分数变为3%,需加入溶质质量分数为1%的硝酸钾溶液 ______ g。
23.配制溶液是初中学生学习化学需要掌握的一项基本实验操作。
Ⅰ.20℃时将20gM固体加入到100g水中充分搅摔溶解得到溶液A后,按如图1所示进行操作(假设每一步均充分溶解)。
(1)A、B、C溶液中一定属于饱和溶液的是______(填字母序号)。
(2)图2能表示M物质溶解度曲线的是______(填“甲”或“乙”)。
(3)由图2分析,若将t1℃乙的饱和溶液升温到t2℃(水的蒸发忽略不计)时,所得溶液与原溶液对比的叙述中正确的是______(填字母序号)。
A溶质质量增加 B溶剂质量减少 C溶质质量分数减小
Ⅱ.某氯化钠样品中混有少量的碳酸氢钠,其溶解度表和提纯过程如下:
温度/℃ 0 10 20 30 40
溶解度/g NaCl 35.7 35.8 36 36.3 36.6
NaHCO3 6.9 8.2 9.6 1.1 27.0
(1)操作1的方法是______。
(2)表中“36”的含义是______。
(3)“加适量的HCl”发生反应的化学方程式为______。
(4)如果饱和溶液B有mg,则最多可得到固体NaCl______g(只需要列计算式表示)。
(5)现用溶质质量分数为18%的浓盐水来配制溶质质量分数为0.9%的生理盐水1000g,需加水______g。
参考答案
1.D
【详解】
A. 试剂瓶玻璃盖应倒置,不符合题意;
B. 使用托盘天平称量时,应遵循“左物右码”,不符合题意;
C. 需要水的体积的47.5mL,使用量筒称量液体时,应选择大而接近的,故需要50mL的量筒,不符合题意;
D. 溶解氯化钠时,使用玻璃棒搅拌加速溶解,操作正确,符合题意。
故选D。
A 3.D 4.A
5.A
【详解】
为了不造成误差,选取的量筒的量程要比量取的液体体积大,且最接近的,所以量取9mL水,应选用10mL量筒;故选:A。
6.D
【解析】
用葡萄糖固体和蒸馏水配制500g 5 %的葡萄糖溶液,需要玻璃棒搅拌,烧杯盛放,天平称量。不需要的实验仪器是D. 漏斗。
7.A
【详解】
检验氧气是否收集满,只需要将带火星的木条放在集气瓶口即可,A选项错误;可燃性气体点燃前都要检验其纯度,否则容易发生爆炸,B选项正确;量取水的体积俯视读数,会使得量取的水的体积偏小,从而使得配置的溶液的质量分数会偏大,C选项正确;测定氧气含量时,必须等装置冷却后在读数,否则瓶内的压强偏大,使得进入集气瓶中水的体积偏小,D选项正确。故选A。
8.D
【详解】
①用量筒量取水时俯视读数,读数大于所量水的实际体积,使量取水的体积偏小,所配制氯化钠溶液的质量分数偏大;
②把量筒中的水转移到配制溶液的烧杯中时有少许洒出,使溶解时所加水的体积偏小,所配制氯化钠溶液的质量分数偏大;
③在托盘天平的右盘放入砝码并移动游码到合适位置,左盘放入氯化钠后移动游码至天平平衡,会使氯化钠的质量偏大或偏小,所配制氯化钠溶液的质量分数也会随着偏大或偏小;
④配制溶液的烧杯用蒸馏水润洗,水的体积因此而偏大,所配制氯化钠溶液的质量分数偏小;
综合判断,故选D
9.B
【详解】
A、取一定量的NaCl时,瓶塞应倒放,应用药匙取用,图中所示操作正确;B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作错误;C、将水从量筒中倒入烧杯中,量筒尖嘴靠在烧杯上,图中所示操作正确;D、进行溶解操作时,应用玻璃棒搅拌,以加速氯化钠的溶解速率,图中所示操作正确。故选B。
10.D
【详解】
A、二氧化碳的密度大,且不支持燃烧,能使燃着的蜡烛熄灭,通过图示操作能够验证CO2不能支持燃烧,正确;
B、氧气具有助燃性,氧气验满时,将带火星的木条放在集气瓶口,若木条复燃,说明氧气集满,正确;
C、稀硫酸与氢氧化钠反应生成硫酸钠和水,反应前后天平保持平衡,能用来验证质量守恒定律,正确;
D、氧化钙溶于水生成氢氧化钙,氢氧化钙属于微溶物,溶解度小于1 g,不可能制得5%的澄清石灰水,错误。故选D。
11.C
【分析】
造成溶质质量分数偏高的原因有:①溶质偏多②溶剂偏少
【详解】
A.氯化钠放在右盘,砝码和食盐放反了,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,不符合题意;
B.氯化钠洒出,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小,不符合题意;
C.如图,假如通过计算需要水21毫升,俯视时眼睛要通过21毫升刻度,但从图看出实际量取的水不到21毫升,水偏少,配得溶液溶质质量分数偏大,符合题意;
D.配好的溶液装瓶时溅出,溶液具有均一性,溶质质量分数不变,不符合题意。
故选C。
12.B
【详解】
A、配制50.0g 质量分数为10%蔗糖溶液,需要蔗糖的质量为50.0g×10%=5.0g 。此项正确。
B、配制50.0g 质量分数为10%蔗糖溶液,需要水的体积为45.0ml;应用50ml的量筒。此项不正确。
C、可在烧杯中溶解蔗糖,用玻璃棒搅拌以加快固体溶解,此项正确。
D、配制后的溶液状态为液态,可装入细口瓶中待用,需要盖好瓶塞并写好标签保存。此项正确。所以应选B项。
13.B 14.B
15.D
【详解】
A. 溶液的特点:均一性、稳定性、属于混合物,植物油不溶于水,二者混合后得到的不是溶液,故A错误;
B. 配制溶液需要的玻璃仪器除烧杯、量筒外还需要玻璃棒,故B错误;
C. 由于溶液是均一的,将10%的,溶液倒出一半,剩余溶液中溶质的质量分数仍为10%,故C错误;
D. 将25gKCl溶液蒸干得到5gKCl固体,所以溶质质量是5g,溶液质量是25g,则原溶液中溶质的质量分数为20%,故D正确。
故选D。
16.B
【详解】
A、二氧化碳与氢氧化钠溶液反应无明显现象,故两集气瓶中现象相同,无法比较二氧化碳的含量,此选项错误;
B、将10g氯化钠完全溶解在90mL(90g)的水中正好可以得到10%氯化钠溶液,此选项正确;
C、盐酸与碳酸钠反应会生成二氧化碳气体,反应装置为开放体系,生成的二氧化碳会逸散到空气中,故无法用此实验来验证质量守恒定律,此选项错误;
D、在蜡烛火焰上方罩一干而冷的烧杯,烧杯内壁有小液滴生成,说明蜡烛中含有氢元素,但无法确定蜡烛中是否含有碳元素,此选项错误。
故选B。
17.② 吸附 偏大 B
【详解】
(1)①过滤只能除去难溶性杂质;②蒸馏可以除去所有杂质;③静置沉淀只能使难溶性杂质沉降,故净化程度最高的是②;
活性炭具有吸附性,可以吸附色素和异味,故净水器中经常使用活性炭,主要利用活性炭的吸附性;
(2)用量筒取水时俯视读数,读取数值大于实际数值,故量取水的体积偏小,溶液质量偏小,则配制的溶液中溶质质量分数会偏大;
(3)用完酒精灯后,必须用灯帽盖灭,这是隔绝氧气,达到熄灭火焰的目的。故选B。
18.偏大 温度达到了酒精的着火点
【详解】
用量筒量取酒精时,仰视液面,读数比实际液体体积小,会造成实际量取的酒精的体积偏大,则使溶质质量分数偏大;酒精在空气中有可燃物、和氧气,燃烧需满足的条件是温度要达到着火点;酒精燃烧生成二氧化碳和水,反应的化学方程式为:。
19.
(1) AC 量取水时,俯视读数
(2)
KClO4
【分析】
(1)
A中左边试管中铁与氧气和水接触,生锈,中间试管中,铁只与水接触,不生锈,右边试管中铁与氧气接触,不生锈,说明铁生锈需要与氧气和水接触,利用了控制变量法;
B中铁在氧气中燃烧实验,没有利用控制变量法;
C中铜片上的白磷燃烧,红磷不燃烧,说明燃烧需要温度达到着火点;铜片上的白磷燃烧,水底的白磷不燃烧,说明燃烧需要氧气,该实验利用了控制变量法;
D、用固体配制质量分数为5%的氯化钠溶液没有利用控制变量法;
故填:AC;
用量筒量取水时,俯视读数,读取数值大于实际数值,会使量取水的体积偏小,溶液质量偏小,溶质质量分数偏大;
(2)
最高价+7价Cl元素与O元素形成的原子团为-1价的高氯酸,设该离子符号为,则(+7)+(-2)x=-1,x=4,故高氯酸根的离子符号是: ;
高氯酸根离子显-1价,钾离子显+1价,故高氯酸钾的化学式为:KClO4。
【详解】
(1)配制500 mL质量分数6%的氯化钠溶液(密度1.04 g/cm3),需要氯化钠的质量为500 mL×1.04 g/cm3×6%=31.2 g。
(2)用托盘天平称量所需氯化钠,托盘天平调节平衡后,接下来的操作顺序是:先在右盘纸片上加砝码和移动游码到所要称量的质量,后在左盘纸片上加氯化钠至平衡,故选B。
(3)①若用质量分数为6%的氯化钠溶液配制100 g质量分数为4%的氯化钠溶液。需要6%的氯化钠溶液的质量为x×6%=100 g×4%,x=66.7 g。
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的玻璃仪器是烧杯。
21.常量 精盐中含有杂质、利用量筒读数时仰视读数等 设反应的二氧化碳质量为x
x=1.1g
原Na2CO3溶液的质量是:50g﹣1.1g=48.9g
答:原Na2CO3溶液的质量是48.9g。
【详解】
(1)生活中,适量的NaCl摄入可以为人体补充常量元素,即补充钠元素和氯元素。
故填:常量。
(2)配制所得的NaCl溶液的浓度低于16%,可能的原因是精盐中含有杂质、利用量筒读数时仰视读数等。
故填:精盐中含有杂质、利用量筒读数时仰视读数等。
(3)见答案。
22.饱和 降温结晶 称量 ①② 100
【详解】
(1)50℃时,的溶解度是85.5g,故50℃时,将85.5g固体药品溶于100g水中,得到的是的饱和溶液。
(2)的溶解度随温度变化较大,故采用降温结晶的方法提纯。
(3)配制一定质量分数的溶液步骤:计算、称量、量取、溶解。所配溶液中溶质质量分数偏小,可能是固体的质量偏少,或水的质量偏多,
①固体仍然不纯,固体质量偏少,溶液质量分数偏小;
②溶解前,烧杯中有水,溶剂偏多,溶液质量分数偏小;
③量取水时,俯视读数,溶剂质量偏小,溶液质量分数偏大;
④装瓶时,有少量溶液洒出,不影响质量分数。故填①②。
(4)配制溶液前后溶质质量不变,设需加入溶质质量分数为1%的硝酸钾溶液质量为x, ,x=100g
23.B 甲 C 蒸发结晶 20℃时,氯化钠在100g水中最多可以溶解36g 950
【详解】
Ⅰ.(1)由图可知,B烧杯底部有未溶解的晶体,所以B溶液一定属于饱和溶液。故填:B。
(2)由图可知,B溶液底部有未溶解的晶体,当B溶液由20℃升温到30℃时,烧杯底部未溶解的晶体溶解消失,所以M物质的溶解度随着温度的升高而增大,所以曲线甲可以表示M物质的溶解度。故填:甲。
(3)A. 由图2分析,乙物质的溶解度随温度的升高而减小,若将t1℃乙的饱和溶液升温到t2℃(水的蒸发忽略不计)时,会析出晶体,所以溶质的质量会减少,故A不符合题意;
B. 水的蒸发忽略不计,所以溶剂的质量不变,故B不符合题意;
C. 根据以上分析,因为析出晶体,溶质的质量会减少,所以溶液的质量分数会减小。故C符合题意。
故选C。
Ⅱ.(1)含用少量碳酸氢钠的氯化钠样品中加适量水,会形成氯化钠和碳酸氢钠的混合溶液,再加入适量的稀盐酸至恰好完全反应,碳酸氢钠和稀盐酸反应会生成氯化钠水和二氧化碳,从而得到30摄氏度时饱和的氯化钠溶液,因为氯化钠的溶解度随温度的变化比较小,可以通过蒸发结晶得到氯化钠固体,所以操作1是蒸发结晶。故填:蒸发结晶。
(2)由表中的数据可知,20摄氏度时氯化钠的溶解度为36克,它的含义为:在20摄氏度时,氯化钠在100克水中最多可以溶解36克。故填:20℃时,氯化钠在100g水中最多可以溶解36g。
(3)根据(1)中的分析可知,溶液A是含有碳酸氢钠的氯化钠溶液,加入适量的稀盐酸,碳酸氢钠和稀盐酸恰好发生反应生成氯化钠水和二氧化碳,反应的化学方程式为。故填: 。
(4)30℃时氯化钠的溶解度为36.3g,若30℃的饱和溶液B有mg,最多可得到固体NaCl的质量可根据:溶质的质量分数= 计算,将溶解度带入式子可得,最多可得到固体NaCl的质量=。故填:。
(5)解:设需加水的质量为,根据稀释前后溶质的质量不变可得:
解得:
答:需加水的质量为950g。
同课章节目录
