7.3溶液浓稀的表示提高练习-2021-2022学年九年级化学科粤版(2012)下册(word版 含解析)
文档属性
| 名称 | 7.3溶液浓稀的表示提高练习-2021-2022学年九年级化学科粤版(2012)下册(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 148.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-15 00:00:00 | ||
图片预览


文档简介
7.3溶液浓稀的表示第七章溶液2021_2022学年九年级化学提高练习(科粤版2012)
一、单选题,共15小题
1.t℃时,A物质的饱和溶液中A的质量分数为15%,B物质的溶解度是25g,C物质的10g饱和溶液蒸干后可得1.5gC。若取等质量的3种物质的饱和溶液,则3种溶液中所含溶质的质量大小顺序是
A.A>C>B B.C>A>B C.B>C=A D.A>B>C
2.向 100g 水中不断加入固体 A 或改变温度,得到相应的溶液①~⑤。下列说法正确的 是( )
资料:A的溶解度
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
A.②中 A 的质量分数最大
B.③⑤中 A 的质量分数相等
C.②④⑤的溶液为饱和溶液
D.①③④⑤中没有固体存在
3.某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则该甲醛溶液中甲醛的质量分数为
A.10% B.12% C.25% D.30%
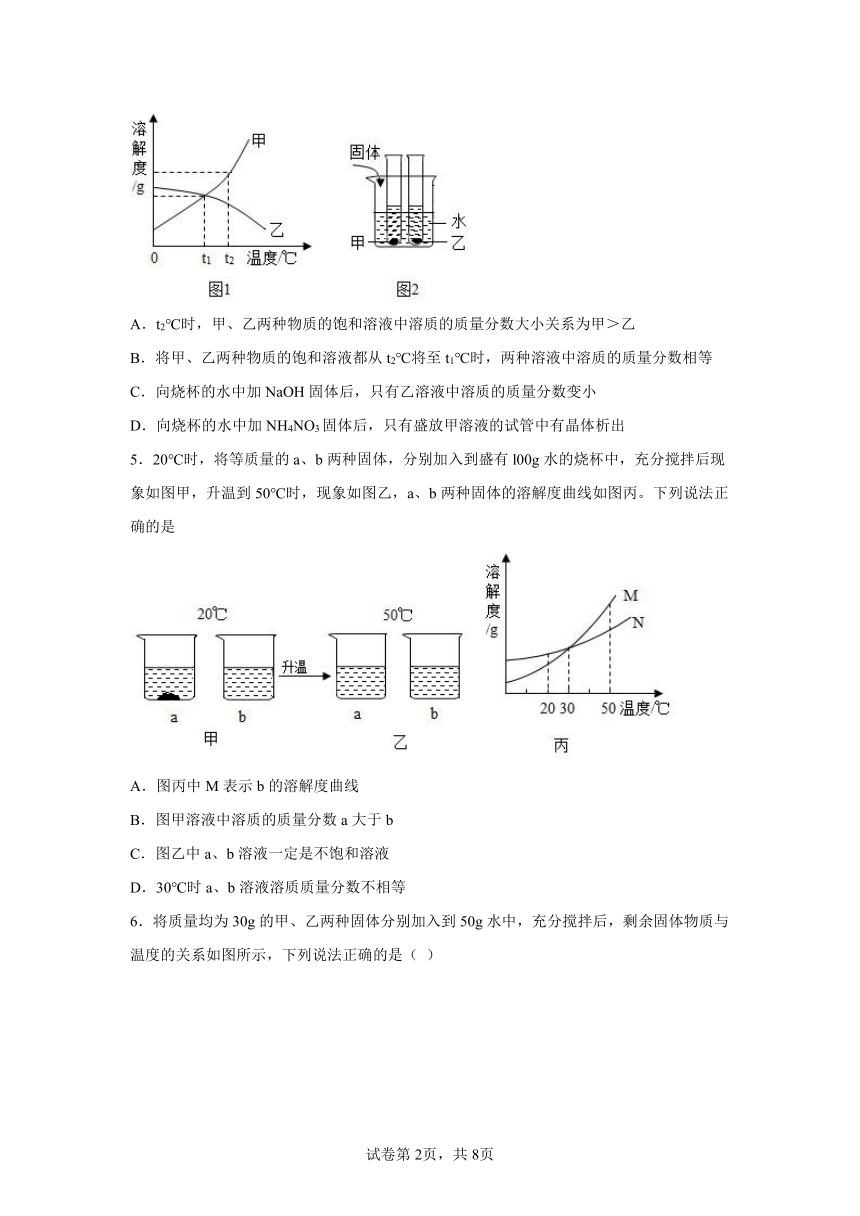
4.图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )
A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为甲>乙
B.将甲、乙两种物质的饱和溶液都从t2℃将至t1℃时,两种溶液中溶质的质量分数相等
C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯的水中加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出
5.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
6.将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( )
A.甲的溶解度随温度升高而增大
B.t1℃时,甲、乙的溶解度均为20g
C.温度由t2℃降低到t1℃时,甲溶液析出5g固体
D.a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b
7.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
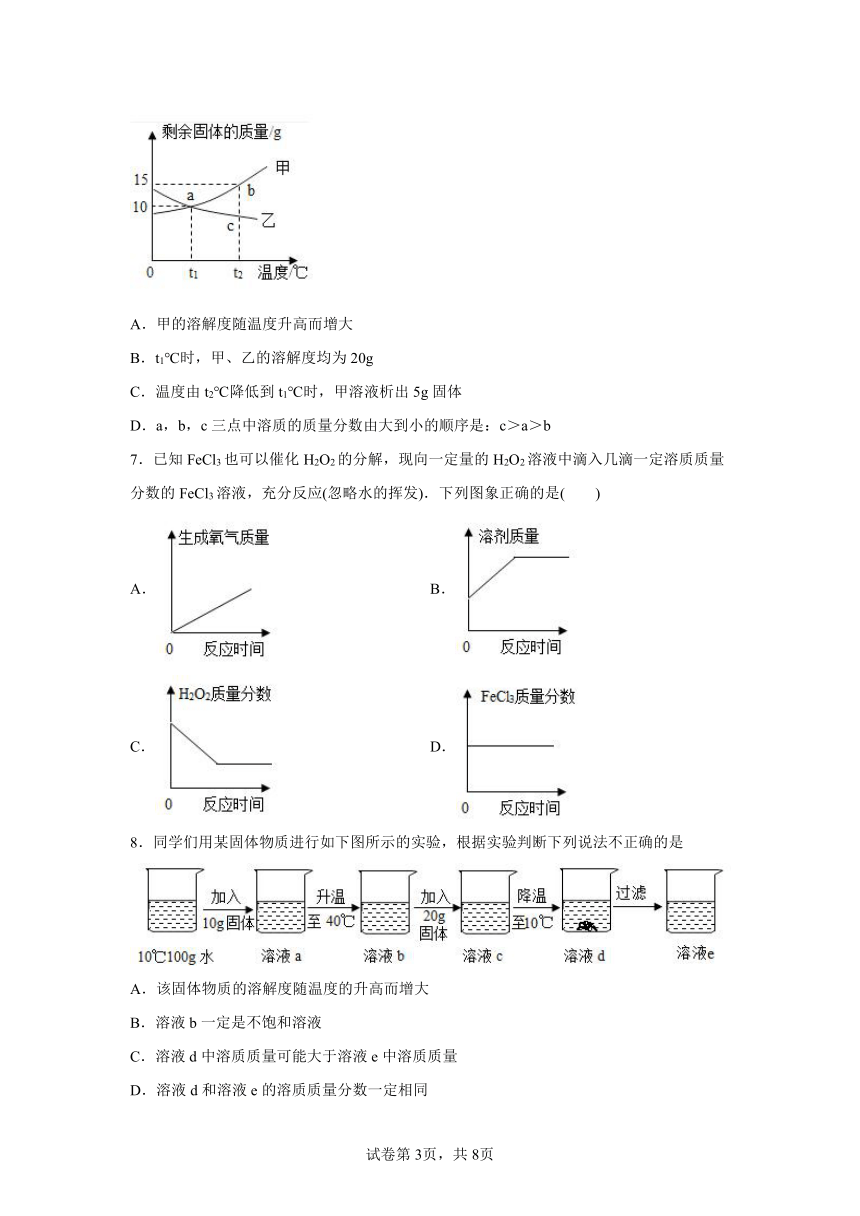
8.同学们用某固体物质进行如下图所示的实验,根据实验判断下列说法不正确的是
A.该固体物质的溶解度随温度的升高而增大
B.溶液b一定是不饱和溶液
C.溶液d中溶质质量可能大于溶液e中溶质质量
D.溶液d和溶液e的溶质质量分数一定相同
9.氯化铵在部分温度下的溶解度见下表,下列说法正确的是
温度/℃ 20 40 60 80
溶解度/g 40 50 58 68
A.20 ℃时,氯化铵饱和溶液中氯化铵的质量分数是25%
B.20 ℃时,70 g氯化铵的饱和溶液升温至40 ℃后得到的是不饱和溶液
C.40 ℃时,75 g氯化铵的饱和溶液加入25 g水后氯化铵的质量分数为30%
D.80 ℃时,84 g氯化铵饱和溶液降温至60 ℃时有10 g氯化铵析出
10.酒精(C2H5OH)的某种水溶液,溶质和溶剂中氢原子个数相等,则该溶液中溶质的质量分数为( )
A.23% B.46% C.55% D.72%
11.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.下列说法正确是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z
12.40℃时,烧杯中盛有100g 硝酸钾的饱和溶液,恒温下蒸发部分溶剂,然后 再将溶液逐渐升温到60℃.能表示此过程溶质质量分数a%与时间t关系的示意图的是
A. B.
C. D.
13.将50g98%的浓硫酸配制成9.8%的稀硫酸,需要水的质量为
A.250g B.350g C.450g D.500g
14.医院常用溶质质量分数为5%的双氧水溶液清洗伤口,若要配制5%的双氧水溶液1200g,需要30%的双氧水溶液的质量为
A.30g B.100g C.200g D.400g
15.本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是
A.R物质是氯化铵
B.溶液的溶质质量分数是烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
二、填空题,共6小题
16.水是生命之源,也是人类最宝贵的资源.用你学过的化学知识回答下列问题:
(1)某同学在完成电解水实验时,发现正极产生了10mL气体,则负极产生的气体体积是_____.
(2)20℃时,等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙物质的溶解度曲线如图3.
①图3中,表示甲的溶解度曲线是_____(填“M”或“N”);
②50℃时,20克乙物质中加入50g水后所得溶液的溶质的质量分数是_____;(结果保留到0.1%)
③根据图中信息下列说法正确的是_____.(填字母序号)
A 图2中乙溶液一定不饱和
B 图2中两溶液中溶质质量分数一定相等
C 图2中的甲乙溶液降温至30℃时其溶质质量分数一定相等
D 图2中乙溶液降温至30℃无晶体析出.
17.水和溶液在生命活动和生产、生活中起着十分重要的作用.
(1)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种.现将100g20%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为_______g.
(2)根据下表回答问题.
温度/℃ 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.5 37.3 38.4 39.8
NH4Cl 29.4 37.2 45.8 55.2 65.6 77.3
分别向两个盛有50gNaCl和NH4Cl固体的烧杯中,各加入100g60℃的水,充分溶解后,饱和溶液是____溶液.
(3)目前市场上销售的汽水饮料大多数是碳酸饮料,其中溶有二氧化碳气体.打 开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与____有关. 喝了汽水后,常常会打嗝,这说明气体的溶解度还与____有关.
18.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
(1)小明配制了5%的双氧水600g,则600g溶液中溶质为____克,溶剂为_____克.
(2)小明用13%的双氧水溶液配制上述溶液,量水时仰视了刻度,则所配制的溶液中溶质的质量分数偏____.
19.下图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)t2℃时,a、b、c三种物质的饱和溶液溶质的质量分数由大到小的顺序是_____________(填序号,下同)。
(2)t1℃时,将100ga物质加入到100g水中并充分搅拌,所得溶液的质量为__________g,该溶液溶质的质量分数为____________________(计算结果精确到0.1%)。
(3)t2℃时,将a、b、c三种物质的饱和溶液降低温度到t1℃,这三种溶液中溶质质量分数的大小关系是________________。
(4)t2℃时,将等质量的a、b、c三种物质的饱和溶液降低温度到t1℃,这三种溶液中析出晶体的质量大小关系是_______________。
20.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,仍有4g氯化钠固体未溶解。请填写下列空白:
(1)所得溶液是20℃时氯化钠的________溶液(填“饱和”或“不饱和”);该溶液中溶质的质量分数为________(列出算式并求结果)。
(2)已知20℃时KCl的溶解度为34g,40℃时为40g。某实验小组做了如下实验。
①B所得溶液中溶质与溶剂的质量比为________;
②A~E所得溶液中,没有固体剩余的饱和溶液是________(填序号,下同),溶质的质量分数相等的是________。
21.A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题。
(1)t2℃时,三种物质中溶解度最大的是_________;
(2)t1℃时,在盛有50克水的烧杯中,加入40克B物质,充分溶解后,得到溶液的质量为_____g;
(3)t1℃时,C的饱和溶液中溶质质量分数为_________;
(4)将t2℃的A、B、C三种饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由大到小的顺序是_____。
(5)若要将t1℃时125克C的饱和溶液的溶质质量分数变为原来的1/2,应加______克水。
三、简答题,共2小题
22.有①Cu﹣Zn ②Cu﹣Ag 两种貌似黄金的合金,它们都有其特殊的用途,但一些骗子常用它们做成饰品冒充真黄金欺骗消费者.对此,化学科学有责任加以揭露.
(1)现有上述两种合金制成的假黄金饰品各一件,小明同学只用稀盐酸和必要的实验仪器就鉴别出其中一种饰品是假黄金,它是合金 (填写代号);若要证明另一种饰品也是假黄金,可选用一种盐溶液来验证,这种盐可以是 (写一种盐的名称或化学式);
(2)取与上述用稀盐酸鉴别出的同种合金10g,放入烧杯中,再向其中加入93.7g某稀盐酸恰好完全反应后,测得烧杯内剩余物质的质量共为103.5g.
①上述过程中变化的质量10g,+93.7g﹣103.5g=0.2g是 (填物质的名称或化学式)的质量;
②10g,该合金中铜的质量是多少?已知反应后的溶液中溶质全部溶解,求该溶液中溶质的质量分数是多少?
试卷第页,共页
试卷第1页,共3页
参考答案:
1.C
【详解】
B物质的溶解度是25g,则B物质的溶质质量分数为:25/125×100%=20%,C物质的溶质质量分数为:1.5/10×100%=15%,取等质量的3种物质的饱和溶液,则B含有的溶质最多,A和C一样多.
故选C.
2.D
【详解】
A、根据资料,固体 A的溶解度随温度升高而增大。20℃时溶解度是37.2克,所以25℃时37.2克物质完全溶解,溶液①中的溶质质量为37.2克,再加入4.2g固体 A后,固体 A质量为41.4g,但固体在30℃时溶解度是41.4克,所以25℃时物质不能完全溶解,而60℃时溶解度是55.2克,在60℃时固体 A能完全溶解,所以溶液②的质量分数小于溶液③,且溶液④中溶质更多,溶质质量分数更大,选项A不正确;
B、溶液③中溶质质量为41.4克,溶液⑤中溶质质量为50.4克,而两溶液中溶质都是100g,因此两溶液的溶质质量分数不相等,选项B不正确;
C、60℃时固体 A的溶解度是55.2g,而溶液④中,溶质质量为50.4克,故溶液④为不饱和溶液,溶液②和溶液⑤为饱和溶液,选项C不正确;
D、20℃时溶解度是37.2克,所以25℃时物质完全溶解,溶液①中无固体存在,60℃时溶解度是55.2克,37.2克+9克+4.2克=50.4克,所以③④中溶质完全溶解,降温到50℃时溶解度是50.4克,恰好完全溶解,溶液⑤中也无固体存在,选项D正确。故选D。
3.C
【分析】
根据题意,某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,结合甲醛分子中氢原子和氧原子的个数比为2:1,水分子中氢原子和氧原子的个数比为2:1,可计算出甲醛的水溶液中氢元素和氧元素的质量比,进而可计算出氧元素的质量分数、碳元素的质量分数,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【详解】
甲醛溶液 HCHO中氢氧质量比为2:16=1:8,而水中氢氧质量比也是1:8,所以当氢元素为10%时,氧元素的质量为80%,则碳的质量分数为1-10%-80%=10%.则甲醛的质量分数为,故选C。
4.B
【详解】
A、图2中两试管底部溶液中都有固体溶质未溶解,因此试管中的溶液均为t2℃时的饱和溶液,图1显示,t2℃时甲的溶解度大于乙的溶解度,而饱和溶液中溶质的质量分数= ,因此两物质的饱和溶液溶解度大的其饱和溶液的溶质质量分数大,故甲的溶质质量分数大于乙的溶质质量分数,选项A正确;
B、甲的溶解度随温度的降低而减小,乙的溶解度随温度的降低而增大,将甲、乙两种物质的饱和溶液都从t2℃将降温至t1℃时,甲析出晶体,乙的溶解度变大则继续溶解试管内的固体,但溶解固体后是否饱和无法确定,若恰好饱和,则二者的溶质质量分数相等,若溶解后不饱和,则降温后甲的溶质质量分数大于乙的溶质质量分数,故降温后二者的溶质质量分数不一定相等,选项B错误;
C、氢氧化钠固体溶于水放出大量的热使溶液温度升高,甲物质逐步溶解,溶质的质量分数变大,乙的溶解度减小,析出晶体,溶质质量减小,溶剂不变,所以溶质的质量分数减小,因此只有乙溶液中溶质的质量分数变小,选项C正确;
D、NH4NO3固体溶于水吸收热量使溶液温度降低,甲的溶解度随温度的降低而减小,析出晶体,乙的溶解度随温度的降低而增大,变为不饱和溶液,不会析出晶体,因此只有盛放甲溶液的试管中有晶体析出,选项D正确。故选B。
5.C
【详解】
A、由甲图可知,20℃时a的溶解度小于b的溶解度,故M表示的是a的溶解度曲线,N表示的是b的溶解度曲线,选项A错误;
B、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,b完全溶解,说明此时b的溶质质量分数大于a的溶质质量分数,选项B错误;
C、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,那么得到的是该温度下的饱和溶液;b中完全溶解,那么可能是饱和溶液,也可能是不饱和溶液;升温到50℃时,a和b中均没有固体剩余,ab的溶解度均大于20℃时b的溶解度,所以ab一定是不饱和溶液,选项C正确;
D、30℃时a、b的溶解度相等,那么等质量的a、b两种固体,分别加入到盛有l00g水中所得溶液的溶质质量分数相等,选项D错误。故选C。
6.D
【详解】
A、纵坐标是剩余固体质量,温度越高,剩余固体越多,表明溶解度是随温度升高而减小的,选项A错误;
B、t1℃时,剩余固体都是10g,说明溶解了20g,因为水的质量是50g,所以甲、乙的溶解度均为40g,选项B错误;
C、温度由t2℃降低到t1℃时,固体减少5g,应该是溶解了5g,选项C错误;
D、c中剩余固体最少,a中次之,b中剩余固体最多,所以a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b,选项D正确。故选D。
7.B
【详解】
A、向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,过氧化氢分解为氧气和水,完全反应后,氧气质量不再变化,错误;
B、过氧化氢分解为氧气和水,溶剂质量增加,完全反应后,溶剂质量不再变化,正确;
C、过氧化氢分解为氧气和水,过氧化氢的质量分数减小,完全反应后,过氧化氢的质量为0,质量分数为0,错误;
D、FeCl3是催化剂,反应前后质量不变,过氧化氢分解为氧气和水,溶液质量减小,FeCl3的质量分数变大,错误。故选B。
8.C
【详解】
A.从溶液c和溶液d可以看出,降低温度则溶液中会析出晶体,说明该固体物质的溶解度随温度的升高而增大,故正确;
B. 溶液b中加入20g固体得到的溶液c中没有未溶解的固体,说明加入的物质全部溶解,故溶液b一定是不饱和溶液,故正确;
C. 溶液d变成溶液e的过程中没有发生化学变化,说明溶液d中的固体除掉,可能是升高温度使固体溶解,则溶液d中溶质质量可能大于溶液e中的溶质质量,错误;
D.若溶液d中的固体是经过过滤除去,则溶液d和溶液e的溶质质量分数可能相同,故正确。
故选C。
9.B
【详解】
A、20℃时,氯化铵饱和溶液中氯化铵的质量分数是×100%≈28.6%,错误;B、根据氯化铵在部分温度下的溶解度表,氯化铵的溶解度随着温度的升高而增大,20℃时,70g氯化铵的饱和溶液升温至40℃后,溶解度增大,得到不饱和溶液,正确;C、40℃时,氯化铵的饱和溶液中溶质质量分数为×100%;75g氯化铵的饱和溶液中含氯化铵的质量为75g××100%=25g;加入25g水后氯化铵的质量分数为×100%=25%,错误;D、80℃时,氯化铵的溶解度为68g,68g氯化铵溶于100g水形成168g饱和溶液,则该温度下84g的氯化铵饱和溶液中含有34g氯化铵,50g水;60℃,氯化铵的溶解度为58g,则50g水中最多溶解氯化铵29g,则80℃时,84g的氯化铵饱和溶液降温至60℃时有34g-29g=5g氯化铵析出,错误。故选B。
点睛:掌握一定温度下饱和溶液中溶质质量分数=×100%、溶液稀释前后溶质的质量不变等是解题的关键。
10.B
【详解】
根据氢原子数相等,找出乙醇分子与水分子间的关系,进而确定出质量关系.
C2H5OH~6H~3H2O
46 54
此乙醇溶液中溶质的质量分数为:×100%=46%
故选B.
11.D
【分析】
饱和溶液的质量分数=×100%
【详解】
A、该图示是溶剂和溶质的质量,没有说溶解度,所以不能说该物质的溶解度随温度的升高而增大,故A错;
B、溶解度单位是克,少了单位,故B错;
C、G点表示溶液中溶质的质量分数为:×100%=16.67%,故C错;
D、G和m的区别是G中有100g水,m中有80g水,溶质相同都是20g,所以G中溶质质量分数要小于m中质量分数,G都是m该温度下的不饱和溶液,w和z都在曲线上,都属于饱和溶液,温度没变,溶解度就不变,所以w和z溶质质量分数相同,因为在同一温度,同一溶质饱和溶液的质量分数最大,所以图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z,故D正确,故选D。
12.D
本题分为两个过程来理解,恒温下蒸发饱和溶液的部分溶剂过程中,温度不变,溶解度不变,所得溶液的溶质质量分数亦不变;然后再将溶液逐渐升温到60℃过程中,随温度升高硝酸钾的溶解度增大,继续溶解部分硝酸钾,所得溶液的溶质质量分数变大而后不变。
【详解】
40℃时,100g硝酸钾的饱和溶液,恒温下蒸发部分溶剂过程中,随水的蒸发硝酸钾不断析出,但溶液仍为饱和溶液且温度不变,所得溶液的溶质质量分数亦不变;然后再将溶液逐渐升温到60℃过程中,随温度升高硝酸钾的溶解度增大,继续溶解部分硝酸钾,所得溶液的溶质质量分数变大而后不变。
A、图示表明,在开始的恒温蒸发部分溶剂过程中,所得溶液的溶质质量分数不变;但将溶液逐渐冷却到40℃的过程中,溶液的溶质质量分数逐渐增大;与实际过程不相符,不符合题意;
B、图示表明,整个操作过程中溶液的溶质质量分数不断增大,与实际不符;不符合题意;
C、图示表明,整个操作过程中溶液的溶质质量分数不断减小,与实际不符;不符合题意;
D、图示表明,在开始的恒温蒸发部分溶剂过程中,所得溶液的溶质质量分数不变;然后再将溶液逐渐升温到60℃过程中,随温度升高硝酸钾的溶解度增大,继续溶解部分硝酸钾,所得溶液的溶质质量分数变大而后不变;与实际过程相符,符合题意。故选D。
【点睛】
当溶液达到饱和时,温度不变,溶解度不变,溶质质量分数也不变。
13.C
依据溶液稀释前后溶质的质量不变,列出等式求解。
【详解】
设需要水的质量为x.则50g×98%=(50g+x)9.8%,解得,x=450g;故选C。
14.C
依据溶液稀释前后溶质的质量不变,列出等式求解。
【详解】
根据稀释前后过氧化氢的质量前后保持不变,设需要30%的双氧水的质量为x,则:1200g×5%=30%x,则x=200g;故选C。
【点睛】
计算方法是依据溶液蒸发和稀释前后溶质的质量不变,列出等式求解。
15.B
【详解】
A、由图甲可知,t2℃时,NH4Cl的溶解度小于60g,而烧杯②中在t2℃时,100g水中溶解了60gR,所以R是KNO3,故A选项错误;
B、由图甲可知,t1℃时,KNO3的溶解度大于40g。t1℃时, 200g水中加入60g KNO3得到烧杯①中的溶液是不饱和溶液,而烧杯③中的溶液是t1℃时KNO3的饱和溶液,所以烧杯①溶液的溶质质量分数小于烧杯③,故B选项正确;
C、因为KNO3的溶解度随温度的升高而增大,若使烧杯③中的固体溶解可以采用加水或升高温度的方法,故C选项错误;
D、由图甲可知,t2℃时,KNO3的溶解度为60g,所以烧杯②中的溶液也是饱和溶液。烧杯①、②、③中,烧杯②、③中的溶液是饱和溶液,故D选项错误。
故选B。
16. 20mL M 23.1% ABCD
【详解】
①在电解水的实验中,正极上产生的氧气和负极上产生的氢气的体积比是 1:2,如果正极产生了10mL气体,则负极产生的气体体积是20mL;
②由图1可知,20℃时甲的溶解度比乙小,故表示甲的溶解度曲线是M;
50℃时,乙的溶解度是30g,即该温度下100g水最多可以溶解30g乙,50g水最多可以溶解15g乙,则20克乙物质中加入50g 水后所得溶液的溶质的质量分数=;
③A、图1中乙溶液不含有未溶解的固体,不一定是不饱和,但随着温度的升高,该物质的溶解度增大,所以图2中乙一定是不饱和溶液,正确
B、图 2 中两溶液中溶质和溶剂一样多,溶质质量分数一定相等,正确;
C、30℃时,甲乙两物质溶解度相同,而由图1我们可以推断30℃时乙为不饱和溶液,所以30℃时甲也为不饱和溶液,两者的溶质质量分数相同,正确;
D、根据图3可知两种物质的溶解度都随温度升高而增大,因此30℃时,甲、乙的溶解度都比20℃时大,且30℃时两物质的溶解度相等;再根据图1中信息可以知道20℃时乙中没有晶体析出,因此30℃时乙中一定也无晶体析出,因此图2中两溶液降温至30℃一定都不会析出晶体,故D正确。故选ABCD。
17. 100g NaCl 压强 温度
【分析】
(1)溶液稀释前后溶质的质量不变,列式求解;(2)60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g可知形成的溶液氯化钠溶液是饱和溶液,氯化铵溶液是不饱和溶液;(3)气体的溶解度随温度的升高而减小,随压强的增大而增大。
【详解】
(1)溶液稀释前后溶质的质量不变.设加入水的质量是x.(100g×20%)=(100g+x)×10%,x=100g。
(2)60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g,即100g水中最多溶解37.3g氯化钠,100g水中最多溶解55.2g氯化铵,所以形成的溶液氯化钠溶液是饱和溶液,氯化铵溶液是不饱和溶液。
(3)二氧化碳的溶解度随温度的升高而减小,随压强的增大而增大;打开瓶塞的过程是瓶内压强的改变过程,压强的改变导致气体溶解度的改变;瓶盖打开后气体喷出来,说明压强减小后气体的溶解度变小.喝了汽水以后常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的。
18. 30 570 小
【分析】
溶质的质量等于溶液的质量乘以溶质的质量分数,溶剂的质量等于溶液的质量减溶质的质量;量取水时仰视量筒量取的水体积偏大。
【详解】
(1)600g溶液中溶质的质量为:600g×5%=30g,需水:600g﹣30g=570g,
(2)若量取水时仰视量筒量取的水体积偏大,溶质不变溶剂多了,所以溶质质量分数偏小.
【点睛】
用量筒量取液体时,仰视读数,读数小于实际体积;俯视读数,读数大于实际体积。
19. a>b>c 120 16.7% b>a>c a>b>c
【分析】
由a、b、c三种物质的溶解度曲线图可知,a、b物质的溶解度随温度的升高而增大,a物质的溶解度受温度的影响较大,b物质的溶解度受温度的影响较小,c物质的溶解度随温度的升高而减小。
【详解】
(1)由a、b、c三种物质的溶解度曲线图可知,t2℃时,a、b、c三种物质的溶解度大小为a>b>c,故溶液溶质的质量分数由大到小的顺序是a>b>c。
(2)t1℃时,a物质的溶解度为20g,将100ga物质加入到100g水中中并充分搅拌,所得溶液的质量为,该溶液溶质的质量分数为。
(3)由溶解度曲线图可以看出,在t2℃时,abc的溶解度关系为a>b>c,其质量分数关系为a>b>c,降温后a、b溶液中均有晶体析出,还是饱和溶液,但在t1℃时,a的溶解度比b小,所以此时溶质质量分数为:b>a,c的溶解度随温度降低而升高变为不饱和溶液,则溶质质量分数将不变,故所得溶液的溶质质量分数由大到小的顺序是b>a>c。
(4)a、b物质的溶解度随温度的升高而增大,a物质的溶解度受温度的影响较大,b物质的溶解度受温度的影响较小,c物质的溶解度随温度的升高而减小,t2℃时,将等质量的a、b、c三种物质的饱和溶液降低温度到t1℃,a析出的晶体较多,b析出少量的晶体,c不会析出晶体,故这三种溶液中析出晶体的质量大小关系是a>b>c。
【点睛】
20.(1) 饱和 ×100%=26.5%
(2) 17:50 D B和E
(1)
将40g氯化钠固体加入100g水中,充分搅拌后,仍有4g氯化钠固体未溶解,故所得溶液是20℃时氯化钠的饱和溶液,该溶液中溶质的质量分数为:=26.5%
(2)
①因为20℃时KCl的溶解度为34g,则B溶液中溶解了34gKCl,溶质与溶剂的质量比为34g:100g=17:50;
②20℃时KCl的溶解度为34g,在100g水中,A中溶解了25gKCl,A溶液不饱和;B所得溶液中只能溶解34gKCl,溶质有剩余,是饱和溶液;由于40℃时为KCl的溶解度为40g,则溶液C中只能溶解40gKCl,溶质剩余10g,是饱和溶液;40℃时,25g水溶解KCl的质量为:40g×=10g,则D溶液中能够完全溶解50g氯化钾,是饱和溶液;E会析出晶体,是20℃时的饱和溶液。所以A~E所得溶液中,没有固体剩余的饱和溶液是D,B和E都是20℃时的饱和溶液,它们的溶质质量分数相等,所以溶质的质量分数相等的是B和E。
21.(1)A
(2)70
(3)20%
(4)B>A>C
(5)125
(1)
由溶解度曲线可知,t2℃时,A、B、C三种物质中溶解度最大的是A;
(2)
t1℃时,B的溶解度为40g,根据溶解度概念可知,50g水中最多溶解20g B物质,得到溶液的质量为:50g+20g=70g;
(3)
t1℃时,C的溶解度为25g,此饱和溶液的溶质质量分数为:;
(4)
将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,A、B的溶解度减小,C的溶解度随温度的降低而增大,A、B有晶体析出,质量分数变小,溶液仍为饱和溶液,C没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t1℃时B的溶解度大于A的溶解度大于t2℃时C的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是B>A>C;
(5)
若要将t1℃时125克C的饱和溶液的溶质质量分数变为原来的1/2,加水125g时,溶液的质量为原溶液的2倍,溶质不变,溶液的溶质质量分数变为原来的1/2。
22.(1)①;硝酸银 (2)①氢气 ②3.6%
【详解】
试题分析:(1)Cu﹣Ag合金中的Cu和Ag都不能与稀盐酸发生置换反应,Cu﹣Zn合金中的Zn可与稀盐酸发生置换反应,故用稀盐酸和必要的实验仪器就能鉴别出Cu﹣Zn饰品是假黄金;铜比银活泼,金不如银活泼,铜可以将银从它的盐溶液里置换出来,因此要证明Cu﹣Ag饰品是假黄金,可滴加硝酸银溶液来验证;
故答案为①;硝酸银;
(2)①根据质量守恒定律,产生氢气的质量=10g+93.7g﹣103.5g=0.2g;
故答案为氢气;
②设该合金中锌的质量为x,生成氯化锌的质量为y,则
Zn+2HCl=ZnCl2+H2↑
65 136 2
x y 0.2g
=,解得x=6.5g
=,解得y=13.6g
因此10g该合金中铜的质量是10g﹣6.5g=3.5g;
该溶液中溶质的质量分数是×100%=13.6%.
答:10g该合金中铜的质量是3.5g;该溶液中溶质的质量分数是13.6%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算;金属的化学性质.
点评:本题主要考查学生对金属的化学性质的认识,以及运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
试卷第页,共页
试卷第页,共页
一、单选题,共15小题
1.t℃时,A物质的饱和溶液中A的质量分数为15%,B物质的溶解度是25g,C物质的10g饱和溶液蒸干后可得1.5gC。若取等质量的3种物质的饱和溶液,则3种溶液中所含溶质的质量大小顺序是
A.A>C>B B.C>A>B C.B>C=A D.A>B>C
2.向 100g 水中不断加入固体 A 或改变温度,得到相应的溶液①~⑤。下列说法正确的 是( )
资料:A的溶解度
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
A.②中 A 的质量分数最大
B.③⑤中 A 的质量分数相等
C.②④⑤的溶液为饱和溶液
D.①③④⑤中没有固体存在
3.某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,则该甲醛溶液中甲醛的质量分数为
A.10% B.12% C.25% D.30%
4.图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )
A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为甲>乙
B.将甲、乙两种物质的饱和溶液都从t2℃将至t1℃时,两种溶液中溶质的质量分数相等
C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯的水中加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出
5.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
6.将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( )
A.甲的溶解度随温度升高而增大
B.t1℃时,甲、乙的溶解度均为20g
C.温度由t2℃降低到t1℃时,甲溶液析出5g固体
D.a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b
7.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
8.同学们用某固体物质进行如下图所示的实验,根据实验判断下列说法不正确的是
A.该固体物质的溶解度随温度的升高而增大
B.溶液b一定是不饱和溶液
C.溶液d中溶质质量可能大于溶液e中溶质质量
D.溶液d和溶液e的溶质质量分数一定相同
9.氯化铵在部分温度下的溶解度见下表,下列说法正确的是
温度/℃ 20 40 60 80
溶解度/g 40 50 58 68
A.20 ℃时,氯化铵饱和溶液中氯化铵的质量分数是25%
B.20 ℃时,70 g氯化铵的饱和溶液升温至40 ℃后得到的是不饱和溶液
C.40 ℃时,75 g氯化铵的饱和溶液加入25 g水后氯化铵的质量分数为30%
D.80 ℃时,84 g氯化铵饱和溶液降温至60 ℃时有10 g氯化铵析出
10.酒精(C2H5OH)的某种水溶液,溶质和溶剂中氢原子个数相等,则该溶液中溶质的质量分数为( )
A.23% B.46% C.55% D.72%
11.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.下列说法正确是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z
12.40℃时,烧杯中盛有100g 硝酸钾的饱和溶液,恒温下蒸发部分溶剂,然后 再将溶液逐渐升温到60℃.能表示此过程溶质质量分数a%与时间t关系的示意图的是
A. B.
C. D.
13.将50g98%的浓硫酸配制成9.8%的稀硫酸,需要水的质量为
A.250g B.350g C.450g D.500g
14.医院常用溶质质量分数为5%的双氧水溶液清洗伤口,若要配制5%的双氧水溶液1200g,需要30%的双氧水溶液的质量为
A.30g B.100g C.200g D.400g
15.本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是
A.R物质是氯化铵
B.溶液的溶质质量分数是烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
二、填空题,共6小题
16.水是生命之源,也是人类最宝贵的资源.用你学过的化学知识回答下列问题:
(1)某同学在完成电解水实验时,发现正极产生了10mL气体,则负极产生的气体体积是_____.
(2)20℃时,等质量的甲、乙固体(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙物质的溶解度曲线如图3.
①图3中,表示甲的溶解度曲线是_____(填“M”或“N”);
②50℃时,20克乙物质中加入50g水后所得溶液的溶质的质量分数是_____;(结果保留到0.1%)
③根据图中信息下列说法正确的是_____.(填字母序号)
A 图2中乙溶液一定不饱和
B 图2中两溶液中溶质质量分数一定相等
C 图2中的甲乙溶液降温至30℃时其溶质质量分数一定相等
D 图2中乙溶液降温至30℃无晶体析出.
17.水和溶液在生命活动和生产、生活中起着十分重要的作用.
(1)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种.现将100g20%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为_______g.
(2)根据下表回答问题.
温度/℃ 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.5 37.3 38.4 39.8
NH4Cl 29.4 37.2 45.8 55.2 65.6 77.3
分别向两个盛有50gNaCl和NH4Cl固体的烧杯中,各加入100g60℃的水,充分溶解后,饱和溶液是____溶液.
(3)目前市场上销售的汽水饮料大多数是碳酸饮料,其中溶有二氧化碳气体.打 开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与____有关. 喝了汽水后,常常会打嗝,这说明气体的溶解度还与____有关.
18.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
(1)小明配制了5%的双氧水600g,则600g溶液中溶质为____克,溶剂为_____克.
(2)小明用13%的双氧水溶液配制上述溶液,量水时仰视了刻度,则所配制的溶液中溶质的质量分数偏____.
19.下图是a、b、c三种物质的溶解度曲线,请据图回答:
(1)t2℃时,a、b、c三种物质的饱和溶液溶质的质量分数由大到小的顺序是_____________(填序号,下同)。
(2)t1℃时,将100ga物质加入到100g水中并充分搅拌,所得溶液的质量为__________g,该溶液溶质的质量分数为____________________(计算结果精确到0.1%)。
(3)t2℃时,将a、b、c三种物质的饱和溶液降低温度到t1℃,这三种溶液中溶质质量分数的大小关系是________________。
(4)t2℃时,将等质量的a、b、c三种物质的饱和溶液降低温度到t1℃,这三种溶液中析出晶体的质量大小关系是_______________。
20.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,仍有4g氯化钠固体未溶解。请填写下列空白:
(1)所得溶液是20℃时氯化钠的________溶液(填“饱和”或“不饱和”);该溶液中溶质的质量分数为________(列出算式并求结果)。
(2)已知20℃时KCl的溶解度为34g,40℃时为40g。某实验小组做了如下实验。
①B所得溶液中溶质与溶剂的质量比为________;
②A~E所得溶液中,没有固体剩余的饱和溶液是________(填序号,下同),溶质的质量分数相等的是________。
21.A、B、C三种固体物质的溶解度曲线如图所示,回答下列问题。
(1)t2℃时,三种物质中溶解度最大的是_________;
(2)t1℃时,在盛有50克水的烧杯中,加入40克B物质,充分溶解后,得到溶液的质量为_____g;
(3)t1℃时,C的饱和溶液中溶质质量分数为_________;
(4)将t2℃的A、B、C三种饱和溶液分别降温至t1℃,所得溶液中溶质质量分数由大到小的顺序是_____。
(5)若要将t1℃时125克C的饱和溶液的溶质质量分数变为原来的1/2,应加______克水。
三、简答题,共2小题
22.有①Cu﹣Zn ②Cu﹣Ag 两种貌似黄金的合金,它们都有其特殊的用途,但一些骗子常用它们做成饰品冒充真黄金欺骗消费者.对此,化学科学有责任加以揭露.
(1)现有上述两种合金制成的假黄金饰品各一件,小明同学只用稀盐酸和必要的实验仪器就鉴别出其中一种饰品是假黄金,它是合金 (填写代号);若要证明另一种饰品也是假黄金,可选用一种盐溶液来验证,这种盐可以是 (写一种盐的名称或化学式);
(2)取与上述用稀盐酸鉴别出的同种合金10g,放入烧杯中,再向其中加入93.7g某稀盐酸恰好完全反应后,测得烧杯内剩余物质的质量共为103.5g.
①上述过程中变化的质量10g,+93.7g﹣103.5g=0.2g是 (填物质的名称或化学式)的质量;
②10g,该合金中铜的质量是多少?已知反应后的溶液中溶质全部溶解,求该溶液中溶质的质量分数是多少?
试卷第页,共页
试卷第1页,共3页
参考答案:
1.C
【详解】
B物质的溶解度是25g,则B物质的溶质质量分数为:25/125×100%=20%,C物质的溶质质量分数为:1.5/10×100%=15%,取等质量的3种物质的饱和溶液,则B含有的溶质最多,A和C一样多.
故选C.
2.D
【详解】
A、根据资料,固体 A的溶解度随温度升高而增大。20℃时溶解度是37.2克,所以25℃时37.2克物质完全溶解,溶液①中的溶质质量为37.2克,再加入4.2g固体 A后,固体 A质量为41.4g,但固体在30℃时溶解度是41.4克,所以25℃时物质不能完全溶解,而60℃时溶解度是55.2克,在60℃时固体 A能完全溶解,所以溶液②的质量分数小于溶液③,且溶液④中溶质更多,溶质质量分数更大,选项A不正确;
B、溶液③中溶质质量为41.4克,溶液⑤中溶质质量为50.4克,而两溶液中溶质都是100g,因此两溶液的溶质质量分数不相等,选项B不正确;
C、60℃时固体 A的溶解度是55.2g,而溶液④中,溶质质量为50.4克,故溶液④为不饱和溶液,溶液②和溶液⑤为饱和溶液,选项C不正确;
D、20℃时溶解度是37.2克,所以25℃时物质完全溶解,溶液①中无固体存在,60℃时溶解度是55.2克,37.2克+9克+4.2克=50.4克,所以③④中溶质完全溶解,降温到50℃时溶解度是50.4克,恰好完全溶解,溶液⑤中也无固体存在,选项D正确。故选D。
3.C
【分析】
根据题意,某甲醛(HCHO)的水溶液中,氢元素的质量分数为10%,结合甲醛分子中氢原子和氧原子的个数比为2:1,水分子中氢原子和氧原子的个数比为2:1,可计算出甲醛的水溶液中氢元素和氧元素的质量比,进而可计算出氧元素的质量分数、碳元素的质量分数,由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
【详解】
甲醛溶液 HCHO中氢氧质量比为2:16=1:8,而水中氢氧质量比也是1:8,所以当氢元素为10%时,氧元素的质量为80%,则碳的质量分数为1-10%-80%=10%.则甲醛的质量分数为,故选C。
4.B
【详解】
A、图2中两试管底部溶液中都有固体溶质未溶解,因此试管中的溶液均为t2℃时的饱和溶液,图1显示,t2℃时甲的溶解度大于乙的溶解度,而饱和溶液中溶质的质量分数= ,因此两物质的饱和溶液溶解度大的其饱和溶液的溶质质量分数大,故甲的溶质质量分数大于乙的溶质质量分数,选项A正确;
B、甲的溶解度随温度的降低而减小,乙的溶解度随温度的降低而增大,将甲、乙两种物质的饱和溶液都从t2℃将降温至t1℃时,甲析出晶体,乙的溶解度变大则继续溶解试管内的固体,但溶解固体后是否饱和无法确定,若恰好饱和,则二者的溶质质量分数相等,若溶解后不饱和,则降温后甲的溶质质量分数大于乙的溶质质量分数,故降温后二者的溶质质量分数不一定相等,选项B错误;
C、氢氧化钠固体溶于水放出大量的热使溶液温度升高,甲物质逐步溶解,溶质的质量分数变大,乙的溶解度减小,析出晶体,溶质质量减小,溶剂不变,所以溶质的质量分数减小,因此只有乙溶液中溶质的质量分数变小,选项C正确;
D、NH4NO3固体溶于水吸收热量使溶液温度降低,甲的溶解度随温度的降低而减小,析出晶体,乙的溶解度随温度的降低而增大,变为不饱和溶液,不会析出晶体,因此只有盛放甲溶液的试管中有晶体析出,选项D正确。故选B。
5.C
【详解】
A、由甲图可知,20℃时a的溶解度小于b的溶解度,故M表示的是a的溶解度曲线,N表示的是b的溶解度曲线,选项A错误;
B、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,b完全溶解,说明此时b的溶质质量分数大于a的溶质质量分数,选项B错误;
C、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,那么得到的是该温度下的饱和溶液;b中完全溶解,那么可能是饱和溶液,也可能是不饱和溶液;升温到50℃时,a和b中均没有固体剩余,ab的溶解度均大于20℃时b的溶解度,所以ab一定是不饱和溶液,选项C正确;
D、30℃时a、b的溶解度相等,那么等质量的a、b两种固体,分别加入到盛有l00g水中所得溶液的溶质质量分数相等,选项D错误。故选C。
6.D
【详解】
A、纵坐标是剩余固体质量,温度越高,剩余固体越多,表明溶解度是随温度升高而减小的,选项A错误;
B、t1℃时,剩余固体都是10g,说明溶解了20g,因为水的质量是50g,所以甲、乙的溶解度均为40g,选项B错误;
C、温度由t2℃降低到t1℃时,固体减少5g,应该是溶解了5g,选项C错误;
D、c中剩余固体最少,a中次之,b中剩余固体最多,所以a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b,选项D正确。故选D。
7.B
【详解】
A、向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,过氧化氢分解为氧气和水,完全反应后,氧气质量不再变化,错误;
B、过氧化氢分解为氧气和水,溶剂质量增加,完全反应后,溶剂质量不再变化,正确;
C、过氧化氢分解为氧气和水,过氧化氢的质量分数减小,完全反应后,过氧化氢的质量为0,质量分数为0,错误;
D、FeCl3是催化剂,反应前后质量不变,过氧化氢分解为氧气和水,溶液质量减小,FeCl3的质量分数变大,错误。故选B。
8.C
【详解】
A.从溶液c和溶液d可以看出,降低温度则溶液中会析出晶体,说明该固体物质的溶解度随温度的升高而增大,故正确;
B. 溶液b中加入20g固体得到的溶液c中没有未溶解的固体,说明加入的物质全部溶解,故溶液b一定是不饱和溶液,故正确;
C. 溶液d变成溶液e的过程中没有发生化学变化,说明溶液d中的固体除掉,可能是升高温度使固体溶解,则溶液d中溶质质量可能大于溶液e中的溶质质量,错误;
D.若溶液d中的固体是经过过滤除去,则溶液d和溶液e的溶质质量分数可能相同,故正确。
故选C。
9.B
【详解】
A、20℃时,氯化铵饱和溶液中氯化铵的质量分数是×100%≈28.6%,错误;B、根据氯化铵在部分温度下的溶解度表,氯化铵的溶解度随着温度的升高而增大,20℃时,70g氯化铵的饱和溶液升温至40℃后,溶解度增大,得到不饱和溶液,正确;C、40℃时,氯化铵的饱和溶液中溶质质量分数为×100%;75g氯化铵的饱和溶液中含氯化铵的质量为75g××100%=25g;加入25g水后氯化铵的质量分数为×100%=25%,错误;D、80℃时,氯化铵的溶解度为68g,68g氯化铵溶于100g水形成168g饱和溶液,则该温度下84g的氯化铵饱和溶液中含有34g氯化铵,50g水;60℃,氯化铵的溶解度为58g,则50g水中最多溶解氯化铵29g,则80℃时,84g的氯化铵饱和溶液降温至60℃时有34g-29g=5g氯化铵析出,错误。故选B。
点睛:掌握一定温度下饱和溶液中溶质质量分数=×100%、溶液稀释前后溶质的质量不变等是解题的关键。
10.B
【详解】
根据氢原子数相等,找出乙醇分子与水分子间的关系,进而确定出质量关系.
C2H5OH~6H~3H2O
46 54
此乙醇溶液中溶质的质量分数为:×100%=46%
故选B.
11.D
【分析】
饱和溶液的质量分数=×100%
【详解】
A、该图示是溶剂和溶质的质量,没有说溶解度,所以不能说该物质的溶解度随温度的升高而增大,故A错;
B、溶解度单位是克,少了单位,故B错;
C、G点表示溶液中溶质的质量分数为:×100%=16.67%,故C错;
D、G和m的区别是G中有100g水,m中有80g水,溶质相同都是20g,所以G中溶质质量分数要小于m中质量分数,G都是m该温度下的不饱和溶液,w和z都在曲线上,都属于饱和溶液,温度没变,溶解度就不变,所以w和z溶质质量分数相同,因为在同一温度,同一溶质饱和溶液的质量分数最大,所以图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z,故D正确,故选D。
12.D
本题分为两个过程来理解,恒温下蒸发饱和溶液的部分溶剂过程中,温度不变,溶解度不变,所得溶液的溶质质量分数亦不变;然后再将溶液逐渐升温到60℃过程中,随温度升高硝酸钾的溶解度增大,继续溶解部分硝酸钾,所得溶液的溶质质量分数变大而后不变。
【详解】
40℃时,100g硝酸钾的饱和溶液,恒温下蒸发部分溶剂过程中,随水的蒸发硝酸钾不断析出,但溶液仍为饱和溶液且温度不变,所得溶液的溶质质量分数亦不变;然后再将溶液逐渐升温到60℃过程中,随温度升高硝酸钾的溶解度增大,继续溶解部分硝酸钾,所得溶液的溶质质量分数变大而后不变。
A、图示表明,在开始的恒温蒸发部分溶剂过程中,所得溶液的溶质质量分数不变;但将溶液逐渐冷却到40℃的过程中,溶液的溶质质量分数逐渐增大;与实际过程不相符,不符合题意;
B、图示表明,整个操作过程中溶液的溶质质量分数不断增大,与实际不符;不符合题意;
C、图示表明,整个操作过程中溶液的溶质质量分数不断减小,与实际不符;不符合题意;
D、图示表明,在开始的恒温蒸发部分溶剂过程中,所得溶液的溶质质量分数不变;然后再将溶液逐渐升温到60℃过程中,随温度升高硝酸钾的溶解度增大,继续溶解部分硝酸钾,所得溶液的溶质质量分数变大而后不变;与实际过程相符,符合题意。故选D。
【点睛】
当溶液达到饱和时,温度不变,溶解度不变,溶质质量分数也不变。
13.C
依据溶液稀释前后溶质的质量不变,列出等式求解。
【详解】
设需要水的质量为x.则50g×98%=(50g+x)9.8%,解得,x=450g;故选C。
14.C
依据溶液稀释前后溶质的质量不变,列出等式求解。
【详解】
根据稀释前后过氧化氢的质量前后保持不变,设需要30%的双氧水的质量为x,则:1200g×5%=30%x,则x=200g;故选C。
【点睛】
计算方法是依据溶液蒸发和稀释前后溶质的质量不变,列出等式求解。
15.B
【详解】
A、由图甲可知,t2℃时,NH4Cl的溶解度小于60g,而烧杯②中在t2℃时,100g水中溶解了60gR,所以R是KNO3,故A选项错误;
B、由图甲可知,t1℃时,KNO3的溶解度大于40g。t1℃时, 200g水中加入60g KNO3得到烧杯①中的溶液是不饱和溶液,而烧杯③中的溶液是t1℃时KNO3的饱和溶液,所以烧杯①溶液的溶质质量分数小于烧杯③,故B选项正确;
C、因为KNO3的溶解度随温度的升高而增大,若使烧杯③中的固体溶解可以采用加水或升高温度的方法,故C选项错误;
D、由图甲可知,t2℃时,KNO3的溶解度为60g,所以烧杯②中的溶液也是饱和溶液。烧杯①、②、③中,烧杯②、③中的溶液是饱和溶液,故D选项错误。
故选B。
16. 20mL M 23.1% ABCD
【详解】
①在电解水的实验中,正极上产生的氧气和负极上产生的氢气的体积比是 1:2,如果正极产生了10mL气体,则负极产生的气体体积是20mL;
②由图1可知,20℃时甲的溶解度比乙小,故表示甲的溶解度曲线是M;
50℃时,乙的溶解度是30g,即该温度下100g水最多可以溶解30g乙,50g水最多可以溶解15g乙,则20克乙物质中加入50g 水后所得溶液的溶质的质量分数=;
③A、图1中乙溶液不含有未溶解的固体,不一定是不饱和,但随着温度的升高,该物质的溶解度增大,所以图2中乙一定是不饱和溶液,正确
B、图 2 中两溶液中溶质和溶剂一样多,溶质质量分数一定相等,正确;
C、30℃时,甲乙两物质溶解度相同,而由图1我们可以推断30℃时乙为不饱和溶液,所以30℃时甲也为不饱和溶液,两者的溶质质量分数相同,正确;
D、根据图3可知两种物质的溶解度都随温度升高而增大,因此30℃时,甲、乙的溶解度都比20℃时大,且30℃时两物质的溶解度相等;再根据图1中信息可以知道20℃时乙中没有晶体析出,因此30℃时乙中一定也无晶体析出,因此图2中两溶液降温至30℃一定都不会析出晶体,故D正确。故选ABCD。
17. 100g NaCl 压强 温度
【分析】
(1)溶液稀释前后溶质的质量不变,列式求解;(2)60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g可知形成的溶液氯化钠溶液是饱和溶液,氯化铵溶液是不饱和溶液;(3)气体的溶解度随温度的升高而减小,随压强的增大而增大。
【详解】
(1)溶液稀释前后溶质的质量不变.设加入水的质量是x.(100g×20%)=(100g+x)×10%,x=100g。
(2)60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g,即100g水中最多溶解37.3g氯化钠,100g水中最多溶解55.2g氯化铵,所以形成的溶液氯化钠溶液是饱和溶液,氯化铵溶液是不饱和溶液。
(3)二氧化碳的溶解度随温度的升高而减小,随压强的增大而增大;打开瓶塞的过程是瓶内压强的改变过程,压强的改变导致气体溶解度的改变;瓶盖打开后气体喷出来,说明压强减小后气体的溶解度变小.喝了汽水以后常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的。
18. 30 570 小
【分析】
溶质的质量等于溶液的质量乘以溶质的质量分数,溶剂的质量等于溶液的质量减溶质的质量;量取水时仰视量筒量取的水体积偏大。
【详解】
(1)600g溶液中溶质的质量为:600g×5%=30g,需水:600g﹣30g=570g,
(2)若量取水时仰视量筒量取的水体积偏大,溶质不变溶剂多了,所以溶质质量分数偏小.
【点睛】
用量筒量取液体时,仰视读数,读数小于实际体积;俯视读数,读数大于实际体积。
19. a>b>c 120 16.7% b>a>c a>b>c
【分析】
由a、b、c三种物质的溶解度曲线图可知,a、b物质的溶解度随温度的升高而增大,a物质的溶解度受温度的影响较大,b物质的溶解度受温度的影响较小,c物质的溶解度随温度的升高而减小。
【详解】
(1)由a、b、c三种物质的溶解度曲线图可知,t2℃时,a、b、c三种物质的溶解度大小为a>b>c,故溶液溶质的质量分数由大到小的顺序是a>b>c。
(2)t1℃时,a物质的溶解度为20g,将100ga物质加入到100g水中中并充分搅拌,所得溶液的质量为,该溶液溶质的质量分数为。
(3)由溶解度曲线图可以看出,在t2℃时,abc的溶解度关系为a>b>c,其质量分数关系为a>b>c,降温后a、b溶液中均有晶体析出,还是饱和溶液,但在t1℃时,a的溶解度比b小,所以此时溶质质量分数为:b>a,c的溶解度随温度降低而升高变为不饱和溶液,则溶质质量分数将不变,故所得溶液的溶质质量分数由大到小的顺序是b>a>c。
(4)a、b物质的溶解度随温度的升高而增大,a物质的溶解度受温度的影响较大,b物质的溶解度受温度的影响较小,c物质的溶解度随温度的升高而减小,t2℃时,将等质量的a、b、c三种物质的饱和溶液降低温度到t1℃,a析出的晶体较多,b析出少量的晶体,c不会析出晶体,故这三种溶液中析出晶体的质量大小关系是a>b>c。
【点睛】
20.(1) 饱和 ×100%=26.5%
(2) 17:50 D B和E
(1)
将40g氯化钠固体加入100g水中,充分搅拌后,仍有4g氯化钠固体未溶解,故所得溶液是20℃时氯化钠的饱和溶液,该溶液中溶质的质量分数为:=26.5%
(2)
①因为20℃时KCl的溶解度为34g,则B溶液中溶解了34gKCl,溶质与溶剂的质量比为34g:100g=17:50;
②20℃时KCl的溶解度为34g,在100g水中,A中溶解了25gKCl,A溶液不饱和;B所得溶液中只能溶解34gKCl,溶质有剩余,是饱和溶液;由于40℃时为KCl的溶解度为40g,则溶液C中只能溶解40gKCl,溶质剩余10g,是饱和溶液;40℃时,25g水溶解KCl的质量为:40g×=10g,则D溶液中能够完全溶解50g氯化钾,是饱和溶液;E会析出晶体,是20℃时的饱和溶液。所以A~E所得溶液中,没有固体剩余的饱和溶液是D,B和E都是20℃时的饱和溶液,它们的溶质质量分数相等,所以溶质的质量分数相等的是B和E。
21.(1)A
(2)70
(3)20%
(4)B>A>C
(5)125
(1)
由溶解度曲线可知,t2℃时,A、B、C三种物质中溶解度最大的是A;
(2)
t1℃时,B的溶解度为40g,根据溶解度概念可知,50g水中最多溶解20g B物质,得到溶液的质量为:50g+20g=70g;
(3)
t1℃时,C的溶解度为25g,此饱和溶液的溶质质量分数为:;
(4)
将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,A、B的溶解度减小,C的溶解度随温度的降低而增大,A、B有晶体析出,质量分数变小,溶液仍为饱和溶液,C没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质分数=,溶解度越大,质量分数越大,t1℃时B的溶解度大于A的溶解度大于t2℃时C的溶解度,所以t1℃时三种物质的溶质质量分数由大到小的顺序是B>A>C;
(5)
若要将t1℃时125克C的饱和溶液的溶质质量分数变为原来的1/2,加水125g时,溶液的质量为原溶液的2倍,溶质不变,溶液的溶质质量分数变为原来的1/2。
22.(1)①;硝酸银 (2)①氢气 ②3.6%
【详解】
试题分析:(1)Cu﹣Ag合金中的Cu和Ag都不能与稀盐酸发生置换反应,Cu﹣Zn合金中的Zn可与稀盐酸发生置换反应,故用稀盐酸和必要的实验仪器就能鉴别出Cu﹣Zn饰品是假黄金;铜比银活泼,金不如银活泼,铜可以将银从它的盐溶液里置换出来,因此要证明Cu﹣Ag饰品是假黄金,可滴加硝酸银溶液来验证;
故答案为①;硝酸银;
(2)①根据质量守恒定律,产生氢气的质量=10g+93.7g﹣103.5g=0.2g;
故答案为氢气;
②设该合金中锌的质量为x,生成氯化锌的质量为y,则
Zn+2HCl=ZnCl2+H2↑
65 136 2
x y 0.2g
=,解得x=6.5g
=,解得y=13.6g
因此10g该合金中铜的质量是10g﹣6.5g=3.5g;
该溶液中溶质的质量分数是×100%=13.6%.
答:10g该合金中铜的质量是3.5g;该溶液中溶质的质量分数是13.6%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算;金属的化学性质.
点评:本题主要考查学生对金属的化学性质的认识,以及运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
试卷第页,共页
试卷第页,共页
