2022年人教版九年级化学下册-第九单元课题3溶液的浓度同步练习(word版有答案)
文档属性
| 名称 | 2022年人教版九年级化学下册-第九单元课题3溶液的浓度同步练习(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 415.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-16 21:04:20 | ||
图片预览


文档简介
课题3溶液的浓度
专题1溶液的浓度(一)
(知识梳理部分请听视频讲解)
1.B 某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是( )
A. 30% B. ×100%
C. 26.5% D. ×100%
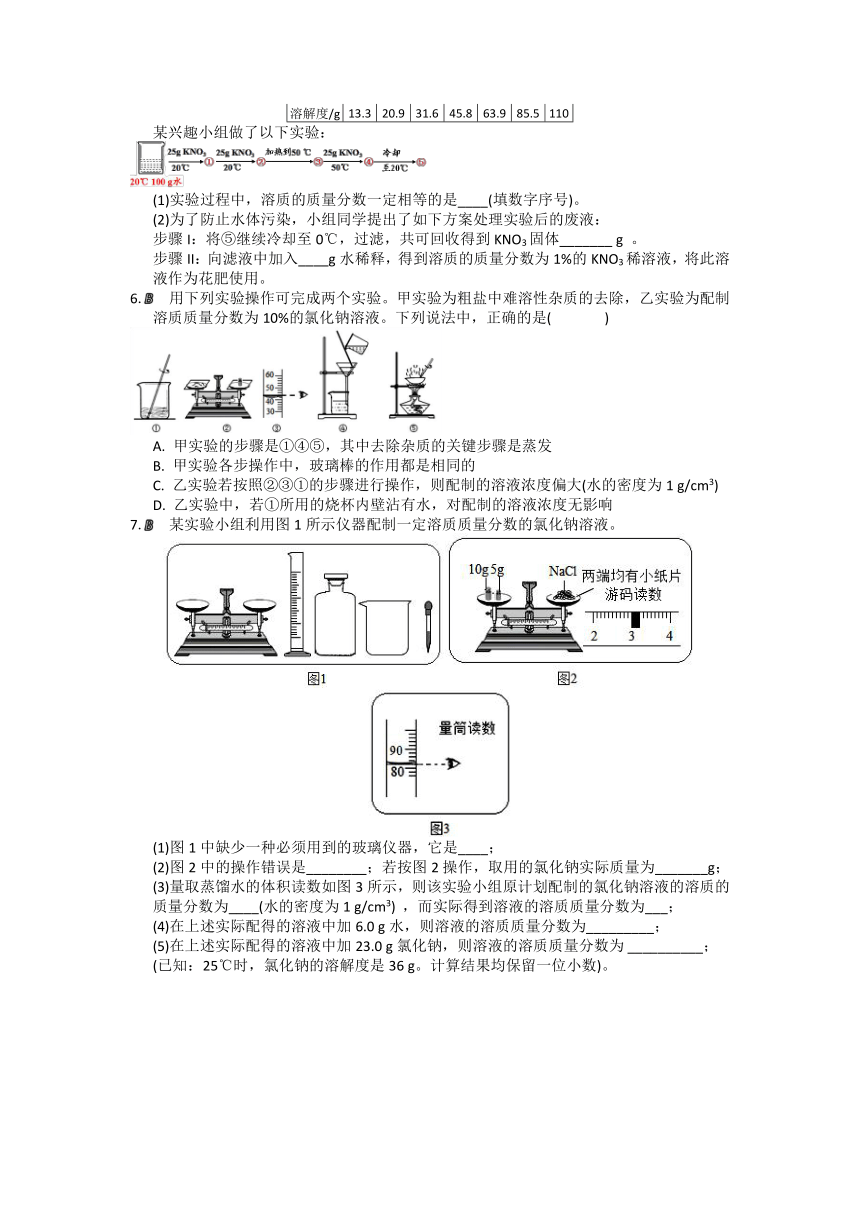
2.A 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
(1)图1中仪器a的名称是_______;
(2)完成此实验正确的操作顺序是(填序号)_________;
①溶解 ②把配好的溶液装入试剂瓶
③称量 ④计算
(3)按实验要求,图1中还缺少的玻璃仪器是(填名称)_____。
(4)小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是________;她称取的氯化钠实际质量为______g。
(5)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液中溶质的质量分数为(水的密度约为1 g/cm3)_______。
3.B 20℃时,某物质溶解于水的实验数据如下表。则下列叙述正确的是( )
实验 序号 水的质量(g) 加入该物质的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.②中所得溶液是饱和溶液
B.20℃时10g饱和溶液溶解3.6g该物质
C.20℃时该物质的溶解度为36g
D.①所得溶液的溶质质量分数为20%
4.B 20℃时,食盐的溶解度为36克:
(1)计算此温度下饱和食盐水的食盐的质量分数
(2)能否配制出20℃溶质质量分数为36%的食盐水
5.C 下表列出了硝酸钾在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110
某兴趣小组做了以下实验:
(1)实验过程中,溶质的质量分数一定相等的是____(填数字序号)。
(2)为了防止水体污染,小组同学提出了如下方案处理实验后的废液:
步骤I:将⑤继续冷却至0℃,过滤,共可回收得到KNO3固体_______ g 。
步骤II:向滤液中加入____g水稀释,得到溶质的质量分数为1%的KNO3稀溶液,将此溶液作为花肥使用。
6.B 用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法中,正确的是( )
A. 甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B. 甲实验各步操作中,玻璃棒的作用都是相同的
C. 乙实验若按照②③①的步骤进行操作,则配制的溶液浓度偏大(水的密度为1 g/cm3)
D. 乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
7.B 某实验小组利用图1所示仪器配制一定溶质质量分数的氯化钠溶液。
(1)图1中缺少一种必须用到的玻璃仪器,它是____;
(2)图2中的操作错误是________;若按图2操作,取用的氯化钠实际质量为_______g;
(3)量取蒸馏水的体积读数如图3所示,则该实验小组原计划配制的氯化钠溶液的溶质的质量分数为____(水的密度为1 g/cm3) ,而实际得到溶液的溶质质量分数为___;
(4)在上述实际配得的溶液中加6.0 g水,则溶液的溶质质量分数为_________;
(5)在上述实际配得的溶液中加23.0 g氯化钠,则溶液的溶质质量分数为 __________;
(已知:25℃时,氯化钠的溶解度是36 g。计算结果均保留一位小数)。
专题2溶液的浓度(二)
(知识梳理部分请听视频讲解)
1.A 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
2.A 某温度时,蒸干35 g氯化钾溶液,得到7 g氯化钾,求该溶液中溶质的质量分数。
3.A 化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50 g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
4.A 100 g某硫酸溶液恰好与13 g锌完全反应,试计算这种硫酸中溶质的质量分数。
5.A 下表是KCl的部分溶解度数据。下列说法正确的是( )
温度(℃) 0 20 40 60
溶解度(g) 27.6 34 40 45.5
A. 20℃时,100 g KCl饱和溶液中含有34 g KCl
B. 任何温度下的KCl饱和溶液都不能再溶解其他物质
C. 40℃的KCl溶液的浓度一定大于20 ℃的KCl溶液的浓度
D. 将60℃的KCl溶液降温至40℃时,不一定有晶体析出
6.A 欲在实验室配制100 g 16%的氯化钠溶液进行选种,下列做法正确的是( )
A. 计算:需要16 g氯化钠,100 g水
B. 称量:用托盘天平称量所需的氯化钠
C. 量取:用50 mL量筒量取所需的水
D. 溶解:将称得的氯化钠倒入量筒溶解
7.A 将6.5 g Zn放入93.7 g的稀硫酸中,恰好完全反应。求所得溶液的质量分数。(H 1 O 16 S 32 Zn 65)
8.B 要配制100克溶质质量分数为10%的氯化钠溶液,下列操作中正确的是( )
A. 将10克氯化钠固体直接放在天平的托盘上称量
B. 量取90毫升水时,俯视读数
C. 为加快固体溶解,用温度计搅拌溶液
D. 将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
9.C 某同学欲配制12.5%的氯化钠溶液100g,配完溶液后, 他发现称量氯化钠时误将食盐和砝码在天平上的位置放颠倒了(质量少于5g时用游码)。试问他配置的氯化钠溶液的实际质量分数为多大?他应采取什么补救措施?
10.C 华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液。请回答下列问题:
(1) 若用氢氧化钠固体配制,需称取氢氧化钠_____g。
(2) 若用25%的氢氧化钠溶液配制,需要25%的氢氧化钠溶液____g;蒸馏水_____g;配制时应选用____mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。
(3) 下列操作正确的是 ( )
A. 在托盘天平的左右盘上垫滤纸称取氢氧化钠固体
B. 将准确称取的氢氧化钠固体直接倒入装有水的量筒中溶解
C. 将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签
(4) 在实验室配制氢氧化钠溶液时,____(填“要”或“不要”)用到玻璃棒。
11.C 某同学用固体氯化钾配制8%的氯化钾溶液,实验室现有①托盘天平;②量筒;③烧杯;④玻璃棒;⑤酒精灯等仪器。
请按要求回答下列问题:
(1)配制100g质量分数为8%的氯化钾溶液,所需氯化钾的质量为 ______ g。
(2)用托盘天平称量所需的氯化钾.托盘天平调节平衡后,接下来的操作应该是_____ (填字母)。
A.先在左盘纸片上加氯化钾,后在右盘纸片上加砝码
B.先在右盘纸片上加砝码,后在左盘纸片上加氯化钾
(3) 配制溶液过程中,上述仪器不需要的是______(填序号)。
(4) 该同学将配制好的溶液装入试剂瓶中,请你帮助他在如图所示的标签内写好标签的内容。
12.B 将某温度下的饱和石灰水:①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是( )
A. 溶液的质量
B. Ca(OH)2的溶解度
C. 溶液中含氢氧化钙的质量
D. 溶液中溶质的质量分数
13.B 图一是甲、乙两种固体物质的溶解度曲线图。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。请根据图一回答问题:
① 50℃时,甲物质的溶解度是________。
② 烧杯中加入浓硫酸后,甲、乙两试管中看到的现象是_____;除了加浓硫酸外,还可以加_____物质,也会发生这样的变化。
③ 图二中,20℃时将20 g 甲物质放入50 g水中,所得溶液的质量分数是________。(精确到0.1)
④ 图二中,40℃时将甲、乙、丙物质的饱和溶液各100 g降温至20℃,所得溶液的质量分数的关系是____(填“﹥”、“﹦”或“﹤”)。
⑤ 图二中,20℃时,甲、乙、丙三物质的溶解度相等,有关这三种物质饱和溶液的性质描述一定正确的是____。(选填编号)
Ⅰ. 溶液质量一定相等
Ⅱ. 溶质质量一定相等
Ⅲ. 溶液的质量分数一定相等
Ⅳ. 溶液的密度一定相等
14.B 20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四只各盛有50 g水的烧杯中,充分溶解后的情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量 /g 4.2 2 0 9.2
下列说法正确的是( )
A. 所得溶液一定都是饱和溶液
B. 丁溶液中溶质质量分数一定最大
C. 20 ℃时物质溶解度的关系为:丁>甲>乙>丙
D. 所得溶液的质量关系为:丙>乙>甲>丁
答案
课题3 溶液的浓度
专题 1溶液的浓度(一)
1. C 2. (1)烧杯;(2)④③①②;(3)玻璃棒;(4)药品和砝码位置放反;12;(5)18% 3. C
4. (1)质量分数=36/136×100%=26.5%;(2)不能配制出20摄氏度溶质质量分数为30%的食盐水,因为20℃时饱和食盐水的食盐的质量分数为26.5%<30% 5. (1)②⑤ (2)61.7 1216.7 6. C 7. (1)玻璃棒;(2)药品和砝码放错位置 12;(3)18% 12.8%;(4)12%;(5)26.5%
专题2溶液的浓度(二)
1. 氯化钠的质量=150 kg×16% = 24 kg;水的质量=150 g – 24 kg = 126 kg
2. 溶质的质量分数=
3. 设:稀释后溶液的质量为 X,
50g × 98% = X × 20%
X==245g
需要水的质量 = 245 g – 50 g = 195 g
答:需要水的质量为195 g。
4. 设这种硫酸中溶质的质量为X。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13g X
X==19.6g
溶质的质量分数=×100%=19.6%
答:这种硫酸溶液中溶质的质量分数为19.6%。
5.D 6. B 7. 16.1% 8. D 9. 放颠倒了,那就是说,游码数值+食盐重量=砝码重量,即食盐重量=10-2.5=7.5g;水的重量应该还是100-12.5=87.5g;
那么氯化钠溶液的实际质量分数=7.5/(7.5+87.5)=7.89%;应采取补加食盐的办法:补加食盐的重量应该为之前少加的食盐的重量,即5g
10. (1)5 (2)20;30;50 (3)C (4)要
11. (1) 8 (2) B (3)⑤ (4)氯化钾8%
12. D 13. ①30g;②甲试管中晶体的量在减少,乙中晶体的量在增加 NaOH固体或生石灰;③23.1%;④甲=乙>丙;⑤Ⅲ 14. D
专题1溶液的浓度(一)
(知识梳理部分请听视频讲解)
1.B 某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是( )
A. 30% B. ×100%
C. 26.5% D. ×100%
2.A 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
(1)图1中仪器a的名称是_______;
(2)完成此实验正确的操作顺序是(填序号)_________;
①溶解 ②把配好的溶液装入试剂瓶
③称量 ④计算
(3)按实验要求,图1中还缺少的玻璃仪器是(填名称)_____。
(4)小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是________;她称取的氯化钠实际质量为______g。
(5)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液中溶质的质量分数为(水的密度约为1 g/cm3)_______。
3.B 20℃时,某物质溶解于水的实验数据如下表。则下列叙述正确的是( )
实验 序号 水的质量(g) 加入该物质的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.②中所得溶液是饱和溶液
B.20℃时10g饱和溶液溶解3.6g该物质
C.20℃时该物质的溶解度为36g
D.①所得溶液的溶质质量分数为20%
4.B 20℃时,食盐的溶解度为36克:
(1)计算此温度下饱和食盐水的食盐的质量分数
(2)能否配制出20℃溶质质量分数为36%的食盐水
5.C 下表列出了硝酸钾在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60
溶解度/g 13.3 20.9 31.6 45.8 63.9 85.5 110
某兴趣小组做了以下实验:
(1)实验过程中,溶质的质量分数一定相等的是____(填数字序号)。
(2)为了防止水体污染,小组同学提出了如下方案处理实验后的废液:
步骤I:将⑤继续冷却至0℃,过滤,共可回收得到KNO3固体_______ g 。
步骤II:向滤液中加入____g水稀释,得到溶质的质量分数为1%的KNO3稀溶液,将此溶液作为花肥使用。
6.B 用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法中,正确的是( )
A. 甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B. 甲实验各步操作中,玻璃棒的作用都是相同的
C. 乙实验若按照②③①的步骤进行操作,则配制的溶液浓度偏大(水的密度为1 g/cm3)
D. 乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
7.B 某实验小组利用图1所示仪器配制一定溶质质量分数的氯化钠溶液。
(1)图1中缺少一种必须用到的玻璃仪器,它是____;
(2)图2中的操作错误是________;若按图2操作,取用的氯化钠实际质量为_______g;
(3)量取蒸馏水的体积读数如图3所示,则该实验小组原计划配制的氯化钠溶液的溶质的质量分数为____(水的密度为1 g/cm3) ,而实际得到溶液的溶质质量分数为___;
(4)在上述实际配得的溶液中加6.0 g水,则溶液的溶质质量分数为_________;
(5)在上述实际配得的溶液中加23.0 g氯化钠,则溶液的溶质质量分数为 __________;
(已知:25℃时,氯化钠的溶解度是36 g。计算结果均保留一位小数)。
专题2溶液的浓度(二)
(知识梳理部分请听视频讲解)
1.A 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
2.A 某温度时,蒸干35 g氯化钾溶液,得到7 g氯化钾,求该溶液中溶质的质量分数。
3.A 化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50 g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
4.A 100 g某硫酸溶液恰好与13 g锌完全反应,试计算这种硫酸中溶质的质量分数。
5.A 下表是KCl的部分溶解度数据。下列说法正确的是( )
温度(℃) 0 20 40 60
溶解度(g) 27.6 34 40 45.5
A. 20℃时,100 g KCl饱和溶液中含有34 g KCl
B. 任何温度下的KCl饱和溶液都不能再溶解其他物质
C. 40℃的KCl溶液的浓度一定大于20 ℃的KCl溶液的浓度
D. 将60℃的KCl溶液降温至40℃时,不一定有晶体析出
6.A 欲在实验室配制100 g 16%的氯化钠溶液进行选种,下列做法正确的是( )
A. 计算:需要16 g氯化钠,100 g水
B. 称量:用托盘天平称量所需的氯化钠
C. 量取:用50 mL量筒量取所需的水
D. 溶解:将称得的氯化钠倒入量筒溶解
7.A 将6.5 g Zn放入93.7 g的稀硫酸中,恰好完全反应。求所得溶液的质量分数。(H 1 O 16 S 32 Zn 65)
8.B 要配制100克溶质质量分数为10%的氯化钠溶液,下列操作中正确的是( )
A. 将10克氯化钠固体直接放在天平的托盘上称量
B. 量取90毫升水时,俯视读数
C. 为加快固体溶解,用温度计搅拌溶液
D. 将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
9.C 某同学欲配制12.5%的氯化钠溶液100g,配完溶液后, 他发现称量氯化钠时误将食盐和砝码在天平上的位置放颠倒了(质量少于5g时用游码)。试问他配置的氯化钠溶液的实际质量分数为多大?他应采取什么补救措施?
10.C 华雪同学想制取“叶脉书签”,需要50g质量分数为10%的氢氧化钠溶液。请回答下列问题:
(1) 若用氢氧化钠固体配制,需称取氢氧化钠_____g。
(2) 若用25%的氢氧化钠溶液配制,需要25%的氢氧化钠溶液____g;蒸馏水_____g;配制时应选用____mL(选填“10”、“20”、“50”、“100”)的量筒量取蒸馏水。
(3) 下列操作正确的是 ( )
A. 在托盘天平的左右盘上垫滤纸称取氢氧化钠固体
B. 将准确称取的氢氧化钠固体直接倒入装有水的量筒中溶解
C. 将配制好的NaOH溶液装入玻璃试剂瓶中,塞好橡胶塞并贴上标签
(4) 在实验室配制氢氧化钠溶液时,____(填“要”或“不要”)用到玻璃棒。
11.C 某同学用固体氯化钾配制8%的氯化钾溶液,实验室现有①托盘天平;②量筒;③烧杯;④玻璃棒;⑤酒精灯等仪器。
请按要求回答下列问题:
(1)配制100g质量分数为8%的氯化钾溶液,所需氯化钾的质量为 ______ g。
(2)用托盘天平称量所需的氯化钾.托盘天平调节平衡后,接下来的操作应该是_____ (填字母)。
A.先在左盘纸片上加氯化钾,后在右盘纸片上加砝码
B.先在右盘纸片上加砝码,后在左盘纸片上加氯化钾
(3) 配制溶液过程中,上述仪器不需要的是______(填序号)。
(4) 该同学将配制好的溶液装入试剂瓶中,请你帮助他在如图所示的标签内写好标签的内容。
12.B 将某温度下的饱和石灰水:①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是( )
A. 溶液的质量
B. Ca(OH)2的溶解度
C. 溶液中含氢氧化钙的质量
D. 溶液中溶质的质量分数
13.B 图一是甲、乙两种固体物质的溶解度曲线图。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量浓硫酸。请根据图一回答问题:
① 50℃时,甲物质的溶解度是________。
② 烧杯中加入浓硫酸后,甲、乙两试管中看到的现象是_____;除了加浓硫酸外,还可以加_____物质,也会发生这样的变化。
③ 图二中,20℃时将20 g 甲物质放入50 g水中,所得溶液的质量分数是________。(精确到0.1)
④ 图二中,40℃时将甲、乙、丙物质的饱和溶液各100 g降温至20℃,所得溶液的质量分数的关系是____(填“﹥”、“﹦”或“﹤”)。
⑤ 图二中,20℃时,甲、乙、丙三物质的溶解度相等,有关这三种物质饱和溶液的性质描述一定正确的是____。(选填编号)
Ⅰ. 溶液质量一定相等
Ⅱ. 溶质质量一定相等
Ⅲ. 溶液的质量分数一定相等
Ⅳ. 溶液的密度一定相等
14.B 20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四只各盛有50 g水的烧杯中,充分溶解后的情况如下表:
物质 甲 乙 丙 丁
未溶解固体的质量 /g 4.2 2 0 9.2
下列说法正确的是( )
A. 所得溶液一定都是饱和溶液
B. 丁溶液中溶质质量分数一定最大
C. 20 ℃时物质溶解度的关系为:丁>甲>乙>丙
D. 所得溶液的质量关系为:丙>乙>甲>丁
答案
课题3 溶液的浓度
专题 1溶液的浓度(一)
1. C 2. (1)烧杯;(2)④③①②;(3)玻璃棒;(4)药品和砝码位置放反;12;(5)18% 3. C
4. (1)质量分数=36/136×100%=26.5%;(2)不能配制出20摄氏度溶质质量分数为30%的食盐水,因为20℃时饱和食盐水的食盐的质量分数为26.5%<30% 5. (1)②⑤ (2)61.7 1216.7 6. C 7. (1)玻璃棒;(2)药品和砝码放错位置 12;(3)18% 12.8%;(4)12%;(5)26.5%
专题2溶液的浓度(二)
1. 氯化钠的质量=150 kg×16% = 24 kg;水的质量=150 g – 24 kg = 126 kg
2. 溶质的质量分数=
3. 设:稀释后溶液的质量为 X,
50g × 98% = X × 20%
X==245g
需要水的质量 = 245 g – 50 g = 195 g
答:需要水的质量为195 g。
4. 设这种硫酸中溶质的质量为X。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
13g X
X==19.6g
溶质的质量分数=×100%=19.6%
答:这种硫酸溶液中溶质的质量分数为19.6%。
5.D 6. B 7. 16.1% 8. D 9. 放颠倒了,那就是说,游码数值+食盐重量=砝码重量,即食盐重量=10-2.5=7.5g;水的重量应该还是100-12.5=87.5g;
那么氯化钠溶液的实际质量分数=7.5/(7.5+87.5)=7.89%;应采取补加食盐的办法:补加食盐的重量应该为之前少加的食盐的重量,即5g
10. (1)5 (2)20;30;50 (3)C (4)要
11. (1) 8 (2) B (3)⑤ (4)氯化钾8%
12. D 13. ①30g;②甲试管中晶体的量在减少,乙中晶体的量在增加 NaOH固体或生石灰;③23.1%;④甲=乙>丙;⑤Ⅲ 14. D
同课章节目录
