2022年人教版九年级化学下册第九单元溶液 单元测试卷(word版含答案)
文档属性
| 名称 | 2022年人教版九年级化学下册第九单元溶液 单元测试卷(word版含答案) |
|
|
| 格式 | doc | ||
| 文件大小 | 153.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-17 00:00:00 | ||
图片预览

文档简介
第九单元《溶液》单元测试卷
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、下列物质不属于溶液的是( )
A.矿泉水 B.冰水混合物 C.碘酒 D.生理盐水
2、生理盐水是医疗上常用的一种溶液。下列关于生理盐水的说法中,错误的是( )
A.生理盐水的溶剂是水
B.生理盐水中存在的微粒有水分子和氯化钠分子
C.生理盐水是一种混合物
D.各部分一样咸体现了溶液成分的均一性
3、为增大二氧化碳的溶解度,可采用的方法是( )
A.增加溶剂 B.减少溶剂 C.升高温度 D.增大压强
4、从化学的角度对下列词句进行解释,错误的是( )
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
5、下列混合物均一、稳定的是( )
A.肥皂水 B.泥水 C.碘酒 D.牛奶
6、小刚同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想从市场上购买一种商品来产生制冷效果,他应该购买的是( )
A.氢氧化钠 B.硝酸铵 C.蔗糖 D.食盐
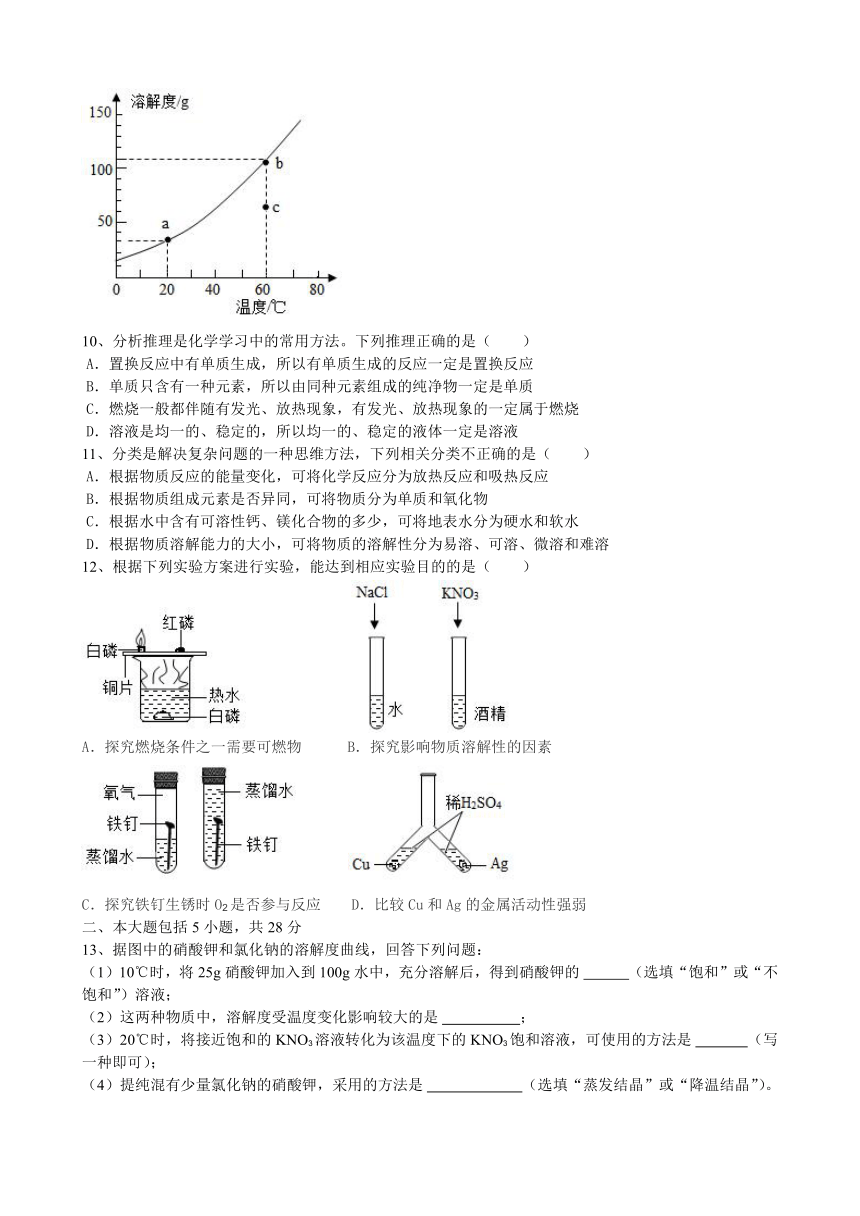
7、在分别盛有100g水的烧杯中分别加入KCl至充分溶解(如图所示),下列说法错误的是( )
温度(℃) t1 t2
KCl的溶解度(g) 40 50
A.甲升温至t2℃,溶液质量增大
B.乙为KCl的饱和溶液
C.丙降温至t1℃,有晶体析出
D.乙、丙溶液中溶质质量相等
8、下列因素不影响固体物质溶解度的是( )
a.固体的种类;b.固体颗粒的大小;c.溶剂的种类;d.溶剂的多少;e.温度。
A.abed B.abe C.bd D.b
9、如图是KNO3的溶解度曲线,下列说法正确的是( )
A.60℃时,b、c点对应的都是饱和溶液
B.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
C.将b点的饱和溶液降温到a点,有晶体析出
D.60℃时,向50g水中加入60g KNO3,形成不饱和溶液
10、分析推理是化学学习中的常用方法。下列推理正确的是( )
A.置换反应中有单质生成,所以有单质生成的反应一定是置换反应
B.单质只含有一种元素,所以由同种元素组成的纯净物一定是单质
C.燃烧一般都伴随有发光、放热现象,有发光、放热现象的一定属于燃烧
D.溶液是均一的、稳定的,所以均一的、稳定的液体一定是溶液
11、分类是解决复杂问题的一种思维方法,下列相关分类不正确的是( )
A.根据物质反应的能量变化,可将化学反应分为放热反应和吸热反应
B.根据物质组成元素是否异同,可将物质分为单质和氧化物
C.根据水中含有可溶性钙、镁化合物的多少,可将地表水分为硬水和软水
D.根据物质溶解能力的大小,可将物质的溶解性分为易溶、可溶、微溶和难溶
12、根据下列实验方案进行实验,能达到相应实验目的的是( )
A.探究燃烧条件之一需要可燃物 B.探究影响物质溶解性的因素
C.探究铁钉生锈时O2是否参与反应 D.比较Cu和Ag的金属活动性强弱
二、本大题包括5小题,共28分
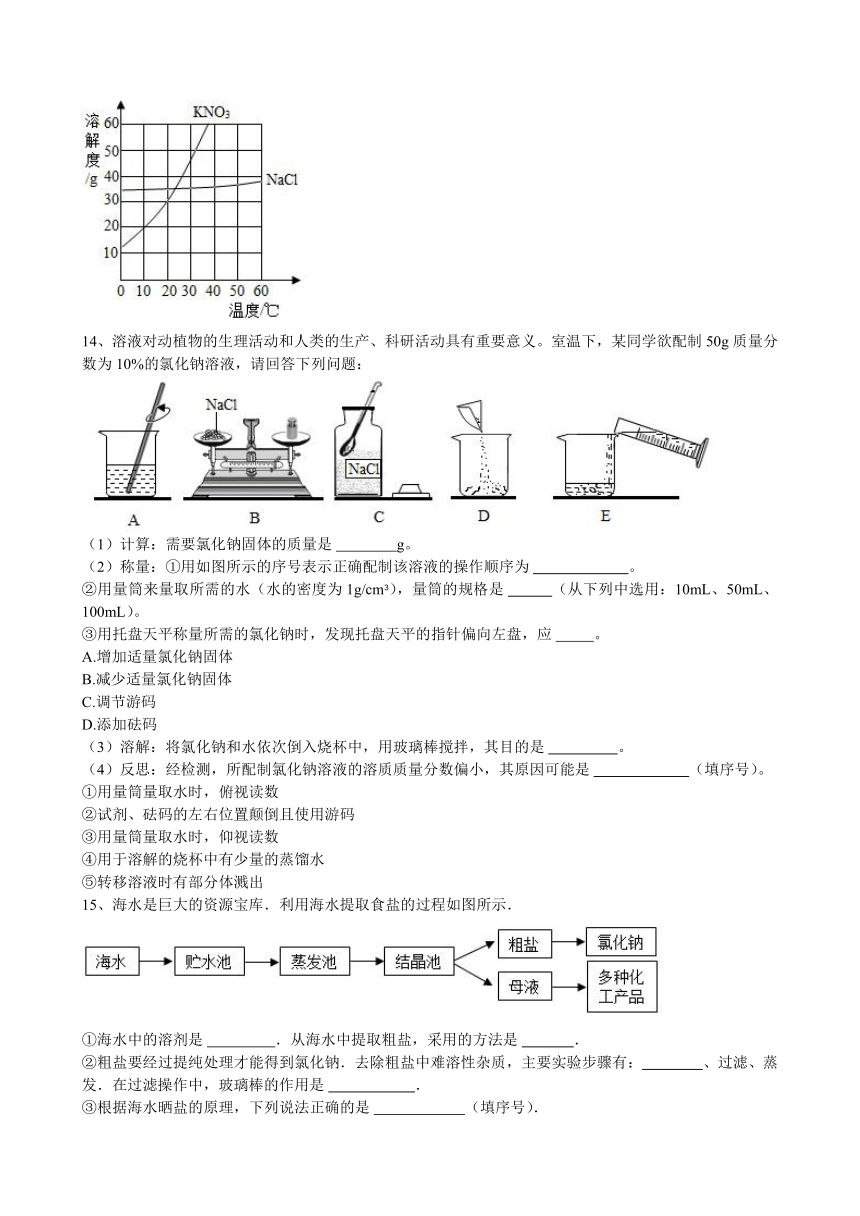
13、据图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将25g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的 (选填“饱和”或“不饱和”)溶液;
(2)这两种物质中,溶解度受温度变化影响较大的是 ;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是 (写一种即可);
(4)提纯混有少量氯化钠的硝酸钾,采用的方法是 (选填“蒸发结晶”或“降温结晶”)。
14、溶液对动植物的生理活动和人类的生产、科研活动具有重要意义。室温下,某同学欲配制50g质量分数为10%的氯化钠溶液,请回答下列问题:
(1)计算:需要氯化钠固体的质量是 g。
(2)称量:①用如图所示的序号表示正确配制该溶液的操作顺序为 。
②用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是 (从下列中选用:10mL、50mL、100mL)。
③用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节游码
D.添加砝码
(3)溶解:将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。
(4)反思:经检测,所配制氯化钠溶液的溶质质量分数偏小,其原因可能是 (填序号)。
①用量筒量取水时,俯视读数
②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数
④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分体溅出
15、海水是巨大的资源宝库.利用海水提取食盐的过程如图所示.
①海水中的溶剂是 .从海水中提取粗盐,采用的方法是 .
②粗盐要经过提纯处理才能得到氯化钠.去除粗盐中难溶性杂质,主要实验步骤有: 、过滤、蒸发.在过滤操作中,玻璃棒的作用是 .
③根据海水晒盐的原理,下列说法正确的是 (填序号).
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池,海水中氯化钠的质量逐渐增加
C.在结晶池,海水中氯化钠溶质的质量分数逐渐增加
D.析出晶体后的母液是氯化钠的饱和溶液.
16、如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,侯晒结浮白,扫而复淋”。
(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为 。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数为15%),用于煎炼海盐。
①1000g“上等卤水”蒸干后,可得到氯化钠的质量约为 g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是 。
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水 100g、NaCl 39.8g、MgCl2 7.65g及其他成分2.55g。将150g此溶液降温至20℃,有 g NaCl析出(溶解度见表)。此时, (填“有”或“没有”)MgCl2析出,原因是 。
温度/℃ 20 60 100
溶解度/g NaCl 36.0 37.3 39.8
MgCl2 54.8 61.3 73.0
17、图1为四种物质的溶解度曲线,向试管内滴加一定量的水后,X的饱和溶液变浑浊(如图2)。
(1)根据图1,10℃时,四种物质溶解度从小到大的顺序为 (填物质序号)。
(2)根据图2,X对应的图1中的物质是 。
(3)(NH4)2HPO4中混有少量NaCl杂质,可用 法提纯,45g (NH4)2HPO4和17g NaCl组成的混合物,按照以下步骤进行提纯:
①在 ℃下,用50g水恰好能将固体完全溶解;
②降温到0℃时,溶液中析出NH4H2PO4的质量为 g;
③经过滤、洗涤、干燥得到纯净的NH4H2PO4。
(4)10℃时,将30gNH4H2PO4加入到100g水中,充分溶解后,所得溶液中溶质质量分数为 (结果保留到小数点后1位)。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、B 2、B 3、D 4、A 5、C 6、B 7、C 8、C 9、C 10、B
11、B 12、C
二、本大题包括5小题,共28分
13、答案:(1)饱和。
(2)硝酸钾。
(3)加溶质或恒温蒸发溶剂。
(4)降温结晶。
14、答案:(1)5g;
(2)①CBDEA;
②50mL;
③B;
(3)加快氯化钠的溶解速率;
(4)②③④。
15、答案:①水;蒸发溶剂;②溶解;引流; ③AD.
16、答案:(1)蒸发结晶;
(2)①150;
②生产等量的海盐,后者消耗燃料更多;
③3.8;没有;20℃时溶液中的氯化镁未达到饱和状态。
17、答案:(1)④②③①;
(2)④或Ce2(SO4)3;
(3)冷却热饱和溶液(或降温结晶);①40; ②25;
(4)17.4%。
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、下列物质不属于溶液的是( )
A.矿泉水 B.冰水混合物 C.碘酒 D.生理盐水
2、生理盐水是医疗上常用的一种溶液。下列关于生理盐水的说法中,错误的是( )
A.生理盐水的溶剂是水
B.生理盐水中存在的微粒有水分子和氯化钠分子
C.生理盐水是一种混合物
D.各部分一样咸体现了溶液成分的均一性
3、为增大二氧化碳的溶解度,可采用的方法是( )
A.增加溶剂 B.减少溶剂 C.升高温度 D.增大压强
4、从化学的角度对下列词句进行解释,错误的是( )
A.点石成金——化学反应中元素种类可以发生改变
B.用洗洁精可除去油污——洗洁精对油污有乳化作用
C.真金不怕火炼——金的化学性质不活泼
D.用铜和黄铜相互刻画,铜上留有更深的划痕——合金的硬度比组成它的纯金属大
5、下列混合物均一、稳定的是( )
A.肥皂水 B.泥水 C.碘酒 D.牛奶
6、小刚同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想从市场上购买一种商品来产生制冷效果,他应该购买的是( )
A.氢氧化钠 B.硝酸铵 C.蔗糖 D.食盐
7、在分别盛有100g水的烧杯中分别加入KCl至充分溶解(如图所示),下列说法错误的是( )
温度(℃) t1 t2
KCl的溶解度(g) 40 50
A.甲升温至t2℃,溶液质量增大
B.乙为KCl的饱和溶液
C.丙降温至t1℃,有晶体析出
D.乙、丙溶液中溶质质量相等
8、下列因素不影响固体物质溶解度的是( )
a.固体的种类;b.固体颗粒的大小;c.溶剂的种类;d.溶剂的多少;e.温度。
A.abed B.abe C.bd D.b
9、如图是KNO3的溶解度曲线,下列说法正确的是( )
A.60℃时,b、c点对应的都是饱和溶液
B.将a点的饱和溶液从20℃升温到60℃时仍是饱和溶液
C.将b点的饱和溶液降温到a点,有晶体析出
D.60℃时,向50g水中加入60g KNO3,形成不饱和溶液
10、分析推理是化学学习中的常用方法。下列推理正确的是( )
A.置换反应中有单质生成,所以有单质生成的反应一定是置换反应
B.单质只含有一种元素,所以由同种元素组成的纯净物一定是单质
C.燃烧一般都伴随有发光、放热现象,有发光、放热现象的一定属于燃烧
D.溶液是均一的、稳定的,所以均一的、稳定的液体一定是溶液
11、分类是解决复杂问题的一种思维方法,下列相关分类不正确的是( )
A.根据物质反应的能量变化,可将化学反应分为放热反应和吸热反应
B.根据物质组成元素是否异同,可将物质分为单质和氧化物
C.根据水中含有可溶性钙、镁化合物的多少,可将地表水分为硬水和软水
D.根据物质溶解能力的大小,可将物质的溶解性分为易溶、可溶、微溶和难溶
12、根据下列实验方案进行实验,能达到相应实验目的的是( )
A.探究燃烧条件之一需要可燃物 B.探究影响物质溶解性的因素
C.探究铁钉生锈时O2是否参与反应 D.比较Cu和Ag的金属活动性强弱
二、本大题包括5小题,共28分
13、据图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将25g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的 (选填“饱和”或“不饱和”)溶液;
(2)这两种物质中,溶解度受温度变化影响较大的是 ;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是 (写一种即可);
(4)提纯混有少量氯化钠的硝酸钾,采用的方法是 (选填“蒸发结晶”或“降温结晶”)。
14、溶液对动植物的生理活动和人类的生产、科研活动具有重要意义。室温下,某同学欲配制50g质量分数为10%的氯化钠溶液,请回答下列问题:
(1)计算:需要氯化钠固体的质量是 g。
(2)称量:①用如图所示的序号表示正确配制该溶液的操作顺序为 。
②用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是 (从下列中选用:10mL、50mL、100mL)。
③用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节游码
D.添加砝码
(3)溶解:将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 。
(4)反思:经检测,所配制氯化钠溶液的溶质质量分数偏小,其原因可能是 (填序号)。
①用量筒量取水时,俯视读数
②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数
④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分体溅出
15、海水是巨大的资源宝库.利用海水提取食盐的过程如图所示.
①海水中的溶剂是 .从海水中提取粗盐,采用的方法是 .
②粗盐要经过提纯处理才能得到氯化钠.去除粗盐中难溶性杂质,主要实验步骤有: 、过滤、蒸发.在过滤操作中,玻璃棒的作用是 .
③根据海水晒盐的原理,下列说法正确的是 (填序号).
A.海水进入贮水池,海水的成分基本不变
B.在蒸发池,海水中氯化钠的质量逐渐增加
C.在结晶池,海水中氯化钠溶质的质量分数逐渐增加
D.析出晶体后的母液是氯化钠的饱和溶液.
16、如图为我国古代“布灰种盐”生产海盐的部分场景,其过程为“烧草为灰,布在滩场,然后以海水渍之,侯晒结浮白,扫而复淋”。
(1)“晒结浮白”是指海水浸渍的草灰经日晒后出现白色海盐颗粒的过程,化学上称之为 。
(2)经过多次“扫而复淋”,提高卤水浓度获得“上等卤水”(氯化钠的质量分数为15%),用于煎炼海盐。
①1000g“上等卤水”蒸干后,可得到氯化钠的质量约为 g。
②从燃料利用角度分析,用获得的“上等卤水”而不直接用海水煎炼海盐的原因是 。
③将“上等卤水”在100℃恒温蒸发至刚有晶体析出,所得溶液的组成为:150g溶液中含水 100g、NaCl 39.8g、MgCl2 7.65g及其他成分2.55g。将150g此溶液降温至20℃,有 g NaCl析出(溶解度见表)。此时, (填“有”或“没有”)MgCl2析出,原因是 。
温度/℃ 20 60 100
溶解度/g NaCl 36.0 37.3 39.8
MgCl2 54.8 61.3 73.0
17、图1为四种物质的溶解度曲线,向试管内滴加一定量的水后,X的饱和溶液变浑浊(如图2)。
(1)根据图1,10℃时,四种物质溶解度从小到大的顺序为 (填物质序号)。
(2)根据图2,X对应的图1中的物质是 。
(3)(NH4)2HPO4中混有少量NaCl杂质,可用 法提纯,45g (NH4)2HPO4和17g NaCl组成的混合物,按照以下步骤进行提纯:
①在 ℃下,用50g水恰好能将固体完全溶解;
②降温到0℃时,溶液中析出NH4H2PO4的质量为 g;
③经过滤、洗涤、干燥得到纯净的NH4H2PO4。
(4)10℃时,将30gNH4H2PO4加入到100g水中,充分溶解后,所得溶液中溶质质量分数为 (结果保留到小数点后1位)。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、B 2、B 3、D 4、A 5、C 6、B 7、C 8、C 9、C 10、B
11、B 12、C
二、本大题包括5小题,共28分
13、答案:(1)饱和。
(2)硝酸钾。
(3)加溶质或恒温蒸发溶剂。
(4)降温结晶。
14、答案:(1)5g;
(2)①CBDEA;
②50mL;
③B;
(3)加快氯化钠的溶解速率;
(4)②③④。
15、答案:①水;蒸发溶剂;②溶解;引流; ③AD.
16、答案:(1)蒸发结晶;
(2)①150;
②生产等量的海盐,后者消耗燃料更多;
③3.8;没有;20℃时溶液中的氯化镁未达到饱和状态。
17、答案:(1)④②③①;
(2)④或Ce2(SO4)3;
(3)冷却热饱和溶液(或降温结晶);①40; ②25;
(4)17.4%。
同课章节目录
