高中化学人教版(2019)必修第二册第五章二氧化硫知识的专题复习 课件(18张PPT)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册第五章二氧化硫知识的专题复习 课件(18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 565.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-15 12:56:24 | ||
图片预览





文档简介
(共18张PPT)
二氧化硫知识的专题复习
[知识要点]
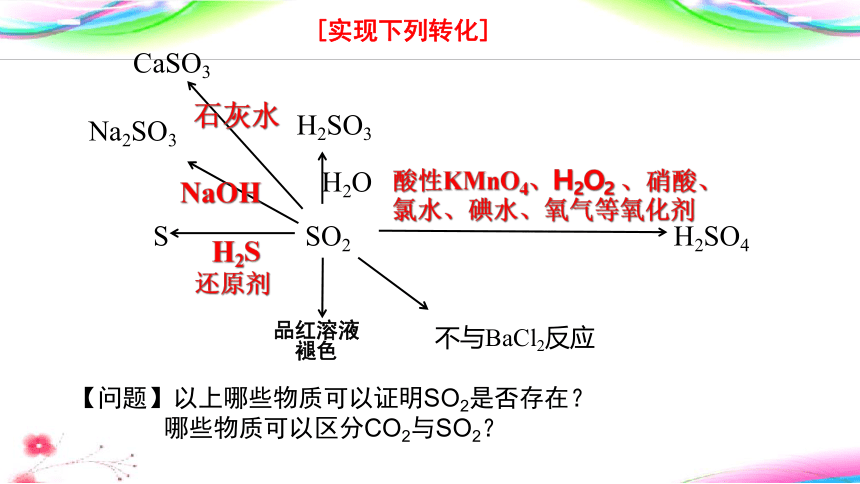
注意: SO2虽具有漂白性,但不能漂白指示剂。因此将SO2通入紫色石蕊溶液中,溶液只会变红,不会褪色。SO2使某些溶液褪色并不都是由于其漂白性。SO2使有机色素褪色属于漂白,SO2使无机物褪色不属于漂白。
S SO2 H2SO4
H2SO3
H2S
酸性KMnO4、H2O2 、硝酸、氯水、碘水、氧气等氧化剂
Na2SO3
CaSO3
还原剂
品红溶液
褪色
不与BaCl2反应
NaOH
石灰水
【问题】以上哪些物质可以证明SO2是否存在?
哪些物质可以区分CO2与SO2?
H2O
[实现下列转化]
对比CO2和SO2的化学性质,哪个更多样?
答:SO2性质更多。还有强还原性、漂白性。
共性:都是酸性氧化物,都有氧化性。
①都能使澄清的石灰水变浑浊
②
【比一比,找差异】
选考
{
①与O2反应:
2SO2+O2
2SO3
(可逆反应)
②与X2反应:
SO2+X2+2H2O=H2SO4+2HX(X2包括:Cl2、Br2、I2)
(Cl2和SO2以物质的量1:1混合后失去漂白作用)
③与KMnO4(H+)反应,使其紫色褪去:
5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
④与Fe3+反应,溶液由黄色变为浅绿色:
SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+
与CO2不同点: SO2有强还原性,能被碘水、溴水、氯水、KMnO4(H+)、FeCl3、O2、H2O2、HNO3等氧化剂氧化
例2:如何除去 CO2中SO2
例1:如何鉴别: SO2、CO2
例3:如何鉴别Na2SO3、Na2CO3
通过饱和NaHCO3溶液
答:使品红或KMnO4溶液(或溴水)褪色的是SO2
加入足量盐酸,产生的气体使品红或KMnO4溶液褪色的原物质是Na2SO3
或KMnO4溶液
注意审题
涉及 SO2、CO2的习题举例
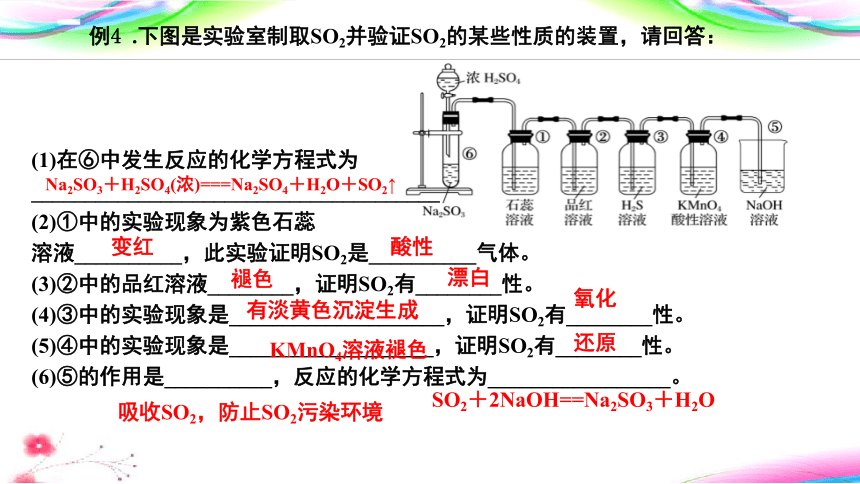
例4 .下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
(1)在⑥中发生反应的化学方程式为______________________________________
(2)①中的实验现象为紫色石蕊
溶液__________,此实验证明SO2是__________气体。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是____________________,证明SO2有________性。
(5)④中的实验现象是___________________,证明SO2有________性。
(6)⑤的作用是__________,反应的化学方程式为_________________。
Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑
变红
酸性
褪色
漂白
有淡黄色沉淀生成
氧化
KMnO4溶液褪色
还原
吸收SO2,防止SO2污染环境
SO2+2NaOH==Na2SO3+H2O
[提示]SO2的漂白性
(1) SO2的漂白具有选择性,可以漂白品红溶液以及棉、麻等物品,
但不能漂白酸碱指示剂,如石蕊溶液等。
(2) SO2能使溴水、酸性KMnO4溶液褪色,是因为SO2具有还原性
而非漂白性。
例5.下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③滴有酚酞的NaOH溶液
④溴水 ⑤碘的淀粉溶液
A.只有①④ B.①②④ C.②③⑤ D.②④⑤
解析:SO2使③中溶液褪色,表现酸性氧化物的通性;使②④⑤中溶液褪色,表现还原性;使①中溶液褪色,表现漂白性。故正确答案为D。
D
1. 检验SO2中是否混有CO2,应采取的措施 ( )
A. 通过氢氧化钡溶液, 再通过石灰水
B. 通过酸性高锰酸钾溶液 ,再通过石灰水
C. 通过小苏打悬浊液,再通过石灰水
D. 通过澄清石灰水,再通过品红溶液
C
B
2. CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是 ( )
A.(1)浓H2SO4 (2)NaOH
B.(1)浓H2SO4 (2)Na2CO3
C.(1)饱和NaHCO3 (2)浓H2SO4
D.(1)NaOH (2)浓H2SO4
3. 若将SO2气体通入足量的BaCl2溶液中,则无明显现象产生。
①同时向BaCl2溶液中通入NH3和SO2,有白色沉淀产生,产生沉淀的化学式为 。
②同时向BaCl2溶液中通入SO2和Cl2,有白色沉淀产生,产生沉淀的化学式为 。
③写出相关反应的化学方程式 。
BaSO3
BaSO4
[解]①2NH3+H2O+SO2==(NH4)2SO3 (NH4)2SO3+BaCl2==BaSO3↓+2NH4Cl
②SO2+Br2+2H2O= H2SO4+2HBr H2SO4+BaCl2==BaSO4↓+2HCl
BaCl2
溶液
SO2
A
溶液
三等分
久置
白色沉淀A
白色沉淀B
白色沉淀C
滴加NaOH
溶液
滴加H2O2
溶液
问:①上述3种白色沉淀的成分是否相同?
②写出相关反应的化学方程式
SO2 + H2 O=H2SO3
O2 +2 H2SO3 = 2H2SO4
2NaOH + H2SO3 = Na2SO3+2H2O
Na2SO3+BaCl2== BaSO3↓+ 2NaCl
H2SO4+BaCl2==BaSO4↓+ 2HCl
H2SO3+H2O2==H2SO4+H2O
H2SO4+BaCl2==BaSO4↓+ 2HCl
【变式训练1】
或H2SO3+H2O2 +BaCl2==BaSO4↓+2HCl+H2O
【变式训练2】Cl2和SO2以体积比 3:1 混合后,通入 中,
现象是否相同?
1:1
1:3
品红溶液
紫色石蕊溶液
Cl2和SO2
1:1
1:3
3:1
通入品红溶液中
不褪色
褪色
褪色
Cl2和SO2
1:1
1:3
3:1
通入紫色石蕊溶液中
不褪色
先变红后褪色
变红后不褪色
分析:
写出相关反应的离子(或化学)方程式,并指出体现SO2的什么性质。
溴水
KMnO4(H+)
1)SO2使 褪色
2)SO2使 变浑浊
石灰水
氢硫酸
3)用饱和NaHCO3溶液除去CO2中的少量SO2
2H2S+SO2 = 3S↓+2H2O
5SO2+2H2O+2MnO4- = 2Mn2++5SO42-+4H+
SO2+Br2+2H2O= 4H++SO42-+2Br-
SO2 + Ca2++ 2OH- = CaSO3 ↓ +2 H2O
2NaHCO3+SO2 = Na2SO3 +2CO2↑ +H2O
2 HCO3-+ SO2 = SO32- +2CO2 ↑+H2O
SO2的还原性
SO2是酸性氧化物
SO2的氧化性
SO2是酸性氧化物,H2SO3酸性比H2CO3强
深化拓展
5)用漂白粉溶液通入足量SO2
SO2的还原性
2SO2 + Ca2++ 2ClO- + 2 H2O= CaSO4 ↓ +SO42-+4H++2Cl-
6) 向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成
2Fe3++SO2+2H2O==SO42-+4H++2Fe2+
SO2的还原性
写出相关反应的离子(或化学)方程式,并指出体现SO2的什么性质。
4)用漂白粉溶液除去少量SO2
SO2的还原性
SO2 + Ca2++ ClO- + H2O= CaSO4 ↓ +2H++ Cl-
深化拓展
Ba2++ +SO42-== BaSO4 ↓
7).探究H2SO3的酸性强于HClO,该同学用如图 所示装置达成实验目的。
①装置的连接顺序为纯净SO2→ (选填字母),D中反应的离子方程式为 。
②可证明H2SO3的酸性强于HClO的实验现象是 。
A.小苏打溶液 B.品红溶液
C.酸性KMnO4溶液 D.漂白粉溶液
【注】二氧化硫具有还原性,不能与漂白粉溶液发生复分解反应证明亚硫酸的酸性强于次氯酸,若要证明亚硫酸的酸性强于次氯酸,应将二氧化硫通入碳酸氢钠溶液中制得二氧化碳气体,将生成的气体通入酸性高锰酸钾溶液中除去二氧化硫,若气体通入品红溶液中不褪色,则说明二氧化硫被酸性高锰酸钾溶液完全吸收,剩余气体通入漂白粉溶液中生成白色沉淀,说明亚硫酸的酸性强于碳酸,碳酸的酸性强于次氯酸,从而证明亚硫酸的酸性强于次氯酸。
A→C→B→D
Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO
B中品红溶液不褪色,D中出现白色沉淀
易错题
深化拓展
8)吸烟有害健康,因为香烟烟雾中含有CO、CO2、SO2、H2O等气体,用下列物质可将其一一检出: A.无水硫酸铜 B.澄清石灰水 C.红热氧化铜 D.生石灰 E.酸性高锰酸钾溶液 F.品红溶液
检出的正确顺序是 ( )
A.混合气→A→E→B→A→D→C
B.混合气→C→D→E→E→A
C.混合气→A→E→F→B→D→C
D.混合气→B→E→A→D→C
【解析】操作顺序为
检验H2O(g)→检验并除去SO2→检验是否仍有SO2→检验CO2→干燥气体→检验CO
C
→
生石灰
深化拓展
9) 为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③浓硫酸
④灼热的铜网 ⑤碱石灰
A.①③④ B.③④⑤ C.②④③ D.②③④
D
周末自主整理作业
3BaSO3+2HNO3=3BaSO4 +2NO↑+H2O
Ba(NO3)2
二氧化硫知识的专题复习
[知识要点]
注意: SO2虽具有漂白性,但不能漂白指示剂。因此将SO2通入紫色石蕊溶液中,溶液只会变红,不会褪色。SO2使某些溶液褪色并不都是由于其漂白性。SO2使有机色素褪色属于漂白,SO2使无机物褪色不属于漂白。
S SO2 H2SO4
H2SO3
H2S
酸性KMnO4、H2O2 、硝酸、氯水、碘水、氧气等氧化剂
Na2SO3
CaSO3
还原剂
品红溶液
褪色
不与BaCl2反应
NaOH
石灰水
【问题】以上哪些物质可以证明SO2是否存在?
哪些物质可以区分CO2与SO2?
H2O
[实现下列转化]
对比CO2和SO2的化学性质,哪个更多样?
答:SO2性质更多。还有强还原性、漂白性。
共性:都是酸性氧化物,都有氧化性。
①都能使澄清的石灰水变浑浊
②
【比一比,找差异】
选考
{
①与O2反应:
2SO2+O2
2SO3
(可逆反应)
②与X2反应:
SO2+X2+2H2O=H2SO4+2HX(X2包括:Cl2、Br2、I2)
(Cl2和SO2以物质的量1:1混合后失去漂白作用)
③与KMnO4(H+)反应,使其紫色褪去:
5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
④与Fe3+反应,溶液由黄色变为浅绿色:
SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+
与CO2不同点: SO2有强还原性,能被碘水、溴水、氯水、KMnO4(H+)、FeCl3、O2、H2O2、HNO3等氧化剂氧化
例2:如何除去 CO2中SO2
例1:如何鉴别: SO2、CO2
例3:如何鉴别Na2SO3、Na2CO3
通过饱和NaHCO3溶液
答:使品红或KMnO4溶液(或溴水)褪色的是SO2
加入足量盐酸,产生的气体使品红或KMnO4溶液褪色的原物质是Na2SO3
或KMnO4溶液
注意审题
涉及 SO2、CO2的习题举例
例4 .下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
(1)在⑥中发生反应的化学方程式为______________________________________
(2)①中的实验现象为紫色石蕊
溶液__________,此实验证明SO2是__________气体。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是____________________,证明SO2有________性。
(5)④中的实验现象是___________________,证明SO2有________性。
(6)⑤的作用是__________,反应的化学方程式为_________________。
Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑
变红
酸性
褪色
漂白
有淡黄色沉淀生成
氧化
KMnO4溶液褪色
还原
吸收SO2,防止SO2污染环境
SO2+2NaOH==Na2SO3+H2O
[提示]SO2的漂白性
(1) SO2的漂白具有选择性,可以漂白品红溶液以及棉、麻等物品,
但不能漂白酸碱指示剂,如石蕊溶液等。
(2) SO2能使溴水、酸性KMnO4溶液褪色,是因为SO2具有还原性
而非漂白性。
例5.下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③滴有酚酞的NaOH溶液
④溴水 ⑤碘的淀粉溶液
A.只有①④ B.①②④ C.②③⑤ D.②④⑤
解析:SO2使③中溶液褪色,表现酸性氧化物的通性;使②④⑤中溶液褪色,表现还原性;使①中溶液褪色,表现漂白性。故正确答案为D。
D
1. 检验SO2中是否混有CO2,应采取的措施 ( )
A. 通过氢氧化钡溶液, 再通过石灰水
B. 通过酸性高锰酸钾溶液 ,再通过石灰水
C. 通过小苏打悬浊液,再通过石灰水
D. 通过澄清石灰水,再通过品红溶液
C
B
2. CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过如图所示的洗气瓶,(1)(2)两瓶中所装的试剂应该是 ( )
A.(1)浓H2SO4 (2)NaOH
B.(1)浓H2SO4 (2)Na2CO3
C.(1)饱和NaHCO3 (2)浓H2SO4
D.(1)NaOH (2)浓H2SO4
3. 若将SO2气体通入足量的BaCl2溶液中,则无明显现象产生。
①同时向BaCl2溶液中通入NH3和SO2,有白色沉淀产生,产生沉淀的化学式为 。
②同时向BaCl2溶液中通入SO2和Cl2,有白色沉淀产生,产生沉淀的化学式为 。
③写出相关反应的化学方程式 。
BaSO3
BaSO4
[解]①2NH3+H2O+SO2==(NH4)2SO3 (NH4)2SO3+BaCl2==BaSO3↓+2NH4Cl
②SO2+Br2+2H2O= H2SO4+2HBr H2SO4+BaCl2==BaSO4↓+2HCl
BaCl2
溶液
SO2
A
溶液
三等分
久置
白色沉淀A
白色沉淀B
白色沉淀C
滴加NaOH
溶液
滴加H2O2
溶液
问:①上述3种白色沉淀的成分是否相同?
②写出相关反应的化学方程式
SO2 + H2 O=H2SO3
O2 +2 H2SO3 = 2H2SO4
2NaOH + H2SO3 = Na2SO3+2H2O
Na2SO3+BaCl2== BaSO3↓+ 2NaCl
H2SO4+BaCl2==BaSO4↓+ 2HCl
H2SO3+H2O2==H2SO4+H2O
H2SO4+BaCl2==BaSO4↓+ 2HCl
【变式训练1】
或H2SO3+H2O2 +BaCl2==BaSO4↓+2HCl+H2O
【变式训练2】Cl2和SO2以体积比 3:1 混合后,通入 中,
现象是否相同?
1:1
1:3
品红溶液
紫色石蕊溶液
Cl2和SO2
1:1
1:3
3:1
通入品红溶液中
不褪色
褪色
褪色
Cl2和SO2
1:1
1:3
3:1
通入紫色石蕊溶液中
不褪色
先变红后褪色
变红后不褪色
分析:
写出相关反应的离子(或化学)方程式,并指出体现SO2的什么性质。
溴水
KMnO4(H+)
1)SO2使 褪色
2)SO2使 变浑浊
石灰水
氢硫酸
3)用饱和NaHCO3溶液除去CO2中的少量SO2
2H2S+SO2 = 3S↓+2H2O
5SO2+2H2O+2MnO4- = 2Mn2++5SO42-+4H+
SO2+Br2+2H2O= 4H++SO42-+2Br-
SO2 + Ca2++ 2OH- = CaSO3 ↓ +2 H2O
2NaHCO3+SO2 = Na2SO3 +2CO2↑ +H2O
2 HCO3-+ SO2 = SO32- +2CO2 ↑+H2O
SO2的还原性
SO2是酸性氧化物
SO2的氧化性
SO2是酸性氧化物,H2SO3酸性比H2CO3强
深化拓展
5)用漂白粉溶液通入足量SO2
SO2的还原性
2SO2 + Ca2++ 2ClO- + 2 H2O= CaSO4 ↓ +SO42-+4H++2Cl-
6) 向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成
2Fe3++SO2+2H2O==SO42-+4H++2Fe2+
SO2的还原性
写出相关反应的离子(或化学)方程式,并指出体现SO2的什么性质。
4)用漂白粉溶液除去少量SO2
SO2的还原性
SO2 + Ca2++ ClO- + H2O= CaSO4 ↓ +2H++ Cl-
深化拓展
Ba2++ +SO42-== BaSO4 ↓
7).探究H2SO3的酸性强于HClO,该同学用如图 所示装置达成实验目的。
①装置的连接顺序为纯净SO2→ (选填字母),D中反应的离子方程式为 。
②可证明H2SO3的酸性强于HClO的实验现象是 。
A.小苏打溶液 B.品红溶液
C.酸性KMnO4溶液 D.漂白粉溶液
【注】二氧化硫具有还原性,不能与漂白粉溶液发生复分解反应证明亚硫酸的酸性强于次氯酸,若要证明亚硫酸的酸性强于次氯酸,应将二氧化硫通入碳酸氢钠溶液中制得二氧化碳气体,将生成的气体通入酸性高锰酸钾溶液中除去二氧化硫,若气体通入品红溶液中不褪色,则说明二氧化硫被酸性高锰酸钾溶液完全吸收,剩余气体通入漂白粉溶液中生成白色沉淀,说明亚硫酸的酸性强于碳酸,碳酸的酸性强于次氯酸,从而证明亚硫酸的酸性强于次氯酸。
A→C→B→D
Ca2++2ClO-+CO2+H2O==CaCO3↓+2HClO
B中品红溶液不褪色,D中出现白色沉淀
易错题
深化拓展
8)吸烟有害健康,因为香烟烟雾中含有CO、CO2、SO2、H2O等气体,用下列物质可将其一一检出: A.无水硫酸铜 B.澄清石灰水 C.红热氧化铜 D.生石灰 E.酸性高锰酸钾溶液 F.品红溶液
检出的正确顺序是 ( )
A.混合气→A→E→B→A→D→C
B.混合气→C→D→E→E→A
C.混合气→A→E→F→B→D→C
D.混合气→B→E→A→D→C
【解析】操作顺序为
检验H2O(g)→检验并除去SO2→检验是否仍有SO2→检验CO2→干燥气体→检验CO
C
→
生石灰
深化拓展
9) 为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( )
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③浓硫酸
④灼热的铜网 ⑤碱石灰
A.①③④ B.③④⑤ C.②④③ D.②③④
D
周末自主整理作业
3BaSO3+2HNO3=3BaSO4 +2NO↑+H2O
Ba(NO3)2
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
