高中化学人教版(2019)必修第二册 5.1 第二课时《硫酸》课件(23张PPT)
文档属性
| 名称 | 高中化学人教版(2019)必修第二册 5.1 第二课时《硫酸》课件(23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-15 12:56:55 | ||
图片预览






文档简介
(共23张PPT)
二、硫 酸
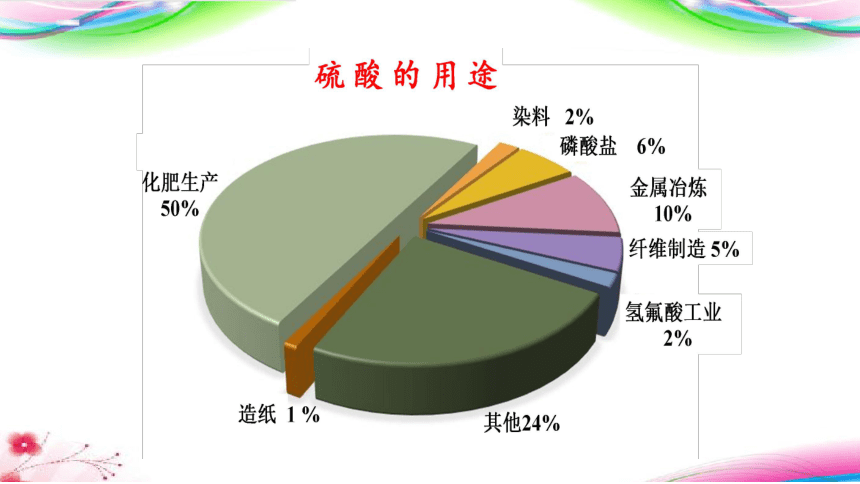
硫酸的美誉——化学工业之母
工业上常用硫酸的年产量来衡量一个国家的化工生产能力
近代化学工业是从无机化学品的生产开始起步的,酸碱盐,特别是“三酸二碱”是无机物生产中必不可少的原料。
“三酸”
“二碱”
硫酸
硝酸
盐酸
纯碱
氢氧化钠
“硫酸是工业之母”
侯德榜
(纯碱和化肥生产)
化学史料
浓硫酸
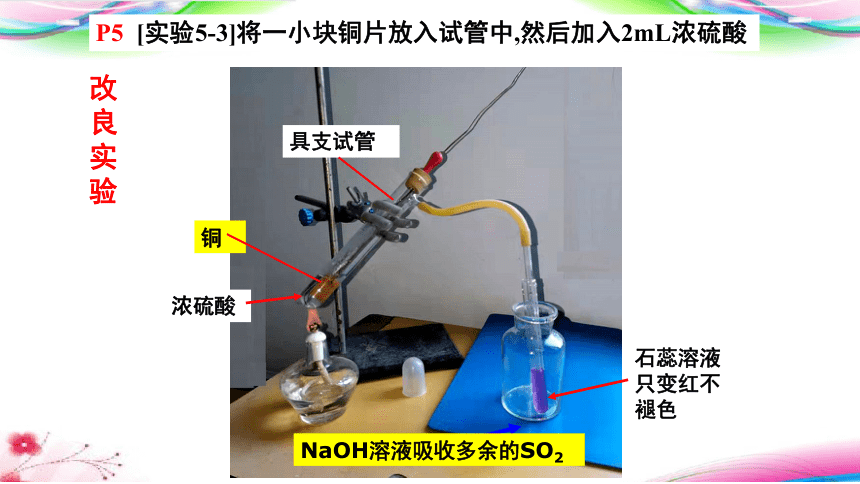
铜
具支试管
NaOH溶液吸收多余的SO2
石蕊溶液只变红不褪色
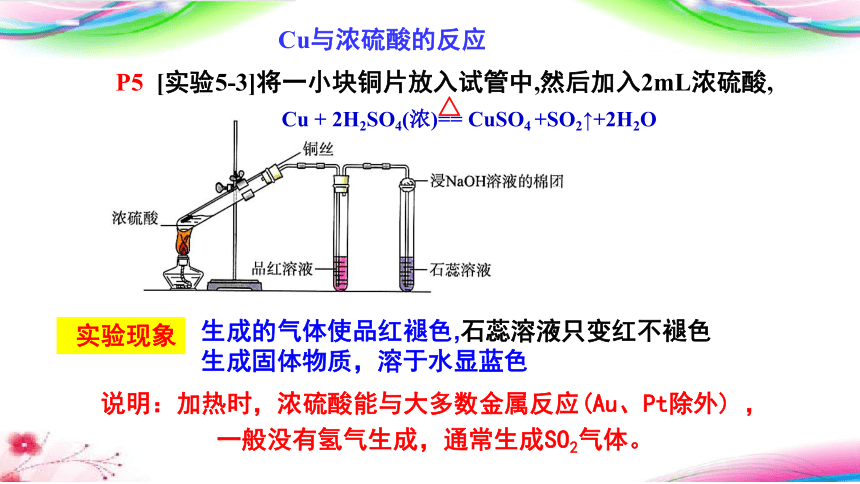
P5 [实验5-3]将一小块铜片放入试管中,然后加入2mL浓硫酸
改良实验
Cu与浓硫酸的反应
P5 [实验5-3]将一小块铜片放入试管中,然后加入2mL浓硫酸,
实验现象
生成的气体使品红褪色,石蕊溶液只变红不褪色
生成固体物质,溶于水显蓝色
Cu + 2H2SO4(浓)== CuSO4 +SO2↑+2H2O
△
说明:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,一般没有氢气生成,通常生成SO2气体。
(实验与思考):
实验4 向试管中加入2药匙胆矾,再加2 mL(约3个滴管)的浓硫酸,用玻璃棒搅拌
吸水性
探究二:探究浓硫酸的脱水性和吸水性
CuSO4·5H2O
浓硫酸
CuSO4
蓝色
白色
(放热)
实验3 用干燥洁净的玻璃棒分别蘸取少量的稀硫酸、浓硫酸点在蓝色石蕊试纸中央,注意观察
浓硫酸用作气体的干燥剂
Cu与浓硫酸的反应
Cu + 2H2SO4(浓)== CuSO4 +SO2↑+2H2O
△
问题一:该反应中浓硫酸能反应完全吗
问题二:常温下,稀硫酸能与活泼金属(铁、铝等)反应,也具有氧化性,二者的氧化性一样吗
浓硫酸既表现强氧化性,又表现酸性。
答:不一样,变价元素种类不同。
答:浓硫酸变稀后不再反应
Fe + H2SO4(稀)== FeSO4 +H2↑
蔗糖C12H22O11
蔗糖中的H与O去哪了?这究竟是什么样的故事!
C
C12H22O11 12C + 11H2O
浓硫酸
脱水性
【实验】黑面包实验
【实验5】取10g蔗糖放入小烧杯中,滴10滴水,加入约10 ml浓硫酸,迅速搅拌,然后罩上矿泉水瓶(去底),观察实验现象(大烧杯内有NaOH溶液)
【现象】蔗糖变黑,体积膨胀,有刺激性气味的气体生成,放出大量的热
【结论】表现浓硫酸的脱水性与氧化性
C12H22O11 12C + 11H2O
浓硫酸
C + 2H2SO4 (浓) = CO2↑+ SO2 ↑+ 2H2O
脱水性
氧化性
吸水性
黑面包实验
【实验5】 取10g蔗糖放入小烧杯中,滴10滴水,加入约10 ml浓硫酸,迅速搅拌,然后罩上矿泉水瓶(去底),观察实验现象(大烧杯内有NaOH溶液)
思考!在该实验过程中为何会闻到了刺激性气味?
浓硫酸
纸、木材
CuSO4 5H2O
C
CuSO4
浓硫酸
+ H2O
+ H2O
(黑色)
(白色)
脱水性
吸水性
吸水性和脱水性有哪些不同?
吸水性,是吸收物质本身含有的水分子(包括结晶水);
脱水性:浓H2SO4将有机物中的H、O两元素以H2O的形式脱去
吸水性,是吸收物质中本身含有的水分子(包括结晶水);
脱水性:浓H2SO4将有机物中的H、O两元素以H2O的形式脱去(原本无H2O)
P5
浓硫酸既表现强氧化性,又表现脱水性。
浓硫酸和稀硫酸的化学性质有哪些不同?为什么不同?
两者浓度不同,溶质微粒不同。
稀硫酸的弱氧化性由H+决定;
浓硫酸的特性由H2SO4分子决定,其强氧化性由H2SO4分子中+6价硫决定。
总结
浓硫酸有特性;稀硫酸有弱氧化性。
量变
引起
质变
稀H2SO4与浓H2SO4氧化性的比较:
比较 浓H2SO4 稀H2SO4
金属
非金属
组成微粒
表现出氧化性的粒子
还原产物
与活泼金属反应
与大部分金属加热时反应;Al、Fe常温下钝化
不反应
加热时能氧化C、S、P
H2SO4分子
SO2
思考:SO2、Cl2、浓H2SO4分别沾到湿润的蓝色石蕊试纸上的现象?
H+、SO42-离子
H2SO4分子
H+
H2
不同浓度硫酸的c(H+)
质量分数 物质的量浓度 mol·L-1 氢离子浓度
mol·L-1
0.48% 0.5 1
98% 18.4 0.79
数据佐证
稀硫酸:+6价的硫原子是以自由移动的SO42-形式存在, SO42-是正四面体结构,对称性好,比较稳定。
浓硫酸:主要以H2SO4分子形式存在,H对SO42-中的氧作用,使氧远离中心的S,S原子周围出现一定的空隙,容易被还原性微粒进攻,表现出氧化性。
知识拓展
②与非金属反应:(浓硫酸与木炭反应)
化学方程式为 。反应中氧化剂是 ,还原剂是 ,还原产物为 。
浓硫酸
C
SO2
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
注意:浓硫酸与非金属反应时,只表现出强氧化性。
浓硫酸
硫酸的储存和运输
工业上用铝(或铁)槽车盛放、运输浓硫酸
铝和铁遇到冷的浓硫酸,表面会生成一层致密的氧化膜而使反应停止,这现象叫钝化.
钝化属化学变化
硫酸的性质
硫酸的酸性
浓硫酸的特性
吸水性和脱水性
强氧化性
氧化大多数金属
氧化非金属
加热时,一般生成金属硫酸盐、二氧化硫和水
常温下,金属Fe、Al 发生“钝化”
总结
1.钝化:常温下浓硫酸使Fe、Al钝化,若加热或将浓硫酸稀释,则可以继续反应。
2.与活泼金属(如Zn)反应:开始产生SO2,硫酸浓度变小后,产生H2。
3.与某些不活泼金属(如Cu)反应:加热一段时间后开始产生SO2,浓度变小后,稀硫酸不再与Cu反应。如1mol Cu与含2mol H2SO4的浓硫酸充分反应,生成SO2的物质的量小于1mol。
浓硫酸与金属的反应规律
例1 .用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下抽拉①中铜丝可控制SO2的生成量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
D
解析:试管中剩余浓硫酸,应将反应后的混合液慢慢加入到大量水中.
例2.浓硫酸有许多重要的性质,在与含有少量水分的蔗糖作用的过程中不能显示的性质是( )
A.酸性 B.脱水性 C.强氧化性 D.吸水性
A
1.判断正误(正确的打“√”,错误的打“×”)
(1)浓硫酸有脱水性,所以可用浓硫酸作干燥剂。 ( )
(2)2 mol 的浓硫酸与足量铜反应,生成1 mol SO2气体 ( )
(3)浓硫酸与足量Zn反应的后期可以生成H2。 ( )
(4)H2、Cl2、CO2、HCl均可用浓硫酸干燥。 ( )
(5)浓硫酸使纸张变黑体现了浓H2SO4的脱水性。 ( )
×
×
√
√
√
(6)在空气中敞口久置的浓硫酸,溶液质量增大(体现了浓H2SO4脱水性)
×
(7)浓硫酸与食盐共热可制取HCl气体.
(体现了浓H2SO4不挥发性) ( )
√
H2SO4+2NaCl== Na2SO4+2HCl↑
2.在实验探究课上,同学们积极思考,共设计出如图所示的四种实验方案用以验证浓硫酸的吸水性,其中在理论上可行的是( )
解析:①中置于空气中的浓硫酸因吸收空气中的水而质量增加;②放置一段时间后,部分胆矾晶体表面会因失去结晶水而出现变白现象;③放置一段时间后饱和KNO3溶液会失去一部分水而析出晶体;④中会因浓硫酸吸收烧瓶中的水蒸气而使其压强减小,试管中的水会在导管中上升一段水柱。 答 ①②③④
①②③④
称量
3. 向50ml18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.等于0.45mol B. 等于0.90mol
C. 小于0.45mol D.在0.45mol与0.90mol之间
分析(1)随着反应的进行,浓硫酸转化为稀硫酸,便不再与铜反应。 n(H2SO4)=18mol/L×50mL×10-3=0.90mol
(2)Cu——2H2SO4——H2SO4(被还原)
若0.90mol浓硫酸全部参加反应,则被还原的为0.45mol.
C
二、硫 酸
硫酸的美誉——化学工业之母
工业上常用硫酸的年产量来衡量一个国家的化工生产能力
近代化学工业是从无机化学品的生产开始起步的,酸碱盐,特别是“三酸二碱”是无机物生产中必不可少的原料。
“三酸”
“二碱”
硫酸
硝酸
盐酸
纯碱
氢氧化钠
“硫酸是工业之母”
侯德榜
(纯碱和化肥生产)
化学史料
浓硫酸
铜
具支试管
NaOH溶液吸收多余的SO2
石蕊溶液只变红不褪色
P5 [实验5-3]将一小块铜片放入试管中,然后加入2mL浓硫酸
改良实验
Cu与浓硫酸的反应
P5 [实验5-3]将一小块铜片放入试管中,然后加入2mL浓硫酸,
实验现象
生成的气体使品红褪色,石蕊溶液只变红不褪色
生成固体物质,溶于水显蓝色
Cu + 2H2SO4(浓)== CuSO4 +SO2↑+2H2O
△
说明:加热时,浓硫酸能与大多数金属反应(Au、Pt除外) ,一般没有氢气生成,通常生成SO2气体。
(实验与思考):
实验4 向试管中加入2药匙胆矾,再加2 mL(约3个滴管)的浓硫酸,用玻璃棒搅拌
吸水性
探究二:探究浓硫酸的脱水性和吸水性
CuSO4·5H2O
浓硫酸
CuSO4
蓝色
白色
(放热)
实验3 用干燥洁净的玻璃棒分别蘸取少量的稀硫酸、浓硫酸点在蓝色石蕊试纸中央,注意观察
浓硫酸用作气体的干燥剂
Cu与浓硫酸的反应
Cu + 2H2SO4(浓)== CuSO4 +SO2↑+2H2O
△
问题一:该反应中浓硫酸能反应完全吗
问题二:常温下,稀硫酸能与活泼金属(铁、铝等)反应,也具有氧化性,二者的氧化性一样吗
浓硫酸既表现强氧化性,又表现酸性。
答:不一样,变价元素种类不同。
答:浓硫酸变稀后不再反应
Fe + H2SO4(稀)== FeSO4 +H2↑
蔗糖C12H22O11
蔗糖中的H与O去哪了?这究竟是什么样的故事!
C
C12H22O11 12C + 11H2O
浓硫酸
脱水性
【实验】黑面包实验
【实验5】取10g蔗糖放入小烧杯中,滴10滴水,加入约10 ml浓硫酸,迅速搅拌,然后罩上矿泉水瓶(去底),观察实验现象(大烧杯内有NaOH溶液)
【现象】蔗糖变黑,体积膨胀,有刺激性气味的气体生成,放出大量的热
【结论】表现浓硫酸的脱水性与氧化性
C12H22O11 12C + 11H2O
浓硫酸
C + 2H2SO4 (浓) = CO2↑+ SO2 ↑+ 2H2O
脱水性
氧化性
吸水性
黑面包实验
【实验5】 取10g蔗糖放入小烧杯中,滴10滴水,加入约10 ml浓硫酸,迅速搅拌,然后罩上矿泉水瓶(去底),观察实验现象(大烧杯内有NaOH溶液)
思考!在该实验过程中为何会闻到了刺激性气味?
浓硫酸
纸、木材
CuSO4 5H2O
C
CuSO4
浓硫酸
+ H2O
+ H2O
(黑色)
(白色)
脱水性
吸水性
吸水性和脱水性有哪些不同?
吸水性,是吸收物质本身含有的水分子(包括结晶水);
脱水性:浓H2SO4将有机物中的H、O两元素以H2O的形式脱去
吸水性,是吸收物质中本身含有的水分子(包括结晶水);
脱水性:浓H2SO4将有机物中的H、O两元素以H2O的形式脱去(原本无H2O)
P5
浓硫酸既表现强氧化性,又表现脱水性。
浓硫酸和稀硫酸的化学性质有哪些不同?为什么不同?
两者浓度不同,溶质微粒不同。
稀硫酸的弱氧化性由H+决定;
浓硫酸的特性由H2SO4分子决定,其强氧化性由H2SO4分子中+6价硫决定。
总结
浓硫酸有特性;稀硫酸有弱氧化性。
量变
引起
质变
稀H2SO4与浓H2SO4氧化性的比较:
比较 浓H2SO4 稀H2SO4
金属
非金属
组成微粒
表现出氧化性的粒子
还原产物
与活泼金属反应
与大部分金属加热时反应;Al、Fe常温下钝化
不反应
加热时能氧化C、S、P
H2SO4分子
SO2
思考:SO2、Cl2、浓H2SO4分别沾到湿润的蓝色石蕊试纸上的现象?
H+、SO42-离子
H2SO4分子
H+
H2
不同浓度硫酸的c(H+)
质量分数 物质的量浓度 mol·L-1 氢离子浓度
mol·L-1
0.48% 0.5 1
98% 18.4 0.79
数据佐证
稀硫酸:+6价的硫原子是以自由移动的SO42-形式存在, SO42-是正四面体结构,对称性好,比较稳定。
浓硫酸:主要以H2SO4分子形式存在,H对SO42-中的氧作用,使氧远离中心的S,S原子周围出现一定的空隙,容易被还原性微粒进攻,表现出氧化性。
知识拓展
②与非金属反应:(浓硫酸与木炭反应)
化学方程式为 。反应中氧化剂是 ,还原剂是 ,还原产物为 。
浓硫酸
C
SO2
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
注意:浓硫酸与非金属反应时,只表现出强氧化性。
浓硫酸
硫酸的储存和运输
工业上用铝(或铁)槽车盛放、运输浓硫酸
铝和铁遇到冷的浓硫酸,表面会生成一层致密的氧化膜而使反应停止,这现象叫钝化.
钝化属化学变化
硫酸的性质
硫酸的酸性
浓硫酸的特性
吸水性和脱水性
强氧化性
氧化大多数金属
氧化非金属
加热时,一般生成金属硫酸盐、二氧化硫和水
常温下,金属Fe、Al 发生“钝化”
总结
1.钝化:常温下浓硫酸使Fe、Al钝化,若加热或将浓硫酸稀释,则可以继续反应。
2.与活泼金属(如Zn)反应:开始产生SO2,硫酸浓度变小后,产生H2。
3.与某些不活泼金属(如Cu)反应:加热一段时间后开始产生SO2,浓度变小后,稀硫酸不再与Cu反应。如1mol Cu与含2mol H2SO4的浓硫酸充分反应,生成SO2的物质的量小于1mol。
浓硫酸与金属的反应规律
例1 .用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下抽拉①中铜丝可控制SO2的生成量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
D
解析:试管中剩余浓硫酸,应将反应后的混合液慢慢加入到大量水中.
例2.浓硫酸有许多重要的性质,在与含有少量水分的蔗糖作用的过程中不能显示的性质是( )
A.酸性 B.脱水性 C.强氧化性 D.吸水性
A
1.判断正误(正确的打“√”,错误的打“×”)
(1)浓硫酸有脱水性,所以可用浓硫酸作干燥剂。 ( )
(2)2 mol 的浓硫酸与足量铜反应,生成1 mol SO2气体 ( )
(3)浓硫酸与足量Zn反应的后期可以生成H2。 ( )
(4)H2、Cl2、CO2、HCl均可用浓硫酸干燥。 ( )
(5)浓硫酸使纸张变黑体现了浓H2SO4的脱水性。 ( )
×
×
√
√
√
(6)在空气中敞口久置的浓硫酸,溶液质量增大(体现了浓H2SO4脱水性)
×
(7)浓硫酸与食盐共热可制取HCl气体.
(体现了浓H2SO4不挥发性) ( )
√
H2SO4+2NaCl== Na2SO4+2HCl↑
2.在实验探究课上,同学们积极思考,共设计出如图所示的四种实验方案用以验证浓硫酸的吸水性,其中在理论上可行的是( )
解析:①中置于空气中的浓硫酸因吸收空气中的水而质量增加;②放置一段时间后,部分胆矾晶体表面会因失去结晶水而出现变白现象;③放置一段时间后饱和KNO3溶液会失去一部分水而析出晶体;④中会因浓硫酸吸收烧瓶中的水蒸气而使其压强减小,试管中的水会在导管中上升一段水柱。 答 ①②③④
①②③④
称量
3. 向50ml18mol/L的H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.等于0.45mol B. 等于0.90mol
C. 小于0.45mol D.在0.45mol与0.90mol之间
分析(1)随着反应的进行,浓硫酸转化为稀硫酸,便不再与铜反应。 n(H2SO4)=18mol/L×50mL×10-3=0.90mol
(2)Cu——2H2SO4——H2SO4(被还原)
若0.90mol浓硫酸全部参加反应,则被还原的为0.45mol.
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
