鲁教版化学九年级下册 7.4酸碱中和反应 同步练习(无答案)
文档属性
| 名称 | 鲁教版化学九年级下册 7.4酸碱中和反应 同步练习(无答案) |  | |
| 格式 | zip | ||
| 文件大小 | 156.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-17 11:03:41 | ||
图片预览



文档简介
7.4酸碱中和反应同步练习
一、选择题
1.逻辑推理是一种重要的化学思维方法。下列推理合理的是( )
A.溶液是均一、稳定的,所以均一、稳定的物质一定是溶液
B.酸性溶液能使紫色石蕊变红,则使紫色石蕊变红的溶液一定呈酸性
C.中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应
D.常温下,碱溶液的pH大于7,碳酸钠溶液的pH也大于7,则碳酸钠属于碱
2.我市有些滩涂地区的土壤被称为"盐碱地",当地农民常用引进内河淡水浸泡再排水的方法改良土壤。若以土壤pH为纵坐标,浸泡水次数(m)为横坐标,下列能正确表示土壤pH变化的图像的是( )
A. B. C. D.
3.下图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作,下列说法正确的是( )。
A.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
B.当滴入液体体积为5mL时,烧杯内溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL时,烧杯内溶液中的微粒有2种
4.为了探究酸碱中和反应是否放热,某同学设计了如图所示的实验装置(夹持等固定装置略),针对该实验目的,下列评价或改进,错误的是( )。
A.若观察到红墨水向右移则说明该实验一定有放热现象
B.为了使实验现象更明显,可改用氢氧化钠固体
C.在打开活塞a之前应先打开橡皮管上的止水夹
D.为了使实验更具有说服力,可用氢氧化钾溶液再次实验
5.下图是在一定量氢氧化钠溶液中不断加入盐酸的曲线图.纵坐标能表示的意义是( )
A.溶液温度变化 B.生成氯化钠的质量
C.溶液中水的质量 D.溶液中氯化氢的质量
6.在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是( )
A.滴入适量CuCl2溶液,溶液变蓝,但无沉淀生成
B.滴入几滴酚酞试液不变色
C.测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.滴入适量硝酸银溶液和稀硝酸,观察到有白色沉淀
7.25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是( )
A.℃,pH=7 B.℃,
C.℃,pH=14 D.℃,
8.下列应用一定与中和反应原理无关的是 ( )
A.施用熟石灰改良酸性土壤
B.用熟石灰和硫酸铜配制波尔多液
C.服用含Al(OH)3的药物治疗胃酸过多
D.用NaOH溶液洗涤石油产品中的残余硫酸
9.下列有关中和反应的说法正确的是 ( )
A.酸性物质和碱性物质发生的反应都属于中和反应
B.有盐和水生成的反应一定是中和反应
C.中和反应的实质是H++OH-H2O
D.中和反应都没有明显的现象
10.图6-K-1是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图。下列有关说法正确的是 ( )
图6-K-1
A.反应前后,溶液的pH不变
B.反应前后,Na+和Cl-的数目不变
C.反应前后,H+和OH-的数目不变
D.反应前后,水分子的数目不变
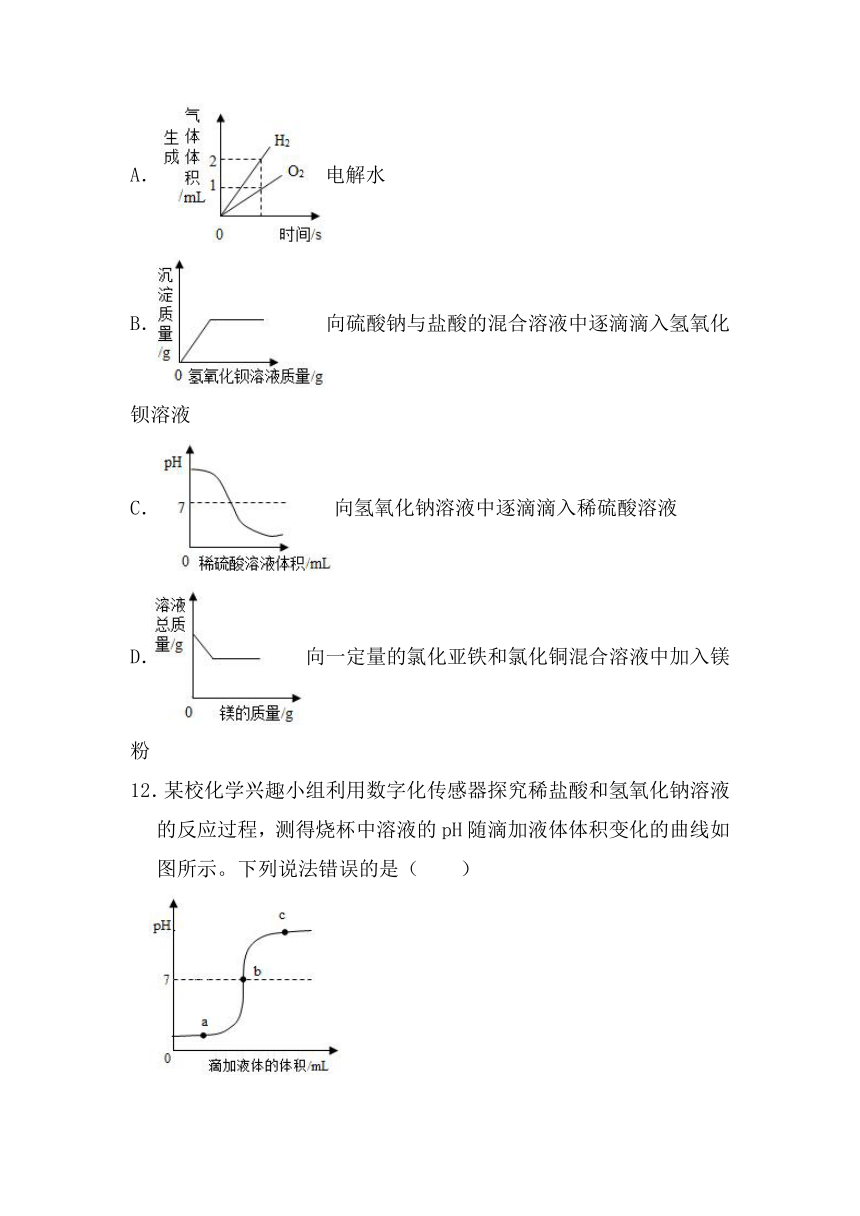
11.下列图象不能正确反映其对应变化关系的是( )
A.电解水
B.向硫酸钠与盐酸的混合溶液中逐滴滴入氢氧化钡溶液
C.向氢氧化钠溶液中逐滴滴入稀硫酸溶液
D.向一定量的氯化亚铁和氯化铜混合溶液中加入镁粉
12.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
二、非选择题
13.室温下,将氢氧化钠溶液慢慢滴入装有稀盐酸的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入氢氧化钠溶液质量的变化的曲线如图所示。
(1)由图可知,两物质发生的反应是 (填“放热”或“吸热”)反应。
(2)从A点到B点的过程中,烧杯中溶液的pH逐渐 (填“增大”或“减小”)。
(3) 点时恰好完全反应,C点的溶液中含有的溶质为 。
14.如图1所示是氢氧化钠溶液与盐酸反应的实验研究.
(1)未滴加盐酸时,烧杯中溶液呈 色.
(2)随着盐酸不断滴入,烧杯中溶液的pH逐渐 (填“增大”、“减小”或“不变”),该反应的化学方程式是 .
(3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图2所示.某时刻测得溶液的温度是32℃,请判断b点时溶液的酸碱性并说明理由 .
(4)当溶液的温度为38℃时,可证明溶液不含氢氧化钠的实验方法是 (填选项).
A.品尝烧杯中溶液的味道
B.用手沾取烧杯中溶液并体验是否有滑腻感
C.往烧杯中再滴加少量氢氧化钠溶液并观察溶液颜色.
15.鉴别稀盐酸、稀硫酸、Ba(OH)2溶液、Na2CO3溶液和NaCl溶液五瓶无标签的溶液时,将它们随意编号为1、2、3、4、5后进行如下实验:
步骤一 分别测pH:1号溶液pH=7,2号、3溶液pH<7,4号、5号溶液pH>7。
步骤二 取样两两混合:2号溶液+4号溶液→产生气泡,2号溶液+5号溶液→产生沉淀,3号溶液+4号溶液→产生气泡,3号溶液+5号溶液→无明显现象
步骤三 将步骤二中实验后的剩余物质倒入倒入同一烧杯中,充分混合后过滤,得沉淀和滤液。
(1)1号溶液中的溶质是_____;
(2)在步骤二中,如果只做一组两两混合实验,就完成了鉴别,这一组混合实验是_____;
A.2号溶液+4号溶液 B.2号溶液+5号溶液
C.3号溶液+4号溶液 D.3号溶液+5号溶液
(3)若将4号溶液与5号溶液混合时发生的反应可用化学方程式表示为_____;
(4)若向步骤三中所得滤液样品逐滴加入Na2CO3溶液至过量,发现先有气泡产生,后有白色沉淀生成,则下列说法中,正确的是_____。
a.步骤三中所得滤液可用于检验NaOH是否变质
b.步骤三中所得沉淀可用于除去BaCl2溶液中的少量盐酸
c.向步骤三中所得滤液里加入Mg、CuO、H2SO4都有明显现象
16.中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
(实验目的)证明氢氧化钠溶液与盐酸发生化学反应。
(实验步骤)
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
(1)(思考拓展)
从下列仪器中选择步骤二中的“仪器A”,名称是________。
(2)兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH 0~8.2 8.2~10.0 10.0~14.0
颜色 无色 粉红色 红色
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是________。
(3)为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:
步骤 现象 结论
将白色固体溶于水形成溶液,均分成两等份 向其中一份滴加CuSO4溶液,振荡、静置 ①无________色沉淀生成 白色固体不是NaOH。
向另一份滴加AgNO3溶液,振荡、静置 出现白色沉淀 ②白色固体是NaCl,反应的化学方程式为________。
(4)(继续探究)
如图1是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是________。
(5)兴趣小组认为上述实验对反应实质缺少直观的验证。
査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了如图实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。
①U型管内液面左低右高说明该反应________热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO-和H+构成。变色硅胶由蓝色变成红色的原因是________(用化学方程式表示)。
一、选择题
1.逻辑推理是一种重要的化学思维方法。下列推理合理的是( )
A.溶液是均一、稳定的,所以均一、稳定的物质一定是溶液
B.酸性溶液能使紫色石蕊变红,则使紫色石蕊变红的溶液一定呈酸性
C.中和反应有盐和水生成,所以生成盐和水的反应一定是中和反应
D.常温下,碱溶液的pH大于7,碳酸钠溶液的pH也大于7,则碳酸钠属于碱
2.我市有些滩涂地区的土壤被称为"盐碱地",当地农民常用引进内河淡水浸泡再排水的方法改良土壤。若以土壤pH为纵坐标,浸泡水次数(m)为横坐标,下列能正确表示土壤pH变化的图像的是( )
A. B. C. D.
3.下图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作,下列说法正确的是( )。
A.该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中
B.当滴入液体体积为5mL时,烧杯内溶液呈酸性
C.当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应
D.当滴入液体体积为9mL时,烧杯内溶液中的微粒有2种
4.为了探究酸碱中和反应是否放热,某同学设计了如图所示的实验装置(夹持等固定装置略),针对该实验目的,下列评价或改进,错误的是( )。
A.若观察到红墨水向右移则说明该实验一定有放热现象
B.为了使实验现象更明显,可改用氢氧化钠固体
C.在打开活塞a之前应先打开橡皮管上的止水夹
D.为了使实验更具有说服力,可用氢氧化钾溶液再次实验
5.下图是在一定量氢氧化钠溶液中不断加入盐酸的曲线图.纵坐标能表示的意义是( )
A.溶液温度变化 B.生成氯化钠的质量
C.溶液中水的质量 D.溶液中氯化氢的质量
6.在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是( )
A.滴入适量CuCl2溶液,溶液变蓝,但无沉淀生成
B.滴入几滴酚酞试液不变色
C.测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.滴入适量硝酸银溶液和稀硝酸,观察到有白色沉淀
7.25℃时,pH=1的盐酸与pH=13的氢氧化钠溶液混合,立即测定混合液的温度T,然后测定混合液的pH(25℃时)。有关判断合理的是( )
A.℃,pH=7 B.℃,
C.℃,pH=14 D.℃,
8.下列应用一定与中和反应原理无关的是 ( )
A.施用熟石灰改良酸性土壤
B.用熟石灰和硫酸铜配制波尔多液
C.服用含Al(OH)3的药物治疗胃酸过多
D.用NaOH溶液洗涤石油产品中的残余硫酸
9.下列有关中和反应的说法正确的是 ( )
A.酸性物质和碱性物质发生的反应都属于中和反应
B.有盐和水生成的反应一定是中和反应
C.中和反应的实质是H++OH-H2O
D.中和反应都没有明显的现象
10.图6-K-1是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图。下列有关说法正确的是 ( )
图6-K-1
A.反应前后,溶液的pH不变
B.反应前后,Na+和Cl-的数目不变
C.反应前后,H+和OH-的数目不变
D.反应前后,水分子的数目不变
11.下列图象不能正确反映其对应变化关系的是( )
A.电解水
B.向硫酸钠与盐酸的混合溶液中逐滴滴入氢氧化钡溶液
C.向氢氧化钠溶液中逐滴滴入稀硫酸溶液
D.向一定量的氯化亚铁和氯化铜混合溶液中加入镁粉
12.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A.图中b点所示溶液中,溶质是NaCl
B.向图中c点所示溶液中滴加无色酚酞,溶液不变色
C.该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D.由a点到b点的pH变化过程证明酸和碱发生了中和反应
二、非选择题
13.室温下,将氢氧化钠溶液慢慢滴入装有稀盐酸的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入氢氧化钠溶液质量的变化的曲线如图所示。
(1)由图可知,两物质发生的反应是 (填“放热”或“吸热”)反应。
(2)从A点到B点的过程中,烧杯中溶液的pH逐渐 (填“增大”或“减小”)。
(3) 点时恰好完全反应,C点的溶液中含有的溶质为 。
14.如图1所示是氢氧化钠溶液与盐酸反应的实验研究.
(1)未滴加盐酸时,烧杯中溶液呈 色.
(2)随着盐酸不断滴入,烧杯中溶液的pH逐渐 (填“增大”、“减小”或“不变”),该反应的化学方程式是 .
(3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图2所示.某时刻测得溶液的温度是32℃,请判断b点时溶液的酸碱性并说明理由 .
(4)当溶液的温度为38℃时,可证明溶液不含氢氧化钠的实验方法是 (填选项).
A.品尝烧杯中溶液的味道
B.用手沾取烧杯中溶液并体验是否有滑腻感
C.往烧杯中再滴加少量氢氧化钠溶液并观察溶液颜色.
15.鉴别稀盐酸、稀硫酸、Ba(OH)2溶液、Na2CO3溶液和NaCl溶液五瓶无标签的溶液时,将它们随意编号为1、2、3、4、5后进行如下实验:
步骤一 分别测pH:1号溶液pH=7,2号、3溶液pH<7,4号、5号溶液pH>7。
步骤二 取样两两混合:2号溶液+4号溶液→产生气泡,2号溶液+5号溶液→产生沉淀,3号溶液+4号溶液→产生气泡,3号溶液+5号溶液→无明显现象
步骤三 将步骤二中实验后的剩余物质倒入倒入同一烧杯中,充分混合后过滤,得沉淀和滤液。
(1)1号溶液中的溶质是_____;
(2)在步骤二中,如果只做一组两两混合实验,就完成了鉴别,这一组混合实验是_____;
A.2号溶液+4号溶液 B.2号溶液+5号溶液
C.3号溶液+4号溶液 D.3号溶液+5号溶液
(3)若将4号溶液与5号溶液混合时发生的反应可用化学方程式表示为_____;
(4)若向步骤三中所得滤液样品逐滴加入Na2CO3溶液至过量,发现先有气泡产生,后有白色沉淀生成,则下列说法中,正确的是_____。
a.步骤三中所得滤液可用于检验NaOH是否变质
b.步骤三中所得沉淀可用于除去BaCl2溶液中的少量盐酸
c.向步骤三中所得滤液里加入Mg、CuO、H2SO4都有明显现象
16.中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
(实验目的)证明氢氧化钠溶液与盐酸发生化学反应。
(实验步骤)
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
(1)(思考拓展)
从下列仪器中选择步骤二中的“仪器A”,名称是________。
(2)兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH 0~8.2 8.2~10.0 10.0~14.0
颜色 无色 粉红色 红色
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是________。
(3)为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:
步骤 现象 结论
将白色固体溶于水形成溶液,均分成两等份 向其中一份滴加CuSO4溶液,振荡、静置 ①无________色沉淀生成 白色固体不是NaOH。
向另一份滴加AgNO3溶液,振荡、静置 出现白色沉淀 ②白色固体是NaCl,反应的化学方程式为________。
(4)(继续探究)
如图1是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是________。
(5)兴趣小组认为上述实验对反应实质缺少直观的验证。
査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了如图实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。
①U型管内液面左低右高说明该反应________热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO-和H+构成。变色硅胶由蓝色变成红色的原因是________(用化学方程式表示)。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
