9.2 溶解度(第1课时)同步课件精讲-九年级化学下册
文档属性
| 名称 | 9.2 溶解度(第1课时)同步课件精讲-九年级化学下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 936.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
人教版 化学(初中)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
1.理解掌握饱和溶液的概念;
2.理解饱和溶液与不饱和溶液的关系;
3.掌握结晶现象。
1.对饱和溶液和不饱和溶液的理解;
2.饱和溶液和不饱和溶液的相互转化。
彤彤要喝糖水,他在一杯水中加了一勺糖,感觉不甜,就加糖,一直加到糖不溶解了,喝了一口水,很甜。他还想让糖水更甜点,于是又加了一勺糖,可是糖水没有变得更甜,这是怎么回事?怎么让没有溶解的糖溶解呢?这个过程说明了什么?
往20mL水中加入5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
往20mL水中加入
5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
再加入15mL水
烧杯内固体全部溶解
溶质在溶剂中的溶解量是受溶剂体积影响。
溶质不能无限制的溶解在(一定量)溶剂里。
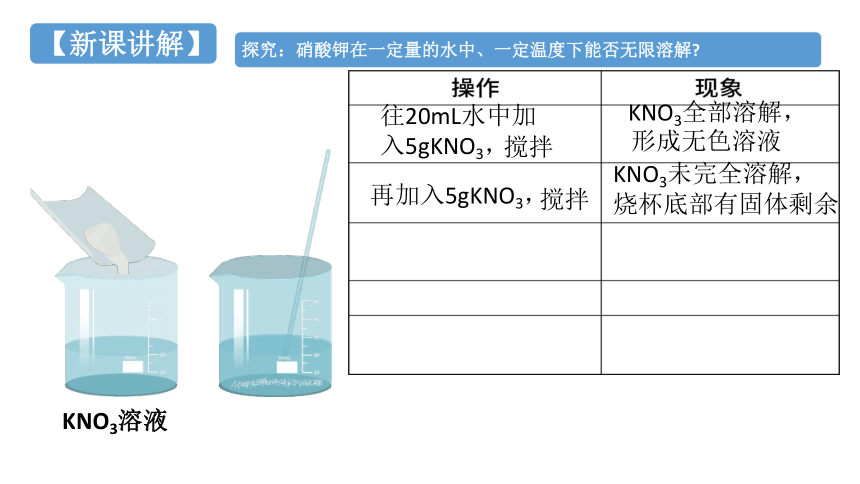
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
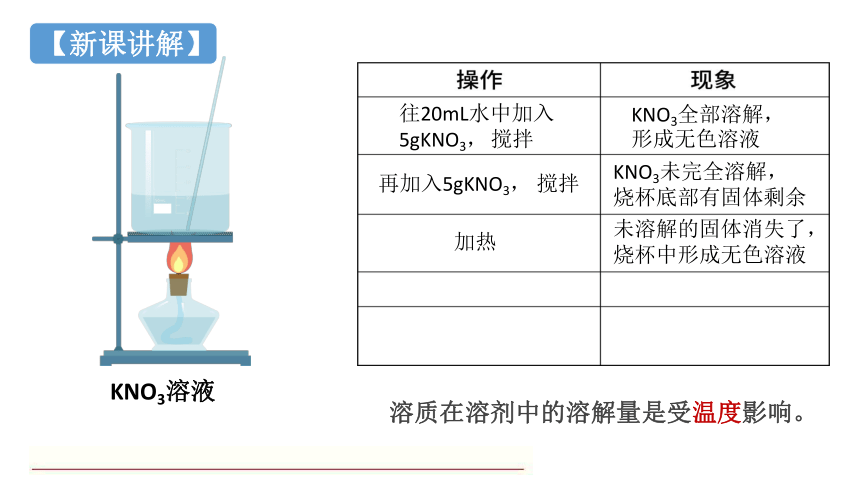
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
冷却
有固体从溶液中结晶出来
一、饱和溶液与不饱和溶液:
在一定的温度下,在一定量的溶剂里,不能再继续溶解某种物质的溶液,叫做该物质的饱和溶液;还能继续溶解该物质的溶液叫做该物质的不饱和溶液。
谈论饱和溶液与不饱和溶液一定要强调温度和溶剂的量不变,否则没有意义。
1、饱和溶液与不饱和溶液的前提条件是什么?
一定温度、一定量的溶剂
溶质是否能继续溶解
2、从实验看饱和溶液与不饱和溶液的根本区别是什么?
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。
2.如果溶液中无剩余物质,则加少量的溶质,溶质能继续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
一种溶质的饱和溶液还能溶解其它物质吗?
一种溶质的饱和溶液还能溶解其他物质
【结论】
操作 现象 结论
向饱和的食盐溶液中加入高锰酸钾固体
高锰酸钾溶解,溶液变成红色
饱和的食盐溶液还可以溶解高锰酸钾
强调:饱和溶液必须说明是“这种溶质”的饱和溶液。
1.不能再溶解某种溶质的溶液叫饱和溶液;
2.装有饱和溶液的瓶的瓶底,一定有这种溶质的固体;
3.使一接近饱和的溶液变成饱和溶液,可将其中的溶剂倒出一些;
4. 浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
在一定温度.一定量的溶剂中,不能再继续溶解该溶质的溶液
不一定,有可能刚好达到饱和.
依然是不饱和溶液
浓溶液不一定是饱和溶液
二、结晶
如何将硝酸钾溶液中的溶质硝酸钾提取出来?
较高温度下的硝酸钾溶液
烧杯底部有晶体析出
结晶后所得到的溶液是饱和溶液。
溶质从溶液中析出的过程叫结晶。
结晶的方法
蒸发溶剂:适用于固体溶解度随温度变化影响不大的物质。如氯化钠。
冷却热饱和溶液:适用于固体溶解度随温度的降低而减小且溶解度受温度影响变化较大的固体物质。如硝酸钾。
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐的构成
蒸发溶剂
海水
贮水池
蒸发池
结晶池
升高温度
饱和溶液
不饱和溶液
饱和溶液
①增加溶质
①增加溶剂
大多数固体:
②蒸发溶剂
③降低温度
②升高温度
降低温度
特例:氢氧化钙Ca(OH)2的溶液
不饱和溶液
①Ca(OH)2和气体等,它的溶解度随温度升高而降低;
②最可靠的方法是:加溶质、蒸发溶剂。
【课堂小结】
增加溶剂或改变温度
饱和溶液
4.结晶:
饱和溶液 结晶
降温结晶
蒸发结晶
1.饱和溶液与不饱和溶液
①“一定温度”;②“一定量溶剂”;③“某溶质”。
2.饱和溶液的判断:“1看2加”
3.转化:
不饱和溶液
增加溶质、蒸发溶剂或改变温度
【典例精讲】
例1.(2021·浙江丽水·中考真题)20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
【典例精讲】
【答案】B
【解析】A、由图可知,20℃时,甲烧杯中硝酸钾固体有剩余,故甲烧杯中,硝酸钾溶液是饱和溶液,不符合题意;B、丙烧杯里的固体硝酸钾已完全溶解,而丁烧杯又加入了25g水,所以可以推断出丁烧杯中,硝酸钾溶液是不饱和溶液,符合题意;C、由图可知,20℃时,乙为饱和溶液,乙→丙过程中,加入25g水,固体全部溶解,丙烧杯中可能是饱和溶液,也可能是不饱和溶液,若丙为饱和溶液,则乙→丙过程中,硝酸钾溶液的溶质质量分数不变,若丙为不饱和溶液,则乙→丙过程中,硝酸钾溶液的溶质质量分数变小,不符合题意;D、丙→丁的过程中,溶质不变,溶剂增加,硝酸钾溶液的溶质质量分数变小,不符合题意。故选B。
【典例精讲】
例2.(2020山东青岛)下列有关溶液的说法正确的是( )
A.溶液是溶质的粒子分散在溶剂中形成的均一、稳定的混合物
B.溶液加水稀释后溶质的质量减少
C.同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化
D.温度和溶剂的种类对物质的溶解性没有影响
【典例精讲】
【答案】AC
【解析】A、溶液是一种物质或一种以上的物质的粒子分散到另一种物质中,形成均一的、稳定的混合物,故选项正确;B、溶液加水稀释后溶质的质量不变,故选项错误;C、在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液,还能继续溶解该种溶质的溶液叫做该种溶质的不饱和溶液;饱和溶液变为不饱和溶液一般方法是加入溶剂或升高(降低)温度,不饱和溶液变为饱和溶液的方法是加入溶质、或蒸发溶剂、或降低(升高)温度。所以同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化,故选项正确;D、影响溶解性的因素包括内部因素和外部因素。其中,内部因素是溶质、溶剂本身的性质,例如,食盐容易溶解在水里,却很难溶解在汽油里;油脂很难溶解在水里,却很容易溶解在汽油里。外部因素是温度、压强(是对气体来说的)。例如,除了气体和氢氧化钙等特殊的固体溶质的溶解性与温度成反比以外,一般物质的溶解性与温度成正比;还有气体的溶解性也与压强成正比。故选项错误。故选AC。
【达标检测】
1、下列关于饱和溶液的说法中,错误的是( )
A.在温度不变时,KNO3饱和溶液不能再溶解KNO3晶体
B.改变条件可以使不饱和溶液变成饱和溶液
C.室温下,与固体溶质共存的溶液一定是这种溶质的饱和溶液
D.在温度升高时,某物质的饱和溶液一定能继续溶解该物质
D
【达标检测】
2、在温度为t℃时,某物质的饱和溶液一定是( )
A.稀溶液 B.含有100g溶剂的溶液
C.浓溶液 D.不能再溶解该物质的溶液
3、某物质的饱和溶液中,加入一些该溶质的固体,则下列说法
中正确的是( )
A.溶质质量减少 B.溶液质量增大
C.固体质量不变 D.溶质质量增加
D
C
【达标检测】
4.下列有关饱和溶液和不饱和溶液的说法中,不正确的是( )
A.在一定条件下,不能继续溶解该溶质的溶液即为该溶质的饱和溶液B.浓溶液一定是饱和溶液
C.析出晶体后的溶液还是当时条件下的饱和溶液
D.冷却或蒸发溶剂都有可能使不饱和氯化钾溶液达到饱和
B
【达标检测】
5.在一定温度下,将一瓶接近饱和的硝酸钾溶液转变为饱和溶液可采取的方法有( )
①升高温度; ②降低温度; ③增加硝酸钾;
④减少硝酸钾; ⑤增加溶剂; ⑥减少溶剂。
A.①②③ B.②③④
C.③④⑤ D.②③⑥
D
1.完成配套练习册;
2.预习固体溶解度;
3.书面作业:课后习题1、2。
谢 谢!
人教版 化学(初中)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
1.理解掌握饱和溶液的概念;
2.理解饱和溶液与不饱和溶液的关系;
3.掌握结晶现象。
1.对饱和溶液和不饱和溶液的理解;
2.饱和溶液和不饱和溶液的相互转化。
彤彤要喝糖水,他在一杯水中加了一勺糖,感觉不甜,就加糖,一直加到糖不溶解了,喝了一口水,很甜。他还想让糖水更甜点,于是又加了一勺糖,可是糖水没有变得更甜,这是怎么回事?怎么让没有溶解的糖溶解呢?这个过程说明了什么?
往20mL水中加入5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
往20mL水中加入
5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
再加入15mL水
烧杯内固体全部溶解
溶质在溶剂中的溶解量是受溶剂体积影响。
溶质不能无限制的溶解在(一定量)溶剂里。
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
冷却
有固体从溶液中结晶出来
一、饱和溶液与不饱和溶液:
在一定的温度下,在一定量的溶剂里,不能再继续溶解某种物质的溶液,叫做该物质的饱和溶液;还能继续溶解该物质的溶液叫做该物质的不饱和溶液。
谈论饱和溶液与不饱和溶液一定要强调温度和溶剂的量不变,否则没有意义。
1、饱和溶液与不饱和溶液的前提条件是什么?
一定温度、一定量的溶剂
溶质是否能继续溶解
2、从实验看饱和溶液与不饱和溶液的根本区别是什么?
1. 如果溶液中有未溶解的溶质, 观察能否继续溶解,若不能继续溶解,则是饱和溶液;反之,则是不饱和溶液。
2.如果溶液中无剩余物质,则加少量的溶质,溶质能继续溶解的是不饱和溶液,不能继续溶解的是饱和溶液。
一种溶质的饱和溶液还能溶解其它物质吗?
一种溶质的饱和溶液还能溶解其他物质
【结论】
操作 现象 结论
向饱和的食盐溶液中加入高锰酸钾固体
高锰酸钾溶解,溶液变成红色
饱和的食盐溶液还可以溶解高锰酸钾
强调:饱和溶液必须说明是“这种溶质”的饱和溶液。
1.不能再溶解某种溶质的溶液叫饱和溶液;
2.装有饱和溶液的瓶的瓶底,一定有这种溶质的固体;
3.使一接近饱和的溶液变成饱和溶液,可将其中的溶剂倒出一些;
4. 浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
在一定温度.一定量的溶剂中,不能再继续溶解该溶质的溶液
不一定,有可能刚好达到饱和.
依然是不饱和溶液
浓溶液不一定是饱和溶液
二、结晶
如何将硝酸钾溶液中的溶质硝酸钾提取出来?
较高温度下的硝酸钾溶液
烧杯底部有晶体析出
结晶后所得到的溶液是饱和溶液。
溶质从溶液中析出的过程叫结晶。
结晶的方法
蒸发溶剂:适用于固体溶解度随温度变化影响不大的物质。如氯化钠。
冷却热饱和溶液:适用于固体溶解度随温度的降低而减小且溶解度受温度影响变化较大的固体物质。如硝酸钾。
食盐
母液
氯化钠
多种化工原料
从海水中提取食盐的构成
蒸发溶剂
海水
贮水池
蒸发池
结晶池
升高温度
饱和溶液
不饱和溶液
饱和溶液
①增加溶质
①增加溶剂
大多数固体:
②蒸发溶剂
③降低温度
②升高温度
降低温度
特例:氢氧化钙Ca(OH)2的溶液
不饱和溶液
①Ca(OH)2和气体等,它的溶解度随温度升高而降低;
②最可靠的方法是:加溶质、蒸发溶剂。
【课堂小结】
增加溶剂或改变温度
饱和溶液
4.结晶:
饱和溶液 结晶
降温结晶
蒸发结晶
1.饱和溶液与不饱和溶液
①“一定温度”;②“一定量溶剂”;③“某溶质”。
2.饱和溶液的判断:“1看2加”
3.转化:
不饱和溶液
增加溶质、蒸发溶剂或改变温度
【典例精讲】
例1.(2021·浙江丽水·中考真题)20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
【典例精讲】
【答案】B
【解析】A、由图可知,20℃时,甲烧杯中硝酸钾固体有剩余,故甲烧杯中,硝酸钾溶液是饱和溶液,不符合题意;B、丙烧杯里的固体硝酸钾已完全溶解,而丁烧杯又加入了25g水,所以可以推断出丁烧杯中,硝酸钾溶液是不饱和溶液,符合题意;C、由图可知,20℃时,乙为饱和溶液,乙→丙过程中,加入25g水,固体全部溶解,丙烧杯中可能是饱和溶液,也可能是不饱和溶液,若丙为饱和溶液,则乙→丙过程中,硝酸钾溶液的溶质质量分数不变,若丙为不饱和溶液,则乙→丙过程中,硝酸钾溶液的溶质质量分数变小,不符合题意;D、丙→丁的过程中,溶质不变,溶剂增加,硝酸钾溶液的溶质质量分数变小,不符合题意。故选B。
【典例精讲】
例2.(2020山东青岛)下列有关溶液的说法正确的是( )
A.溶液是溶质的粒子分散在溶剂中形成的均一、稳定的混合物
B.溶液加水稀释后溶质的质量减少
C.同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化
D.温度和溶剂的种类对物质的溶解性没有影响
【典例精讲】
【答案】AC
【解析】A、溶液是一种物质或一种以上的物质的粒子分散到另一种物质中,形成均一的、稳定的混合物,故选项正确;B、溶液加水稀释后溶质的质量不变,故选项错误;C、在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液,还能继续溶解该种溶质的溶液叫做该种溶质的不饱和溶液;饱和溶液变为不饱和溶液一般方法是加入溶剂或升高(降低)温度,不饱和溶液变为饱和溶液的方法是加入溶质、或蒸发溶剂、或降低(升高)温度。所以同种溶质的饱和溶液与不饱和溶液通过改变条件可以相互转化,故选项正确;D、影响溶解性的因素包括内部因素和外部因素。其中,内部因素是溶质、溶剂本身的性质,例如,食盐容易溶解在水里,却很难溶解在汽油里;油脂很难溶解在水里,却很容易溶解在汽油里。外部因素是温度、压强(是对气体来说的)。例如,除了气体和氢氧化钙等特殊的固体溶质的溶解性与温度成反比以外,一般物质的溶解性与温度成正比;还有气体的溶解性也与压强成正比。故选项错误。故选AC。
【达标检测】
1、下列关于饱和溶液的说法中,错误的是( )
A.在温度不变时,KNO3饱和溶液不能再溶解KNO3晶体
B.改变条件可以使不饱和溶液变成饱和溶液
C.室温下,与固体溶质共存的溶液一定是这种溶质的饱和溶液
D.在温度升高时,某物质的饱和溶液一定能继续溶解该物质
D
【达标检测】
2、在温度为t℃时,某物质的饱和溶液一定是( )
A.稀溶液 B.含有100g溶剂的溶液
C.浓溶液 D.不能再溶解该物质的溶液
3、某物质的饱和溶液中,加入一些该溶质的固体,则下列说法
中正确的是( )
A.溶质质量减少 B.溶液质量增大
C.固体质量不变 D.溶质质量增加
D
C
【达标检测】
4.下列有关饱和溶液和不饱和溶液的说法中,不正确的是( )
A.在一定条件下,不能继续溶解该溶质的溶液即为该溶质的饱和溶液B.浓溶液一定是饱和溶液
C.析出晶体后的溶液还是当时条件下的饱和溶液
D.冷却或蒸发溶剂都有可能使不饱和氯化钾溶液达到饱和
B
【达标检测】
5.在一定温度下,将一瓶接近饱和的硝酸钾溶液转变为饱和溶液可采取的方法有( )
①升高温度; ②降低温度; ③增加硝酸钾;
④减少硝酸钾; ⑤增加溶剂; ⑥减少溶剂。
A.①②③ B.②③④
C.③④⑤ D.②③⑥
D
1.完成配套练习册;
2.预习固体溶解度;
3.书面作业:课后习题1、2。
谢 谢!
同课章节目录
