9.2 溶解度(第2课时)同步课件精讲-九年级化学下册
文档属性
| 名称 | 9.2 溶解度(第2课时)同步课件精讲-九年级化学下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-14 18:46:03 | ||
图片预览









文档简介
(共40张PPT)
人教版 化学(初中)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
1.了解溶解度的含义;
2.会绘制溶解度曲线,并能从溶解度曲线得出相关信息;
3.会阐明影响气体溶解度的因素,并能解释一些生活现象。
1.固体溶解度含义的理解;
2.从溶解度曲线上得出相关信息。
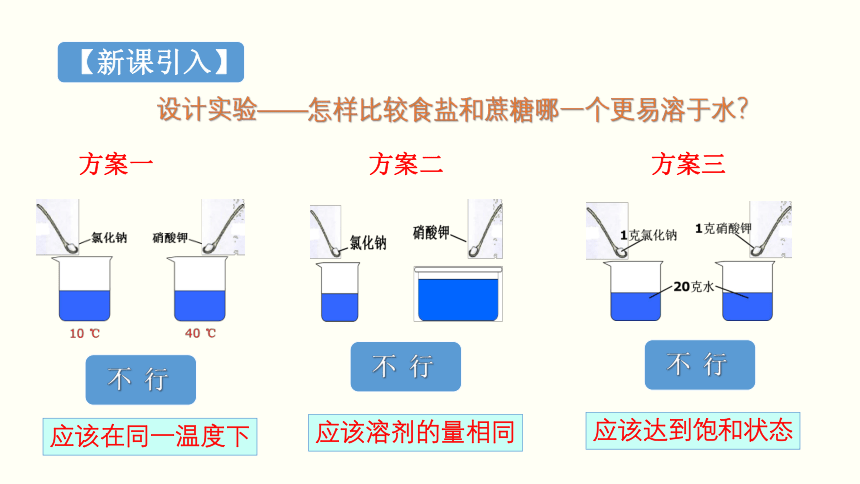
设计实验——怎样比较食盐和蔗糖哪一个更易溶于水?
应该在同一温度下
方案一
应该溶剂的量相同
方案二
方案三
应该达到饱和状态
定状态(达到饱和)
比较不同物质的溶解能力,应该控制的条件有:
定温度
定溶剂的量
溶解性:
一种物质(溶质)溶解在另一种物质(溶剂)里的能力。
溶解性大小:
如何定量描述物质溶解能力?
(定性)
易溶、可溶、微溶、难溶
条件:
(s)
标准:
单位:
状态:
在一定温度下。
在100g溶剂里。
饱和。
g
四元素
1、固体物质的溶解度:
概念:
注意:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时
所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
没有指明溶剂,溶剂默认为水。
下列有关NaCl的溶解度的说法正确的是( )
A.20℃时,18gNaCl溶解在50g水中达到饱和状态,20℃时,NaCl的溶解度为18g
B.36gNaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36g
C.20℃时,35gNaCl完全溶解在100g水中,20℃时,NaCl的溶解度为35g
D.20℃时,100g水中最多溶解36gNaCl,20℃时,NaCl的溶解度为36g
20℃时,100g水中最多能溶解36gNaCl
D
溶解度的含义:
20℃时,NaCl的溶解度为36g
20℃时,NaCl在100g水中达到饱和状态时所溶解的质量为36g
判断下列说法是否正确,并指明错误原因。
①把20g某物质溶解在100g水里恰好制成饱和溶液,这种物质的溶解度就是20g。
②20℃时10g氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10g。
③20℃时10g氯化钠可溶解在100g水里,故20℃时氯化钠的溶解度是10g。
④20℃时36g食盐溶解在100g水中恰好饱和,故20℃时食盐的溶解度是36。
未指明温度
未指明溶剂的量
未指明溶液的状态是饱和
溶解度的单位是“克”
×
×
×
×
2. 溶解性与溶解度的关系
>10
1~10
0.01~1
<0.01
溶解性 溶解度/g
易溶
可溶
微溶
难溶
3.影响固体溶解度的因素
①溶质的性质
②溶剂的性质
③温度(外因)
(水)
(某一种固体物质)
注意:对于固体物质来说改变溶剂的量不会改变溶解度
溶质质量
溶剂质量
100g
4.某温度下的饱和溶液,溶质、溶解溶液之间的关系
溶液质量
S
100g+S
=
=
S
100g+S
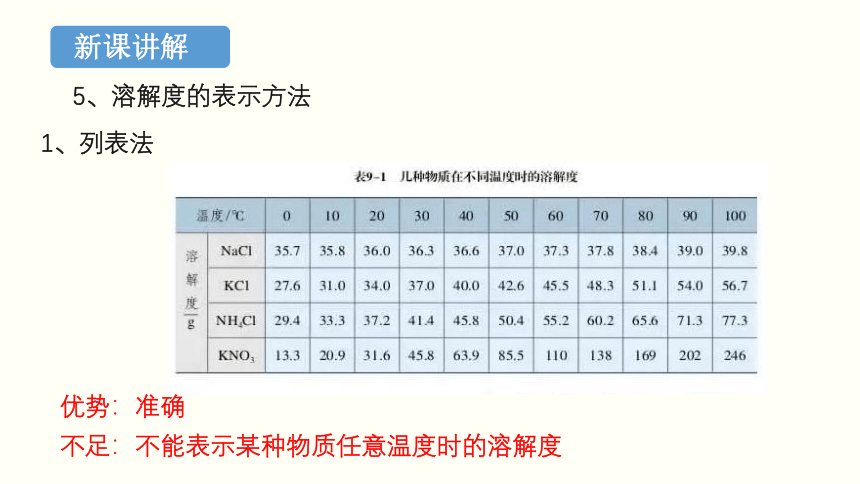
5、溶解度的表示方法
1、列表法
优势:准确
不足:不能表示某种物质任意温度时的溶解度
2、曲线法
溶解度/g
100
90
80
70
60
50
40
30
20
10
0
温度/℃
13.3
20.9
31.6
63.9
45.8
85.5
110
138
202
246
168
硝酸钾在不同温度时的溶解度
纵坐标表示溶解度
横坐标表示温度
优势:可以反映出表示某种物质任意温度时的溶解度
不足:不准确
6.溶解度曲线图
几种固体物质溶解度曲线
熟石灰的溶解度随温度升高而降低
Ca(OH)2
1、概念:溶解度随温度变化的曲线。
溶解度/g
KNO3
NaCl
Ca(OH)2
A
t1 t2
S1
S2
2、点的含义
①曲线上的点A:表示t1℃时,Ca(OH)2的溶解度为S1g。
②曲线的交点B:表示t2℃时,Ca(OH)2和KNO3的溶解度相等,为S2g。
B
B
陡升型
3、线的含义
①大多数固体物质的溶解度随温度的升高而明显增大。如:KNO3等。
缓升型
②少数固体物质的溶解度受温度影响变化不大。如:NaCl。
下降型
③极少数固体物质的溶解度随温度的升高而减小。如:Ca(OH)2。
Ca(OH)2
4、面的含义
①曲线上方的区域表示该物质的过饱和溶液。即溶液中有溶质固体剩余。
②曲线下方的区域表示该物质的不饱和溶液。
溶解度曲线的应用:
1、可以查出某种物质在某温度时的溶解度大小。
6、通过溶解度曲线确定混合物的分离、提纯方法。
2、可以看出物质的溶解度随温度变化的规律。
3、比较不同物质在同一温度时的溶解度大小。
4、可以比较不同物质的溶解度受温度变化影响的大小。
5、可以根据溶解度曲线确定如何让制得某温度时的该物质的饱和溶液。
适用于溶解度随温度升高而减小的物质如:Ca(OH) 2
(1)降温结晶:(又叫冷却热饱和溶液法)
(2)蒸发溶剂法:
适用于溶解度随温度变化影响较小的物质如:NaCl
适用于溶解度随温度变化影响较大的物质如:KNO3
从溶解度曲线分析结晶情况
应用----结晶方法
(3)升温结晶法:
饱和状态时的气体体积。
四要素
条件:
101kPa和一定温度
一体积水
标准:
状态:饱和
单位:
体积/没有单位
CO2在0℃下的溶解度是1.713。
0℃,101kPa条件下,
一体积水中最多可以溶解1.713体积的CO2。
0℃,101kPa条件下,
水中最多溶解的CO2 的体积
水的体积
= 1.713
标准状况
气体物质的溶解度
概念:
气体的压强为101kPa和一定温度时,
(1)气体溶解度与固体溶解度的比较
气体溶解度 固体溶解度
溶剂的量
条件
单位
相同点
温度和压强(101kPa)
温度
体积/没有单位
克(g)
1体积水
100g溶剂
要求溶质溶解在溶剂中达到饱和状态
②压强:一般随压强增大而增大,压强减小而减小。
①温度:一般随温度升高而减小,温度降低而增大。
(2)影响气体溶解度的因素:
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
表示方法
溶解度曲线
列表法
定量描述
②压强:一般随压强增大而增大,压强减小而减小。
①温度:一般随温度升高而减小,温度降低而增大。
(2)影响气体溶解度的因素:
饱和状态时的气体体积。
(1)概念:
气体的压强为101kPa和一定温度时,
气体溶解度
【典例精讲】
例1(2021·四川成都)60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,析出固体质量的变化如图1,结合图2,下列说法正确的是( )
A.加入的KNO3质量为41.6g
B.降温过程中KNO3溶液始终为饱和溶液
C.蒸发溶剂可将M点的溶液转化到N点
D.20℃时,100g KNO3饱和溶液中有KNO331. 6g
【典例精讲】
【答案】A
【解析】A、20℃时,硝酸钾的溶解度为31.6g,即该温度下,100g水中最多能溶解31.6g硝酸钾,故60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,共析出10g硝酸钾,说明加入硝酸钾的质量为41.6g,符合题意;B、由图2可知,硝酸钾的溶解度随温度的升高而增加,由图1可知,降温过程中,一开始没有溶质析出,说明一开始是不饱和溶液,后有溶质析出,变为饱和溶液,不符合题意;C、M点为20℃时,硝酸钾的饱和溶液,N点为20℃时,硝酸钾的不饱和溶液,故增加溶剂或恒温蒸发可将M点的溶液转化到N点,不符合题意;D、20℃时,硝酸钾的溶解度为31.6g,131.6g硝酸钾饱和溶液中硝酸钾的质量31.6g,不符合题意。故选A。
【典例精讲】
例2.(2021·山东泰安)如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )
A.使a、c的饱和溶液析出晶体都可以
采用降温结晶的方法
B.t1℃时,a、c两种物质的溶液溶质
质量分数一定相等
C.t2℃时,a、b、c三种物质的饱和
溶液溶质质量分数由大到小的关系是:a>b>c
D.在t2℃时,将30ga物质加入50g水中充分溶解,
所得溶液质量为80g
【典例精讲】
【答案】C
【解析】A、根据图中曲线可知,a的溶解度随温度降低而减小,使其饱和溶液析出晶体可以采用降温结晶的方法。c的溶解度随温度升高而减小,使其饱和溶液析出晶体应采用升温结晶的方法,选项A不正确;B、t1℃时,a、c两种物质的溶解度曲线相交,溶解度相等,两种物质的饱和溶液溶质质量分数一定相等,否则不一定相等,选项B不正确;C、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是:a>b>c,溶解度越大,其饱和溶液溶质质量分数越大,因此t2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是:a>b>c,选项C正确;D、在t2℃时,a的溶解度是50g,因此将30ga物质加入50g水中充分溶解,只能溶解25g,所得溶液质量为75g,选项D不正确。故选C。
【典例精讲】
例3.(2021·江苏连云港)向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等
D.蔗糖的溶解度随温度的升高而减小
【典例精讲】
【答案】A
【解析】A、对比乙丙图可知,升温固体溶解,可采用升温的方法使乙烧杯中剩余的固体溶解,A正确。B、溶液中没有固体不溶解,可能刚好饱和,也可能不饱和,B错误。C、乙、丙烧杯中溶剂质量相等,乙部分溶解,丙全部溶解,溶质的质量分数不相等,C错误。D、对比乙丙图可知,升温固体溶解,蔗糖的溶解度随温度的升高而增大,D错误。故选:A。
【典例精讲】
例4.(2021·江苏扬州)Na2SO4与NaCl的溶解度曲线如图所示。下列说法正确的是( )
A.加水能使NaCl溶液从不饱和变为饱和
B.20℃时,NaCl的溶解度比Na2SO4大
C.P点时,NaC1与Na2SO4的饱和溶液质量分数相等
D.将Na2SO4饱和溶液从30℃冷却至10℃,有晶体析出,溶液变为不饱和
【典例精讲】
【答案】BC
【解析】A、不饱和溶液转化为饱和溶液常用的方法有:加入同种溶质,恒温蒸发溶剂,降温(大多数溶液),故加水能使NaCl溶液从不饱和变为饱和说法错误;B、根据Na2SO4与NaCl的溶解度曲线,在20℃时,氯化钠的溶解度大于硫酸钠,说法正确;C、在P点时,氯化钠和硫酸钠的溶解度相等,饱和的两种溶液中溶质质量分数相等,故说法正确;D、将Na2SO4饱和溶液从30℃冷却至10℃,有晶体析出,溶液仍然是饱和溶液,故说法错误;故选择BC。
【达标检测】
1.甲、乙两种固体的溶解度曲线如下图。现将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里, 则下列说法正确的是( )
A.甲溶液中溶质的质量分数增大
B.乙溶液中剩余的固体减少
C.试管里甲、乙物质的溶解度都增大
D.试管里甲、乙两溶液中的溶质都减少
B
【达标检测】
2.生活中的下列现象,不能说明气体的溶解度随温
度的升高而减小的是( )
A.刚烧水时,水中有气泡冒出
B.喝下汽水时,感觉有气体冲到鼻腔里
C.打开啤酒瓶盖时,有大量的泡沫溢出
D.夏季午后池塘里鱼常跃出水面
C
【达标检测】
3.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是_______________
(2)当温度为t1 C,三种物质溶解度由小到大依次为_______,当温度为t3 C时,溶解度
最大的是____.
(3)C可能表示哪种物质:____________________
A和C两种物质在t2 C时的溶解度相同
C>A>B
A
Ca(OH)2或CO2等气体
1.完成配套练习册;
2.预习课题3溶液的浓度;
3.书面作业:课后习题1、2。
谢 谢!
人教版 化学(初中)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
1.了解溶解度的含义;
2.会绘制溶解度曲线,并能从溶解度曲线得出相关信息;
3.会阐明影响气体溶解度的因素,并能解释一些生活现象。
1.固体溶解度含义的理解;
2.从溶解度曲线上得出相关信息。
设计实验——怎样比较食盐和蔗糖哪一个更易溶于水?
应该在同一温度下
方案一
应该溶剂的量相同
方案二
方案三
应该达到饱和状态
定状态(达到饱和)
比较不同物质的溶解能力,应该控制的条件有:
定温度
定溶剂的量
溶解性:
一种物质(溶质)溶解在另一种物质(溶剂)里的能力。
溶解性大小:
如何定量描述物质溶解能力?
(定性)
易溶、可溶、微溶、难溶
条件:
(s)
标准:
单位:
状态:
在一定温度下。
在100g溶剂里。
饱和。
g
四元素
1、固体物质的溶解度:
概念:
注意:
在一定温度下,某固态物质在100g溶剂里达到饱和状态时
所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
没有指明溶剂,溶剂默认为水。
下列有关NaCl的溶解度的说法正确的是( )
A.20℃时,18gNaCl溶解在50g水中达到饱和状态,20℃时,NaCl的溶解度为18g
B.36gNaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36g
C.20℃时,35gNaCl完全溶解在100g水中,20℃时,NaCl的溶解度为35g
D.20℃时,100g水中最多溶解36gNaCl,20℃时,NaCl的溶解度为36g
20℃时,100g水中最多能溶解36gNaCl
D
溶解度的含义:
20℃时,NaCl的溶解度为36g
20℃时,NaCl在100g水中达到饱和状态时所溶解的质量为36g
判断下列说法是否正确,并指明错误原因。
①把20g某物质溶解在100g水里恰好制成饱和溶液,这种物质的溶解度就是20g。
②20℃时10g氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10g。
③20℃时10g氯化钠可溶解在100g水里,故20℃时氯化钠的溶解度是10g。
④20℃时36g食盐溶解在100g水中恰好饱和,故20℃时食盐的溶解度是36。
未指明温度
未指明溶剂的量
未指明溶液的状态是饱和
溶解度的单位是“克”
×
×
×
×
2. 溶解性与溶解度的关系
>10
1~10
0.01~1
<0.01
溶解性 溶解度/g
易溶
可溶
微溶
难溶
3.影响固体溶解度的因素
①溶质的性质
②溶剂的性质
③温度(外因)
(水)
(某一种固体物质)
注意:对于固体物质来说改变溶剂的量不会改变溶解度
溶质质量
溶剂质量
100g
4.某温度下的饱和溶液,溶质、溶解溶液之间的关系
溶液质量
S
100g+S
=
=
S
100g+S
5、溶解度的表示方法
1、列表法
优势:准确
不足:不能表示某种物质任意温度时的溶解度
2、曲线法
溶解度/g
100
90
80
70
60
50
40
30
20
10
0
温度/℃
13.3
20.9
31.6
63.9
45.8
85.5
110
138
202
246
168
硝酸钾在不同温度时的溶解度
纵坐标表示溶解度
横坐标表示温度
优势:可以反映出表示某种物质任意温度时的溶解度
不足:不准确
6.溶解度曲线图
几种固体物质溶解度曲线
熟石灰的溶解度随温度升高而降低
Ca(OH)2
1、概念:溶解度随温度变化的曲线。
溶解度/g
KNO3
NaCl
Ca(OH)2
A
t1 t2
S1
S2
2、点的含义
①曲线上的点A:表示t1℃时,Ca(OH)2的溶解度为S1g。
②曲线的交点B:表示t2℃时,Ca(OH)2和KNO3的溶解度相等,为S2g。
B
B
陡升型
3、线的含义
①大多数固体物质的溶解度随温度的升高而明显增大。如:KNO3等。
缓升型
②少数固体物质的溶解度受温度影响变化不大。如:NaCl。
下降型
③极少数固体物质的溶解度随温度的升高而减小。如:Ca(OH)2。
Ca(OH)2
4、面的含义
①曲线上方的区域表示该物质的过饱和溶液。即溶液中有溶质固体剩余。
②曲线下方的区域表示该物质的不饱和溶液。
溶解度曲线的应用:
1、可以查出某种物质在某温度时的溶解度大小。
6、通过溶解度曲线确定混合物的分离、提纯方法。
2、可以看出物质的溶解度随温度变化的规律。
3、比较不同物质在同一温度时的溶解度大小。
4、可以比较不同物质的溶解度受温度变化影响的大小。
5、可以根据溶解度曲线确定如何让制得某温度时的该物质的饱和溶液。
适用于溶解度随温度升高而减小的物质如:Ca(OH) 2
(1)降温结晶:(又叫冷却热饱和溶液法)
(2)蒸发溶剂法:
适用于溶解度随温度变化影响较小的物质如:NaCl
适用于溶解度随温度变化影响较大的物质如:KNO3
从溶解度曲线分析结晶情况
应用----结晶方法
(3)升温结晶法:
饱和状态时的气体体积。
四要素
条件:
101kPa和一定温度
一体积水
标准:
状态:饱和
单位:
体积/没有单位
CO2在0℃下的溶解度是1.713。
0℃,101kPa条件下,
一体积水中最多可以溶解1.713体积的CO2。
0℃,101kPa条件下,
水中最多溶解的CO2 的体积
水的体积
= 1.713
标准状况
气体物质的溶解度
概念:
气体的压强为101kPa和一定温度时,
(1)气体溶解度与固体溶解度的比较
气体溶解度 固体溶解度
溶剂的量
条件
单位
相同点
温度和压强(101kPa)
温度
体积/没有单位
克(g)
1体积水
100g溶剂
要求溶质溶解在溶剂中达到饱和状态
②压强:一般随压强增大而增大,压强减小而减小。
①温度:一般随温度升高而减小,温度降低而增大。
(2)影响气体溶解度的因素:
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
表示方法
溶解度曲线
列表法
定量描述
②压强:一般随压强增大而增大,压强减小而减小。
①温度:一般随温度升高而减小,温度降低而增大。
(2)影响气体溶解度的因素:
饱和状态时的气体体积。
(1)概念:
气体的压强为101kPa和一定温度时,
气体溶解度
【典例精讲】
例1(2021·四川成都)60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,析出固体质量的变化如图1,结合图2,下列说法正确的是( )
A.加入的KNO3质量为41.6g
B.降温过程中KNO3溶液始终为饱和溶液
C.蒸发溶剂可将M点的溶液转化到N点
D.20℃时,100g KNO3饱和溶液中有KNO331. 6g
【典例精讲】
【答案】A
【解析】A、20℃时,硝酸钾的溶解度为31.6g,即该温度下,100g水中最多能溶解31.6g硝酸钾,故60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,共析出10g硝酸钾,说明加入硝酸钾的质量为41.6g,符合题意;B、由图2可知,硝酸钾的溶解度随温度的升高而增加,由图1可知,降温过程中,一开始没有溶质析出,说明一开始是不饱和溶液,后有溶质析出,变为饱和溶液,不符合题意;C、M点为20℃时,硝酸钾的饱和溶液,N点为20℃时,硝酸钾的不饱和溶液,故增加溶剂或恒温蒸发可将M点的溶液转化到N点,不符合题意;D、20℃时,硝酸钾的溶解度为31.6g,131.6g硝酸钾饱和溶液中硝酸钾的质量31.6g,不符合题意。故选A。
【典例精讲】
例2.(2021·山东泰安)如图是a、b、c三种固体物质的溶解度曲线。下列说法正确的是( )
A.使a、c的饱和溶液析出晶体都可以
采用降温结晶的方法
B.t1℃时,a、c两种物质的溶液溶质
质量分数一定相等
C.t2℃时,a、b、c三种物质的饱和
溶液溶质质量分数由大到小的关系是:a>b>c
D.在t2℃时,将30ga物质加入50g水中充分溶解,
所得溶液质量为80g
【典例精讲】
【答案】C
【解析】A、根据图中曲线可知,a的溶解度随温度降低而减小,使其饱和溶液析出晶体可以采用降温结晶的方法。c的溶解度随温度升高而减小,使其饱和溶液析出晶体应采用升温结晶的方法,选项A不正确;B、t1℃时,a、c两种物质的溶解度曲线相交,溶解度相等,两种物质的饱和溶液溶质质量分数一定相等,否则不一定相等,选项B不正确;C、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是:a>b>c,溶解度越大,其饱和溶液溶质质量分数越大,因此t2℃时,a、b、c三种物质的饱和溶液溶质质量分数由大到小的关系是:a>b>c,选项C正确;D、在t2℃时,a的溶解度是50g,因此将30ga物质加入50g水中充分溶解,只能溶解25g,所得溶液质量为75g,选项D不正确。故选C。
【典例精讲】
例3.(2021·江苏连云港)向盛有等质量水的甲、乙、丙三个烧杯中分别加入15g、30g、30g蔗糖固体,充分搅拌后静置,现象如图所示。下列说法正确的是( )
A.可采用升温的方法使乙烧杯中剩余的固体溶解
B.甲、丙烧杯中的溶液一定属于不饱和溶液
C.乙、丙烧杯中溶质的质量分数相等
D.蔗糖的溶解度随温度的升高而减小
【典例精讲】
【答案】A
【解析】A、对比乙丙图可知,升温固体溶解,可采用升温的方法使乙烧杯中剩余的固体溶解,A正确。B、溶液中没有固体不溶解,可能刚好饱和,也可能不饱和,B错误。C、乙、丙烧杯中溶剂质量相等,乙部分溶解,丙全部溶解,溶质的质量分数不相等,C错误。D、对比乙丙图可知,升温固体溶解,蔗糖的溶解度随温度的升高而增大,D错误。故选:A。
【典例精讲】
例4.(2021·江苏扬州)Na2SO4与NaCl的溶解度曲线如图所示。下列说法正确的是( )
A.加水能使NaCl溶液从不饱和变为饱和
B.20℃时,NaCl的溶解度比Na2SO4大
C.P点时,NaC1与Na2SO4的饱和溶液质量分数相等
D.将Na2SO4饱和溶液从30℃冷却至10℃,有晶体析出,溶液变为不饱和
【典例精讲】
【答案】BC
【解析】A、不饱和溶液转化为饱和溶液常用的方法有:加入同种溶质,恒温蒸发溶剂,降温(大多数溶液),故加水能使NaCl溶液从不饱和变为饱和说法错误;B、根据Na2SO4与NaCl的溶解度曲线,在20℃时,氯化钠的溶解度大于硫酸钠,说法正确;C、在P点时,氯化钠和硫酸钠的溶解度相等,饱和的两种溶液中溶质质量分数相等,故说法正确;D、将Na2SO4饱和溶液从30℃冷却至10℃,有晶体析出,溶液仍然是饱和溶液,故说法错误;故选择BC。
【达标检测】
1.甲、乙两种固体的溶解度曲线如下图。现将两试管分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里, 则下列说法正确的是( )
A.甲溶液中溶质的质量分数增大
B.乙溶液中剩余的固体减少
C.试管里甲、乙物质的溶解度都增大
D.试管里甲、乙两溶液中的溶质都减少
B
【达标检测】
2.生活中的下列现象,不能说明气体的溶解度随温
度的升高而减小的是( )
A.刚烧水时,水中有气泡冒出
B.喝下汽水时,感觉有气体冲到鼻腔里
C.打开啤酒瓶盖时,有大量的泡沫溢出
D.夏季午后池塘里鱼常跃出水面
C
【达标检测】
3.如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是_______________
(2)当温度为t1 C,三种物质溶解度由小到大依次为_______,当温度为t3 C时,溶解度
最大的是____.
(3)C可能表示哪种物质:____________________
A和C两种物质在t2 C时的溶解度相同
C>A>B
A
Ca(OH)2或CO2等气体
1.完成配套练习册;
2.预习课题3溶液的浓度;
3.书面作业:课后习题1、2。
谢 谢!
同课章节目录
