四川省凉山州宁南中学2021-2022学年高二下学期开学考试化学试题(Word版含答案)
文档属性
| 名称 | 四川省凉山州宁南中学2021-2022学年高二下学期开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 227.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-15 19:32:42 | ||
图片预览



文档简介
宁南中学2021-2022学年度下期高二年级入学考试
化学试题
考试时间:90分钟 满分:100分
审题:高二化学备课组
可能用到的相对原子质量:H-1 C-12 Fe—56 O—16 Cu-64
第Ⅰ卷(选择题)
一、选择题(每小题只有一个正确选项,共17小题,每小题3分,共51分。)
1.下列根据反应原理设计的应用,不正确的是 ( )。
A.CO32-+H2O ??HCO3-+OH-用热的纯碱溶液清洗油污
B.Al3++3H2O ?? Al(OH)3+3H+明矾净水
C.TiCl4+(x+2)H2O(过量) ??TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
2.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L 0.05mol·L-1的FeCl3溶液中所含的Fe3+的数目为0.05NA
B.0.2molSO2和0.1molO2充分反应后,得到SO3的分子数为0.2NA
C.100mL 0.2mol·L-1H2SO4溶液中,所含的氧原子的数目为0.08NA
D.1L 0.1mol·L-1NH4NO3溶液中,含有的氮原子数为0.2NA
3.常温下,下列指定溶液中离子可能大量共存的是
A.由水电离产生的的溶液:K+、、、
B.NaHCO3溶液中:K+、、、
C.的溶液中:、、、
D.含有的溶液:K+、、、
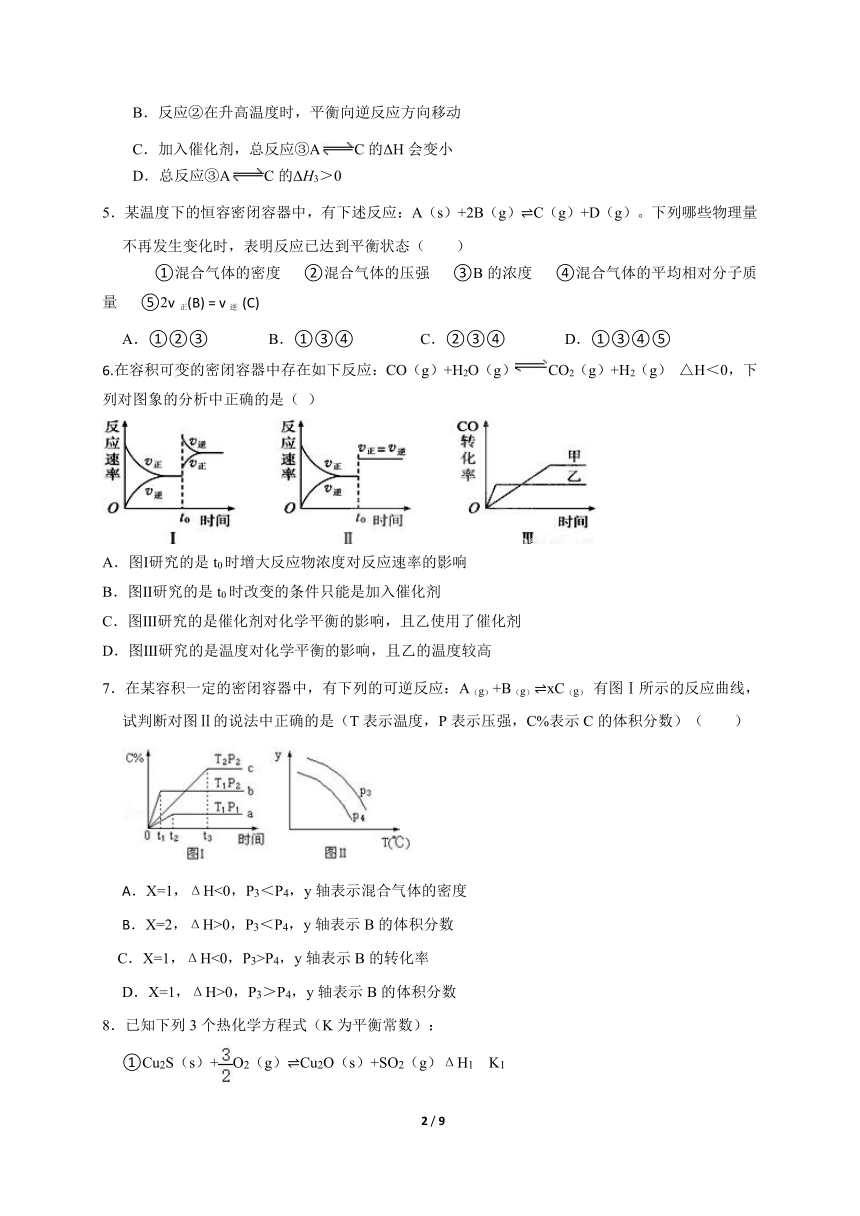
4.化学反应①AB和②BC的反应过程中能量变化如图所示。下列有关该反应的叙述错误的是( )
A.反应①的ΔH1>0
B.反应②在升高温度时,平衡向逆反应方向移动
C.加入催化剂,总反应③AC的ΔH会变小
D.总反应③AC的ΔH3>0
5.某温度下的恒容密闭容器中,有下述反应:A(s)+2B(g) C(g)+D(g)。下列哪些物理量不再发生变化时,表明反应已达到平衡状态( )
①混合气体的密度 ②混合气体的压强 ③B的浓度 ④混合气体的平均相对分子质量 ⑤2v 正(B) = v逆 (C)
A.①②③ B.①③④ C.②③④ D.①③④⑤
6.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g) △H<0,下列对图象的分析中正确的是( )
A.图Ⅰ研究的是t0时增大反应物浓度对反应速率的影响
B.图Ⅱ研究的是t0时改变的条件只能是加入催化剂
C.图Ⅲ研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
7.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g) 有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
X=1,ΔH<0,P3<P4,y轴表示混合气体的密度
X=2,ΔH>0,P3<P4,y轴表示B的体积分数
C.X=1,ΔH<0,P3>P4,y轴表示B的转化率
D.X=1,ΔH>0,P3>P4,y轴表示B的体积分数
8.已知下列3个热化学方程式(K为平衡常数):
①Cu2S(s)+O2(g) Cu2O(s)+SO2(g)ΔH1 K1
②2Cu2O(s)+Cu2S(s) 6Cu(s)+SO2(g)ΔH2 K2
③Cu2S(s)+O2(g) 2Cu(s)+SO2(g)ΔH3 K3
则ΔH3和K3的表达式分别为( )
A.2ΔH1+ΔH2,2K1 K2 B. C. D.
9.25 ℃时,水的电离达到平衡:H2OH++OH-;ΔH>0,下列叙述正确的是
A.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变
C.向水中加入少量固体Na,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
10.下列四种溶液中,水的电离程度最大的是
A.的溶液 B.的溶液
C.pH=7的NaCl溶液 D.的溶液
11.下表是Fe2+、Fe3+、Cu2+被完全沉淀时溶液的pH。某硫酸铜酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的CuSO4,加入试剂最佳组合是( )
金属离子 Fe2+ Fe3+ Cu2+
完全沉淀时的pH 7.7 4.5 6.7
A.H2O2、CuO B.氨水
C.KMnO4、CuCO3 D.NaOH溶液
12.下列实验误差分析不正确的是( )
A.用标准溶液滴定溶液来测定其浓度,选择酚酞为指示剂
B.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测放出的热量偏小
C.用润湿的试纸测稀碱溶液的,测定值偏小
D.用酸式滴定管盛放盐酸溶液,滴定前开始调节液面时,仰视读数,滴定后正常读数,最终会使所测液体体积偏低
13.已知数据:(25℃)
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.7×10-5 K1=4.3×10-7 K2=5.6×10-11 3.0×10-8
下列有关说法正确的是( )
A.浓度相等的四种溶液:a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3,其PH由大到小顺序为:a>b>c>d
B.将少量的通入到NaClO溶液中离子方程式为:
C.溶液中,存在关系:
D.的HF溶液与的NaOH溶液以体积1:1混合,则有
14.下列实验操作正确且能达到相应实验目的的是( )
实验目的 实验操作
A 称取2.0gNaOH固体 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B 配制FeCl3溶液 将FeCl3固体溶解于适量蒸馏水
C 检验溶液中是否含有NH4+ 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D 验证铁的吸氧腐蚀 将铁钉放入试管中,用盐酸浸没
15.用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
A.燃料电池工作时,正极反应为:O2 + 4e-+4H+=2H2O
B.若要实现铁上镀铜,则a极是铁,b极是铜,硫酸铜溶液浓度不变
C.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出,硫酸铜溶液浓度不变
D.a、b两极均是石墨时,在标准状况下当电池中消耗H2 22.4 L时,b极析出铜64 g
16.室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H2S)
B.NaHC2O4溶液:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.等浓度Na2CO3和NaHCO3的混合溶液:3c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3)
17.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O的水解)。下列叙述正确的是( )
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O)的混合溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数为109.04
第II卷(非选择题)
二、非选择题(本题共4个小题,共49分)
18.(14分)I.将CO2转化成甲醇燃料是减排、环保的一种科学方法。
已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为___________________
II.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为____________。
(2)能判断该反应达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________,该反应为_______反应(填吸热或放热),判断理由是______________________________。
(4)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
19.(11分)在室温下,下列五种溶液:①0.1mol/LNH4Cl溶液②0.1mol/LCH3COONH4溶液③0.1mol/LNH4HSO4溶液④0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液⑤0.1mol/L氨水,请根据要求填写下列空白:
(1)溶液①呈________(填“酸”、“碱”或“中”)性,其原因是___________(用离子方程式表示)。
(2)溶液②③中的大小关系是②________③。(填“>”、“<”或“=”)
(3)在溶液④中________(离子)的浓度为0.1mol/L;NH3·H2O和________(离子)的浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,CH3COO-与浓度的大小关系是________(填“>”、“<”或“=”)
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:____________、____________。
②若溶液M由10mL2mol/LNaHA溶液与10mL2mol/LNaOH溶液混合而得,则溶液M的pH________(填“>”、“<”或“=”)7
(6)常温下,CH3COOH溶液,pH=4,CH3COOH的电离平衡常数Ka=1.75×10-5,求:______。
20.(11分)某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4·2H2O,杂质不与KMnO4反应)。实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液。此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和__________
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定。
①滴定时,KMnO4溶液应装在__________ (填“酸式”、“碱式”)滴定管中。
②滴定时所发生反应的离子方程式: 。
③滴定达到终点的标志是 。
(3)按正确操作测得有关数据记录如下:
滴定次数 草酸溶液体积 酸性KMnO4溶液体积
滴定前读数/m L 滴定后读数/m L
第一次 25.00 0.20 20.58
第二次 25.00 4.00 24.40
第三次 25.00 2.38 a
(
2
2
23
)
① a的读数如右图所示,则a=________;
②草酸晶体的纯度为 (结果保留两位小数)。
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是 。
A. 称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B. 锥形瓶水洗后用草酸溶液润洗
C. 读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D. 盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失
21.(13分)硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
(1)经过“操作I”,得到滤渣的主要成分是_______。
(2)实验室实现“操作I”,所用的玻璃仪器有_______、________和烧杯。
(3)检验“酸溶”后的溶液中含有Fe3+试剂是_______,现象是_________________________。
(4)“操作III”系列操作名称依次为_____________、_____________、过滤和洗涤。
洗涤沉淀的具体操作是____________________________________________________。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:__________________。
(6)已知25℃时M(OH)3的溶度积常数Ksp=1×10-36.取适量的M2(SO4)3溶液,向其中加入一定量的烧碱溶液使M3+沉淀完全,则此时溶液的pH=______.(保留一位小数)
宁南中学2021-2022学年度下期高二入学考试
化学试题
参考答案
1-5、DDACB 6-10、DCDBA 11-15、AACCD 16-17、BD
18.(14分,每空2分)
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1
II.(1)0.12mol·L—1·min—1 ;
(2)ab ;
(3)1.8 L/mol ;吸热;随着温度的升高,D的含量增多,依据勒夏特列原理,温度升高有利于向吸热方向进行;
(4)向正反应方向
19.(11分)
(1)酸(1分)
+H2O NH3·H2O+H+(1分)
(2)< (1分)
(3) Cl- (1分) (1分)
(4)= (1分)
(5)H2A H++HA-(1分)、HA- H++A2- (1分) > (1分)
(6)1.75×10-1 (2分)
20. (11分)
(1)250mL容量瓶(1分)
(2)① 酸式(1分)
②2MnO+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(2分)
③当最后滴入一滴KMnO4溶液时,锥形瓶内溶液由无色变为浅红色,且半分钟内不恢复原色(1分)
(3)① 22.80(2分) ② 98.86%(2分) (4)BD(2分)
21.(13分)
(1)SiO2或二氧化硅(1分)
(2)漏斗(1分 玻璃棒 (1分) (3) KSCN 溶液(1分),溶液变为红色(1分); (4)蒸发浓缩(1分) 冷却结晶 (1分)
沿玻璃棒向漏斗中加入蒸馏水,至水浸没沉淀,待水自然流下后,重复操作2~3次(2分);(5) 2Fe2+ + H2O2 + 2H+= 2Fe3++2H2O(2分)(6)3.7(2分) 2 / 2
化学试题
考试时间:90分钟 满分:100分
审题:高二化学备课组
可能用到的相对原子质量:H-1 C-12 Fe—56 O—16 Cu-64
第Ⅰ卷(选择题)
一、选择题(每小题只有一个正确选项,共17小题,每小题3分,共51分。)
1.下列根据反应原理设计的应用,不正确的是 ( )。
A.CO32-+H2O ??HCO3-+OH-用热的纯碱溶液清洗油污
B.Al3++3H2O ?? Al(OH)3+3H+明矾净水
C.TiCl4+(x+2)H2O(过量) ??TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
2.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L 0.05mol·L-1的FeCl3溶液中所含的Fe3+的数目为0.05NA
B.0.2molSO2和0.1molO2充分反应后,得到SO3的分子数为0.2NA
C.100mL 0.2mol·L-1H2SO4溶液中,所含的氧原子的数目为0.08NA
D.1L 0.1mol·L-1NH4NO3溶液中,含有的氮原子数为0.2NA
3.常温下,下列指定溶液中离子可能大量共存的是
A.由水电离产生的的溶液:K+、、、
B.NaHCO3溶液中:K+、、、
C.的溶液中:、、、
D.含有的溶液:K+、、、
4.化学反应①AB和②BC的反应过程中能量变化如图所示。下列有关该反应的叙述错误的是( )
A.反应①的ΔH1>0
B.反应②在升高温度时,平衡向逆反应方向移动
C.加入催化剂,总反应③AC的ΔH会变小
D.总反应③AC的ΔH3>0
5.某温度下的恒容密闭容器中,有下述反应:A(s)+2B(g) C(g)+D(g)。下列哪些物理量不再发生变化时,表明反应已达到平衡状态( )
①混合气体的密度 ②混合气体的压强 ③B的浓度 ④混合气体的平均相对分子质量 ⑤2v 正(B) = v逆 (C)
A.①②③ B.①③④ C.②③④ D.①③④⑤
6.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g) △H<0,下列对图象的分析中正确的是( )
A.图Ⅰ研究的是t0时增大反应物浓度对反应速率的影响
B.图Ⅱ研究的是t0时改变的条件只能是加入催化剂
C.图Ⅲ研究的是催化剂对化学平衡的影响,且乙使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
7.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g) 有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
X=1,ΔH<0,P3<P4,y轴表示混合气体的密度
X=2,ΔH>0,P3<P4,y轴表示B的体积分数
C.X=1,ΔH<0,P3>P4,y轴表示B的转化率
D.X=1,ΔH>0,P3>P4,y轴表示B的体积分数
8.已知下列3个热化学方程式(K为平衡常数):
①Cu2S(s)+O2(g) Cu2O(s)+SO2(g)ΔH1 K1
②2Cu2O(s)+Cu2S(s) 6Cu(s)+SO2(g)ΔH2 K2
③Cu2S(s)+O2(g) 2Cu(s)+SO2(g)ΔH3 K3
则ΔH3和K3的表达式分别为( )
A.2ΔH1+ΔH2,2K1 K2 B. C. D.
9.25 ℃时,水的电离达到平衡:H2OH++OH-;ΔH>0,下列叙述正确的是
A.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变
C.向水中加入少量固体Na,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
10.下列四种溶液中,水的电离程度最大的是
A.的溶液 B.的溶液
C.pH=7的NaCl溶液 D.的溶液
11.下表是Fe2+、Fe3+、Cu2+被完全沉淀时溶液的pH。某硫酸铜酸性溶液中含有少量Fe2+、Fe3+杂质,为制得纯净的CuSO4,加入试剂最佳组合是( )
金属离子 Fe2+ Fe3+ Cu2+
完全沉淀时的pH 7.7 4.5 6.7
A.H2O2、CuO B.氨水
C.KMnO4、CuCO3 D.NaOH溶液
12.下列实验误差分析不正确的是( )
A.用标准溶液滴定溶液来测定其浓度,选择酚酞为指示剂
B.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测放出的热量偏小
C.用润湿的试纸测稀碱溶液的,测定值偏小
D.用酸式滴定管盛放盐酸溶液,滴定前开始调节液面时,仰视读数,滴定后正常读数,最终会使所测液体体积偏低
13.已知数据:(25℃)
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.7×10-5 K1=4.3×10-7 K2=5.6×10-11 3.0×10-8
下列有关说法正确的是( )
A.浓度相等的四种溶液:a.CH3COONa b.NaHCO3 c.NaClO d.Na2CO3,其PH由大到小顺序为:a>b>c>d
B.将少量的通入到NaClO溶液中离子方程式为:
C.溶液中,存在关系:
D.的HF溶液与的NaOH溶液以体积1:1混合,则有
14.下列实验操作正确且能达到相应实验目的的是( )
实验目的 实验操作
A 称取2.0gNaOH固体 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B 配制FeCl3溶液 将FeCl3固体溶解于适量蒸馏水
C 检验溶液中是否含有NH4+ 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D 验证铁的吸氧腐蚀 将铁钉放入试管中,用盐酸浸没
15.用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
A.燃料电池工作时,正极反应为:O2 + 4e-+4H+=2H2O
B.若要实现铁上镀铜,则a极是铁,b极是铜,硫酸铜溶液浓度不变
C.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出,硫酸铜溶液浓度不变
D.a、b两极均是石墨时,在标准状况下当电池中消耗H2 22.4 L时,b极析出铜64 g
16.室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H2S)
B.NaHC2O4溶液:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.等浓度Na2CO3和NaHCO3的混合溶液:3c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3)
17.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O的水解)。下列叙述正确的是( )
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O)的混合溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数为109.04
第II卷(非选择题)
二、非选择题(本题共4个小题,共49分)
18.(14分)I.将CO2转化成甲醇燃料是减排、环保的一种科学方法。
已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为___________________
II.在容积为2L的密闭容器中,进行如下反应:A(g)+2B(g) C(g)+D(g),最初加入1.0molA和2.2molB,在不同温度下,D的物质的量n(D)和时间t的关系如图。
试回答下列问题:
(1)800℃时,0—5min内,以B表示的平均反应速率为____________。
(2)能判断该反应达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=________,该反应为_______反应(填吸热或放热),判断理由是______________________________。
(4)800℃时,某时刻测得体系中各物质的量如下:n(A)=0.9mol,n(B)=2.0mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应________进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
19.(11分)在室温下,下列五种溶液:①0.1mol/LNH4Cl溶液②0.1mol/LCH3COONH4溶液③0.1mol/LNH4HSO4溶液④0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液⑤0.1mol/L氨水,请根据要求填写下列空白:
(1)溶液①呈________(填“酸”、“碱”或“中”)性,其原因是___________(用离子方程式表示)。
(2)溶液②③中的大小关系是②________③。(填“>”、“<”或“=”)
(3)在溶液④中________(离子)的浓度为0.1mol/L;NH3·H2O和________(离子)的浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,CH3COO-与浓度的大小关系是________(填“>”、“<”或“=”)
(5)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
①写出酸H2A的电离方程式:____________、____________。
②若溶液M由10mL2mol/LNaHA溶液与10mL2mol/LNaOH溶液混合而得,则溶液M的pH________(填“>”、“<”或“=”)7
(6)常温下,CH3COOH溶液,pH=4,CH3COOH的电离平衡常数Ka=1.75×10-5,求:______。
20.(11分)某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4·2H2O,杂质不与KMnO4反应)。实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液。此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和__________
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定。
①滴定时,KMnO4溶液应装在__________ (填“酸式”、“碱式”)滴定管中。
②滴定时所发生反应的离子方程式: 。
③滴定达到终点的标志是 。
(3)按正确操作测得有关数据记录如下:
滴定次数 草酸溶液体积 酸性KMnO4溶液体积
滴定前读数/m L 滴定后读数/m L
第一次 25.00 0.20 20.58
第二次 25.00 4.00 24.40
第三次 25.00 2.38 a
(
2
2
23
)
① a的读数如右图所示,则a=________;
②草酸晶体的纯度为 (结果保留两位小数)。
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是 。
A. 称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B. 锥形瓶水洗后用草酸溶液润洗
C. 读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D. 盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失
21.(13分)硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
(1)经过“操作I”,得到滤渣的主要成分是_______。
(2)实验室实现“操作I”,所用的玻璃仪器有_______、________和烧杯。
(3)检验“酸溶”后的溶液中含有Fe3+试剂是_______,现象是_________________________。
(4)“操作III”系列操作名称依次为_____________、_____________、过滤和洗涤。
洗涤沉淀的具体操作是____________________________________________________。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式:__________________。
(6)已知25℃时M(OH)3的溶度积常数Ksp=1×10-36.取适量的M2(SO4)3溶液,向其中加入一定量的烧碱溶液使M3+沉淀完全,则此时溶液的pH=______.(保留一位小数)
宁南中学2021-2022学年度下期高二入学考试
化学试题
参考答案
1-5、DDACB 6-10、DCDBA 11-15、AACCD 16-17、BD
18.(14分,每空2分)
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1
II.(1)0.12mol·L—1·min—1 ;
(2)ab ;
(3)1.8 L/mol ;吸热;随着温度的升高,D的含量增多,依据勒夏特列原理,温度升高有利于向吸热方向进行;
(4)向正反应方向
19.(11分)
(1)酸(1分)
+H2O NH3·H2O+H+(1分)
(2)< (1分)
(3) Cl- (1分) (1分)
(4)= (1分)
(5)H2A H++HA-(1分)、HA- H++A2- (1分) > (1分)
(6)1.75×10-1 (2分)
20. (11分)
(1)250mL容量瓶(1分)
(2)① 酸式(1分)
②2MnO+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(2分)
③当最后滴入一滴KMnO4溶液时,锥形瓶内溶液由无色变为浅红色,且半分钟内不恢复原色(1分)
(3)① 22.80(2分) ② 98.86%(2分) (4)BD(2分)
21.(13分)
(1)SiO2或二氧化硅(1分)
(2)漏斗(1分 玻璃棒 (1分) (3) KSCN 溶液(1分),溶液变为红色(1分); (4)蒸发浓缩(1分) 冷却结晶 (1分)
沿玻璃棒向漏斗中加入蒸馏水,至水浸没沉淀,待水自然流下后,重复操作2~3次(2分);(5) 2Fe2+ + H2O2 + 2H+= 2Fe3++2H2O(2分)(6)3.7(2分) 2 / 2
同课章节目录
