8.3酸 和碱的反应 第一课时中和反应、复分解反应 课件(共29张PPT)-2021-2022学年九年级化学人教版下册
文档属性
| 名称 | 8.3酸 和碱的反应 第一课时中和反应、复分解反应 课件(共29张PPT)-2021-2022学年九年级化学人教版下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 17.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 08:39:13 | ||
图片预览








文档简介
(共29张PPT)
第八章 常见的酸、碱、盐
8.3 酸和碱的反应
(第一课时)
中和反应、复分解反应
8.3 酸和碱的反应
【教学目标】:
1. 认识酸和碱的组成,知道酸和碱在溶液中产生了氢离子和氢氧根离子。
2. 理解中和反应的原理和实质,系统归纳酸和碱的化学相似性。
3.明确复分解反应是两化合物相互交换成分的反应类型。
二、【教学重点】:
中和反应,酸和碱的化学相似性的归纳。
复分解反应。
三、【教学难点】:
中和反应。
酸和碱的化学相似性原因的理解。
知识回顾:
酸的通性
项目 酸的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液变红
使无色酚酞溶液不变色
酸 + 金属氧化物 → 盐 + 水
酸 + 盐 → 新盐 + 新酸
酸 + 较活泼金属 → 盐 + 氢气
(本节学习)
碱的通性
项目 碱的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液蓝色
使无色酚酞溶液变红
碱 + 非金属氧化物 → 盐 + 水
碱 + 盐 → 新盐 + 新碱
(本节学习)
知识回顾:
我们已经知道酸、碱各自有相似的化学性质,这是什么原因造成的呢
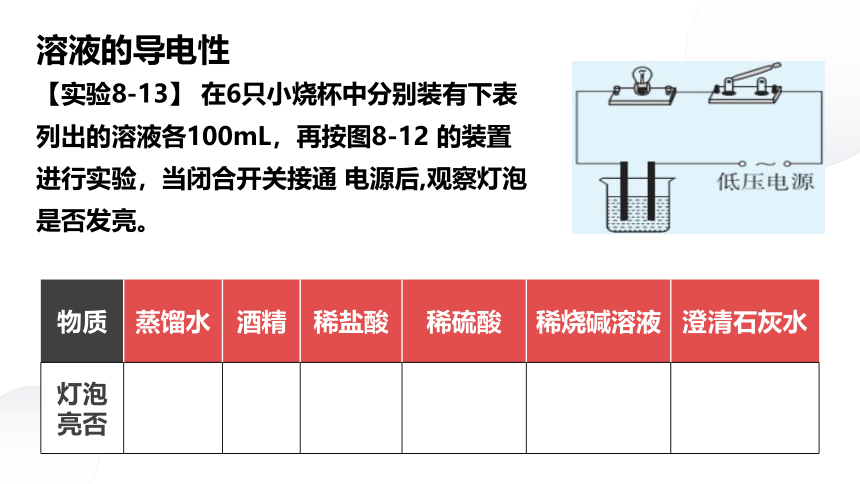
溶液的导电性
【实验8-13】 在6只小烧杯中分别装有下表列出的溶液各100mL,再按图8-12 的装置进行实验,当闭合开关接通 电源后,观察灯泡是否发亮。
物质 蒸馏水 酒精 稀盐酸 稀硫酸 稀烧碱溶液 澄清石灰水
灯泡亮否
一、溶液的导电性
【实验8-13】 在6只小烧杯中分别装有下表列出的溶液各100mL,再按图8-12 的装置进行实验,当闭合开关接通 电源后,观察灯泡是否发亮。
物质 蒸馏水 酒精 稀盐酸 稀硫酸 稀烧碱溶液 澄清石灰水
灯泡亮否
×
×
1、溶液能导电的原因:溶液里存在有能够自由
移动的,带电的粒子。
如:HCl==H+ + Cl-
2、电离:物质溶解于水时,离解成能自由移动的离子的过程。(注意:电离与通电与否无关.)
3、酸
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
(1)、酸的定义:电离时生成的阳离子全部都是氢离子(H+)的化合物叫做酸。
(2)、组成特点: H+ + 酸根离子
(3)、常见的酸根离子: Cl- 、 NO3- 、 SO42- 、CO32- 、 PO43-
判断:NaHSO4 = Na+ + H+ + SO42-
4、碱
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
KOH = K+ + OH-
(1)、碱的定义: 电离时生成的阴离子全部都是氢氧根离子(OH-)的 化合物叫做碱。
(2)、组成特点:金属离子 + OH-
判断:Cu2(OH)2CO3 = 2Cu2+ + 2OH- + CO32-
5、知识回顾:盐 (P232)
NaCl = Na+ + Cl-
CaCl2 = Ca2+ + 2Cl-
Na2SO4 = 2Na+ + SO42-
(1)、盐的定义:电离时生成金属离子和酸根离子的化合物叫做盐。
(2)、组成特点:金属离子 + 酸根离子
判断:NaHSO4 = Na+ + H+ + SO42-
判断:Cu2(OH)2CO3 = 2Cu2+ + 2OH- + CO32-
盐
Na
K
Ca
Cl
Cl
SO4
Na+ Ca2+ Na+
Cl- Cl- SO42-
酸碱溶液中的粒子
分子
无法自由
移动的离子
能够自由移动的离子
酸 H+ + 酸根离子
在水溶液中
电 离
碱 金属离子 + OH-
在水溶液中
电 离
如:HCl = H+ + Cl-
如:NaOH = Na+ + OH-
在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
在不同的碱溶液中都含有相同的OH-,所以碱也有一些相似的性质。
思考:
酸溶液中有氢离子(H+),碱溶液中有氢氧根离子(OH-)。把酸溶液和碱溶液相互混合,它们之间又会发生什么反应呢?
二、中和反应
2.为了观察到上述两种溶液发生反应的现象?应采取什么措施?
提示信息:
紫色石蕊溶液遇酸变红,遇碱会变蓝。酚酞遇碱会显红色,遇酸则不显色。
取3mL稀氢氧化钠溶液于试管中,逐滴加入稀盐酸,观察到什么现象?有没有反应发生?
a、没有现象,没有反应。
b、发生了反应,但没有现象。
【实验8-14】
编号 操作步骤 观察到的现象
① 取3mLNaOH溶液于试管中,滴1、2滴酚酞溶液
② 逐渐往NaOH溶液中滴稀盐酸,振荡
③ 向上述刚好褪色的溶液中再滴两滴NaOH,振荡
④ 再次滴入微量稀盐酸,振荡
步骤设计:
取3mLNaOH溶液于试管中,滴1、2滴酚酞溶液,使氢氧化钠溶液显红色,滴加稀盐酸至变色,再滴加氢氧化钠至变色,再次滴加稀盐酸至变色……
溶液由无色变红色
溶液由红色变无色
溶液由无色变红色
溶液由红色变无色
结论:指示剂的颜色变化说明酸和碱发生了化学反应。
思考:
①用玻璃棒沾上述氢氧化钠溶液与稀盐酸刚好反应生成的溶液,在酒精灯火焰上方加热烘干,有何现象 说明什么
②如果改用其他酸 (如稀硫酸) 和碱 (如氢氧化钾溶液) 来进行上述实验,结果会怎样 为什么
玻璃棒上有白色固体析出,说明有盐生成。
玻璃棒上有白色固体析出,说明有盐生成。
盐酸与氢氧化钠反应:
HCl + NaOH==NaCl + H2O
硫酸与氢氧化钾反应:
H2SO4 + 2KOH == K2SO4 + 2H2O
酸
碱
盐
水
解释与结论:
中和反应:酸跟碱发生反应生成盐和水的反应,叫做中和反应。
小结:酸 + 碱 → 盐 + 水
酸的组成=
H+ + 酸根离子
碱的组成=
金属离子+ OH-
H2O
中和反应的实质:H+ + OH- == H2O
H+
OH-
HCl→H+ + Cl
NaOH→Na+ + OH
讨论:有人说:凡是生成盐和水的反应就是中和反应,请问对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 = 盐 + 水
如:2HCl+CuO=CuCl2+H2O
酸 + 碱 = 盐 + 水
如:HCl+NaOH=NaCl+H2O
碱 + 非金属氧化物 = 盐 + 水
如:2NaOH+CO2=Na2CO3+H2O
项目 酸的主要化学性质 碱的主要化学性质
与指示剂作用 紫色石蕊 使紫色石蕊溶液( ) 使紫色石蕊溶液( )
无色酚酞 无色的酚酞溶液( ) 无色的酚酞溶液( )
酸碱相互反应 酸 + 碱 ( )+( ) 与氧化物反应 酸 + ( )氧化物 ( )+( ) 碱 + ( )氧化物
( )+( )
与盐反应 酸 + 盐 ( )+( ) 碱 + 盐 ( )+( )
与较活泼金属反应 酸 + 较活泼金属 ( )+( )
酸和碱的主要化学性质:P239
变红
变蓝
不变色
变红
盐
水
金属
非金属
盐
盐
水
水
新盐
新酸
新盐
新碱
盐
氢气
大家结合这些化学反应看能发现有什么共同点?
(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
H2CO3
H2CO3
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做_______________。
复分解反应
讨论与交流:( P239)
1. 若用AB和CD分别表示两种化合物,如何表示复分解反应的通式
通式:AB+CD → AD+CB
反应特点:
③中和反应属于复分解反应中的一种
①反应物和生成物都是化合物
②反应物之间一定要交换成分(化合价不变)
2.中和反应和复分解反应两者有什么关系 为什么
中和反应一定是复分解反应 ,复分解反应不一定是中和反应;
只有反应物是酸和碱时,复分解反应才是中和反应。
3、我们已经学习过化合、分解、置换、复分解等各种基本反应类型。你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗 请举例说明。
(1)化合反应:
(2)分解反应:
(3)置换反应:
(4)复分解反应:
AB+CD → AD+CB
A+B → AB
AB→ A+B
A+BC → B+AC
巩固练习:
1.向含有酚酞的NaOH溶液中滴加盐酸,溶液红色退去变为无色,此时溶液pH可能是( )
A.5 B.9 C.12 D.13
2.在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是 ( )
A.由红色变为蓝色 B.由蓝色变为红色
C.由红色变为无色 D.由无色变成红色
C
A
巩固练习:
3.下列反应属于中和反应的是( )
A.2NaOH + SO2 == Na2SO3 + H2O
B.Cu(OH)2 + 2HCl == CuCl2 + 2H2O
C.Ca(OH)2 + CO2 == CaCO3↓ + H2O
D.CuO + 2HCl == CuCl2 + H2O
4.下列反应属于复分解反应的是( )
A.Na2O + H2O == 2NaOH
B.H2 + CuO == Cu + H2O
C.Cu(OH)2 == CuO + H2O
D.H2SO4 + Ca(OH)2 == CaSO4 + 2H2O
D
B
巩固练习:
5.X可以发生如下反应:①X + 酸 → 盐 + 水;
②X + 非金属氧化物 → 盐 + 水。X可能是( )
A.氧化铜 B.盐酸
C.氢氧化钠 D.碳酸钠
C
巩固练习:
6.如图是稀盐酸与氢氧化钠溶液恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应前后所有元素的化合价均无变化
B.反应前的溶液均可导电,反应后的溶液不导电
C.反应后溶液呈碱性
D.反应后溶液中存在的粒子只有Na+和Cl-
A
第八章 常见的酸、碱、盐
8.3 酸和碱的反应
(第一课时)
中和反应、复分解反应
8.3 酸和碱的反应
【教学目标】:
1. 认识酸和碱的组成,知道酸和碱在溶液中产生了氢离子和氢氧根离子。
2. 理解中和反应的原理和实质,系统归纳酸和碱的化学相似性。
3.明确复分解反应是两化合物相互交换成分的反应类型。
二、【教学重点】:
中和反应,酸和碱的化学相似性的归纳。
复分解反应。
三、【教学难点】:
中和反应。
酸和碱的化学相似性原因的理解。
知识回顾:
酸的通性
项目 酸的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液变红
使无色酚酞溶液不变色
酸 + 金属氧化物 → 盐 + 水
酸 + 盐 → 新盐 + 新酸
酸 + 较活泼金属 → 盐 + 氢气
(本节学习)
碱的通性
项目 碱的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液蓝色
使无色酚酞溶液变红
碱 + 非金属氧化物 → 盐 + 水
碱 + 盐 → 新盐 + 新碱
(本节学习)
知识回顾:
我们已经知道酸、碱各自有相似的化学性质,这是什么原因造成的呢
溶液的导电性
【实验8-13】 在6只小烧杯中分别装有下表列出的溶液各100mL,再按图8-12 的装置进行实验,当闭合开关接通 电源后,观察灯泡是否发亮。
物质 蒸馏水 酒精 稀盐酸 稀硫酸 稀烧碱溶液 澄清石灰水
灯泡亮否
一、溶液的导电性
【实验8-13】 在6只小烧杯中分别装有下表列出的溶液各100mL,再按图8-12 的装置进行实验,当闭合开关接通 电源后,观察灯泡是否发亮。
物质 蒸馏水 酒精 稀盐酸 稀硫酸 稀烧碱溶液 澄清石灰水
灯泡亮否
×
×
1、溶液能导电的原因:溶液里存在有能够自由
移动的,带电的粒子。
如:HCl==H+ + Cl-
2、电离:物质溶解于水时,离解成能自由移动的离子的过程。(注意:电离与通电与否无关.)
3、酸
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
(1)、酸的定义:电离时生成的阳离子全部都是氢离子(H+)的化合物叫做酸。
(2)、组成特点: H+ + 酸根离子
(3)、常见的酸根离子: Cl- 、 NO3- 、 SO42- 、CO32- 、 PO43-
判断:NaHSO4 = Na+ + H+ + SO42-
4、碱
NaOH = Na+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
KOH = K+ + OH-
(1)、碱的定义: 电离时生成的阴离子全部都是氢氧根离子(OH-)的 化合物叫做碱。
(2)、组成特点:金属离子 + OH-
判断:Cu2(OH)2CO3 = 2Cu2+ + 2OH- + CO32-
5、知识回顾:盐 (P232)
NaCl = Na+ + Cl-
CaCl2 = Ca2+ + 2Cl-
Na2SO4 = 2Na+ + SO42-
(1)、盐的定义:电离时生成金属离子和酸根离子的化合物叫做盐。
(2)、组成特点:金属离子 + 酸根离子
判断:NaHSO4 = Na+ + H+ + SO42-
判断:Cu2(OH)2CO3 = 2Cu2+ + 2OH- + CO32-
盐
Na
K
Ca
Cl
Cl
SO4
Na+ Ca2+ Na+
Cl- Cl- SO42-
酸碱溶液中的粒子
分子
无法自由
移动的离子
能够自由移动的离子
酸 H+ + 酸根离子
在水溶液中
电 离
碱 金属离子 + OH-
在水溶液中
电 离
如:HCl = H+ + Cl-
如:NaOH = Na+ + OH-
在不同的酸溶液中都含有相同的H+,所以,酸有一些相似的性质。
在不同的碱溶液中都含有相同的OH-,所以碱也有一些相似的性质。
思考:
酸溶液中有氢离子(H+),碱溶液中有氢氧根离子(OH-)。把酸溶液和碱溶液相互混合,它们之间又会发生什么反应呢?
二、中和反应
2.为了观察到上述两种溶液发生反应的现象?应采取什么措施?
提示信息:
紫色石蕊溶液遇酸变红,遇碱会变蓝。酚酞遇碱会显红色,遇酸则不显色。
取3mL稀氢氧化钠溶液于试管中,逐滴加入稀盐酸,观察到什么现象?有没有反应发生?
a、没有现象,没有反应。
b、发生了反应,但没有现象。
【实验8-14】
编号 操作步骤 观察到的现象
① 取3mLNaOH溶液于试管中,滴1、2滴酚酞溶液
② 逐渐往NaOH溶液中滴稀盐酸,振荡
③ 向上述刚好褪色的溶液中再滴两滴NaOH,振荡
④ 再次滴入微量稀盐酸,振荡
步骤设计:
取3mLNaOH溶液于试管中,滴1、2滴酚酞溶液,使氢氧化钠溶液显红色,滴加稀盐酸至变色,再滴加氢氧化钠至变色,再次滴加稀盐酸至变色……
溶液由无色变红色
溶液由红色变无色
溶液由无色变红色
溶液由红色变无色
结论:指示剂的颜色变化说明酸和碱发生了化学反应。
思考:
①用玻璃棒沾上述氢氧化钠溶液与稀盐酸刚好反应生成的溶液,在酒精灯火焰上方加热烘干,有何现象 说明什么
②如果改用其他酸 (如稀硫酸) 和碱 (如氢氧化钾溶液) 来进行上述实验,结果会怎样 为什么
玻璃棒上有白色固体析出,说明有盐生成。
玻璃棒上有白色固体析出,说明有盐生成。
盐酸与氢氧化钠反应:
HCl + NaOH==NaCl + H2O
硫酸与氢氧化钾反应:
H2SO4 + 2KOH == K2SO4 + 2H2O
酸
碱
盐
水
解释与结论:
中和反应:酸跟碱发生反应生成盐和水的反应,叫做中和反应。
小结:酸 + 碱 → 盐 + 水
酸的组成=
H+ + 酸根离子
碱的组成=
金属离子+ OH-
H2O
中和反应的实质:H+ + OH- == H2O
H+
OH-
HCl→H+ + Cl
NaOH→Na+ + OH
讨论:有人说:凡是生成盐和水的反应就是中和反应,请问对不对?
答:不正确。因为能生成盐和水的反应有3种
酸 + 金属氧化物 = 盐 + 水
如:2HCl+CuO=CuCl2+H2O
酸 + 碱 = 盐 + 水
如:HCl+NaOH=NaCl+H2O
碱 + 非金属氧化物 = 盐 + 水
如:2NaOH+CO2=Na2CO3+H2O
项目 酸的主要化学性质 碱的主要化学性质
与指示剂作用 紫色石蕊 使紫色石蕊溶液( ) 使紫色石蕊溶液( )
无色酚酞 无色的酚酞溶液( ) 无色的酚酞溶液( )
酸碱相互反应 酸 + 碱 ( )+( ) 与氧化物反应 酸 + ( )氧化物 ( )+( ) 碱 + ( )氧化物
( )+( )
与盐反应 酸 + 盐 ( )+( ) 碱 + 盐 ( )+( )
与较活泼金属反应 酸 + 较活泼金属 ( )+( )
酸和碱的主要化学性质:P239
变红
变蓝
不变色
变红
盐
水
金属
非金属
盐
盐
水
水
新盐
新酸
新盐
新碱
盐
氢气
大家结合这些化学反应看能发现有什么共同点?
(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
H2CO3
H2CO3
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做_______________。
复分解反应
讨论与交流:( P239)
1. 若用AB和CD分别表示两种化合物,如何表示复分解反应的通式
通式:AB+CD → AD+CB
反应特点:
③中和反应属于复分解反应中的一种
①反应物和生成物都是化合物
②反应物之间一定要交换成分(化合价不变)
2.中和反应和复分解反应两者有什么关系 为什么
中和反应一定是复分解反应 ,复分解反应不一定是中和反应;
只有反应物是酸和碱时,复分解反应才是中和反应。
3、我们已经学习过化合、分解、置换、复分解等各种基本反应类型。你能归纳出它们各自的特点,并准确判断某个具体化学反应属于什么基本反应类型吗 请举例说明。
(1)化合反应:
(2)分解反应:
(3)置换反应:
(4)复分解反应:
AB+CD → AD+CB
A+B → AB
AB→ A+B
A+BC → B+AC
巩固练习:
1.向含有酚酞的NaOH溶液中滴加盐酸,溶液红色退去变为无色,此时溶液pH可能是( )
A.5 B.9 C.12 D.13
2.在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是 ( )
A.由红色变为蓝色 B.由蓝色变为红色
C.由红色变为无色 D.由无色变成红色
C
A
巩固练习:
3.下列反应属于中和反应的是( )
A.2NaOH + SO2 == Na2SO3 + H2O
B.Cu(OH)2 + 2HCl == CuCl2 + 2H2O
C.Ca(OH)2 + CO2 == CaCO3↓ + H2O
D.CuO + 2HCl == CuCl2 + H2O
4.下列反应属于复分解反应的是( )
A.Na2O + H2O == 2NaOH
B.H2 + CuO == Cu + H2O
C.Cu(OH)2 == CuO + H2O
D.H2SO4 + Ca(OH)2 == CaSO4 + 2H2O
D
B
巩固练习:
5.X可以发生如下反应:①X + 酸 → 盐 + 水;
②X + 非金属氧化物 → 盐 + 水。X可能是( )
A.氧化铜 B.盐酸
C.氢氧化钠 D.碳酸钠
C
巩固练习:
6.如图是稀盐酸与氢氧化钠溶液恰好完全反应的微观示意图,由此得出的结论正确的是( )
A.反应前后所有元素的化合价均无变化
B.反应前的溶液均可导电,反应后的溶液不导电
C.反应后溶液呈碱性
D.反应后溶液中存在的粒子只有Na+和Cl-
A
同课章节目录
