7.3溶液的酸碱性 课后练习-2021_2022学年九年级化学鲁教版下册(word版 含解析)
文档属性
| 名称 | 7.3溶液的酸碱性 课后练习-2021_2022学年九年级化学鲁教版下册(word版 含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 229.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-17 00:00:00 | ||
图片预览


文档简介
7.3溶液的酸碱性
一、选择题(共15题)
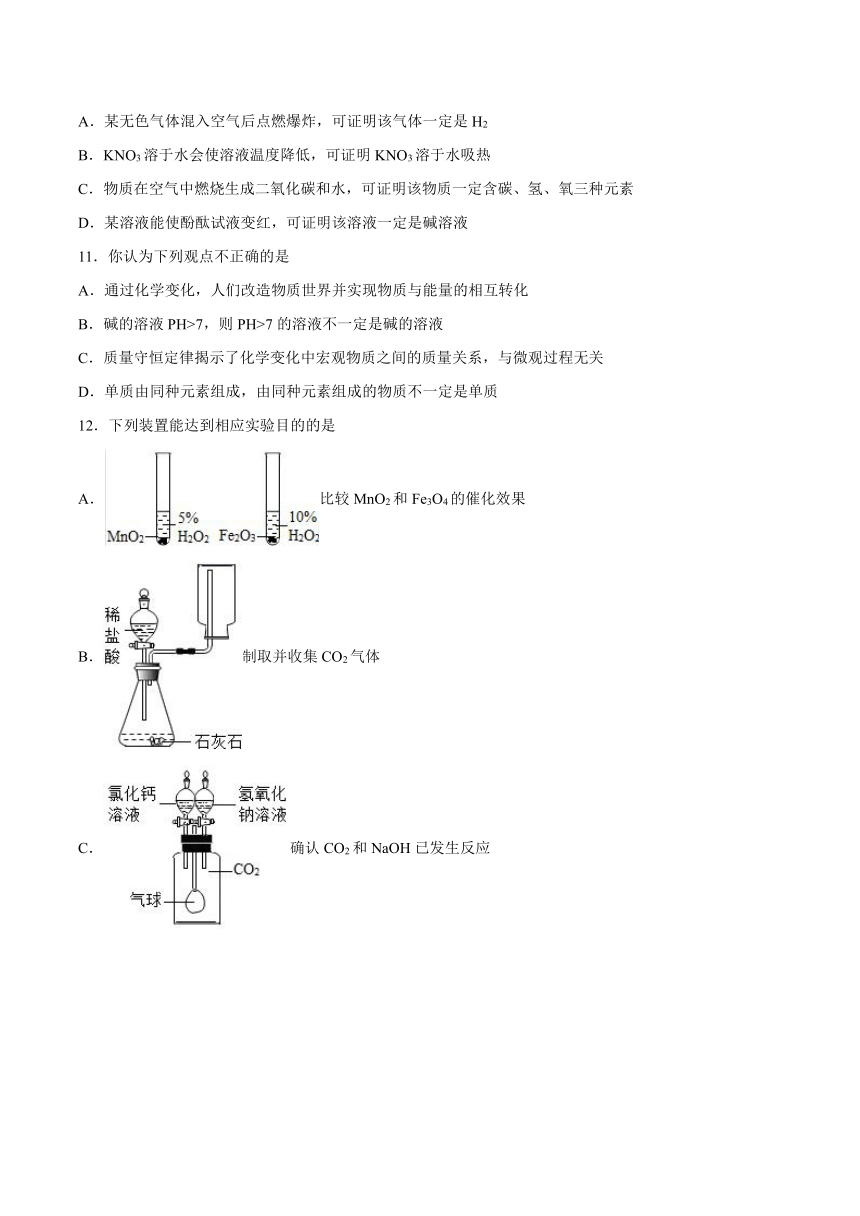
1.下列实验操作不正确的是
A.闻气味 B.倾倒液体
C.测溶液的pH D.稀释浓硫酸
2.“关爱生命,注意安全,拥抱健康”是永恒的主题。有关叙述错误的是
A.如果饮食过量,胃会分泌大量的胃酸,造成消化不良
B.健康人体内血浆的pH范围是6.35-7.45
C.医疗上用作消毒的医用酒精体积分数为75%
D.氯离子在人体中具有促生盐酸、帮助消化和增进食欲的作用
3.小明同学在实验室中测定某未知溶液的pH,他的实验操作如下,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测液于pH试纸上进行测定,你认为小明同学这样测得的结果与该溶液的实际pH比较
A.偏低 B.偏高 C.偏低或偏高 D.无法判定
4.化学学习小组做实验时,记录了下列实验现象,其中正确的是
A.细铁丝在空气中剧烈燃烧,火星四射,有黑色固体生成
B.红磷在空气中燃烧,发出红色的火焰,产生大量白色烟雾
C.碳在氧气中燃烧发出白光,生成二氧化碳
D.向浓氨水中滴加几滴酚酞试液,溶液变成红色
5.下列实验操作正确的是
A.稀释浓硫酸
B.称量氢氧化钠固体
C.液体的量取
D.测量溶液的pH
6.在一定溶质质量分数的稀盐酸中加入下列物质,充分反应后,溶液的pH值没有明显变化的是( )
A.锌粉 B.硝酸银粉末
C.碳酸氢钠粉末 D.氢氧化钡粉来
7.下列实验操作,能达到预期目的的是
①用托盘天平称取5.6g铁粉;②用10mL量筒量取8.8mL水;③用普通pH试纸测定某溶液的pH为5.5;④将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸。
A.①② B.③④ C.①②④ D.①②③④
8.下列操作正确的是( )
A.实验后剩余的药品应该放回原瓶,避免浪费
B.不小心碰倒酒精灯,洒出的酒精在桌子上燃烧起来,应立即用水扑灭
C.用pH试纸测定溶液酸碱度时,先将pH试纸用水润湿,然后再进行测定
D.洗过的玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表明已经洗干净
9.小明设计了如图装置探究“微粒是不断运动的”,一段时间后,可观察到紫色石蕊变红,则物质 A是
A.浓氨水 B.浓硫酸 C.浓食盐水 D.浓盐酸
10.对实验现象的观察和分析,有助于获得化学知识并学会科学探究的方法。下列对实验现象的分析合理的是
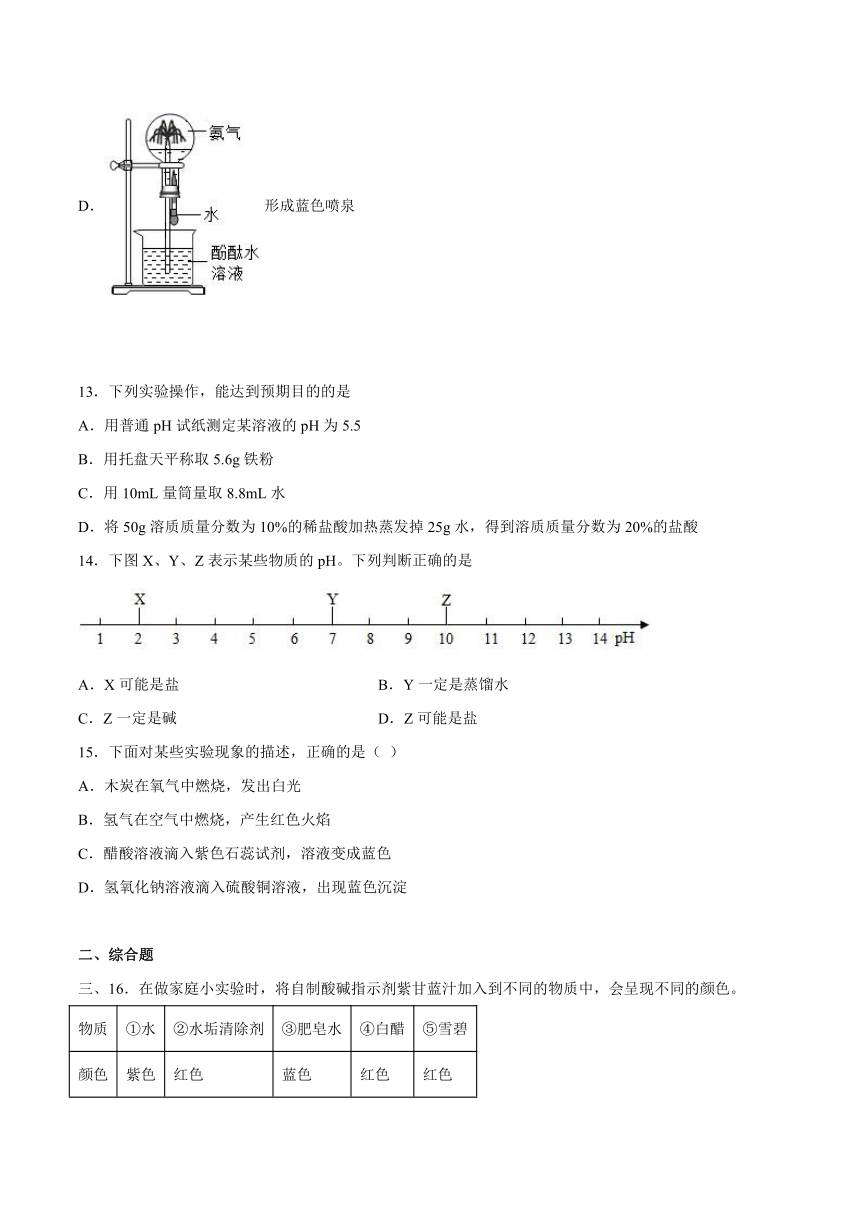
A.某无色气体混入空气后点燃爆炸,可证明该气体一定是H2
B.KNO3溶于水会使溶液温度降低,可证明KNO3溶于水吸热
C.物质在空气中燃烧生成二氧化碳和水,可证明该物质一定含碳、氢、氧三种元素
D.某溶液能使酚酞试液变红,可证明该溶液一定是碱溶液
11.你认为下列观点不正确的是
A.通过化学变化,人们改造物质世界并实现物质与能量的相互转化
B.碱的溶液PH>7,则PH>7的溶液不一定是碱的溶液
C.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
D.单质由同种元素组成,由同种元素组成的物质不一定是单质
12.下列装置能达到相应实验目的的是
A.比较MnO2和Fe3O4的催化效果
B.制取并收集CO2气体
C.确认CO2和NaOH已发生反应
D.形成蓝色喷泉
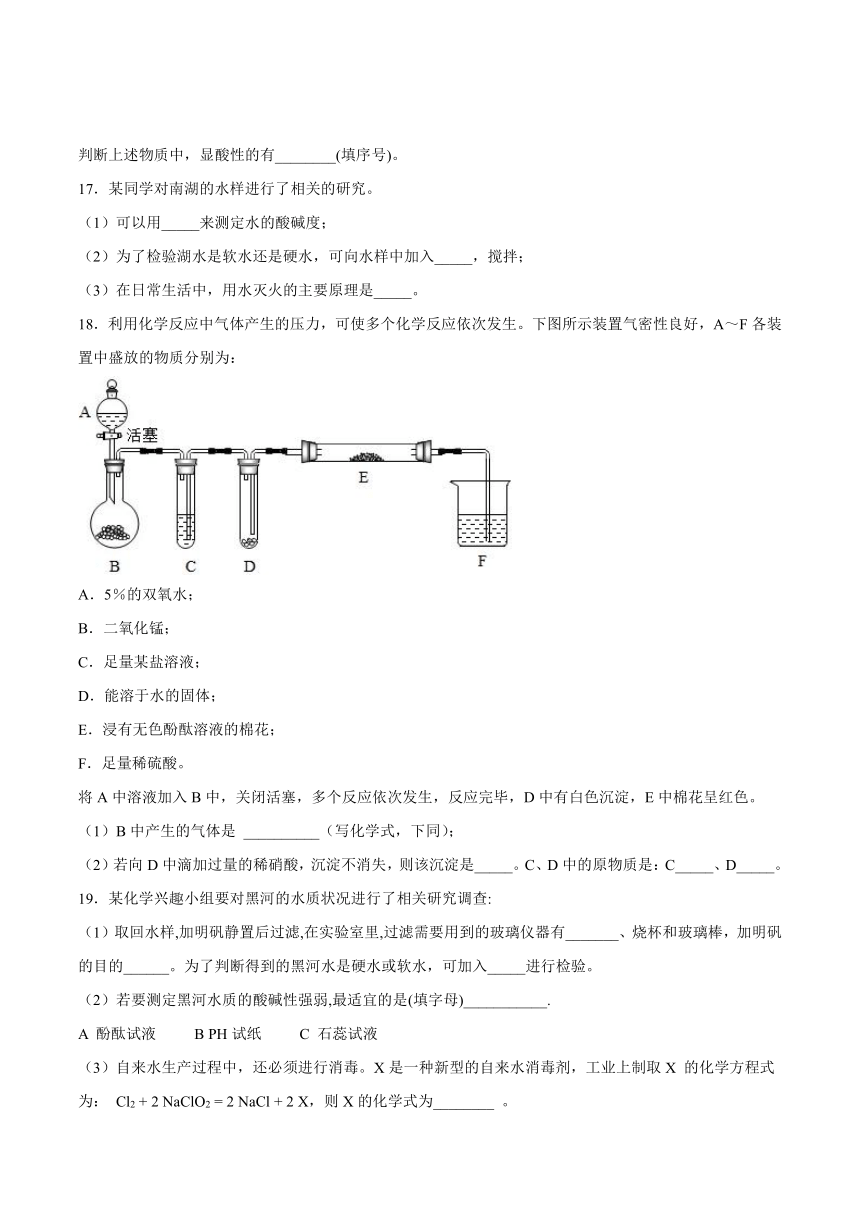
13.下列实验操作,能达到预期目的的是
A.用普通pH试纸测定某溶液的pH为5.5
B.用托盘天平称取5.6g铁粉
C.用10mL量筒量取8.8mL水
D.将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸
14.下图X、Y、Z表示某些物质的pH。下列判断正确的是
A.X可能是盐 B.Y一定是蒸馏水
C.Z一定是碱 D.Z可能是盐
15.下面对某些实验现象的描述,正确的是( )
A.木炭在氧气中燃烧,发出白光
B.氢气在空气中燃烧,产生红色火焰
C.醋酸溶液滴入紫色石蕊试剂,溶液变成蓝色
D.氢氧化钠溶液滴入硫酸铜溶液,出现蓝色沉淀
综合题
16.在做家庭小实验时,将自制酸碱指示剂紫甘蓝汁加入到不同的物质中,会呈现不同的颜色。
物质 ①水 ②水垢清除剂 ③肥皂水 ④白醋 ⑤雪碧
颜色 紫色 红色 蓝色 红色 红色
判断上述物质中,显酸性的有________(填序号)。
17.某同学对南湖的水样进行了相关的研究。
(1)可以用_____来测定水的酸碱度;
(2)为了检验湖水是软水还是硬水,可向水样中加入_____,搅拌;
(3)在日常生活中,用水灭火的主要原理是_____。
18.利用化学反应中气体产生的压力,可使多个化学反应依次发生。下图所示装置气密性良好,A~F各装置中盛放的物质分别为:
A.5%的双氧水;
B.二氧化锰;
C.足量某盐溶液;
D.能溶于水的固体;
E.浸有无色酚酞溶液的棉花;
F.足量稀硫酸。
将A中溶液加入B中,关闭活塞,多个反应依次发生,反应完毕,D中有白色沉淀,E中棉花呈红色。
(1)B中产生的气体是 __________(写化学式,下同);
(2)若向D中滴加过量的稀硝酸,沉淀不消失,则该沉淀是_____。C、D中的原物质是:C_____、D_____。
19.某化学兴趣小组要对黑河的水质状况进行了相关研究调查:
(1)取回水样,加明矾静置后过滤,在实验室里,过滤需要用到的玻璃仪器有_______、烧杯和玻璃棒,加明矾的目的______。为了判断得到的黑河水是硬水或软水,可加入_____进行检验。
(2)若要测定黑河水质的酸碱性强弱,最适宜的是(填字母)___________.
A 酚酞试液 B PH试纸 C 石蕊试液
(3)自来水生产过程中,还必须进行消毒。X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为: Cl2 + 2 NaClO2 = 2 NaCl + 2 X,则X的化学式为________ 。
(4)下列做法会造成水体污染的是 (填字母)___________.
A 随意弃置废旧电池 B 含二氧化硫的工业废气任意排放
C 工业废水处理达标后再排放 D 严格监管化肥和农药的使用
20.微粒观是化学学科重要的观念之一。在探究微粒性质的课外活动中,化学兴趣小组的小刚按照课本方案(见图1)进行实验,闻到了刺激性的氨味,于是,小刚在老师的指导下,对实验进行了改进。
(实验探究)小刚设计了如图2的实验装置,进行同样的实验:
(1)滴入浓氨水后,可观察到湿润的酚酞滤纸条变红,从微观角度分析,此现象可说明的结论是 ______ 。
(2)“与图1比较,图2的实验装置,能更快速出现实验现象”说明固体氢氧化钠遇到浓氨水时可能 ____ (填“放热”或“吸热”)。
(实验结论)改进后的实验不再有刺激性的氨味,且快速出现实验现象,得到了和课本实验同样的结论。
(反思交流)和课本实验比较,小刚改进后的装置的优点是(写出一点) _______ 。
(继续探究)小红受小刚实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的某些性质。打开活塞K滴入稀盐酸后,小试管中发生的反应产生二氧化碳气体后,发现两条用紫色石蕊试液润湿的试纸变红的情况可能是 ______ 。
A下面的先变红,上面的后变红 B上面的和下面的一起变红
C上面的先变红,下面的后变红 D以上均有可能
(3)小刚对酚酞的组成产生兴趣,查阅资料知道其化学式为C20H14O4,并进行了相关计算:
①该物质中碳、氢、氧三种元素的质量比为 ________ 。
②该物质中碳元素的质量分数为 ________ 。(小数点后保留一位有效数字)
③31.8g该物质中碳元素的质量为 ______ g。
21.甜瓜珍品——江西梨瓜以“脆、甜、香”而闻名。梨瓜中含有丰富的蛋白质、粗纤维、维生素、钙、磷、铁、镁、钾、硒等人体所需的营养素;
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝_______防止腐烂;
(2)梨瓜适宜生长在pH为6.0-6.8的土壤中,实验室测定溶液pH的操作方法是_______________;
(3)如图为硒元素的某些信息,硒原子核内有_______个质子,硒原子的相对原子质量是_____,硒原子在化学反应中易_______(填“得到”或“失去”)电子。
22.根据下列装置图回答问题。
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为 _______________________ 。
(2)二氧化碳通入紫色石蕊试液,试液变 _______ 色。
(3)实验室用一定质量的氯酸钾和二氧化锰制取氧气,通过排水量测定所收集到的氧气体积(装置如图)。
①其中二氧化锰的作用是 ___________________________ ;
②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为 _____________ ;KClO3的相对分子质量为 _____ 。计算完全反应后产生氧气的质量为 _________ g。
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是 _________ 。(任写一种情况)
23.兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如下图所示的A、B、C、D四组探究实验。
(查阅资料)氯化钙、氯化钡溶液都呈中性。
(实验探究)取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
(分析与结论)
(1)上述四组实验中不能达到实验目的的是______(填字母序号)。
(2)实验A中,观察到______的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是______。
(4)要证明该氢氧化钠部分变质,请写出实验步骤、可能的现象及相关推理________。
(5)若实验证明氢氧化钠部分变质,为测定其中氢氧化钠的质量分数,该同学采用沉淀法进行如下操作:①取15g样品于烧杯中,加入足量水配成溶液;②在样品溶液中加入足量的氯化钡溶液;③待反应完全后,过滤。有关数据如表:
反应前 反应后
烧杯和样品溶液总质量/g 加入氯化钡溶液质量/g 过滤后烧杯和溶液总质量/g(不计滤液损失)
105 65 150.3
请回答下列问题:
①原样品中氢氧化钠的质量分数是______(保留到0.1%)
②另取样品溶于水,若要除去杂质获取氢氧化钠溶液,可以向其中加入______溶液,然后______(填操作名称)即可。
参考答案
1.C
【详解】
A、闻气体的气味要用手轻轻扇动使少量的气体进入鼻子闻气味,选项正确;
B、取用液体药品,试管要紧靠试剂瓶口倾倒,瓶塞要倒放,标签朝向手心,选项正确;
C、测定溶液pH时不能将试纸直接伸入溶液中,以防污染溶液, 选项错误;
D、稀释浓硫酸必须将浓硫酸加入水中,并用玻璃棒不断搅拌,选项正确。故选C。
2.B
【详解】
A、如果饮食过量,胃会分泌大量的胃酸,造成消化不良,故A正确;B、 健康人体内血浆呈弱碱性,pH范围是7.35-7.45,故B错误;C、 医疗上用作消毒的医用酒精体积分数为75%,故C正确;D、 氯离子在人体中具有促生盐酸、帮助消化和增进食欲的作用,故D正确。故选B。
3.D
【详解】
小明同学在测量某未知溶液的pH时,先用蒸馏水将pH试纸润湿,再滴加待测液,相当于稀释了待测液,会使溶液中的溶质质量分数减小,对于酸性溶液来说会使其酸性减弱,pH变大;对于碱性溶液来说会使其碱性减弱,pH变小;但对于中性溶液来说,pH不变。
故选D。
4.D
【详解】
A、细铁丝在空气中产生红热现象,故A不正确;
B、红磷在空气中燃烧,发出红色的火焰,产生大量白烟,故B不正确;
C、碳在氧气中燃烧发出白光,生成二氧化碳属于结论,不是现象,故C不正确;
D、向稀氨水中滴加几滴酚酞试液,稀氨水显碱性,溶液变成红色,故D正确。故选D。
5.A
【详解】
A、稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌,注意安全,图中操作正确,符合题意;
B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,且氢氧化钠具有强烈的腐蚀性,不能放在纸片上称量,应放在烧杯中称量,不符合题意;
C、量筒的读数方法:视线与凹液面最低处保持水平,不符合题意;
D、不能将pH试纸直接浸入待测溶液中测酸碱性,以防止污染待测液,应用洁净、干燥的玻璃棒蘸取待测液点在pH试纸上,待显色后,与标准比色卡对照,不符合题意。
故选A。
6.B
【详解】
A、稀盐酸和锌反应后酸性减弱,pH升高;
B、稀盐酸和硝酸银反应生成氯化银沉淀和硝酸,酸性几乎不变,溶液的pH值没有明显变化;
C、稀盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,反应后酸性减弱,pH升高;
D、稀盐酸和氢氧化钡反应生成氯化钡和水,反应后酸性减弱,pH升高。
故选B。
7.A
【详解】
①用托盘天平称取物质的质量时,可精确到小数点后一位,所以能称量到5.6g铁粉;②用量筒量取液体时,可精确到0.1ml,所以用10mL量筒量取8.8mL水;③用普通pH试纸测定某溶液的pH时只能粗略测定到整数,不测到5.5;④将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,由于在加热时溶质挥发,得到溶质质量分数小于20%。选A
8.D
【解析】A、实验后剩余的药品应放在指定的容器中,不能放回原瓶,否则污染试剂,故错误;
B、不小心碰倒酒精灯,洒出的酒精在桌上燃烧起来时,应用湿抹布扑灭,或用沙子盖灭,用水扑灭会引起火势的蔓延,故错误;
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能用水湿润pH试纸,否则稀释了待测溶液,测定结果不准确,故错误;
D、洗过的玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表明已经洗干净,故正确。
故选:D.
9.D
【详解】
A、浓氨水挥发出氨气,氨气溶于水溶液呈碱性,会使紫色石蕊试液变蓝色,此项错误;
B、浓硫酸没有挥发性,不能使紫色石蕊试液变红,此项错误;
C、食盐水显中性,不能使紫色石蕊变色,此项错误;
D、浓盐酸有挥发性,挥发出氯化氢气体,溶于水后使紫色石蕊变红,此项正确。
故选:D。
10.B
【解析】
A、可燃性气体的性质:点燃它们与空气或氧气的混合物易发生爆炸,所以某无色气体混入空气后点燃爆炸,不能证明该气体一定是H2还可能是一氧化碳、甲烷等,故A错误;
B、物质溶于水会使溶液温度降低,可证明该物质溶于水吸热,故B正确;
C、物质在空气中燃烧生成二氧化碳和水,可证明该物质一定含碳、氢两种元素可能含有氧元素.故C错误;
D、使酚酞试液变红只能说明显碱性,不能说是碱溶液,故D错误.
故选B.
11.C
【详解】
A. 化学变化不仅有新的物质生成,还一定伴随能量的变化,所以通过化学变化,人们改造物质世界并实现物质与能量的相互转化;B. 碱的溶液PH>7,则PH>7的溶液不一定是碱的溶液,如碳酸钠是盐,溶液的PH>7;C. 质量守恒定律揭示了化学变化中宏观物质之间的质量关系,这种关系是由化学变化中原子的种类、个数、质量不变决定的。D. 单质由同种元素组成的纯净物,由同种元素组成的物质不一定是单质,也可能是由同种元素组成的不同单质组成的混合物。选C
12.C
【详解】
A、由于过氧化氢溶液的浓度不同,不能比较二氧化锰和三氧化二铁的催化效果,故选项装置不能达到对应实验目的;
B、二氧化碳的密度比空气的大,应用向上排空气法收集,故选项装置不能达到对应实验目的;
C、滴加氢氧化钠溶液,会观察到气球膨胀,滴加稀盐酸,会产生大量气泡,能证明生成了新物质,说明CO2和NaOH已发生反应,故选项装置能达到对应实验目的;
D、氨气极易溶于水,水溶液显碱性,能使酚酞溶液变红色,会形成红色喷泉,故选项装置不能达到对应实验目的。
故选:C。
13.BC
【详解】
A、由于标准比色卡上的数字只有整数,用pH试纸测得某溶液的pH不可能精确为5.5,故选项说法错误;
B、托盘天平用于粗略称量药品的质量,能准确到0.1g,可用托盘天平称取5.6g铁粉,故选项说法正确;
C、选取量筒时,尽量选用能一次量取的最小规格的量筒。用10mL量筒量取8.8mL水,量筒选择合理,故选项说法正确;
D、将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,盐酸具有挥发性,得到的盐酸溶质质量分数小于20%,故选项说法错误。
故选BC。
14.AD
【详解】
A、X溶液的pH<7,说明该溶液显酸性, 可能是酸溶液,也可能是盐溶液,如氯化铁溶液,是盐溶液,但显酸性,故A选项正确;
B、Y溶液的pH=7,说明该溶液显中性,氯化钠溶液呈中性,但它是盐溶液,不是蒸馏水,故B错误;
C、Z溶液的pH>7,说明该溶液显碱性,不能说明物质是碱,也可能是盐,如碳酸钠,其水液呈碱性,但碳酸钠是盐类,故C选错误;
D、Z溶液的pH>7,说明该溶液显碱性,根据前面的分析,盐溶液有酸性、中性、碱性的可能,所以Z可能是盐,故D选项正确;
故选D。
15.AD
【解析】
A、木炭在氧气中燃烧,发出白光,故选项说法正确.
B、氢气在空气中燃烧,产生淡蓝色火焰,故选项说法错误.
C、醋酸溶液显酸性,滴入紫色石蕊试剂,溶液变成红色,故选项说法错误.
D、氢氧化钠能与硫酸铜反应生成氢氧化铜蓝色沉淀,故氢氧化钠溶液滴入硫酸铜溶液,会出现蓝色沉淀,故选项说法正确.
故选AD.
16.②④⑤
【详解】
由表格中的信息可知,白醋显酸性,能使紫甘蓝汁液变红色,所以能使紫甘蓝汁液变红色的物质均显酸性,即②④⑤显酸性。
17.pH试纸 肥皂水 降低可燃物温度至着火点以下
【详解】
(1)pH大于7显碱性,pH越大,碱性越强,pH小于7显酸性,pH越小,酸性越强,可通过pH试纸来测定水的酸碱度,故填:pH试纸。
(2)硬水加肥皂水起泡少,浮渣多,软水加肥皂水,起泡多浮渣少,可通过肥皂水鉴别硬水和软水,故填:肥皂水。
(3)在日常生活中,用水灭火的主要原理是用水来吸热,降低可燃物温度至着火点以下,故填:降低可燃物温度至着火点以下。
18.O2 BaSO4 (NH4)2SO4 Ba(OH)2
【详解】
试题分析:B中的反应物是二氧化锰和双氧水,所以产生的气体是氧气;向D中滴加过量的稀硝酸,沉淀不消失,说明该沉淀是氯化银或硫酸钡;E中棉花呈红色,说明D中有氨气产生,说明D中沉淀是硫酸钡,C中盐是硫酸铵,D中原物质是显碱性的氢氧化钡。
19.玻璃棒 吸附悬浮杂质、加速沉降 肥皂水 B ClO2 AB
【详解】
(1)过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒,加入明矾的目的吸附悬浮杂质、加速沉降,硬水的检验可以用肥皂水,泡沫多浮渣少是软水,反之是硬水,
故填:玻璃棒;吸附悬浮杂质、加速沉降;肥皂水;
(2)A、酚酞试液,遇碱性物质变红,酸性中性不变色,也不能反映酸碱性的强弱,不符合题意;
B、pH试纸可以测出酸碱性强弱的具体大小,符合题意;
C、石蕊试液遇酸变红遇碱变蓝,可以判断酸碱性,无法判断强弱,不符合题意;
故选:B;
(3)根据质量守恒定律,在化学反应前,氯原子有4个,钠原子有2个,氧原子有4个,而反应后钠原子有2个,氯原子有2个,所以2X中应有2个氯原子,4个氧原子,所以X的化学式为ClO2,故填:ClO2;
(4)A、随意弃置废旧电池,会造成水体和土壤污染,符合题意;
B、含二氧化硫的工业废气任意排放,会形成酸雨引起水体污染,符合题意;
C、工业废水处理达标后再排放能防止水体污染,不符合题意;
D、严格监管化肥和农药的使用能防止水体污染,不符合题意;
故选:AB。
20.分子是不断运动的 放热 节约药品/不污染空气 A 120:7:32 75.5% 24
【详解】
(1)滴入浓氨水后,可观察到湿润的酚酞滤纸条变红,从微观角度分析,此现象可说明分子是不断运动的;
(2)温度越高分子运动越剧烈,固体氢氧化钠遇到浓氨水时能更快速出现实验现象,说明固体氢氧化钠遇到浓氨水时可能放热;
反思交流:和课本实验比较,小刚改进后的装置的优点是节约药品或者不污染空气;
继续探究:二氧化碳的密度大于空气,故两条用紫色石蕊试液润湿的试纸变红的情况是下面的先变红,上面的后变红;
(3)①酚酞化学式为C20H14O4,其中碳、氢、氧三种元素的质量比=12×20:1×14:16×4=120:7:32;
②酚酞中碳元素的质量分数=×100%≈75.5%;
③31.8g该物质中碳元素的质量=31.8g××100%=24g。
21.氧气 用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH 34 78.96 得到
【解析】
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝氧气防止腐烂;(2)实验室测定溶液pH的操作方法是用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH;(3)如图为硒元素的某些信息,根据质子数=核电荷数=原子序数,硒原子核内有34个质子,根据元素周期表中的一格可知,硒原子的相对原子质量是78.96,根据硒原子的和外电子排布规律可知,硒原子在化学反应中易得到2个电子达到稳定结构。
22.CaCO3+2HCl=CaCl2+H2O+CO2↑ 红色 做催化剂 2KClO32KCl + 3O2 ↑; 122.5 4.8 一加热就马上收集气体。
【详解】
试题分析:(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;(2)二氧化碳通入紫色石蕊试液,试液变红色;因为二氧化碳溶于水生成碳酸;(3)①其中二氧化锰的作用是做催化剂;②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为2KClO3 2KCl + 3O2 ↑,KClO3的相对分子质量为122.5,反应后产生氧气的质量为X,
2KClO3 2KCl + 3O2 ↑
245 96
122.5 X
245/96=122.5/X
X=4.8g
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确)的原因可能是一加热就马上收集气体。
23.
(1)B
(2)有气泡产生
(3)
(4)取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质
(5) 29.3% 氢氧化钙 过滤
【分析】
证明氢氧化钠变质,实质是考查碳酸钠的化学性质,可以选择足量酸、氢氧化钙(或者氢氧化钡)、氯化钙(或者硝酸钙、硝酸钡、氯化钡),分别会生成气体、产生沉淀、产生沉淀,但不能根据酸碱性来验证氢氧化钠是否变质;但要检验碳酸钠、氢氧化钠同时存在时,则要先选择足量的钙盐溶液或者钡盐溶液验证并除尽碳酸钠,再用酚酞来检验氢氧化钠。
(1)
氢氧化钠变质,是氢氧化钠与二氧化碳反应生成碳酸钠和水,氢氧化钠溶液、碳酸钠溶液都显碱性,都可以使酚酞试液变红,故B不能达到实验目的;
(2)
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,故实验A中,观察到有气泡产生则说明氢氧化钠已变质;
(3)
实验D中若生成白色沉淀则能证明氢氧化钠变质,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,化学方程式为:;
(4)
要证明该氢氧化钠部分变质,取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质;
(5)
①根据质量守恒定律可得,生成的碳酸钡的质量为105g+65g-150. 3g=19. 7g;设样品中碳酸钠的质量为x
解得x=10. 6g
样品中氢氧化钠的质量为15g-10. 6g=4. 4g
样品中氢氧化钠的质量分数为:;
②氢氧化钠变质生成碳酸钠,除去碳酸根离子可以用钙离子,不能引入新的杂质,所以应该选用氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以可以将样品溶于水后滴加适量的氢氧化钙溶液,充分反应后过滤。
一、选择题(共15题)
1.下列实验操作不正确的是
A.闻气味 B.倾倒液体
C.测溶液的pH D.稀释浓硫酸
2.“关爱生命,注意安全,拥抱健康”是永恒的主题。有关叙述错误的是
A.如果饮食过量,胃会分泌大量的胃酸,造成消化不良
B.健康人体内血浆的pH范围是6.35-7.45
C.医疗上用作消毒的医用酒精体积分数为75%
D.氯离子在人体中具有促生盐酸、帮助消化和增进食欲的作用
3.小明同学在实验室中测定某未知溶液的pH,他的实验操作如下,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测液于pH试纸上进行测定,你认为小明同学这样测得的结果与该溶液的实际pH比较
A.偏低 B.偏高 C.偏低或偏高 D.无法判定
4.化学学习小组做实验时,记录了下列实验现象,其中正确的是
A.细铁丝在空气中剧烈燃烧,火星四射,有黑色固体生成
B.红磷在空气中燃烧,发出红色的火焰,产生大量白色烟雾
C.碳在氧气中燃烧发出白光,生成二氧化碳
D.向浓氨水中滴加几滴酚酞试液,溶液变成红色
5.下列实验操作正确的是
A.稀释浓硫酸
B.称量氢氧化钠固体
C.液体的量取
D.测量溶液的pH
6.在一定溶质质量分数的稀盐酸中加入下列物质,充分反应后,溶液的pH值没有明显变化的是( )
A.锌粉 B.硝酸银粉末
C.碳酸氢钠粉末 D.氢氧化钡粉来
7.下列实验操作,能达到预期目的的是
①用托盘天平称取5.6g铁粉;②用10mL量筒量取8.8mL水;③用普通pH试纸测定某溶液的pH为5.5;④将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸。
A.①② B.③④ C.①②④ D.①②③④
8.下列操作正确的是( )
A.实验后剩余的药品应该放回原瓶,避免浪费
B.不小心碰倒酒精灯,洒出的酒精在桌子上燃烧起来,应立即用水扑灭
C.用pH试纸测定溶液酸碱度时,先将pH试纸用水润湿,然后再进行测定
D.洗过的玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表明已经洗干净
9.小明设计了如图装置探究“微粒是不断运动的”,一段时间后,可观察到紫色石蕊变红,则物质 A是
A.浓氨水 B.浓硫酸 C.浓食盐水 D.浓盐酸
10.对实验现象的观察和分析,有助于获得化学知识并学会科学探究的方法。下列对实验现象的分析合理的是
A.某无色气体混入空气后点燃爆炸,可证明该气体一定是H2
B.KNO3溶于水会使溶液温度降低,可证明KNO3溶于水吸热
C.物质在空气中燃烧生成二氧化碳和水,可证明该物质一定含碳、氢、氧三种元素
D.某溶液能使酚酞试液变红,可证明该溶液一定是碱溶液
11.你认为下列观点不正确的是
A.通过化学变化,人们改造物质世界并实现物质与能量的相互转化
B.碱的溶液PH>7,则PH>7的溶液不一定是碱的溶液
C.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
D.单质由同种元素组成,由同种元素组成的物质不一定是单质
12.下列装置能达到相应实验目的的是
A.比较MnO2和Fe3O4的催化效果
B.制取并收集CO2气体
C.确认CO2和NaOH已发生反应
D.形成蓝色喷泉
13.下列实验操作,能达到预期目的的是
A.用普通pH试纸测定某溶液的pH为5.5
B.用托盘天平称取5.6g铁粉
C.用10mL量筒量取8.8mL水
D.将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸
14.下图X、Y、Z表示某些物质的pH。下列判断正确的是
A.X可能是盐 B.Y一定是蒸馏水
C.Z一定是碱 D.Z可能是盐
15.下面对某些实验现象的描述,正确的是( )
A.木炭在氧气中燃烧,发出白光
B.氢气在空气中燃烧,产生红色火焰
C.醋酸溶液滴入紫色石蕊试剂,溶液变成蓝色
D.氢氧化钠溶液滴入硫酸铜溶液,出现蓝色沉淀
综合题
16.在做家庭小实验时,将自制酸碱指示剂紫甘蓝汁加入到不同的物质中,会呈现不同的颜色。
物质 ①水 ②水垢清除剂 ③肥皂水 ④白醋 ⑤雪碧
颜色 紫色 红色 蓝色 红色 红色
判断上述物质中,显酸性的有________(填序号)。
17.某同学对南湖的水样进行了相关的研究。
(1)可以用_____来测定水的酸碱度;
(2)为了检验湖水是软水还是硬水,可向水样中加入_____,搅拌;
(3)在日常生活中,用水灭火的主要原理是_____。
18.利用化学反应中气体产生的压力,可使多个化学反应依次发生。下图所示装置气密性良好,A~F各装置中盛放的物质分别为:
A.5%的双氧水;
B.二氧化锰;
C.足量某盐溶液;
D.能溶于水的固体;
E.浸有无色酚酞溶液的棉花;
F.足量稀硫酸。
将A中溶液加入B中,关闭活塞,多个反应依次发生,反应完毕,D中有白色沉淀,E中棉花呈红色。
(1)B中产生的气体是 __________(写化学式,下同);
(2)若向D中滴加过量的稀硝酸,沉淀不消失,则该沉淀是_____。C、D中的原物质是:C_____、D_____。
19.某化学兴趣小组要对黑河的水质状况进行了相关研究调查:
(1)取回水样,加明矾静置后过滤,在实验室里,过滤需要用到的玻璃仪器有_______、烧杯和玻璃棒,加明矾的目的______。为了判断得到的黑河水是硬水或软水,可加入_____进行检验。
(2)若要测定黑河水质的酸碱性强弱,最适宜的是(填字母)___________.
A 酚酞试液 B PH试纸 C 石蕊试液
(3)自来水生产过程中,还必须进行消毒。X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为: Cl2 + 2 NaClO2 = 2 NaCl + 2 X,则X的化学式为________ 。
(4)下列做法会造成水体污染的是 (填字母)___________.
A 随意弃置废旧电池 B 含二氧化硫的工业废气任意排放
C 工业废水处理达标后再排放 D 严格监管化肥和农药的使用
20.微粒观是化学学科重要的观念之一。在探究微粒性质的课外活动中,化学兴趣小组的小刚按照课本方案(见图1)进行实验,闻到了刺激性的氨味,于是,小刚在老师的指导下,对实验进行了改进。
(实验探究)小刚设计了如图2的实验装置,进行同样的实验:
(1)滴入浓氨水后,可观察到湿润的酚酞滤纸条变红,从微观角度分析,此现象可说明的结论是 ______ 。
(2)“与图1比较,图2的实验装置,能更快速出现实验现象”说明固体氢氧化钠遇到浓氨水时可能 ____ (填“放热”或“吸热”)。
(实验结论)改进后的实验不再有刺激性的氨味,且快速出现实验现象,得到了和课本实验同样的结论。
(反思交流)和课本实验比较,小刚改进后的装置的优点是(写出一点) _______ 。
(继续探究)小红受小刚实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的某些性质。打开活塞K滴入稀盐酸后,小试管中发生的反应产生二氧化碳气体后,发现两条用紫色石蕊试液润湿的试纸变红的情况可能是 ______ 。
A下面的先变红,上面的后变红 B上面的和下面的一起变红
C上面的先变红,下面的后变红 D以上均有可能
(3)小刚对酚酞的组成产生兴趣,查阅资料知道其化学式为C20H14O4,并进行了相关计算:
①该物质中碳、氢、氧三种元素的质量比为 ________ 。
②该物质中碳元素的质量分数为 ________ 。(小数点后保留一位有效数字)
③31.8g该物质中碳元素的质量为 ______ g。
21.甜瓜珍品——江西梨瓜以“脆、甜、香”而闻名。梨瓜中含有丰富的蛋白质、粗纤维、维生素、钙、磷、铁、镁、钾、硒等人体所需的营养素;
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝_______防止腐烂;
(2)梨瓜适宜生长在pH为6.0-6.8的土壤中,实验室测定溶液pH的操作方法是_______________;
(3)如图为硒元素的某些信息,硒原子核内有_______个质子,硒原子的相对原子质量是_____,硒原子在化学反应中易_______(填“得到”或“失去”)电子。
22.根据下列装置图回答问题。
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为 _______________________ 。
(2)二氧化碳通入紫色石蕊试液,试液变 _______ 色。
(3)实验室用一定质量的氯酸钾和二氧化锰制取氧气,通过排水量测定所收集到的氧气体积(装置如图)。
①其中二氧化锰的作用是 ___________________________ ;
②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为 _____________ ;KClO3的相对分子质量为 _____ 。计算完全反应后产生氧气的质量为 _________ g。
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因可能是 _________ 。(任写一种情况)
23.兴趣小组的同学为探究在空气中久置的某氢氧化钠样品是否变质,设计了如下图所示的A、B、C、D四组探究实验。
(查阅资料)氯化钙、氯化钡溶液都呈中性。
(实验探究)取适量该氢氧化钠样品,加足量的水溶解,将得到的溶液分别加入到四支试管中,再向四支试管中分别加入稀盐酸(足量)、酚酞试液、氢氧化钙溶液、氯化钙溶液,如图所示:
(分析与结论)
(1)上述四组实验中不能达到实验目的的是______(填字母序号)。
(2)实验A中,观察到______的现象,说明该氢氧化钠样品已经变质。
(3)实验D中,证明该氢氧化钠样品已经变质的反应的化学方程式是______。
(4)要证明该氢氧化钠部分变质,请写出实验步骤、可能的现象及相关推理________。
(5)若实验证明氢氧化钠部分变质,为测定其中氢氧化钠的质量分数,该同学采用沉淀法进行如下操作:①取15g样品于烧杯中,加入足量水配成溶液;②在样品溶液中加入足量的氯化钡溶液;③待反应完全后,过滤。有关数据如表:
反应前 反应后
烧杯和样品溶液总质量/g 加入氯化钡溶液质量/g 过滤后烧杯和溶液总质量/g(不计滤液损失)
105 65 150.3
请回答下列问题:
①原样品中氢氧化钠的质量分数是______(保留到0.1%)
②另取样品溶于水,若要除去杂质获取氢氧化钠溶液,可以向其中加入______溶液,然后______(填操作名称)即可。
参考答案
1.C
【详解】
A、闻气体的气味要用手轻轻扇动使少量的气体进入鼻子闻气味,选项正确;
B、取用液体药品,试管要紧靠试剂瓶口倾倒,瓶塞要倒放,标签朝向手心,选项正确;
C、测定溶液pH时不能将试纸直接伸入溶液中,以防污染溶液, 选项错误;
D、稀释浓硫酸必须将浓硫酸加入水中,并用玻璃棒不断搅拌,选项正确。故选C。
2.B
【详解】
A、如果饮食过量,胃会分泌大量的胃酸,造成消化不良,故A正确;B、 健康人体内血浆呈弱碱性,pH范围是7.35-7.45,故B错误;C、 医疗上用作消毒的医用酒精体积分数为75%,故C正确;D、 氯离子在人体中具有促生盐酸、帮助消化和增进食欲的作用,故D正确。故选B。
3.D
【详解】
小明同学在测量某未知溶液的pH时,先用蒸馏水将pH试纸润湿,再滴加待测液,相当于稀释了待测液,会使溶液中的溶质质量分数减小,对于酸性溶液来说会使其酸性减弱,pH变大;对于碱性溶液来说会使其碱性减弱,pH变小;但对于中性溶液来说,pH不变。
故选D。
4.D
【详解】
A、细铁丝在空气中产生红热现象,故A不正确;
B、红磷在空气中燃烧,发出红色的火焰,产生大量白烟,故B不正确;
C、碳在氧气中燃烧发出白光,生成二氧化碳属于结论,不是现象,故C不正确;
D、向稀氨水中滴加几滴酚酞试液,稀氨水显碱性,溶液变成红色,故D正确。故选D。
5.A
【详解】
A、稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌,注意安全,图中操作正确,符合题意;
B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,且氢氧化钠具有强烈的腐蚀性,不能放在纸片上称量,应放在烧杯中称量,不符合题意;
C、量筒的读数方法:视线与凹液面最低处保持水平,不符合题意;
D、不能将pH试纸直接浸入待测溶液中测酸碱性,以防止污染待测液,应用洁净、干燥的玻璃棒蘸取待测液点在pH试纸上,待显色后,与标准比色卡对照,不符合题意。
故选A。
6.B
【详解】
A、稀盐酸和锌反应后酸性减弱,pH升高;
B、稀盐酸和硝酸银反应生成氯化银沉淀和硝酸,酸性几乎不变,溶液的pH值没有明显变化;
C、稀盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,反应后酸性减弱,pH升高;
D、稀盐酸和氢氧化钡反应生成氯化钡和水,反应后酸性减弱,pH升高。
故选B。
7.A
【详解】
①用托盘天平称取物质的质量时,可精确到小数点后一位,所以能称量到5.6g铁粉;②用量筒量取液体时,可精确到0.1ml,所以用10mL量筒量取8.8mL水;③用普通pH试纸测定某溶液的pH时只能粗略测定到整数,不测到5.5;④将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,由于在加热时溶质挥发,得到溶质质量分数小于20%。选A
8.D
【解析】A、实验后剩余的药品应放在指定的容器中,不能放回原瓶,否则污染试剂,故错误;
B、不小心碰倒酒精灯,洒出的酒精在桌上燃烧起来时,应用湿抹布扑灭,或用沙子盖灭,用水扑灭会引起火势的蔓延,故错误;
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能用水湿润pH试纸,否则稀释了待测溶液,测定结果不准确,故错误;
D、洗过的玻璃仪器内壁附着的水既不聚成水滴,也不成股流下时,表明已经洗干净,故正确。
故选:D.
9.D
【详解】
A、浓氨水挥发出氨气,氨气溶于水溶液呈碱性,会使紫色石蕊试液变蓝色,此项错误;
B、浓硫酸没有挥发性,不能使紫色石蕊试液变红,此项错误;
C、食盐水显中性,不能使紫色石蕊变色,此项错误;
D、浓盐酸有挥发性,挥发出氯化氢气体,溶于水后使紫色石蕊变红,此项正确。
故选:D。
10.B
【解析】
A、可燃性气体的性质:点燃它们与空气或氧气的混合物易发生爆炸,所以某无色气体混入空气后点燃爆炸,不能证明该气体一定是H2还可能是一氧化碳、甲烷等,故A错误;
B、物质溶于水会使溶液温度降低,可证明该物质溶于水吸热,故B正确;
C、物质在空气中燃烧生成二氧化碳和水,可证明该物质一定含碳、氢两种元素可能含有氧元素.故C错误;
D、使酚酞试液变红只能说明显碱性,不能说是碱溶液,故D错误.
故选B.
11.C
【详解】
A. 化学变化不仅有新的物质生成,还一定伴随能量的变化,所以通过化学变化,人们改造物质世界并实现物质与能量的相互转化;B. 碱的溶液PH>7,则PH>7的溶液不一定是碱的溶液,如碳酸钠是盐,溶液的PH>7;C. 质量守恒定律揭示了化学变化中宏观物质之间的质量关系,这种关系是由化学变化中原子的种类、个数、质量不变决定的。D. 单质由同种元素组成的纯净物,由同种元素组成的物质不一定是单质,也可能是由同种元素组成的不同单质组成的混合物。选C
12.C
【详解】
A、由于过氧化氢溶液的浓度不同,不能比较二氧化锰和三氧化二铁的催化效果,故选项装置不能达到对应实验目的;
B、二氧化碳的密度比空气的大,应用向上排空气法收集,故选项装置不能达到对应实验目的;
C、滴加氢氧化钠溶液,会观察到气球膨胀,滴加稀盐酸,会产生大量气泡,能证明生成了新物质,说明CO2和NaOH已发生反应,故选项装置能达到对应实验目的;
D、氨气极易溶于水,水溶液显碱性,能使酚酞溶液变红色,会形成红色喷泉,故选项装置不能达到对应实验目的。
故选:C。
13.BC
【详解】
A、由于标准比色卡上的数字只有整数,用pH试纸测得某溶液的pH不可能精确为5.5,故选项说法错误;
B、托盘天平用于粗略称量药品的质量,能准确到0.1g,可用托盘天平称取5.6g铁粉,故选项说法正确;
C、选取量筒时,尽量选用能一次量取的最小规格的量筒。用10mL量筒量取8.8mL水,量筒选择合理,故选项说法正确;
D、将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,盐酸具有挥发性,得到的盐酸溶质质量分数小于20%,故选项说法错误。
故选BC。
14.AD
【详解】
A、X溶液的pH<7,说明该溶液显酸性, 可能是酸溶液,也可能是盐溶液,如氯化铁溶液,是盐溶液,但显酸性,故A选项正确;
B、Y溶液的pH=7,说明该溶液显中性,氯化钠溶液呈中性,但它是盐溶液,不是蒸馏水,故B错误;
C、Z溶液的pH>7,说明该溶液显碱性,不能说明物质是碱,也可能是盐,如碳酸钠,其水液呈碱性,但碳酸钠是盐类,故C选错误;
D、Z溶液的pH>7,说明该溶液显碱性,根据前面的分析,盐溶液有酸性、中性、碱性的可能,所以Z可能是盐,故D选项正确;
故选D。
15.AD
【解析】
A、木炭在氧气中燃烧,发出白光,故选项说法正确.
B、氢气在空气中燃烧,产生淡蓝色火焰,故选项说法错误.
C、醋酸溶液显酸性,滴入紫色石蕊试剂,溶液变成红色,故选项说法错误.
D、氢氧化钠能与硫酸铜反应生成氢氧化铜蓝色沉淀,故氢氧化钠溶液滴入硫酸铜溶液,会出现蓝色沉淀,故选项说法正确.
故选AD.
16.②④⑤
【详解】
由表格中的信息可知,白醋显酸性,能使紫甘蓝汁液变红色,所以能使紫甘蓝汁液变红色的物质均显酸性,即②④⑤显酸性。
17.pH试纸 肥皂水 降低可燃物温度至着火点以下
【详解】
(1)pH大于7显碱性,pH越大,碱性越强,pH小于7显酸性,pH越小,酸性越强,可通过pH试纸来测定水的酸碱度,故填:pH试纸。
(2)硬水加肥皂水起泡少,浮渣多,软水加肥皂水,起泡多浮渣少,可通过肥皂水鉴别硬水和软水,故填:肥皂水。
(3)在日常生活中,用水灭火的主要原理是用水来吸热,降低可燃物温度至着火点以下,故填:降低可燃物温度至着火点以下。
18.O2 BaSO4 (NH4)2SO4 Ba(OH)2
【详解】
试题分析:B中的反应物是二氧化锰和双氧水,所以产生的气体是氧气;向D中滴加过量的稀硝酸,沉淀不消失,说明该沉淀是氯化银或硫酸钡;E中棉花呈红色,说明D中有氨气产生,说明D中沉淀是硫酸钡,C中盐是硫酸铵,D中原物质是显碱性的氢氧化钡。
19.玻璃棒 吸附悬浮杂质、加速沉降 肥皂水 B ClO2 AB
【详解】
(1)过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒,加入明矾的目的吸附悬浮杂质、加速沉降,硬水的检验可以用肥皂水,泡沫多浮渣少是软水,反之是硬水,
故填:玻璃棒;吸附悬浮杂质、加速沉降;肥皂水;
(2)A、酚酞试液,遇碱性物质变红,酸性中性不变色,也不能反映酸碱性的强弱,不符合题意;
B、pH试纸可以测出酸碱性强弱的具体大小,符合题意;
C、石蕊试液遇酸变红遇碱变蓝,可以判断酸碱性,无法判断强弱,不符合题意;
故选:B;
(3)根据质量守恒定律,在化学反应前,氯原子有4个,钠原子有2个,氧原子有4个,而反应后钠原子有2个,氯原子有2个,所以2X中应有2个氯原子,4个氧原子,所以X的化学式为ClO2,故填:ClO2;
(4)A、随意弃置废旧电池,会造成水体和土壤污染,符合题意;
B、含二氧化硫的工业废气任意排放,会形成酸雨引起水体污染,符合题意;
C、工业废水处理达标后再排放能防止水体污染,不符合题意;
D、严格监管化肥和农药的使用能防止水体污染,不符合题意;
故选:AB。
20.分子是不断运动的 放热 节约药品/不污染空气 A 120:7:32 75.5% 24
【详解】
(1)滴入浓氨水后,可观察到湿润的酚酞滤纸条变红,从微观角度分析,此现象可说明分子是不断运动的;
(2)温度越高分子运动越剧烈,固体氢氧化钠遇到浓氨水时能更快速出现实验现象,说明固体氢氧化钠遇到浓氨水时可能放热;
反思交流:和课本实验比较,小刚改进后的装置的优点是节约药品或者不污染空气;
继续探究:二氧化碳的密度大于空气,故两条用紫色石蕊试液润湿的试纸变红的情况是下面的先变红,上面的后变红;
(3)①酚酞化学式为C20H14O4,其中碳、氢、氧三种元素的质量比=12×20:1×14:16×4=120:7:32;
②酚酞中碳元素的质量分数=×100%≈75.5%;
③31.8g该物质中碳元素的质量=31.8g××100%=24g。
21.氧气 用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH 34 78.96 得到
【解析】
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝氧气防止腐烂;(2)实验室测定溶液pH的操作方法是用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH;(3)如图为硒元素的某些信息,根据质子数=核电荷数=原子序数,硒原子核内有34个质子,根据元素周期表中的一格可知,硒原子的相对原子质量是78.96,根据硒原子的和外电子排布规律可知,硒原子在化学反应中易得到2个电子达到稳定结构。
22.CaCO3+2HCl=CaCl2+H2O+CO2↑ 红色 做催化剂 2KClO32KCl + 3O2 ↑; 122.5 4.8 一加热就马上收集气体。
【详解】
试题分析:(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为CaCO3+2HCl==CaCl2+H2O+CO2↑;(2)二氧化碳通入紫色石蕊试液,试液变红色;因为二氧化碳溶于水生成碳酸;(3)①其中二氧化锰的作用是做催化剂;②用12.25g氯酸钾和二氧化锰制取制取氧气,反应的化学方程式为2KClO3 2KCl + 3O2 ↑,KClO3的相对分子质量为122.5,反应后产生氧气的质量为X,
2KClO3 2KCl + 3O2 ↑
245 96
122.5 X
245/96=122.5/X
X=4.8g
(4)根据③的氧气的质量计算得出的氧气体积为理论值。如果实际测得氧气的体积大于理论值(水的体积测量准确)的原因可能是一加热就马上收集气体。
23.
(1)B
(2)有气泡产生
(3)
(4)取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质
(5) 29.3% 氢氧化钙 过滤
【分析】
证明氢氧化钠变质,实质是考查碳酸钠的化学性质,可以选择足量酸、氢氧化钙(或者氢氧化钡)、氯化钙(或者硝酸钙、硝酸钡、氯化钡),分别会生成气体、产生沉淀、产生沉淀,但不能根据酸碱性来验证氢氧化钠是否变质;但要检验碳酸钠、氢氧化钠同时存在时,则要先选择足量的钙盐溶液或者钡盐溶液验证并除尽碳酸钠,再用酚酞来检验氢氧化钠。
(1)
氢氧化钠变质,是氢氧化钠与二氧化碳反应生成碳酸钠和水,氢氧化钠溶液、碳酸钠溶液都显碱性,都可以使酚酞试液变红,故B不能达到实验目的;
(2)
碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,故实验A中,观察到有气泡产生则说明氢氧化钠已变质;
(3)
实验D中若生成白色沉淀则能证明氢氧化钠变质,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,化学方程式为:;
(4)
要证明该氢氧化钠部分变质,取样品溶解,加入足量的氯化钙溶液,若有白色沉淀生成,则其中含有碳酸钠,过滤向滤液中滴加酚酞,若变红,则氢氧化钠剩余,说明部分变质;
(5)
①根据质量守恒定律可得,生成的碳酸钡的质量为105g+65g-150. 3g=19. 7g;设样品中碳酸钠的质量为x
解得x=10. 6g
样品中氢氧化钠的质量为15g-10. 6g=4. 4g
样品中氢氧化钠的质量分数为:;
②氢氧化钠变质生成碳酸钠,除去碳酸根离子可以用钙离子,不能引入新的杂质,所以应该选用氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以可以将样品溶于水后滴加适量的氢氧化钙溶液,充分反应后过滤。
