6.3金属矿物与冶炼 同步练习(含解析)-2021-2022学年九年级化学科粤版(2012)下册
文档属性
| 名称 | 6.3金属矿物与冶炼 同步练习(含解析)-2021-2022学年九年级化学科粤版(2012)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 387.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 09:10:23 | ||
图片预览



文档简介
6.3金属矿物与冶炼
一、选择题(共12题)
1.下列有关实验现象的描述,错误的是。
A.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
B.硫在空气中燃烧发出淡蓝色火焰,生成二氧化硫气体
C.红磷在空气中燃烧,产生大量白烟
D.一氧化碳高温还原氧化铁时,红棕色粉末逐渐变成黑色
2.下列物质不属于合金的是
A.黄铜 B.硬铝 C.金刚石 D.生铁
3.科学家将微小的固态氢置于488万个大气压下,使固体中所有的氢气分子破裂为氢原子,制得具有金属性质的新物质——金属氢。下列说法错误的是
A.该过程发生了物理变化
B.金属氢是一种高能燃料
C.金属氢有良好的导电性
D.金属氢由氢原子直接构成
4.下列矿石的主要成分为Fe3O4的是( )
A.赤铁矿 B.磁铁矿 C.菱铁矿 D.褐铁矿
5.下列说法正确的是( )
A.所有金属都呈银白色 B.常温下金属都是固体
C.多数合金的熔点高于组成它的成分金属的熔点 D.工业炼铁的主要原理是用一氧化碳与铁矿石在高温下反应生成铁
6.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
7.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
8.用如图装置完成以下实验:
(1)探究燃烧条件:若 B 处盛放木炭。
Ⅰ.先在 A 处通入氮气一段时间后,在 B 处加热B、C 处没有明显变化;
Ⅱ.待 B 处冷却至室温,在 A 处通入氧气一段时间后,B、C 处没有明显变化;
Ⅲ.在 A 处继续通入氧气,然后在 B 处加热,发现木炭燃烧,C 处变浑浊。
(2)模拟工业炼铁:若 B 处盛放氧化铁粉末。在 A 处通入一氧化碳一段时间后,B 处下方用酒精喷灯加热。下列说法中正确的个数有()
①Ⅰ和Ⅲ对比,说明燃烧需要可燃物与氧气接触
②Ⅰ和Ⅲ对比,说明氧气的化学性质比氮气活泼
③Ⅱ和Ⅲ对比,说明燃烧需要温度达到可燃物的着火点
④实验(2)中缺乏尾气处理装置
⑤实验(2)中玻璃管内物质的质量在反应前后的减少量等于 C 中反应前后物质的质量的增加量
A.5 个 B.4 个 C.3 个 D.2 个
9.下列对应实验中,现象和结论都正确且两者具有因果关系的是
选项 实验操作 现象 结论
A 高温下,将一氧化碳通过氧化铁粉末 黑色粉末变为红色 一氧化碳具有还原性
B 电解水实验 正、负极产生的气体质量之比为1:2 1个水分子中含有1个氧原子和2个氢原子
c 在装有等量水的试管中分别加入等量NaOH和NH4NO3固体 前者水温升高,后者水温降低 不同物质在溶于水的过程中产生吸热或放热现象
D 用乙醇(CH3CH2OH)进行导电性试验,观察小灯泡是否变亮 小灯泡变亮 乙醇中存在自由移动的离子
A.A B.B C.C D.D
10.下列有关物质性质与用途的说法均正确的是
A.一氧化碳具有还原性,可用于铁的冶炼
B.金属铝不能与氧气反应,常用于制作炊具
C.碳酸钠能与酸反应,常用于治疗胃酸过多
D.活性炭具有吸附性,常用于自来水杀菌消毒
11.现有640t含 Fe2O380%赤铁矿石,炼制过程中Fe2O3利用率为90%理论上可炼出含杂质4%的生铁的质量为
A.336t B.224t C.206 t D.112t
12.铁是一种应用广泛的金属。下列有关铁的叙述正确的是( )
A.铁是地壳中含量最多的金属
B.工业上用二氧化碳冶炼钢铁
C.用铁可以回收硝酸银废液中的银
D.铁丝在氧气中燃烧生成氧化铁
二、综合题(共6题)
13.请写出下列反应的化学方程式:
(1)一氧化碳还原氧化铁:__________;
(2)木炭还原氧化铜:__________;
(3)甲烷充分燃烧:______。
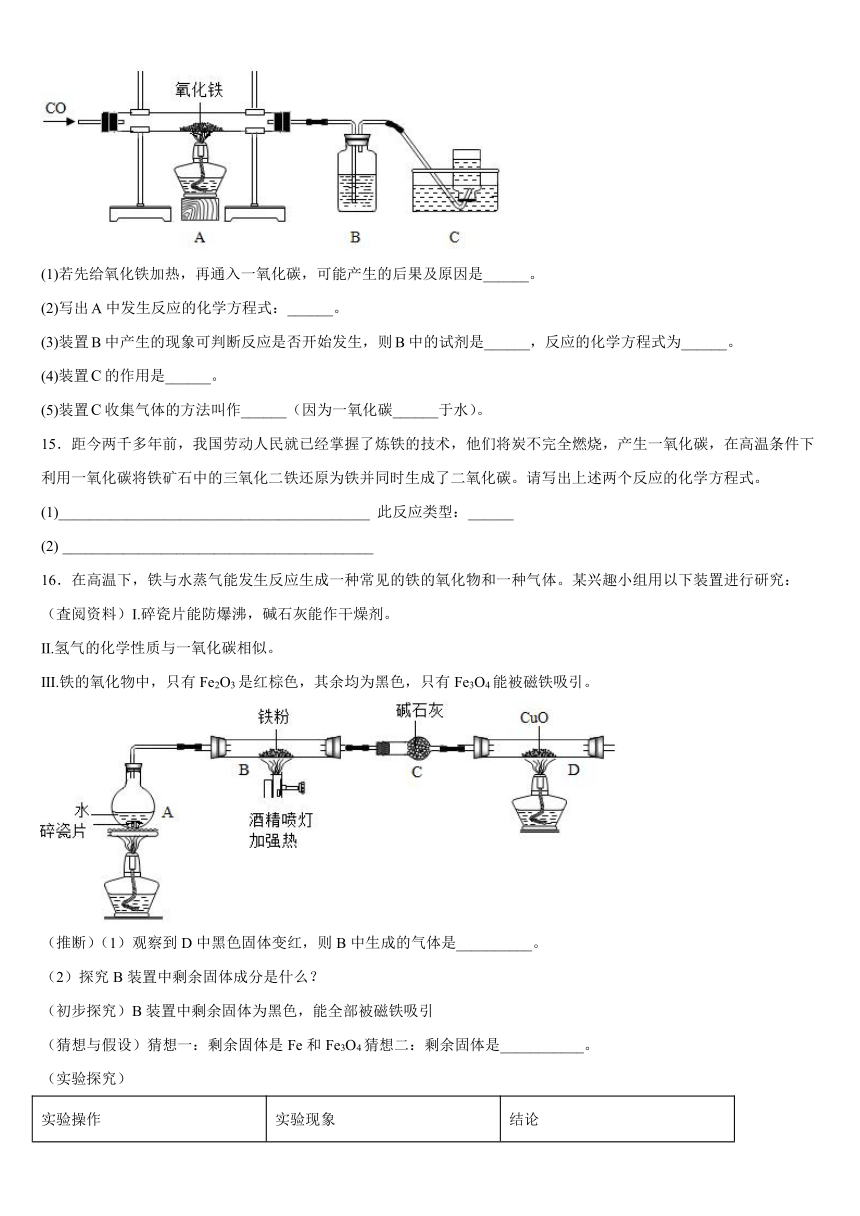
14.某学生改进一氧化碳还原氧化铁的实验装置,如图所示:
(1)若先给氧化铁加热,再通入一氧化碳,可能产生的后果及原因是______。
(2)写出中发生反应的化学方程式:______。
(3)装置中产生的现象可判断反应是否开始发生,则中的试剂是______,反应的化学方程式为______。
(4)装置的作用是______。
(5)装置收集气体的方法叫作______(因为一氧化碳______于水)。
15.距今两千多年前,我国劳动人民就已经掌握了炼铁的技术,他们将炭不完全燃烧,产生一氧化碳,在高温条件下利用一氧化碳将铁矿石中的三氧化二铁还原为铁并同时生成了二氧化碳。请写出上述两个反应的化学方程式。
(1)_________________________________________ 此反应类型:______
(2) _________________________________________
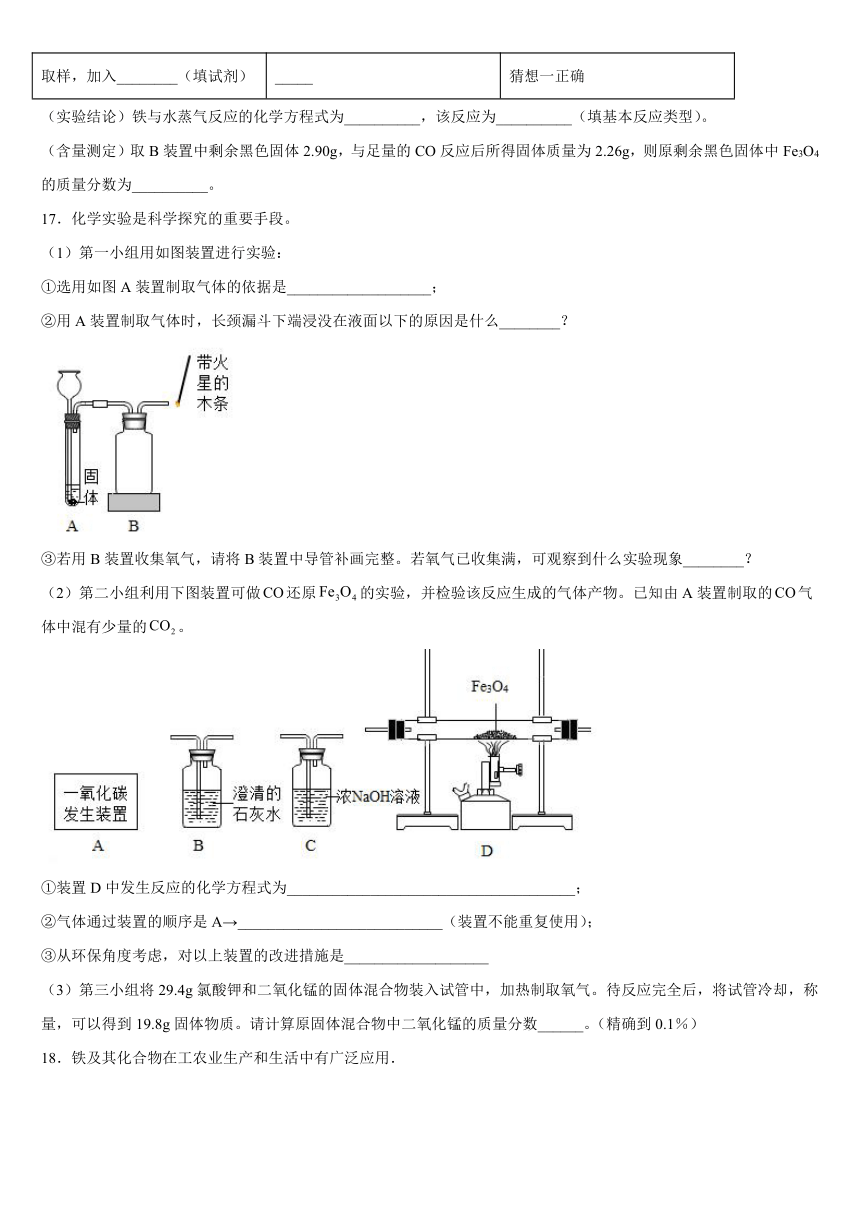
16.在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组用以下装置进行研究:
(査阅资料)Ⅰ.碎瓷片能防爆沸,碱石灰能作干燥剂。
Ⅱ.氢气的化学性质与一氧化碳相似。
Ⅲ.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
(推断)(1)观察到D中黑色固体变红,则B中生成的气体是__________。
(2)探究B装置中剩余固体成分是什么?
(初步探究)B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想与假设)猜想一:剩余固体是Fe和Fe3O4猜想二:剩余固体是___________。
(实验探究)
实验操作 实验现象 结论
取样,加入________(填试剂) _____ 猜想一正确
(实验结论)铁与水蒸气反应的化学方程式为__________,该反应为__________(填基本反应类型)。
(含量测定)取B装置中剩余黑色固体2.90g,与足量的CO反应后所得固体质量为2.26g,则原剩余黑色固体中Fe3O4的质量分数为__________。
17.化学实验是科学探究的重要手段。
(1)第一小组用如图装置进行实验:
①选用如图A装置制取气体的依据是___________________;
②用A装置制取气体时,长颈漏斗下端浸没在液面以下的原因是什么________?
③若用B装置收集氧气,请将B装置中导管补画完整。若氧气已收集满,可观察到什么实验现象________?
(2)第二小组利用下图装置可做还原的实验,并检验该反应生成的气体产物。已知由A装置制取的气体中混有少量的。
①装置D中发生反应的化学方程式为______________________________________;
②气体通过装置的顺序是A→___________________________(装置不能重复使用);
③从环保角度考虑,对以上装置的改进措施是___________________
(3)第三小组将29.4g氯酸钾和二氧化锰的固体混合物装入试管中,加热制取氧气。待反应完全后,将试管冷却,称量,可以得到19.8g固体物质。请计算原固体混合物中二氧化锰的质量分数______。(精确到0.1%)
18.铁及其化合物在工农业生产和生活中有广泛应用.
(1)图1为高炉炼铁示意图.从炉底流出的生铁属________(填“金属单质”或“合金”).
下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有_________(填字母).
A.①② B.①③ C.②③ D.②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
(查阅资料)碱石灰能吸收二氧化碳和水蒸气
(问题讨论)装置B的作用是_______________________,从环保角度看该实验装置有一明显缺陷是:_________________.
(数据处理)称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.则 样品中氧化铁质量分数为___________%.
(实验反思)当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数_________(填“偏大”,“偏小”,“无影响”)
(3)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:
①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+Fe2(SO4)3=3FeSO4外,还有_______________________;
②滤液M的溶质有____________________,操作1为___________________;
③FeSO4的溶解度和析出组成如下表.在操作2中,析出FeSO4 7H2O晶体的最高温度不超过___________℃.
温度t/℃ 0 10 30 40 50 60 64 70 80 90
溶解度S/g 15.6 20.5 33.0 40.4 48.8 55.0 55.3 50.6 43.7 37.2
析出晶体 FeSO4 7H2O FeSO4 4H2O FeSO4 H2O
(4)5.56g硫酸亚铁晶体(FeSO4 xH2O)隔绝空气受热分解时,生成金属氧化物和气体.固体产物的质量随温度变化的曲线如图3所示.
①0~t1℃,发生的变化是加热失去结晶水,x=__________;
②t2℃时B点固体组成只有一种,化学式为_____________.
参考答案
1.B
【详解】
A、细铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法正确。
B、硫在空气中燃烧发出淡蓝色火焰,生成二氧化硫气体是实验结论而不是实验现象,故选项说法错误。
C、红磷在空气中燃烧,产生大量白烟,故选项说法正确。
D、一氧化碳高温还原氧化铁时,生成铁和二氧化碳,会观察到红棕色粉末逐渐变成黑色,故选项说法正确。
故选:B。
2.C
【详解】
A、反应前Fe2O3中的Fe元素显+3价,反应后Fe元素显0价,反应前后Fe元素化合价降低,不符合题意;
B、由质量守恒定律可知,反应前后原子的种类没有改变,数目没有增减,X的化学式是CO,化学反应方程式为:,不符合题意;
C、赤铁矿经粉碎处理后,冶炼得更快、更充分,这是因为赤铁矿粉与一氧化碳有更大的接触面,符合题意;
D、该反应属于氧化还原反应,不符合题意。
故选C。
3.B
【详解】
该氧化物中铁的质量分数:×100%=75%;
Fe2O3中铁的质量分数:×100%=70%;
FeO中铁的质量分数:×100%≈77.8%
Fe3O4中铁的质量分数:×100%≈72.4%;
根据以上计算结果,FeO、Fe2O3、Fe3O4组成的混合物质量分数可以是75%。
故选B。
4.B
【详解】
A.赤铁矿的主要成分是氧化铁﹣﹣Fe2O3,选项错误;
B.磁铁矿的主要成分是四氧化三铁﹣﹣Fe3O4,选项正确;
C.菱铁矿的主要成分是碳酸亚铁﹣﹣FeCO3,选项错误;
D.褐铁矿的主要成分是Fe2O3 3H2O,选项错误,故选B。
5.D
【详解】
A、不是所有金属都呈银白色,如铜呈紫红色,不符合题意;
B、常温下金属不一定都是固体,如汞是液体,不符合题意;
C、多数合金的熔点低于组成它的成分金属的熔点,不符合题意;
D、工业炼铁的主要原理是利用一氧化碳具有还原性,用一氧化碳与铁矿石在高温下反应生成铁,符合题意。故选D。
6.A
【解析】
【详解】
A、一氧化碳具有可燃性,混有一定量的空气,遇明火容易发生爆炸,故应先滴加HCOOH,产生一氧化碳,将装置内的空气排尽,然后点燃乙处酒精灯,符合题意;
B、一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,二氧化碳与澄清石灰水反应,由于消耗了二氧化碳,装置内压强减小,澄清石灰水容易倒吸,炸裂试管,故装置丙的作用是防止倒吸,不符合题意;
C、二氧化碳能使澄清石灰水变浑浊,故装置丁可以检验CO2,同时一氧化碳与澄清石灰水不反应,可用排水法收集CO,不符合题意;
D、,该反应有水生成,随着反应的进行,浓硫酸浓度降低,产生CO气体速率减小,不符合题意。
故选A。
7.C
【解析】
【详解】
A、得氧的过程是氧化反应,失氧的过程是还原反应,B处玻璃管内发生的化学反应是氧化铁和一氧化碳反应生成铁和二氧化碳,是氧化还原反应,还原剂是CO,选项正确;
B、CO与空气的混合气体,点燃或加热时可能发生爆炸。在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气,防止加热事发生爆炸,选项正确;
C、氧化铁是红色固体,铁粉是黑色固体,该实验可以观察到B处固体从红色逐渐变成黑色,选项错误;
D、一氧化碳是大气污染物,该模拟实验缺少尾气处理装置,会污染空气,选项正确。
故选C。
8.B
【解析】
【详解】
①Ⅰ和Ⅲ对比,通入的气体不同,温度相同,由Ⅲ中木炭能燃烧Ⅰ中木炭不燃烧说明燃烧需要可燃物与氧气接触,故正确;
②Ⅰ和Ⅲ对比,氧气能与木炭反应氮气不能与木炭反应,说明O2的化学性质比氮气活泼,故正确;
③Ⅱ和Ⅲ对比,说明燃烧需要温度达到可燃物的着火点,故正确;
④实验(2)中的尾气中含有一氧化碳,能污染空气,该装置缺乏尾气处理装置,故正确;
⑤实验(2)中玻璃管内物质的质量在反应前后的减少量是氧元素的质量,C中反应前后物质的质量的增加量是二氧化碳的质量,二者不可能相等,故错误;
由以上分析可知,B正确。
故选B。
9.C
【详解】
A、高温下,将一氧化碳通过氧化铁粉末,一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,红棕色粉末变为黑色,说明一氧化碳具有还原性,故选项说法错误;
B、电解水实验中正、负极产生的气体体积之比为1:2,错误;
C、在装有等量水的试管中分别加入等量NaOH和NH4NO3固体,现象为前者水温升高,后者水温降低,说明不同物质在溶于水的过程中产生吸热或放热现象,正确;
D、酒精中不含有自由移动的离子,错误;
故选C。
10.A
【解析】
试题分析:CO具有夺取金属氧化物中的氧元素生成CO2的性质,即还原性,因此可用于冶炼金属,如炼铁,A正确;金属铝在常温下即可与氧气发生反应,而铝用作炊具是利用了铝的延展性和导热性,B错误;用于治疗胃酸过多的盐是碳酸氢钠(小苏打),而不是碳酸钠(纯碱、苏打),C错误;利用活性炭的吸附性,可除去水中的色素和异味,但不能起到杀菌消毒作用,D错误。故选A
11.A
【详解】
解:设理论上可炼出含杂质4%的生铁的质量为x
x=336t。
故选A。
12.C
【详解】
A. 铝是地壳中含量最多的金属,选项A不正确;
B. 工业上用一氧化碳冶炼钢铁,选项B不正确;
C. 铁比银活泼,因此用铁可以回收硝酸银废液中的银,选项C正确;
D. 铁丝在氧气中燃烧生成黑色的四氧化三铁,选项D不正确。
故选C。
13.(1)Fe2O3+3CO2Fe+3CO2
(2)C+2CuO2Cu+CO2↑
(3)CH4+2O2CO2+2H2
【解析】
(1)
一氧化碳在高温下和氧化铁反应生成铁和二氧化碳,化学方程式为: ;
(2)
碳和氧化铜在高温下生成铜和二氧化碳,化学方程式为:;
(3)
甲烷和氧气点燃生成水和二氧化碳,化学方程式为:。
14.(1)发生爆炸,其原因是可燃性气体(一氧化碳)和助燃性气体(氧气)混合加热可能发生爆炸
(2)3CO + Fe2O3 2Fe + 3CO2
(3) 澄清石灰水 CO2 + Ca(OH)2 = CaCO3↓+ H2O
(4)收集尾气
(5) 排水法 难溶
【解析】
略
15. 化合反应
【解析】
【详解】
(1)炭不完全燃烧,产生一氧化碳,化学方程式为:,该反应是由两种或两种以上的物质反应生成一种新物质的反应,特点是 “多变一”, 是化学反应的常见的四大基本反应类型之一,属于化合反应。
(2)一氧化碳在高温下还原氧化铁,生成铁和二氧化碳,化学方程式为:。
16.氢气 四氧化三铁 稀盐酸 有气泡生成 置换反应 设:四氧化三铁的质量为
答:原剩余黑色固体中Fe3O4的质量分数为80%
【详解】
(1)观察到D中黑色固体变红,则B中生成的气体具有还原性,再根据反应物为“铁与水蒸气”,该气体是氢气;
[猜想与假设]能被磁铁吸引的只有铁和四氧化三铁,则猜想其一是四氧化三铁;又不能只有铁没有其他反应物,猜想其二是四氧化三铁;
[实验探究]
根据铁与稀盐酸反应生成气体,进行设计实验:取少量黑色固体与试管中,加入足量的稀盐酸,若固体全部溶解,没有气泡生成,则猜想二正确;若固体全部溶解,有气泡冒出,则猜想易正确,故填:稀盐酸;有气泡生成;
[实验结论]
铁与水蒸气在高温的条件下反应生成四氧化三铁和氢气,该反应是由单质和化合物反应生成另一种单质和化合物,属于置换反应,该反应的化学方程式为:
;
[实验测定]见答案。
17.反应物是固体和液体,反应条件不加热(或固液不加热)。 防止气体从长颈漏斗中逸出。 带火星的木条复燃。 在A装置后增加一个尾气处理装置或将尾气点燃或进行收集等 16.7%。
【详解】
(1)①由图可知,该装置是固液混合常温型发生装置。故选用该装置制取气体的依据是:反应物是固体和液体,反应条件不加热(或固液不加热);
②用A装置制取气体时,长颈漏斗下端浸没在液面以下的原因是:防止气体从长颈漏斗中逸出;
③由于氧气的密度比空气大,用多功能瓶收集氧气时,氧气应“长进短出”,故B装置应为:;由于氧气有助燃性,可使带火星的木条复燃。故若氧气已收集满,可观察到:带火星的木条复燃;
(2)①装置D中一氧化碳与四氧化三铁在高温的条件下反应,生成铁和二氧化碳,反应的化学方程式为:Fe3O4+4CO 高温3Fe+4CO2;
②要检验生成二氧化碳,需要先将一氧化碳中混有的二氧化碳除去,可以先通过氢氧化钠溶液,检验二氧化碳使用的是澄清的石灰水,故气体通过装置的顺序是A→C→D→B;
③从环保角度考虑,需要对一氧化碳进行尾气处理,故对以上装置的改进措施是:在A装置后增加一个尾气处理装置(或将尾气点燃或进行收集等);
(3)反应生成氧气的质量为:29.4g-19.8g=9.6g
设混合物中氯酸钾的质量为x。
x=24.5g
原固体混合物中二氧化锰的质量分数=×100%≈16.7%
答:原固体混合物中二氧化锰的质量分数为16.7%。
18.合金 D 吸收空气中的水和二氧化碳 未进行尾气处理 66.3 无影响 Fe+H2SO4═FeSO4+H2↑ FeSO4、H2SO4 过滤 60 7 Fe2O3
【详解】
(1)从炉底流出的生铁是铁和碳的混合物,属于铁的合金;在高炉炼铁中碳能燃烧产生热量、能生成一氧化碳作为还原氧化铁的物质,故填:合金,D;
(2)[问题讨论]
装置B中盛有的是碱石灰,碱石灰能吸收空气中的水和二氧化碳,防止对实验结果造成干扰,一氧化碳是有毒的气体,而该装置中没有进行尾气处理,故填:吸收空气中的水和二氧化碳;未进行尾气处理;
[数据处理]
称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.说明生成二氧化碳的质量为4.4g,设氧化铁的质量为x
x≈5.3g
则样品中氧化铁质量分数为,故填:66.3。
[实验反思]
当观察到反应管中固体全部变黑后,若立即停止通CO,装置A增重不变,测得的样品中氧化铁的质量分数无影响,故填:无影响;
(3)①通过分析可知,铁和硫酸反应生成了硫酸亚铁和氢气,氧化铁和硫酸反应生成了硫酸铁和水,铁与硫酸铁反应生成硫酸亚铁.故填:Fe+H2SO4═FeSO4+H2↑;
②加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁,所以滤液M中肯定含有的溶质的化学式是:FeSO4、H2SO4;操作2后得到了滤液和固体,所以可以判断操作1为过滤,故填:FeSO4、H2SO4;过滤;
③根据图表中的信息可以知道当温度大于60℃时产生了FeSO4 4H2O,所以应该将温度控制在60℃以下;故填:60;
(4)5.56g硫酸亚铁晶体(FeSO4 xH2O)隔绝空气受热分解时,生成金属氧化物和气体,固体产物的质量随温度变化的曲线如图所示;
①0﹣t1℃,发生的变化是加热失去结晶水;
x=7;
故填:7;
②硫酸亚铁分解生成金属氧化物和气体,t2℃时B点固体组成只有一种,故是氧化铁,故填:Fe2O3。
一、选择题(共12题)
1.下列有关实验现象的描述,错误的是。
A.细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
B.硫在空气中燃烧发出淡蓝色火焰,生成二氧化硫气体
C.红磷在空气中燃烧,产生大量白烟
D.一氧化碳高温还原氧化铁时,红棕色粉末逐渐变成黑色
2.下列物质不属于合金的是
A.黄铜 B.硬铝 C.金刚石 D.生铁
3.科学家将微小的固态氢置于488万个大气压下,使固体中所有的氢气分子破裂为氢原子,制得具有金属性质的新物质——金属氢。下列说法错误的是
A.该过程发生了物理变化
B.金属氢是一种高能燃料
C.金属氢有良好的导电性
D.金属氢由氢原子直接构成
4.下列矿石的主要成分为Fe3O4的是( )
A.赤铁矿 B.磁铁矿 C.菱铁矿 D.褐铁矿
5.下列说法正确的是( )
A.所有金属都呈银白色 B.常温下金属都是固体
C.多数合金的熔点高于组成它的成分金属的熔点 D.工业炼铁的主要原理是用一氧化碳与铁矿石在高温下反应生成铁
6.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
7.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
8.用如图装置完成以下实验:
(1)探究燃烧条件:若 B 处盛放木炭。
Ⅰ.先在 A 处通入氮气一段时间后,在 B 处加热B、C 处没有明显变化;
Ⅱ.待 B 处冷却至室温,在 A 处通入氧气一段时间后,B、C 处没有明显变化;
Ⅲ.在 A 处继续通入氧气,然后在 B 处加热,发现木炭燃烧,C 处变浑浊。
(2)模拟工业炼铁:若 B 处盛放氧化铁粉末。在 A 处通入一氧化碳一段时间后,B 处下方用酒精喷灯加热。下列说法中正确的个数有()
①Ⅰ和Ⅲ对比,说明燃烧需要可燃物与氧气接触
②Ⅰ和Ⅲ对比,说明氧气的化学性质比氮气活泼
③Ⅱ和Ⅲ对比,说明燃烧需要温度达到可燃物的着火点
④实验(2)中缺乏尾气处理装置
⑤实验(2)中玻璃管内物质的质量在反应前后的减少量等于 C 中反应前后物质的质量的增加量
A.5 个 B.4 个 C.3 个 D.2 个
9.下列对应实验中,现象和结论都正确且两者具有因果关系的是
选项 实验操作 现象 结论
A 高温下,将一氧化碳通过氧化铁粉末 黑色粉末变为红色 一氧化碳具有还原性
B 电解水实验 正、负极产生的气体质量之比为1:2 1个水分子中含有1个氧原子和2个氢原子
c 在装有等量水的试管中分别加入等量NaOH和NH4NO3固体 前者水温升高,后者水温降低 不同物质在溶于水的过程中产生吸热或放热现象
D 用乙醇(CH3CH2OH)进行导电性试验,观察小灯泡是否变亮 小灯泡变亮 乙醇中存在自由移动的离子
A.A B.B C.C D.D
10.下列有关物质性质与用途的说法均正确的是
A.一氧化碳具有还原性,可用于铁的冶炼
B.金属铝不能与氧气反应,常用于制作炊具
C.碳酸钠能与酸反应,常用于治疗胃酸过多
D.活性炭具有吸附性,常用于自来水杀菌消毒
11.现有640t含 Fe2O380%赤铁矿石,炼制过程中Fe2O3利用率为90%理论上可炼出含杂质4%的生铁的质量为
A.336t B.224t C.206 t D.112t
12.铁是一种应用广泛的金属。下列有关铁的叙述正确的是( )
A.铁是地壳中含量最多的金属
B.工业上用二氧化碳冶炼钢铁
C.用铁可以回收硝酸银废液中的银
D.铁丝在氧气中燃烧生成氧化铁
二、综合题(共6题)
13.请写出下列反应的化学方程式:
(1)一氧化碳还原氧化铁:__________;
(2)木炭还原氧化铜:__________;
(3)甲烷充分燃烧:______。
14.某学生改进一氧化碳还原氧化铁的实验装置,如图所示:
(1)若先给氧化铁加热,再通入一氧化碳,可能产生的后果及原因是______。
(2)写出中发生反应的化学方程式:______。
(3)装置中产生的现象可判断反应是否开始发生,则中的试剂是______,反应的化学方程式为______。
(4)装置的作用是______。
(5)装置收集气体的方法叫作______(因为一氧化碳______于水)。
15.距今两千多年前,我国劳动人民就已经掌握了炼铁的技术,他们将炭不完全燃烧,产生一氧化碳,在高温条件下利用一氧化碳将铁矿石中的三氧化二铁还原为铁并同时生成了二氧化碳。请写出上述两个反应的化学方程式。
(1)_________________________________________ 此反应类型:______
(2) _________________________________________
16.在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组用以下装置进行研究:
(査阅资料)Ⅰ.碎瓷片能防爆沸,碱石灰能作干燥剂。
Ⅱ.氢气的化学性质与一氧化碳相似。
Ⅲ.铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
(推断)(1)观察到D中黑色固体变红,则B中生成的气体是__________。
(2)探究B装置中剩余固体成分是什么?
(初步探究)B装置中剩余固体为黑色,能全部被磁铁吸引
(猜想与假设)猜想一:剩余固体是Fe和Fe3O4猜想二:剩余固体是___________。
(实验探究)
实验操作 实验现象 结论
取样,加入________(填试剂) _____ 猜想一正确
(实验结论)铁与水蒸气反应的化学方程式为__________,该反应为__________(填基本反应类型)。
(含量测定)取B装置中剩余黑色固体2.90g,与足量的CO反应后所得固体质量为2.26g,则原剩余黑色固体中Fe3O4的质量分数为__________。
17.化学实验是科学探究的重要手段。
(1)第一小组用如图装置进行实验:
①选用如图A装置制取气体的依据是___________________;
②用A装置制取气体时,长颈漏斗下端浸没在液面以下的原因是什么________?
③若用B装置收集氧气,请将B装置中导管补画完整。若氧气已收集满,可观察到什么实验现象________?
(2)第二小组利用下图装置可做还原的实验,并检验该反应生成的气体产物。已知由A装置制取的气体中混有少量的。
①装置D中发生反应的化学方程式为______________________________________;
②气体通过装置的顺序是A→___________________________(装置不能重复使用);
③从环保角度考虑,对以上装置的改进措施是___________________
(3)第三小组将29.4g氯酸钾和二氧化锰的固体混合物装入试管中,加热制取氧气。待反应完全后,将试管冷却,称量,可以得到19.8g固体物质。请计算原固体混合物中二氧化锰的质量分数______。(精确到0.1%)
18.铁及其化合物在工农业生产和生活中有广泛应用.
(1)图1为高炉炼铁示意图.从炉底流出的生铁属________(填“金属单质”或“合金”).
下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有_________(填字母).
A.①② B.①③ C.②③ D.②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
(查阅资料)碱石灰能吸收二氧化碳和水蒸气
(问题讨论)装置B的作用是_______________________,从环保角度看该实验装置有一明显缺陷是:_________________.
(数据处理)称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.则 样品中氧化铁质量分数为___________%.
(实验反思)当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数_________(填“偏大”,“偏小”,“无影响”)
(3)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:
①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+Fe2(SO4)3=3FeSO4外,还有_______________________;
②滤液M的溶质有____________________,操作1为___________________;
③FeSO4的溶解度和析出组成如下表.在操作2中,析出FeSO4 7H2O晶体的最高温度不超过___________℃.
温度t/℃ 0 10 30 40 50 60 64 70 80 90
溶解度S/g 15.6 20.5 33.0 40.4 48.8 55.0 55.3 50.6 43.7 37.2
析出晶体 FeSO4 7H2O FeSO4 4H2O FeSO4 H2O
(4)5.56g硫酸亚铁晶体(FeSO4 xH2O)隔绝空气受热分解时,生成金属氧化物和气体.固体产物的质量随温度变化的曲线如图3所示.
①0~t1℃,发生的变化是加热失去结晶水,x=__________;
②t2℃时B点固体组成只有一种,化学式为_____________.
参考答案
1.B
【详解】
A、细铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体,故选项说法正确。
B、硫在空气中燃烧发出淡蓝色火焰,生成二氧化硫气体是实验结论而不是实验现象,故选项说法错误。
C、红磷在空气中燃烧,产生大量白烟,故选项说法正确。
D、一氧化碳高温还原氧化铁时,生成铁和二氧化碳,会观察到红棕色粉末逐渐变成黑色,故选项说法正确。
故选:B。
2.C
【详解】
A、反应前Fe2O3中的Fe元素显+3价,反应后Fe元素显0价,反应前后Fe元素化合价降低,不符合题意;
B、由质量守恒定律可知,反应前后原子的种类没有改变,数目没有增减,X的化学式是CO,化学反应方程式为:,不符合题意;
C、赤铁矿经粉碎处理后,冶炼得更快、更充分,这是因为赤铁矿粉与一氧化碳有更大的接触面,符合题意;
D、该反应属于氧化还原反应,不符合题意。
故选C。
3.B
【详解】
该氧化物中铁的质量分数:×100%=75%;
Fe2O3中铁的质量分数:×100%=70%;
FeO中铁的质量分数:×100%≈77.8%
Fe3O4中铁的质量分数:×100%≈72.4%;
根据以上计算结果,FeO、Fe2O3、Fe3O4组成的混合物质量分数可以是75%。
故选B。
4.B
【详解】
A.赤铁矿的主要成分是氧化铁﹣﹣Fe2O3,选项错误;
B.磁铁矿的主要成分是四氧化三铁﹣﹣Fe3O4,选项正确;
C.菱铁矿的主要成分是碳酸亚铁﹣﹣FeCO3,选项错误;
D.褐铁矿的主要成分是Fe2O3 3H2O,选项错误,故选B。
5.D
【详解】
A、不是所有金属都呈银白色,如铜呈紫红色,不符合题意;
B、常温下金属不一定都是固体,如汞是液体,不符合题意;
C、多数合金的熔点低于组成它的成分金属的熔点,不符合题意;
D、工业炼铁的主要原理是利用一氧化碳具有还原性,用一氧化碳与铁矿石在高温下反应生成铁,符合题意。故选D。
6.A
【解析】
【详解】
A、一氧化碳具有可燃性,混有一定量的空气,遇明火容易发生爆炸,故应先滴加HCOOH,产生一氧化碳,将装置内的空气排尽,然后点燃乙处酒精灯,符合题意;
B、一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,二氧化碳与澄清石灰水反应,由于消耗了二氧化碳,装置内压强减小,澄清石灰水容易倒吸,炸裂试管,故装置丙的作用是防止倒吸,不符合题意;
C、二氧化碳能使澄清石灰水变浑浊,故装置丁可以检验CO2,同时一氧化碳与澄清石灰水不反应,可用排水法收集CO,不符合题意;
D、,该反应有水生成,随着反应的进行,浓硫酸浓度降低,产生CO气体速率减小,不符合题意。
故选A。
7.C
【解析】
【详解】
A、得氧的过程是氧化反应,失氧的过程是还原反应,B处玻璃管内发生的化学反应是氧化铁和一氧化碳反应生成铁和二氧化碳,是氧化还原反应,还原剂是CO,选项正确;
B、CO与空气的混合气体,点燃或加热时可能发生爆炸。在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气,防止加热事发生爆炸,选项正确;
C、氧化铁是红色固体,铁粉是黑色固体,该实验可以观察到B处固体从红色逐渐变成黑色,选项错误;
D、一氧化碳是大气污染物,该模拟实验缺少尾气处理装置,会污染空气,选项正确。
故选C。
8.B
【解析】
【详解】
①Ⅰ和Ⅲ对比,通入的气体不同,温度相同,由Ⅲ中木炭能燃烧Ⅰ中木炭不燃烧说明燃烧需要可燃物与氧气接触,故正确;
②Ⅰ和Ⅲ对比,氧气能与木炭反应氮气不能与木炭反应,说明O2的化学性质比氮气活泼,故正确;
③Ⅱ和Ⅲ对比,说明燃烧需要温度达到可燃物的着火点,故正确;
④实验(2)中的尾气中含有一氧化碳,能污染空气,该装置缺乏尾气处理装置,故正确;
⑤实验(2)中玻璃管内物质的质量在反应前后的减少量是氧元素的质量,C中反应前后物质的质量的增加量是二氧化碳的质量,二者不可能相等,故错误;
由以上分析可知,B正确。
故选B。
9.C
【详解】
A、高温下,将一氧化碳通过氧化铁粉末,一氧化碳与氧化铁在高温下反应生成铁和二氧化碳,红棕色粉末变为黑色,说明一氧化碳具有还原性,故选项说法错误;
B、电解水实验中正、负极产生的气体体积之比为1:2,错误;
C、在装有等量水的试管中分别加入等量NaOH和NH4NO3固体,现象为前者水温升高,后者水温降低,说明不同物质在溶于水的过程中产生吸热或放热现象,正确;
D、酒精中不含有自由移动的离子,错误;
故选C。
10.A
【解析】
试题分析:CO具有夺取金属氧化物中的氧元素生成CO2的性质,即还原性,因此可用于冶炼金属,如炼铁,A正确;金属铝在常温下即可与氧气发生反应,而铝用作炊具是利用了铝的延展性和导热性,B错误;用于治疗胃酸过多的盐是碳酸氢钠(小苏打),而不是碳酸钠(纯碱、苏打),C错误;利用活性炭的吸附性,可除去水中的色素和异味,但不能起到杀菌消毒作用,D错误。故选A
11.A
【详解】
解:设理论上可炼出含杂质4%的生铁的质量为x
x=336t。
故选A。
12.C
【详解】
A. 铝是地壳中含量最多的金属,选项A不正确;
B. 工业上用一氧化碳冶炼钢铁,选项B不正确;
C. 铁比银活泼,因此用铁可以回收硝酸银废液中的银,选项C正确;
D. 铁丝在氧气中燃烧生成黑色的四氧化三铁,选项D不正确。
故选C。
13.(1)Fe2O3+3CO2Fe+3CO2
(2)C+2CuO2Cu+CO2↑
(3)CH4+2O2CO2+2H2
【解析】
(1)
一氧化碳在高温下和氧化铁反应生成铁和二氧化碳,化学方程式为: ;
(2)
碳和氧化铜在高温下生成铜和二氧化碳,化学方程式为:;
(3)
甲烷和氧气点燃生成水和二氧化碳,化学方程式为:。
14.(1)发生爆炸,其原因是可燃性气体(一氧化碳)和助燃性气体(氧气)混合加热可能发生爆炸
(2)3CO + Fe2O3 2Fe + 3CO2
(3) 澄清石灰水 CO2 + Ca(OH)2 = CaCO3↓+ H2O
(4)收集尾气
(5) 排水法 难溶
【解析】
略
15. 化合反应
【解析】
【详解】
(1)炭不完全燃烧,产生一氧化碳,化学方程式为:,该反应是由两种或两种以上的物质反应生成一种新物质的反应,特点是 “多变一”, 是化学反应的常见的四大基本反应类型之一,属于化合反应。
(2)一氧化碳在高温下还原氧化铁,生成铁和二氧化碳,化学方程式为:。
16.氢气 四氧化三铁 稀盐酸 有气泡生成 置换反应 设:四氧化三铁的质量为
答:原剩余黑色固体中Fe3O4的质量分数为80%
【详解】
(1)观察到D中黑色固体变红,则B中生成的气体具有还原性,再根据反应物为“铁与水蒸气”,该气体是氢气;
[猜想与假设]能被磁铁吸引的只有铁和四氧化三铁,则猜想其一是四氧化三铁;又不能只有铁没有其他反应物,猜想其二是四氧化三铁;
[实验探究]
根据铁与稀盐酸反应生成气体,进行设计实验:取少量黑色固体与试管中,加入足量的稀盐酸,若固体全部溶解,没有气泡生成,则猜想二正确;若固体全部溶解,有气泡冒出,则猜想易正确,故填:稀盐酸;有气泡生成;
[实验结论]
铁与水蒸气在高温的条件下反应生成四氧化三铁和氢气,该反应是由单质和化合物反应生成另一种单质和化合物,属于置换反应,该反应的化学方程式为:
;
[实验测定]见答案。
17.反应物是固体和液体,反应条件不加热(或固液不加热)。 防止气体从长颈漏斗中逸出。 带火星的木条复燃。 在A装置后增加一个尾气处理装置或将尾气点燃或进行收集等 16.7%。
【详解】
(1)①由图可知,该装置是固液混合常温型发生装置。故选用该装置制取气体的依据是:反应物是固体和液体,反应条件不加热(或固液不加热);
②用A装置制取气体时,长颈漏斗下端浸没在液面以下的原因是:防止气体从长颈漏斗中逸出;
③由于氧气的密度比空气大,用多功能瓶收集氧气时,氧气应“长进短出”,故B装置应为:;由于氧气有助燃性,可使带火星的木条复燃。故若氧气已收集满,可观察到:带火星的木条复燃;
(2)①装置D中一氧化碳与四氧化三铁在高温的条件下反应,生成铁和二氧化碳,反应的化学方程式为:Fe3O4+4CO 高温3Fe+4CO2;
②要检验生成二氧化碳,需要先将一氧化碳中混有的二氧化碳除去,可以先通过氢氧化钠溶液,检验二氧化碳使用的是澄清的石灰水,故气体通过装置的顺序是A→C→D→B;
③从环保角度考虑,需要对一氧化碳进行尾气处理,故对以上装置的改进措施是:在A装置后增加一个尾气处理装置(或将尾气点燃或进行收集等);
(3)反应生成氧气的质量为:29.4g-19.8g=9.6g
设混合物中氯酸钾的质量为x。
x=24.5g
原固体混合物中二氧化锰的质量分数=×100%≈16.7%
答:原固体混合物中二氧化锰的质量分数为16.7%。
18.合金 D 吸收空气中的水和二氧化碳 未进行尾气处理 66.3 无影响 Fe+H2SO4═FeSO4+H2↑ FeSO4、H2SO4 过滤 60 7 Fe2O3
【详解】
(1)从炉底流出的生铁是铁和碳的混合物,属于铁的合金;在高炉炼铁中碳能燃烧产生热量、能生成一氧化碳作为还原氧化铁的物质,故填:合金,D;
(2)[问题讨论]
装置B中盛有的是碱石灰,碱石灰能吸收空气中的水和二氧化碳,防止对实验结果造成干扰,一氧化碳是有毒的气体,而该装置中没有进行尾气处理,故填:吸收空气中的水和二氧化碳;未进行尾气处理;
[数据处理]
称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.说明生成二氧化碳的质量为4.4g,设氧化铁的质量为x
x≈5.3g
则样品中氧化铁质量分数为,故填:66.3。
[实验反思]
当观察到反应管中固体全部变黑后,若立即停止通CO,装置A增重不变,测得的样品中氧化铁的质量分数无影响,故填:无影响;
(3)①通过分析可知,铁和硫酸反应生成了硫酸亚铁和氢气,氧化铁和硫酸反应生成了硫酸铁和水,铁与硫酸铁反应生成硫酸亚铁.故填:Fe+H2SO4═FeSO4+H2↑;
②加入的硫酸是过量的,所以在溶液中含有硫酸和反应生成的硫酸亚铁,所以滤液M中肯定含有的溶质的化学式是:FeSO4、H2SO4;操作2后得到了滤液和固体,所以可以判断操作1为过滤,故填:FeSO4、H2SO4;过滤;
③根据图表中的信息可以知道当温度大于60℃时产生了FeSO4 4H2O,所以应该将温度控制在60℃以下;故填:60;
(4)5.56g硫酸亚铁晶体(FeSO4 xH2O)隔绝空气受热分解时,生成金属氧化物和气体,固体产物的质量随温度变化的曲线如图所示;
①0﹣t1℃,发生的变化是加热失去结晶水;
x=7;
故填:7;
②硫酸亚铁分解生成金属氧化物和气体,t2℃时B点固体组成只有一种,故是氧化铁,故填:Fe2O3。
