5.1.3不同价态含硫物质的转化课件2021-2022学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.3不同价态含硫物质的转化课件2021-2022学年下学期高一化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 996.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-16 19:16:08 | ||
图片预览




文档简介
(共18张PPT)
人教版必修第二册
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第三课时 不同价态含硫物质的转化
网
科
学
核心素养和发展目标
1.了解含硫物质在自然界中的存在与转化,熟悉自然界中常见的含硫物质的类别及硫元素的化合价。
2.根据硫元素化合价会分析含硫物质的性质,并能设计实验实现不同价态硫元素的相互转化。
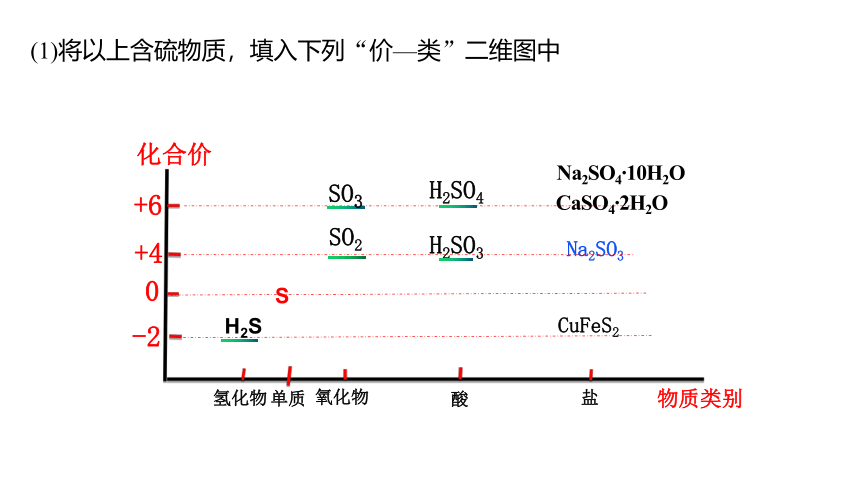
自然界中有丰富的含硫元素物质,如下图
资料卡片应用
物质类别
氢化物
氧化物
酸
盐
Na2SO4 10H2O
CuFeS2
Na2SO3
S
化合价
0
+4
+6
-2
单质
CaSO4 2H2O
(1)将以上含硫物质,填入下列“价—类”二维图中
—
—
—
SO2
H2SO4
SO3
H2SO3
—
—
H2S
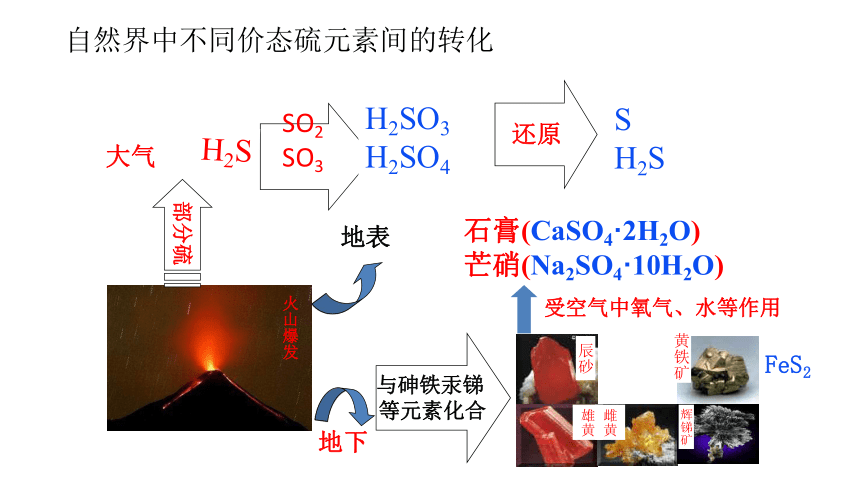
自然界中不同价态硫元素间的转化
SO2
SO3
H2SO3
H2SO4
还原
S
H2S
火山爆发
大气
地表
地下
与砷铁汞锑
等元素化合
含硫
矿物
雄黄
雌黄
辉锑矿
黄铁矿
辰砂
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
受空气中氧气、水等作用
H2S
部分硫
FeS2
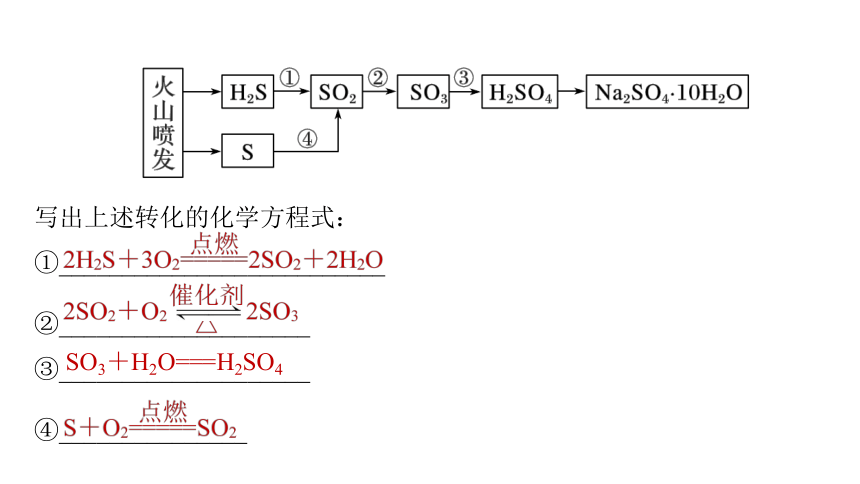
写出上述转化的化学方程式:
①__________________________
②____________________
③____________________
④_______________
SO3+H2O===H2SO4
硫元素最高价(+6)只有______,最低价(-2)只具有_______ ;中间价(0、+4)既具有_______,又具有________。
氧化性
还原性
还原性
氧化性
实现不同价态硫元素间的相互转化依据是什么?
-2
o
+4
+6
S S S S
O2 、 Cl2(氯水)、 H2O2、 HNO3、KMnO4、 溴水等
氧化剂:
化合价升高,选用
化合价降低,选用
_氧化剂
_还原剂_
_还原剂:_
思维建模
设计实验实现不同价态含硫物质的转化
序号 转化 目标 转化前的 含硫物质 选择试剂 转化后的
含硫物质
① -2→0 H2S ________ S
___ ② 0→-2 S __ H2S
_______ _________
O2(不足)
SO2
H2
Fe或Cu
FeS或Cu2S
2H2S+O2 2S+2H2O
点燃
====
SO2+2H2S===3S+2H2O
H2+ S H2S
Fe+S FeS或2Cu+S Cu2S
△
====
△
====
△
====
序号 转化 目标 转化前的 含硫物质 选择试剂 转化后的
含硫物质
③ -2→+4 H2S ________ SO2
④ 0→+4 S __ SO2
⑤ +4→0 SO2 ___ S
⑥ +4→+6 SO2 __ SO3
___ H2SO4
⑦ +6→+4 H2SO4 ___ SO2
O2(足量)
O2
H2S
O2
Cl2
Cu
④____________
⑤___________________
⑥___________________
___________________________
⑦ Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
S+O2 SO2
SO2+2H2S====3S+2H2O
2SO2+ O2 2SO3
Cl2+ SO2+2H2O === H2SO4+2HCl
点燃
====
△
催化剂
△
====
2H2S+3O2 2SO2+2H2O
点燃
====
③
-2 0 +4 +6 +6
【整理与归纳】
S
Na2SO4
H2SO4
SO3
Na2SO3
H2SO3
SO2
HgS
BaSO4
通过氧化还原反应
通过氧化还原反应
通过非氧化还原反应
硫单质及其化合物之间的转化规律
(1)邻位价态原则
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,如
(2)相邻价态的粒子不发生氧化还原反应:如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(3)归中规律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2H2S+SO2===3S+2H2O,2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
判断正误
(1)将SO2通入氢硫酸中,若出现黄色浑浊,则证明SO2具有氧化性( )
(2)硫化氢气体与浓硫酸反应的双线桥法表示电子转移为
(3)H2S与O2反应,氧气不足生成单质S,氧气过量可以生成SO2( )
(4)SO2+2H2S===3S+2H2O反应中氧化剂与还原剂的物质的量之比为2∶1( )
√
√
×
√
( )
1.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是( )
A.硫化钠溶液 B.盐酸 C.氯化钙溶液 D.溴水
D
随堂检测
2.在通常情况下,A为固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:
A._____;B._____;
C._____;D._____;
E._______。
S
H2S
SO2
SO3
H2SO4
(2)写出下列反应的化学方程式:
①E→C:________________________________________;
②C转化为D:_____________________;
③B转化为C:_____________________________。
3.Na2SO3中+4价的硫既有氧化性又有还原性。从以下试剂中选择合适试剂验证上述性质。新制氯水、Na2S溶液、Na2SO3溶液、稀H2SO4、NaOH溶液。
性质 还原性 氧化性
试剂
现象
反应的离子方程式
新制氯水、Na2SO3溶液
Na2S溶液、稀H2SO4、Na2SO3溶液
氯水褪色
有淡黄色沉淀生成
3S↓+3H2O
课堂小结
人教版必修第二册
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第三课时 不同价态含硫物质的转化
网
科
学
核心素养和发展目标
1.了解含硫物质在自然界中的存在与转化,熟悉自然界中常见的含硫物质的类别及硫元素的化合价。
2.根据硫元素化合价会分析含硫物质的性质,并能设计实验实现不同价态硫元素的相互转化。
自然界中有丰富的含硫元素物质,如下图
资料卡片应用
物质类别
氢化物
氧化物
酸
盐
Na2SO4 10H2O
CuFeS2
Na2SO3
S
化合价
0
+4
+6
-2
单质
CaSO4 2H2O
(1)将以上含硫物质,填入下列“价—类”二维图中
—
—
—
SO2
H2SO4
SO3
H2SO3
—
—
H2S
自然界中不同价态硫元素间的转化
SO2
SO3
H2SO3
H2SO4
还原
S
H2S
火山爆发
大气
地表
地下
与砷铁汞锑
等元素化合
含硫
矿物
雄黄
雌黄
辉锑矿
黄铁矿
辰砂
石膏(CaSO4·2H2O)
芒硝(Na2SO4·10H2O)
受空气中氧气、水等作用
H2S
部分硫
FeS2
写出上述转化的化学方程式:
①__________________________
②____________________
③____________________
④_______________
SO3+H2O===H2SO4
硫元素最高价(+6)只有______,最低价(-2)只具有_______ ;中间价(0、+4)既具有_______,又具有________。
氧化性
还原性
还原性
氧化性
实现不同价态硫元素间的相互转化依据是什么?
-2
o
+4
+6
S S S S
O2 、 Cl2(氯水)、 H2O2、 HNO3、KMnO4、 溴水等
氧化剂:
化合价升高,选用
化合价降低,选用
_氧化剂
_还原剂_
_还原剂:_
思维建模
设计实验实现不同价态含硫物质的转化
序号 转化 目标 转化前的 含硫物质 选择试剂 转化后的
含硫物质
① -2→0 H2S ________ S
___ ② 0→-2 S __ H2S
_______ _________
O2(不足)
SO2
H2
Fe或Cu
FeS或Cu2S
2H2S+O2 2S+2H2O
点燃
====
SO2+2H2S===3S+2H2O
H2+ S H2S
Fe+S FeS或2Cu+S Cu2S
△
====
△
====
△
====
序号 转化 目标 转化前的 含硫物质 选择试剂 转化后的
含硫物质
③ -2→+4 H2S ________ SO2
④ 0→+4 S __ SO2
⑤ +4→0 SO2 ___ S
⑥ +4→+6 SO2 __ SO3
___ H2SO4
⑦ +6→+4 H2SO4 ___ SO2
O2(足量)
O2
H2S
O2
Cl2
Cu
④____________
⑤___________________
⑥___________________
___________________________
⑦ Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑
S+O2 SO2
SO2+2H2S====3S+2H2O
2SO2+ O2 2SO3
Cl2+ SO2+2H2O === H2SO4+2HCl
点燃
====
△
催化剂
△
====
2H2S+3O2 2SO2+2H2O
点燃
====
③
-2 0 +4 +6 +6
【整理与归纳】
S
Na2SO4
H2SO4
SO3
Na2SO3
H2SO3
SO2
HgS
BaSO4
通过氧化还原反应
通过氧化还原反应
通过非氧化还原反应
硫单质及其化合物之间的转化规律
(1)邻位价态原则
当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,如
(2)相邻价态的粒子不发生氧化还原反应:如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。
(3)归中规律
当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2H2S+SO2===3S+2H2O,2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
判断正误
(1)将SO2通入氢硫酸中,若出现黄色浑浊,则证明SO2具有氧化性( )
(2)硫化氢气体与浓硫酸反应的双线桥法表示电子转移为
(3)H2S与O2反应,氧气不足生成单质S,氧气过量可以生成SO2( )
(4)SO2+2H2S===3S+2H2O反应中氧化剂与还原剂的物质的量之比为2∶1( )
√
√
×
√
( )
1.Na2SO3中+4价的硫元素,既有氧化性,又有还原性。要证明Na2SO3具有还原性,需选用的试剂是( )
A.硫化钠溶液 B.盐酸 C.氯化钙溶液 D.溴水
D
随堂检测
2.在通常情况下,A为固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:
A._____;B._____;
C._____;D._____;
E._______。
S
H2S
SO2
SO3
H2SO4
(2)写出下列反应的化学方程式:
①E→C:________________________________________;
②C转化为D:_____________________;
③B转化为C:_____________________________。
3.Na2SO3中+4价的硫既有氧化性又有还原性。从以下试剂中选择合适试剂验证上述性质。新制氯水、Na2S溶液、Na2SO3溶液、稀H2SO4、NaOH溶液。
性质 还原性 氧化性
试剂
现象
反应的离子方程式
新制氯水、Na2SO3溶液
Na2S溶液、稀H2SO4、Na2SO3溶液
氯水褪色
有淡黄色沉淀生成
3S↓+3H2O
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
