第二章第一节 共价键课件2021-2022学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章第一节 共价键课件2021-2022学年下学期高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 539.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-16 00:00:00 | ||
图片预览








文档简介
(共34张PPT)
第二章 分子结构与性质
第一节 共价键
学习目标
课程目标 素养目标
1.认识共价键的本质。 2.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。 3.知道原子轨道的重叠方式,共价键可分为σ键和π键等类型。 4.知道共价键可分为极性共价键和非极性共价键。 5.共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。 1.宏观辨识与微观探析:通过键参数对分子性质、结构的解释和预测,培养宏观辨识与微观探析素养。
2.证据推理与模型认知:通过共价键的形成过程和模式的探究学习,强化模型认知素养;借助共价键参数与分子结构和性质的关系探究学习,培养证据推理素养。
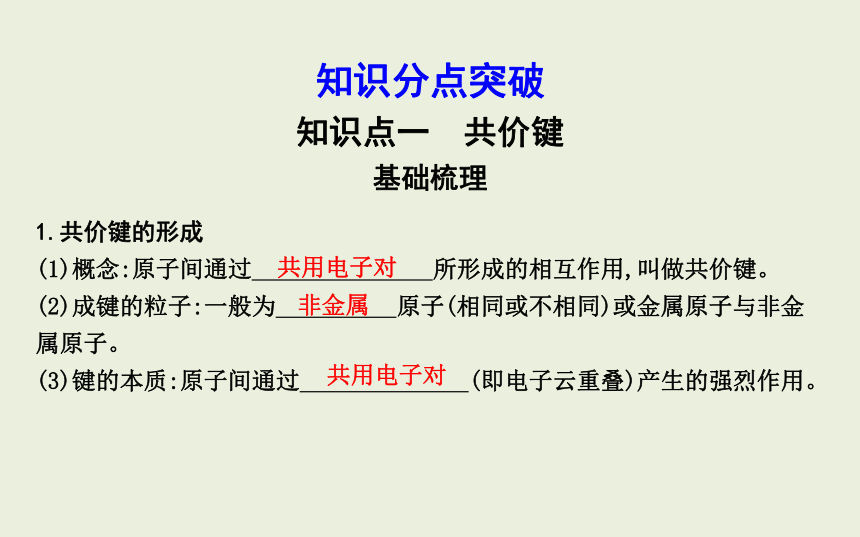
知识分点突破
知识点一 共价键
基础梳理
1.共价键的形成
(1)概念:原子间通过 所形成的相互作用,叫做共价键。
(2)成键的粒子:一般为 原子(相同或不相同)或金属原子与非金属原子。
(3)键的本质:原子间通过 (即电子云重叠)产生的强烈作用。
共用电子对
非金属
共用电子对
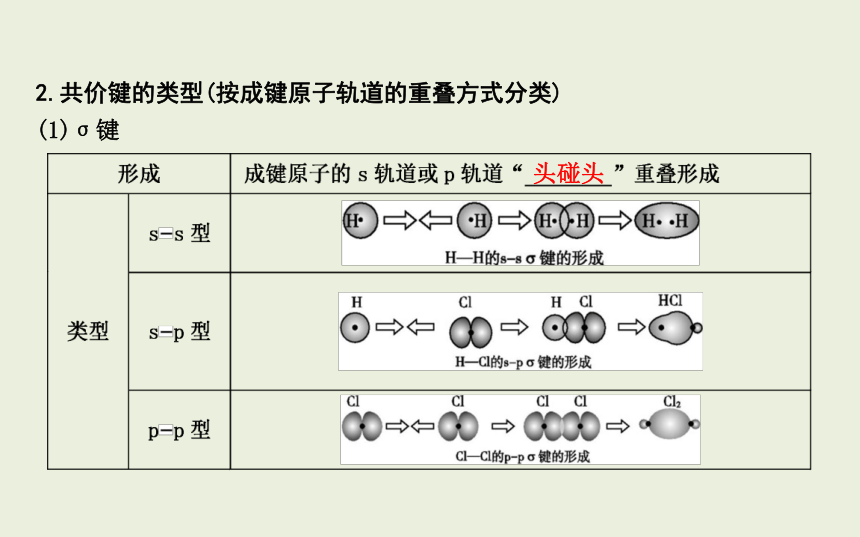
2.共价键的类型(按成键原子轨道的重叠方式分类)
(1)σ键
头碰头
特征 ①以形成化学键的两原子核的 为轴做旋转操作,共价键的电子云的图形 ,这种特征称为 ;
②σ键的强度 .
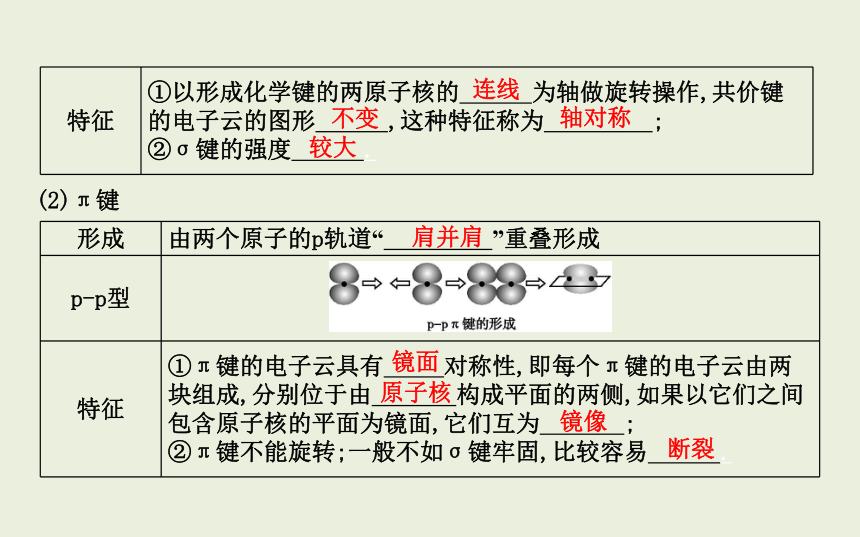
(2)π键
形成 由两个原子的p轨道“ ”重叠形成
p-p型
特征 ①π键的电子云具有 对称性,即每个π键的电子云由两块组成,分别位于由 构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为 ;
②π键不能旋转;一般不如σ键牢固,比较容易 .
连线
不变
轴对称
较大
肩并肩
镜面
原子核
镜像
断裂
3.共价键的特征
(1)饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。饱和性决定了分子的 。
(2)方向性
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的越多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性。方向性决定了分子的空间结构。
微点拨:共价键的方向性决定了分子的空间结构,并不是所有共价键都具有方向性,如两个s电子形成共价键时就没有方向性。
组成
互动探究
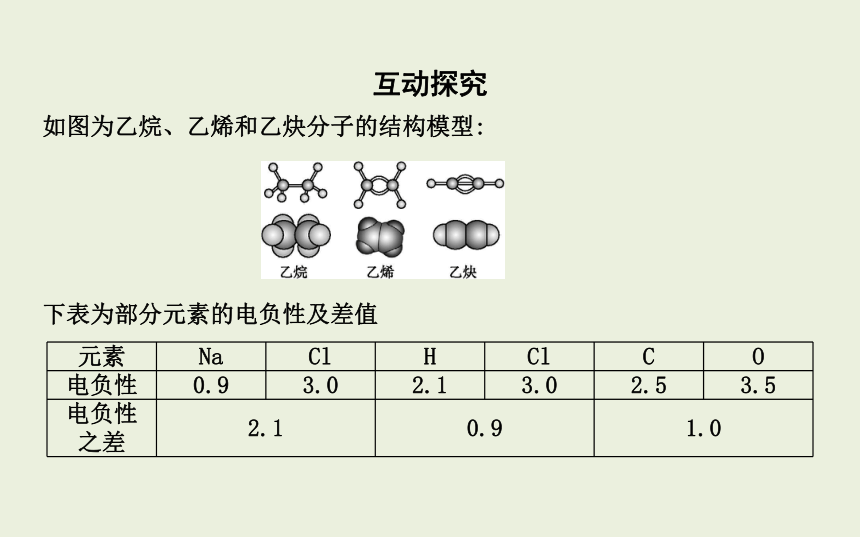
如图为乙烷、乙烯和乙炔分子的结构模型:
下表为部分元素的电负性及差值
元素 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性 之差 2.1 0.9 1.0 任务1 σ键和π键判断与比较
问题1:结合上述图中乙烷、乙烯和乙炔分子结构模型判断其分子中分别有几个σ键和几个π键
问题2:如何判断分子中存在的σ键和π键的数目
提示:单键只有σ键,双键由1个σ键和1个π键组成,三键由1个σ键和2个π键组成。如氮气(N≡N)含有1个σ键和2个π键。
问题3:σ键、π键原子轨道重叠方式和稳定性有何区别 结合乙烷、乙烯、乙炔的结构与性质做一下说明。
提示:σ键是原子轨道沿键轴方向“头碰头”重叠,π键是原子轨道沿键轴方向“肩并肩”重叠;σ键稳定,π键不稳定,化学性质活泼。乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个、2个π键,π键原子轨道重叠程度小,不稳定,容易断裂,而乙烷中碳与碳之间以σ键结合,原子轨道重叠程度大,σ键稳定,不易断裂。
任务2 共价键形成的条件
问题4:结合已有知识判断NaCl、HCl、CO(CO2)中化学键类别。
提示:NaCl是由活泼金属和活泼非金属元素形成的化合物,存在离子键;HCl、CO(CO2)均由非金属元素组成,分子中存在的都是共价键。
问题5:由上述表格提供的数据信息,如何从元素电负性差值角度判断化学键类型
提示:一般当两种元素电负性差值大于1.7时,两者形成离子键,小于1.7时,形成共价键。
归纳拓展
1.σ键与π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式 “头碰头”重叠 “肩并肩”重叠
对称类型 轴对称 镜面对称
原子轨道 重叠程度 大 小
键的强度 较大 较小
化学活泼性 不活泼 活泼
成键规律 共价单键是σ键;共价双键中一个σ键、一个π键;共价三键中一个σ键、两个π键
2.共价键与离子键的判断规律
(1)定性判断:一般活泼金属与活泼非金属元素之间形成离子键,非金属元素之间形成共价键。
(2)定量判断:可以根据成键元素的电负性相对大小判断,两者差值小于1.7可以形成共用电子对,形成共价键,两者差值大于1.7,电负性小的电子完全失去给电负性大的,形成离子键。
[凝练素养] 通过σ键与π键的形成过程及特点比较,强化证据推理与模型认知素养;通过乙烷、乙烯、乙炔性质与结构的探究学习,发展宏观辨识与微观探析素养。
题点一 共价键的实质与特征
1.下列不属于共价键成键因素的是( )
A.共用电子对在两原子核之间高概率出现
B.共用的电子必须配对
C.成键后体系能量降低,趋于稳定
D.两原子核体积大小要适中
题组例练
D
解析:共价键的成因和本质是当成键原子相互靠近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系的能量降低。
2.共价键具有饱和性和方向性,下列关于共价键这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的饱和性与原子轨道的重叠程度有关
D
解析:原子的未成对电子配对成键后,一般就不再与其他原子的未成对电子配对成键了,故原子的未成对电子数决定了该原子形成的共价键具有饱和性,这一饱和性也就决定了该原子成键时最多连接的原子数,故A、C正确;形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,故B正确。
题点二 σ键和π键的判断与比较
D
4.关于σ键和π键的比较,下列说法不正确的是( )
A.σ键是轴对称的,π键是镜面对称的
B.σ键是“头碰头”式重叠,π键是“肩并肩”式重叠
C.σ键不能断裂,π键容易断裂
D.氢原子只能形成σ键,氧原子可以形成σ键和π键
解析:σ键较稳定,不易断裂,而不是不能断裂。
C
5.已知碳的氧化物可以制备尿素、乙烯脲等,其中乙烯脲可用于制备树脂、增塑剂、喷漆、胶黏剂等。
解析:单键为σ键,双键中含1个σ键、1个π键。1个乙烯脲分子中含12个σ键、1个π键,故σ键与π键数目之比为12∶1;1个尿素分子中含7个σ键、1个π键,故σ键与π键的数目之比为7∶1。
(1)乙烯脲中含σ键与π键数目之比为 。
(2)尿素分子中σ键与π键的数目之比为 。
答案:(1)12∶1 (2)7∶1
思维建模
分子中σ键和π键的判断方法
(1)根据成键原子的价层电子数来判断能形成几个共用电子对。如果只形成一个共用电子对,则该共价键一定是σ键;如果形成多个共用电子对,则先形成1个σ键,其余的原子轨道形成π键。
(2)一般规律:共价单键是σ键;共价双键中有一个σ键和一个π键;共价三键中有一个σ键和两个π键。
知识点二 键参数——键能、键长与键角
基础梳理
1.键能
(1)键能是指 中1 mol化学键解离成 所吸收的能量。键能的单位是 。键能通常是298.15 K、101 kPa条件下的标准值。例如,H—H的键能为436.0 kJ· mol-1。
气态分子
气态原子
kJ· mol-1
(2)下表中是H—X的键能数据
共价键 H—F H—Cl H—Br H—I
键能/(kJ· mol-1) 568 431.8 366 298.7
①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是 的能量。
②表中共价键最难断裂的是 ,最易断裂的是 。
③由表中键能数据大小说明键能与分子稳定性的关系:HF、HCl、HBr、HI的键能依次 ,说明四种分子的稳定性依次 ,即HF分子最稳定,最 分解,HI分子最不稳定,最 分解。
微点拨:键能数值可通过实验测定,更多的却是推算获得;注意ABn型分子中断开每个A—B的键能不同,一般给出的都是其平均值。
吸收863.6 kJ
H—F
H—I
减小
减弱
难
2.键长
(1)键长是构成化学键的两个原子的 ,因此 决定化学键的键长, 越小,共价键的键长越短。
易
核间距
原子半径
原子半径
(2)键长与共价键的稳定性之间的关系:共价键的键长越短,往往键能越 ,表明共价键越稳定。
如下列三种分子中:①H2、②Cl2、③Br2,共价键的键长最长的是 ,键能最大的是 。
3.键角
(1)键角是指在多原子分子中, 之间的夹角。在多原子分子中的键角是一定的,这表明共价键具有 。键角是描述分子 的重要参数。
大
③
①
两个相邻共价键
方向性
空间结构
(2)常见分子键角与空间结构
105°
实例 键角 分子空间结构
NH3 107° 三角锥形
H2O , V形(或角形)
CO2 . 直线形
180°
互动探究
键能与键长是衡量共价键稳定性的参数,知道键能大小就能比较分子的稳定性,判断生成该物质的难易,计算反应过程中的能量变化等。已知部分共价键的键能和键长:
任务 键参数对物质性质的影响
问题1:结合上述数据计算分别生成2 mol HCl和2 mol HBr,哪一个放出能量多,并判断HCl和HBr哪一种物质更稳定。
提示:根据反应热等于反应物断键吸收能量与生成物成键放出能量作差,可知是生成2 mol HCl放出的能量多;反应过程放出能量越多,生成物越稳定,所以HCl更稳定。
问题2:实验证明N2、O2、F2与H2的反应能力依次增强,如何从化学键的键能角度解释
提示:由已知信息可知:N2、O2、F2的键能依次减小,反应过程中断键越来越容易,而N—H、O—H、H—F的键能依次增大,生成物越来越稳定,越容易生成,所以N2、O2、F2与H2的反应能力依次增强。
问题3:键能和键长对分子稳定性有何影响
提示:键长越短、键能越大,共价化合物越稳定。
归纳拓展
共价键参数的应用
1.键能的应用
(1)表示共价键的强弱
键能越大,断开化学键时需要的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)判断化学反应的能量变化
在化学反应中,旧化学键的断裂吸收能量,新化学键的形成释放能量,因此反应焓变与键能的关系为ΔH=反应物键能总和-生成物键能总和。ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
2.键长的应用
(1)一般键长越短,键能越大,共价键越稳定,分子越稳定。
(2)键长的比较方法
①根据原子半径比较:同类型的共价键,成键原子的原子半径越小,键长 越短。
②根据共用电子对数比较:相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
3.键角的应用
(1)键长和键角决定分子的空间结构。
(2)常见分子的键角与分子空间结构
化学式 键角 分子空间结构
CO2 180° 直线形
NH3 107° 三角锥形
H2O 105° V形
BF3 120° 平面三角形
CH4 109°28′ 正四面体形
[凝练素养] 通过共价键参数对分子结构和性质的解释和预测的探究学习,强化宏观辨识与微观探析素养。
题组例练
C
1.下列关于键长、键角和键能的说法中,不正确的是( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越长,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
解析:键长越短、键能越大,共价化合物越稳定,C不正确。
C
2.下列说法正确的是( )
A.在分子中,两个成键原子的原子间的距离叫做键长
B.键长:N—H>P—H
C.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可以说明HCl分子比HI分子稳定
D.键能越大,含有该键的物质越容易分解
解析:两个成键原子的原子核间的距离叫做该化学键的键长,A错误;成键原子的半径越大,键长越长,原子半径P>N,键长P—H>N—H,B错误;键能越大,含有该键的物质越稳定,越不易分解,C正确,D错误。
A
3.能说明BF3分子中四个原子在同一平面的理由是( )
A.任意两个键的夹角为120°
B.B—F是极性共价键
C.三个B—F的键能相同
D.三个B—F的键长相等
解析:当键角为120°时,BF3的空间结构为平面三角形,故分子中四个原子共面。
B
4.下列事实不能用键能的大小来解释的是( )
A.氮元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.HF比H2O稳定
解析:由于N2分子中存在氮氮三键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I,原子半径逐渐增大,其氢化物中化学键的键长逐渐变长,键能逐渐变小,所以稳定性HF>HCl>HBr>HI;由于H—F的键能大于H—O,所以稳定性HF>H2O。
[知识网络]
能力总结提升
[易错警示]
1.误认为只有非金属元素间才可能形成共价键,其实如氯化铝中存在共价键。
2.误认为所有共价键均具有方向性,其实s轨道与s轨道形成的σ键没有方 向性。
3.误认为π键键能一定小于σ键的键能,其实如N≡N(946 kJ·mol-1),
N—N(193 kJ·mol-1)。
5.误认为键能越大,物质本身具有的能量就越多,其实键能和物质本身具有的能量没有关系,物质本身含有的能量是物质的一种固有属性,没法测量,只能测量物质变化过程中的能量变化即反应热。
6.误认为对于同类型的分子,成键原子半径越小,共价键键能就越大,其实一般情况下,成键原子半径越小,共价键键能就越大,但也存在特例,如: r(F)7.误认为所有分子中的C—H键能都一样,其实即便是断裂同一个碳上的
C—H所需能量也不相等,教材中给出的碳氢键键能是平均值。
第二章 分子结构与性质
第一节 共价键
学习目标
课程目标 素养目标
1.认识共价键的本质。 2.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。 3.知道原子轨道的重叠方式,共价键可分为σ键和π键等类型。 4.知道共价键可分为极性共价键和非极性共价键。 5.共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。 1.宏观辨识与微观探析:通过键参数对分子性质、结构的解释和预测,培养宏观辨识与微观探析素养。
2.证据推理与模型认知:通过共价键的形成过程和模式的探究学习,强化模型认知素养;借助共价键参数与分子结构和性质的关系探究学习,培养证据推理素养。
知识分点突破
知识点一 共价键
基础梳理
1.共价键的形成
(1)概念:原子间通过 所形成的相互作用,叫做共价键。
(2)成键的粒子:一般为 原子(相同或不相同)或金属原子与非金属原子。
(3)键的本质:原子间通过 (即电子云重叠)产生的强烈作用。
共用电子对
非金属
共用电子对
2.共价键的类型(按成键原子轨道的重叠方式分类)
(1)σ键
头碰头
特征 ①以形成化学键的两原子核的 为轴做旋转操作,共价键的电子云的图形 ,这种特征称为 ;
②σ键的强度 .
(2)π键
形成 由两个原子的p轨道“ ”重叠形成
p-p型
特征 ①π键的电子云具有 对称性,即每个π键的电子云由两块组成,分别位于由 构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为 ;
②π键不能旋转;一般不如σ键牢固,比较容易 .
连线
不变
轴对称
较大
肩并肩
镜面
原子核
镜像
断裂
3.共价键的特征
(1)饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。饱和性决定了分子的 。
(2)方向性
除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。在形成共价键时,原子轨道重叠的越多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性。方向性决定了分子的空间结构。
微点拨:共价键的方向性决定了分子的空间结构,并不是所有共价键都具有方向性,如两个s电子形成共价键时就没有方向性。
组成
互动探究
如图为乙烷、乙烯和乙炔分子的结构模型:
下表为部分元素的电负性及差值
元素 Na Cl H Cl C O
电负性 0.9 3.0 2.1 3.0 2.5 3.5
电负性 之差 2.1 0.9 1.0 任务1 σ键和π键判断与比较
问题1:结合上述图中乙烷、乙烯和乙炔分子结构模型判断其分子中分别有几个σ键和几个π键
问题2:如何判断分子中存在的σ键和π键的数目
提示:单键只有σ键,双键由1个σ键和1个π键组成,三键由1个σ键和2个π键组成。如氮气(N≡N)含有1个σ键和2个π键。
问题3:σ键、π键原子轨道重叠方式和稳定性有何区别 结合乙烷、乙烯、乙炔的结构与性质做一下说明。
提示:σ键是原子轨道沿键轴方向“头碰头”重叠,π键是原子轨道沿键轴方向“肩并肩”重叠;σ键稳定,π键不稳定,化学性质活泼。乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个、2个π键,π键原子轨道重叠程度小,不稳定,容易断裂,而乙烷中碳与碳之间以σ键结合,原子轨道重叠程度大,σ键稳定,不易断裂。
任务2 共价键形成的条件
问题4:结合已有知识判断NaCl、HCl、CO(CO2)中化学键类别。
提示:NaCl是由活泼金属和活泼非金属元素形成的化合物,存在离子键;HCl、CO(CO2)均由非金属元素组成,分子中存在的都是共价键。
问题5:由上述表格提供的数据信息,如何从元素电负性差值角度判断化学键类型
提示:一般当两种元素电负性差值大于1.7时,两者形成离子键,小于1.7时,形成共价键。
归纳拓展
1.σ键与π键的比较
共价键类型 σ键 π键
原子轨道 重叠方式 “头碰头”重叠 “肩并肩”重叠
对称类型 轴对称 镜面对称
原子轨道 重叠程度 大 小
键的强度 较大 较小
化学活泼性 不活泼 活泼
成键规律 共价单键是σ键;共价双键中一个σ键、一个π键;共价三键中一个σ键、两个π键
2.共价键与离子键的判断规律
(1)定性判断:一般活泼金属与活泼非金属元素之间形成离子键,非金属元素之间形成共价键。
(2)定量判断:可以根据成键元素的电负性相对大小判断,两者差值小于1.7可以形成共用电子对,形成共价键,两者差值大于1.7,电负性小的电子完全失去给电负性大的,形成离子键。
[凝练素养] 通过σ键与π键的形成过程及特点比较,强化证据推理与模型认知素养;通过乙烷、乙烯、乙炔性质与结构的探究学习,发展宏观辨识与微观探析素养。
题点一 共价键的实质与特征
1.下列不属于共价键成键因素的是( )
A.共用电子对在两原子核之间高概率出现
B.共用的电子必须配对
C.成键后体系能量降低,趋于稳定
D.两原子核体积大小要适中
题组例练
D
解析:共价键的成因和本质是当成键原子相互靠近时,原子轨道发生重叠,自旋方向相反的未成对电子形成共用电子对,两原子核间的电子云密度增加,体系的能量降低。
2.共价键具有饱和性和方向性,下列关于共价键这两个特征的叙述中,不正确的是( )
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.共价键的方向性是由成键原子的轨道的方向性决定的
C.共价键的饱和性决定了分子内部的原子的数量关系
D.共价键的饱和性与原子轨道的重叠程度有关
D
解析:原子的未成对电子配对成键后,一般就不再与其他原子的未成对电子配对成键了,故原子的未成对电子数决定了该原子形成的共价键具有饱和性,这一饱和性也就决定了该原子成键时最多连接的原子数,故A、C正确;形成共价键时,原子轨道重叠的程度越大越好,为了达到原子轨道的最大重叠程度,成键的方向与原子轨道的伸展方向就存在着必然的联系,故B正确。
题点二 σ键和π键的判断与比较
D
4.关于σ键和π键的比较,下列说法不正确的是( )
A.σ键是轴对称的,π键是镜面对称的
B.σ键是“头碰头”式重叠,π键是“肩并肩”式重叠
C.σ键不能断裂,π键容易断裂
D.氢原子只能形成σ键,氧原子可以形成σ键和π键
解析:σ键较稳定,不易断裂,而不是不能断裂。
C
5.已知碳的氧化物可以制备尿素、乙烯脲等,其中乙烯脲可用于制备树脂、增塑剂、喷漆、胶黏剂等。
解析:单键为σ键,双键中含1个σ键、1个π键。1个乙烯脲分子中含12个σ键、1个π键,故σ键与π键数目之比为12∶1;1个尿素分子中含7个σ键、1个π键,故σ键与π键的数目之比为7∶1。
(1)乙烯脲中含σ键与π键数目之比为 。
(2)尿素分子中σ键与π键的数目之比为 。
答案:(1)12∶1 (2)7∶1
思维建模
分子中σ键和π键的判断方法
(1)根据成键原子的价层电子数来判断能形成几个共用电子对。如果只形成一个共用电子对,则该共价键一定是σ键;如果形成多个共用电子对,则先形成1个σ键,其余的原子轨道形成π键。
(2)一般规律:共价单键是σ键;共价双键中有一个σ键和一个π键;共价三键中有一个σ键和两个π键。
知识点二 键参数——键能、键长与键角
基础梳理
1.键能
(1)键能是指 中1 mol化学键解离成 所吸收的能量。键能的单位是 。键能通常是298.15 K、101 kPa条件下的标准值。例如,H—H的键能为436.0 kJ· mol-1。
气态分子
气态原子
kJ· mol-1
(2)下表中是H—X的键能数据
共价键 H—F H—Cl H—Br H—I
键能/(kJ· mol-1) 568 431.8 366 298.7
①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是 的能量。
②表中共价键最难断裂的是 ,最易断裂的是 。
③由表中键能数据大小说明键能与分子稳定性的关系:HF、HCl、HBr、HI的键能依次 ,说明四种分子的稳定性依次 ,即HF分子最稳定,最 分解,HI分子最不稳定,最 分解。
微点拨:键能数值可通过实验测定,更多的却是推算获得;注意ABn型分子中断开每个A—B的键能不同,一般给出的都是其平均值。
吸收863.6 kJ
H—F
H—I
减小
减弱
难
2.键长
(1)键长是构成化学键的两个原子的 ,因此 决定化学键的键长, 越小,共价键的键长越短。
易
核间距
原子半径
原子半径
(2)键长与共价键的稳定性之间的关系:共价键的键长越短,往往键能越 ,表明共价键越稳定。
如下列三种分子中:①H2、②Cl2、③Br2,共价键的键长最长的是 ,键能最大的是 。
3.键角
(1)键角是指在多原子分子中, 之间的夹角。在多原子分子中的键角是一定的,这表明共价键具有 。键角是描述分子 的重要参数。
大
③
①
两个相邻共价键
方向性
空间结构
(2)常见分子键角与空间结构
105°
实例 键角 分子空间结构
NH3 107° 三角锥形
H2O , V形(或角形)
CO2 . 直线形
180°
互动探究
键能与键长是衡量共价键稳定性的参数,知道键能大小就能比较分子的稳定性,判断生成该物质的难易,计算反应过程中的能量变化等。已知部分共价键的键能和键长:
任务 键参数对物质性质的影响
问题1:结合上述数据计算分别生成2 mol HCl和2 mol HBr,哪一个放出能量多,并判断HCl和HBr哪一种物质更稳定。
提示:根据反应热等于反应物断键吸收能量与生成物成键放出能量作差,可知是生成2 mol HCl放出的能量多;反应过程放出能量越多,生成物越稳定,所以HCl更稳定。
问题2:实验证明N2、O2、F2与H2的反应能力依次增强,如何从化学键的键能角度解释
提示:由已知信息可知:N2、O2、F2的键能依次减小,反应过程中断键越来越容易,而N—H、O—H、H—F的键能依次增大,生成物越来越稳定,越容易生成,所以N2、O2、F2与H2的反应能力依次增强。
问题3:键能和键长对分子稳定性有何影响
提示:键长越短、键能越大,共价化合物越稳定。
归纳拓展
共价键参数的应用
1.键能的应用
(1)表示共价键的强弱
键能越大,断开化学键时需要的能量越多,化学键越稳定。
(2)判断分子的稳定性
结构相似的分子中,共价键的键能越大,分子越稳定。
(3)判断化学反应的能量变化
在化学反应中,旧化学键的断裂吸收能量,新化学键的形成释放能量,因此反应焓变与键能的关系为ΔH=反应物键能总和-生成物键能总和。ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
2.键长的应用
(1)一般键长越短,键能越大,共价键越稳定,分子越稳定。
(2)键长的比较方法
①根据原子半径比较:同类型的共价键,成键原子的原子半径越小,键长 越短。
②根据共用电子对数比较:相同的两个原子间形成共价键时,单键键长>双键键长>三键键长。
3.键角的应用
(1)键长和键角决定分子的空间结构。
(2)常见分子的键角与分子空间结构
化学式 键角 分子空间结构
CO2 180° 直线形
NH3 107° 三角锥形
H2O 105° V形
BF3 120° 平面三角形
CH4 109°28′ 正四面体形
[凝练素养] 通过共价键参数对分子结构和性质的解释和预测的探究学习,强化宏观辨识与微观探析素养。
题组例练
C
1.下列关于键长、键角和键能的说法中,不正确的是( )
A.键角是描述分子空间结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越长,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
解析:键长越短、键能越大,共价化合物越稳定,C不正确。
C
2.下列说法正确的是( )
A.在分子中,两个成键原子的原子间的距离叫做键长
B.键长:N—H>P—H
C.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可以说明HCl分子比HI分子稳定
D.键能越大,含有该键的物质越容易分解
解析:两个成键原子的原子核间的距离叫做该化学键的键长,A错误;成键原子的半径越大,键长越长,原子半径P>N,键长P—H>N—H,B错误;键能越大,含有该键的物质越稳定,越不易分解,C正确,D错误。
A
3.能说明BF3分子中四个原子在同一平面的理由是( )
A.任意两个键的夹角为120°
B.B—F是极性共价键
C.三个B—F的键能相同
D.三个B—F的键长相等
解析:当键角为120°时,BF3的空间结构为平面三角形,故分子中四个原子共面。
B
4.下列事实不能用键能的大小来解释的是( )
A.氮元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.HF比H2O稳定
解析:由于N2分子中存在氮氮三键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I,原子半径逐渐增大,其氢化物中化学键的键长逐渐变长,键能逐渐变小,所以稳定性HF>HCl>HBr>HI;由于H—F的键能大于H—O,所以稳定性HF>H2O。
[知识网络]
能力总结提升
[易错警示]
1.误认为只有非金属元素间才可能形成共价键,其实如氯化铝中存在共价键。
2.误认为所有共价键均具有方向性,其实s轨道与s轨道形成的σ键没有方 向性。
3.误认为π键键能一定小于σ键的键能,其实如N≡N(946 kJ·mol-1),
N—N(193 kJ·mol-1)。
5.误认为键能越大,物质本身具有的能量就越多,其实键能和物质本身具有的能量没有关系,物质本身含有的能量是物质的一种固有属性,没法测量,只能测量物质变化过程中的能量变化即反应热。
6.误认为对于同类型的分子,成键原子半径越小,共价键键能就越大,其实一般情况下,成键原子半径越小,共价键键能就越大,但也存在特例,如: r(F)
C—H所需能量也不相等,教材中给出的碳氢键键能是平均值。
