鲁教版九年级化学上册 2.4 元素与元素符号 课件(30张PPT)
文档属性
| 名称 | 鲁教版九年级化学上册 2.4 元素与元素符号 课件(30张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 11:10:33 | ||
图片预览











文档简介
(共30张PPT)
第四节 元 素
第1课时 元素与元素符号
活动天地2-4
结论:
原子可以通过结合成分子构成物质;也可以通过得失电子形成离子构成物质;原子还可以直接构成物质
——即原子是构成物质的最基本粒子。
1、电解水的实验说明水是由什么组成的?什么是元素?
2、什么是相对原子质量?其中一种碳原子是指哪一种碳原子?有没有别的碳原子呢?
思考
碳原子B:质子数6,中子数7
碳原子A:质子数6,中子数6
碳原子C:质子数6,中子数8
碳元素
碳原子
具有相同质子数的一类碳原子总称为碳元素。
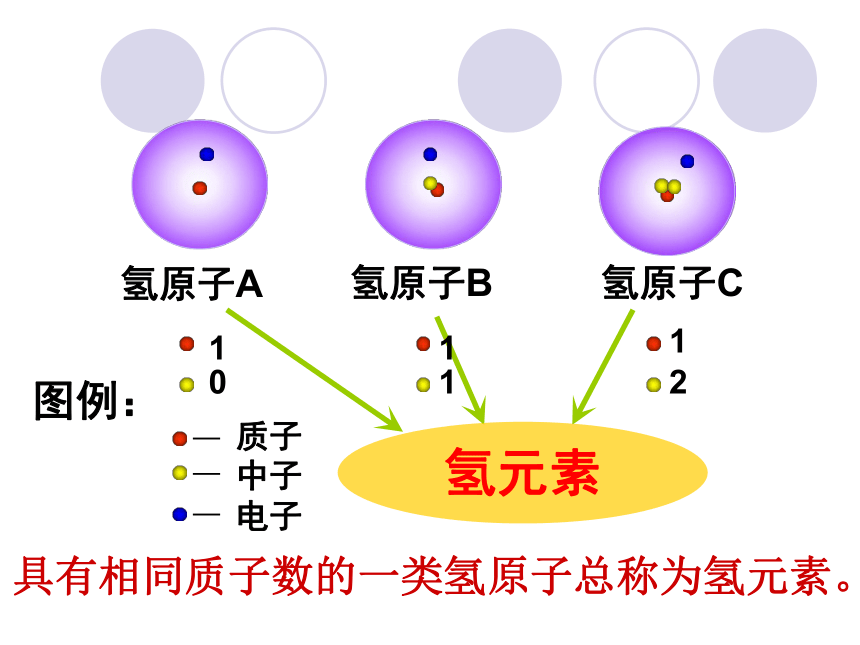
氢原子A
图例:
质子
电子
中子
1
1
1
氢原子C
氢原子B
2
1
0
氢元素
具有相同质子数的一类氢原子总称为氢元素。
元素就是具有相同
(即核内质子数)的一类原子的总称。
=
核内质子数
的一类原子的总称。
元素
核电荷数
元素只讲种类,不讲个数
同种元素包括质子数相同中子数不同的原子,也包括质子数相同而电子数不同原子和离子
伴你学习
元素的化学性质由最外层电子数决定,同种元素的离子因带电荷数不同,化学性质也不同
元素的分类:
1.稀有气体:气字头
2.金属元素:“钅”字旁
固态非金属元素(“石”字旁)
液态非金属元素(“氵”字旁)
气态非金属元素(“气”字头除稀有气体)
3.非金属元素
元素之间的根本区别是 ( )
A.中子数不同 B.质子数不同
C.电子数不同 D.相对原子质量不同
B
伴你学习
下列说法有没有错误?把错误的说法加以改正。
1、二氧化碳中有碳和氧两个元素。
2、一个水分子是由一个氧元素和两个氢元素构成。
一个水分子是由一个氧原子和两个氢原子构成。
二氧化碳中有碳和氧两种元素。
×
×
伴你学习
元素
下列元素单独或相互组合能组成多少种你所知道的物质?
碳 氢 氧
根据组成物质的元素种类将纯净物分类
单质:
由一种元素组成 的纯净物
如 O2 C He Fe
化合物:
由两种或两种以上元素组成 的纯净物
如 H2O CO2 NaCl CaCO3
物质
纯净物
混合物
单质
化合物
自然界中有一百多种元素,
而存在的物质有两千多万种。
元素和物质的关系就像英语中字母和单词的关系。
元素的种类及含量
地壳中元素含量
元素的分布:
氧
硅
铝
铁
人体细胞中元素含量
3、生物细胞中含量最多的元素
氧元素
1、地壳中含量最多的元素是
2、地壳中含量最多的金属元素
氧元素
铝元素
你还能说出更多的化学之最吗?
说说看
名称 拉丁文名称 符号
氢 Hydrogenium H
氧 Oxygenium O
碳 Carbonium C
铜 Cuprum Cu
铁 Ferrum Fe
元素符号
如何正确书写元素符号?
N O H
Fe Cu
一 大 二 小
元素符号
下列元素符号书写正确吗?
锰mn 镁mg 钙cA
Mn
Mg
Ca
元素符号表示什么意义?
氧元素
一个氧原子
思考:如何表示两个氧原子呢?
如果在元素符号前面加上一个数字,则只能表示几个这样的原子。
O
2
氢元素
一个氢原子
H
N
氮元素
一个氮原子
铁元素
一个铁原子
Fe
铁单质
练一练
用符号和数字表达含义及写出元素符号表示的意义。
1、5个氧原子
2、氮元素
3、2个钙原子
4、Cl
5O
N
2Ca
表示氯元素
表示一个氯原子
由原子直接构成的物质
1.稀有气体:氦He、氖Ne
2.金属 ,如:铜Cu、 铝Al
3.某些非金属,如:碳C、 硫S、磷P、硅Si
请说出下列符号的意义:
Cl
2S
52C
氯元素;1个氯原子
2个硫原子
52个碳原子
比较元素与原子的异同
联系 1.具有相同的核电荷数(即质子数)的一类原子的总称为某元素。
2.原子与元素一一对应,化学符号相同。
如:氢原子符号H、氢元素符号H。
区别 1.原子是微观粒子(具体);元素是宏观概念(抽象)。
2.原子既分种类,又论个数;元素只分种类,不论个数。
如:氢原子、氧原子——种类; 8个氢原子——个数;
氢元素、氧元素。
第四节 元 素
第1课时 元素与元素符号
活动天地2-4
结论:
原子可以通过结合成分子构成物质;也可以通过得失电子形成离子构成物质;原子还可以直接构成物质
——即原子是构成物质的最基本粒子。
1、电解水的实验说明水是由什么组成的?什么是元素?
2、什么是相对原子质量?其中一种碳原子是指哪一种碳原子?有没有别的碳原子呢?
思考
碳原子B:质子数6,中子数7
碳原子A:质子数6,中子数6
碳原子C:质子数6,中子数8
碳元素
碳原子
具有相同质子数的一类碳原子总称为碳元素。
氢原子A
图例:
质子
电子
中子
1
1
1
氢原子C
氢原子B
2
1
0
氢元素
具有相同质子数的一类氢原子总称为氢元素。
元素就是具有相同
(即核内质子数)的一类原子的总称。
=
核内质子数
的一类原子的总称。
元素
核电荷数
元素只讲种类,不讲个数
同种元素包括质子数相同中子数不同的原子,也包括质子数相同而电子数不同原子和离子
伴你学习
元素的化学性质由最外层电子数决定,同种元素的离子因带电荷数不同,化学性质也不同
元素的分类:
1.稀有气体:气字头
2.金属元素:“钅”字旁
固态非金属元素(“石”字旁)
液态非金属元素(“氵”字旁)
气态非金属元素(“气”字头除稀有气体)
3.非金属元素
元素之间的根本区别是 ( )
A.中子数不同 B.质子数不同
C.电子数不同 D.相对原子质量不同
B
伴你学习
下列说法有没有错误?把错误的说法加以改正。
1、二氧化碳中有碳和氧两个元素。
2、一个水分子是由一个氧元素和两个氢元素构成。
一个水分子是由一个氧原子和两个氢原子构成。
二氧化碳中有碳和氧两种元素。
×
×
伴你学习
元素
下列元素单独或相互组合能组成多少种你所知道的物质?
碳 氢 氧
根据组成物质的元素种类将纯净物分类
单质:
由一种元素组成 的纯净物
如 O2 C He Fe
化合物:
由两种或两种以上元素组成 的纯净物
如 H2O CO2 NaCl CaCO3
物质
纯净物
混合物
单质
化合物
自然界中有一百多种元素,
而存在的物质有两千多万种。
元素和物质的关系就像英语中字母和单词的关系。
元素的种类及含量
地壳中元素含量
元素的分布:
氧
硅
铝
铁
人体细胞中元素含量
3、生物细胞中含量最多的元素
氧元素
1、地壳中含量最多的元素是
2、地壳中含量最多的金属元素
氧元素
铝元素
你还能说出更多的化学之最吗?
说说看
名称 拉丁文名称 符号
氢 Hydrogenium H
氧 Oxygenium O
碳 Carbonium C
铜 Cuprum Cu
铁 Ferrum Fe
元素符号
如何正确书写元素符号?
N O H
Fe Cu
一 大 二 小
元素符号
下列元素符号书写正确吗?
锰mn 镁mg 钙cA
Mn
Mg
Ca
元素符号表示什么意义?
氧元素
一个氧原子
思考:如何表示两个氧原子呢?
如果在元素符号前面加上一个数字,则只能表示几个这样的原子。
O
2
氢元素
一个氢原子
H
N
氮元素
一个氮原子
铁元素
一个铁原子
Fe
铁单质
练一练
用符号和数字表达含义及写出元素符号表示的意义。
1、5个氧原子
2、氮元素
3、2个钙原子
4、Cl
5O
N
2Ca
表示氯元素
表示一个氯原子
由原子直接构成的物质
1.稀有气体:氦He、氖Ne
2.金属 ,如:铜Cu、 铝Al
3.某些非金属,如:碳C、 硫S、磷P、硅Si
请说出下列符号的意义:
Cl
2S
52C
氯元素;1个氯原子
2个硫原子
52个碳原子
比较元素与原子的异同
联系 1.具有相同的核电荷数(即质子数)的一类原子的总称为某元素。
2.原子与元素一一对应,化学符号相同。
如:氢原子符号H、氢元素符号H。
区别 1.原子是微观粒子(具体);元素是宏观概念(抽象)。
2.原子既分种类,又论个数;元素只分种类,不论个数。
如:氢原子、氧原子——种类; 8个氢原子——个数;
氢元素、氧元素。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
