7.1酸液溶液和碱性溶液随堂练习—2021_2022学年九年级化学仁爱版下册(word版含解析)
文档属性
| 名称 | 7.1酸液溶液和碱性溶液随堂练习—2021_2022学年九年级化学仁爱版下册(word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 229.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 00:00:00 | ||
图片预览




文档简介
7.1酸液溶液和碱性溶液
一、选择题(共16题)
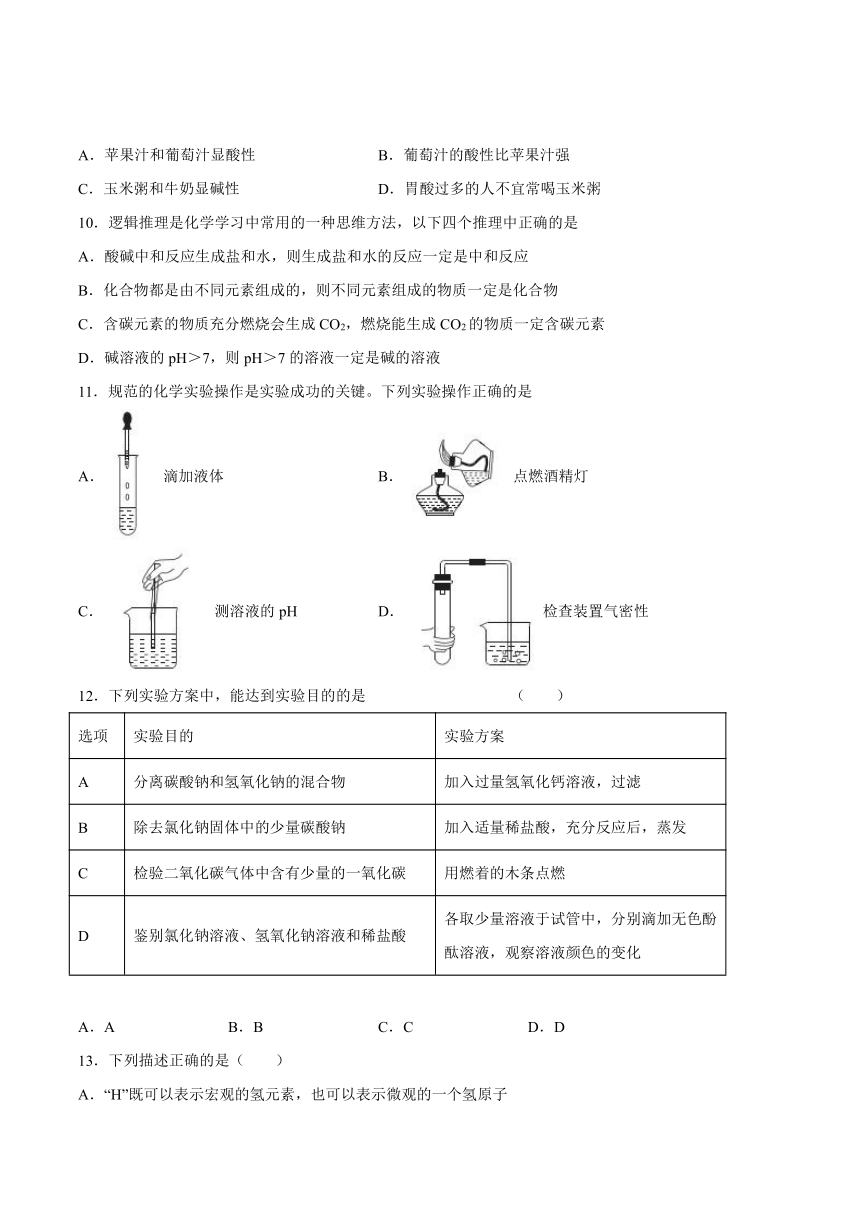
1.下列实验操作正确的是( )
A.熄灭酒精灯 B.液体读数
C.称量NaOH固体 D.测定溶液的pH
2.一些物质的pH范围如下,其中酸性最强的是
A.柠檬汁(2-3) B.酱油(4-5) C.西瓜汁(5-6) D.洗发水(8-9)
3.下列说法正确的是
A.为了提高水的利用率,农业上可将喷灌或滴灌改为大水漫灌
B.人体血浆的pH约为0.9~1.5
C.蚊虫叮咬后应涂一些含有酸性物质的溶液,可以减轻痛痒
D.石墨具有导电性,可以用做干电池的电极
4.测定pH最简单的方法是使用
A.石蕊溶液 B.澄清石灰水
C.酚酞溶液 D.pH试纸
5.向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是
A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中溶质都含有NaCl
6.某同学用pH试纸测定日常生活中的一些液体的pH.他的实验记录一定错误的是( )
A.肥皂水pH=10 B.纯碱溶液pH=11 C.橘子汁pH=4 D.食醋pH=7
7.小红观察在不同酸碱度下紫甘蓝(见右图)汁液所显示的颜色,记录如下。
pH 1 2~3 4~6 7~9 10 11 12~14
颜色 深红 紫红 浅紫 蓝 绿 黄绿 黄
下列物质中,能使紫甘蓝汁液变黄的是
A.水 B.食盐溶液 C.硫酸溶液 D.氢氧化钠溶液
8.下列有关化学知识的描述正确的是
A.催化剂不仅能改变化学反应速率,而且会增加生成物的质量
B.物质和氧气发生的反应是氧化反应,所以氧化反应一定有氧气参加
C.二氧化碳通入紫色石蕊试液,溶液变红色,说明二氧化碳具有酸性
D.含有不同种元素的纯净物一定是化合物
9.依据所给食物的近似 pH判断,下列说法正确的是:
食物 葡萄汁 苹果汁 牛奶 玉米粥
pH 3.5~4.5 2.9~3.3 6.3~6.6 6.8~8.0
A.苹果汁和葡萄汁显酸性 B.葡萄汁的酸性比苹果汁强
C.玉米粥和牛奶显碱性 D.胃酸过多的人不宜常喝玉米粥
10.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是
A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.化合物都是由不同元素组成的,则不同元素组成的物质一定是化合物
C.含碳元素的物质充分燃烧会生成CO2,燃烧能生成CO2的物质一定含碳元素
D.碱溶液的pH>7,则pH>7的溶液一定是碱的溶液
11.规范的化学实验操作是实验成功的关键。下列实验操作正确的是
A.滴加液体 B.点燃酒精灯
C.测溶液的pH D.检查装置气密性
12.下列实验方案中,能达到实验目的的是 ( )
选项 实验目的 实验方案
A 分离碳酸钠和氢氧化钠的混合物 加入过量氢氧化钙溶液,过滤
B 除去氯化钠固体中的少量碳酸钠 加入适量稀盐酸,充分反应后,蒸发
C 检验二氧化碳气体中含有少量的一氧化碳 用燃着的木条点燃
D 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸 各取少量溶液于试管中,分别滴加无色酚酞溶液,观察溶液颜色的变化
A.A B.B C.C D.D
13.下列描述正确的是( )
A.“H”既可以表示宏观的氢元素,也可以表示微观的一个氢原子
B.烧碱、熟石灰、纯碱按物质分类均属于碱
C.金刚石、均为碳单质,所以物理性质、化学性质完全相同
D.泡沫灭火器灭火的原理是提高了可燃物质的着火点
14.某同学对下列四个实验都设计了两种方案,两种方案均合理的是
选项 A B C D
实验目的 除去NaOH中的 Ca(OH)2 鉴别盐酸、氢氧化钙 氯化钠三种溶液 检验CO中是否有少量CO2 分离铜粉和 碳粉
方案1 滴加适量HC1 滴加紫色石蕊溶液 通入澄清石灰水 滴加稀硫酸
方案2 滴加适最Na2CO3 溶液 滴加无色酚酞溶液 通入紫色石蕊溶液 氧气中加热
A.A B.B C.C D.D
15.有一种“白纸血印”的街头骗术,原本是一张雪白的纸,只见“大师”用力一拍,纸上竟然出现了一个血手印,表明妖魔鬼怪被降服,接下来“大师”把纸放入水中,血手印又慢慢消失了,表明妖魔鬼怪被驱走了.其实“大师”事先在手上涂了碳酸钠溶液,在白纸和水中各加入了一种化学试剂,则在水中加入的化学试剂可能是
A.稀盐酸 B.酚酞试液 C.氢氧化钠溶液 D.氯化钠溶液
16.下列说法正确的是
A.如果不慎将碱液沾到皮肤上,应立即涂上盐酸溶液
B.用稀H2SO4可鉴别NaCl、NaOH、K2CO3、BaCl2四种白色固体
C.酚酞和NaOH混合溶液中加稀硫酸红色褪去,说明硫酸与酚酞发生了反应
D.在滴有石蕊溶液的水中通入CO2后溶液变红,说明CO2能与石蕊反应
二、综合题(共6题)
17.中和反应是一类重要的化学反应,某同学利用图1装置研究稀硫酸于氢氧化钠溶液反应的过程,并用PH传感器和温度传感器测量反应过程中相关的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为______。
(2)仪器A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______((填“6”、“12”或“16”)。
(4)下列说法正确的是______。
A.图2中b点所示溶液中的溶质是Na2SO4和NaOH
B.图2中d点所示溶液中所含微粒有Na+、、H+
C.图2中c→d所示溶液中Na2SO4的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
(5)本实验中需要准备溶质质量分数为9.8%的稀硫酸250g,若用98%的浓硫酸来配制,需要浓硫酸______克,需加水______mL(水的密度为lg/mL)。
18.钠的化合物在日常生活中有着广泛的应用。
(1)根据生活经验,可用于治疗胃酸过多的含钠的盐是______(填化学式)。
(2)小明同学做中和反应并探究反应产物过程如下:用试管取适量氢氧化钠溶液,滴加酚酞后溶液变______色,再往试管里滴入足量稀盐酸,振荡后溶液又变色,此时溶液显______性;取反应后的溶液蒸发,出现了白色固体,对于白色固体成分(指示剂忽略),小明认为是氯化钠,小亮认为还可能是氯化钠和氢氧化钠的混合物。你认为谁的判断正确______?
(3)盛放氢氧化钠溶液的试剂瓶若密封不严会使氢氧化钠发生变质,氢氧化钠变质的原因是______(用化学方程式表示);若该溶液为部分变质,请设计实验证明______。(请写出简要的步骤、现象)
(4)有一瓶碳酸钠和氢氧化钠固体混合物。现取该样品10g,加入一定量稀盐酸溶液恰好完全反应,同时产生了2.2g气体。试计算该混合物中氢氧化钠的质量分数______。
19.下表是我国颁布的生活饮用水水质标准的部分内容。
项目 标准
感官指标 无异味、异臭等
化学指标 pH 6.5~8.5,铜<1.0mg L-1,氟化物<1.0mg L-1,游离氯≥0.3mg L-1等
(1)感官指标表现的是自来水的______性质(填“物理”或“化学”);若化学指标中的pH=8时,表明自来水呈________(填“酸性”、“碱性”或“中性”)。
(2)天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是__________。
(3)硬水给生活和生产带来很多麻烦,生活中可用______来区分硬水和软水,常用______的方法来降低水的硬度。
(4)液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为________;从能量变化角度看,该反应中将________能转化为化学能。
(5)饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是_____。NH2Cl中氯元素与氢元素的质量比是_______。
(6)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
该反应的化学方程式是_________。
20.甜瓜珍品——江西梨瓜以“脆、甜、香”而闻名。梨瓜中含有丰富的蛋白质、粗纤维、维生素、钙、磷、铁、镁、钾、硒等人体所需的营养素;
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝_______防止腐烂;
(2)梨瓜适宜生长在pH为6.0-6.8的土壤中,实验室测定溶液pH的操作方法是_______________;
(3)如图为硒元素的某些信息,硒原子核内有_______个质子,硒原子的相对原子质量是_____,硒原子在化学反应中易_______(填“得到”或“失去”)电子。
21.实验室有一瓶标签模糊的烧碱溶液,小杰设计实验测定了其溶质质量分数。请根据下图所示的实验过程和提供的数据进行分析和计算。(注:滴入酚酞试液的质量忽略不计)
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好________________时,停止滴液。反应所消耗稀盐酸的质量为_______g。
(2)通过计算确定该瓶烧碱溶液的溶质质量分数。(写出计算步骤)________
(3)问题讨论:小红做同样的实验得到的结果比小杰得到的结果偏小,从实验操作的角度分析产生这种误差的原因可能是_______________________(填写一条即可)。
22.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
参考答案
1.B
【详解】
A、熄灭酒精灯,用灯帽盖,不能用嘴吹,否则会引发危险,故A错误;
B、量取液体时,读取量筒内液体体积时,视线应与液体凹液面的最低处保持水平,故B正确;
C、氢氧化钠溶液是强碱,具有很强的腐蚀性,不能放在纸片上,应放玻璃器皿中,图中操作错误,故C错误;
D、pH试纸在使用时,不能直接将pH试纸伸入到待测液中,这样会污染溶液,故错误;
故选:B。
2.A
【详解】
由分析可知,在柠檬汁、酱油、西瓜汁、 洗发水中,柠檬汁的pH为(2-3)最小,所以柠檬汁的酸性最强,选项A符合题意。
故选A。
3.D
【详解】
A、为了提高水的利用率,农业上可将大水漫灌改为喷灌或滴灌,故A不正确;
B、人体血浆的pH约为7.35~7.45,故B不正确;
C、蚊虫叮咬后会产生蚁酸,需要涂抹碱性物质进行中和,故C不正确;
D、石墨具有导电性,可以用做干电池的电极,故D正确。故选D。
4.D
【详解】
A、石蕊溶液只能粗略的测定溶液的是否显酸性,不能测出溶液的具体pH值,故错误;
B、澄清石灰水不能测出溶液的pH值,故错误;
C、酚酞溶液只能粗略的测定出溶液是否显碱性,不能测出溶液的具体pH值,故错误;
D、pH试纸可以测出溶液的酸碱度,故正确。故选D。
5.D
【详解】
A. a点所示的溶液已经加入了少量的氢氧化钠溶液,发生了反应产生了NaCl和水,但pH小于7,说明盐酸没有反应完,含有的溶质是HCl和NaCl,不符合题意;
B. b点所示的溶液pH等于7,为中性,不能使紫色石蕊溶液变色,仍为紫色,不符合题意;
C. c点pH大于7,表示NaOH已经过量了,不符合题意;
D. 从加入氢氧化钠开始就产生了NaCl,所以a、b、c所示的溶液中溶质都含有NaCl,符合题意。故选D。
6.D
【详解】
当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;肥皂水显碱性,pH大于7;纯碱溶液显碱性,pH大于7;橘子汁显酸性,pH小于7;食醋显酸性,pH应小于7。
7.D
【详解】
紫甘蓝汁液在碱性溶液中为黄色,水和食盐溶液为中性,硫酸为酸性,烧碱溶液为碱性,所以在烧碱溶液中紫甘蓝汁液变黄,故选D.
8.D
【详解】
A. 催化剂只改变化学反应速率,不影响生成物的质量,此选项错误;
B. 物质和氧发生的反应是氧化反应,所以有氧气参加的反应一定是氧化反应,此选项错误;
C. 二氧化碳通入紫色石蕊试液,溶液变红色,是二氧化碳与石蕊试液中的水反应生成了碳酸,生成的碳酸具有酸性,使石蕊试液变红,此选项错误;
D. 由不同种元素组成的纯净物是化合物,所以含有不同种元素的纯净物一定是化合物,此选项正确。故选D。
9.A
【详解】
pH<7的溶液呈酸性,且pH越小酸性越强;pH>7的溶液呈碱性,pH越大,碱性越强。A、由表格信息可知苹果汁和葡萄汁的pH<7,呈酸性,正确;B、葡萄汁的pH更大,即酸性比苹果汁弱,错误;C、牛奶显酸性,玉米粥可能呈碱性,错误;D、胃酸的主要成分是盐酸,盐酸呈酸性,故胃酸过多的人可以常喝玉米粥,错误。故选A。
10.C
【详解】
A、金属氧化物和酸反应生成盐和水,但不是中和反应,故A错误;
B、化合物都是由不同元素组成的纯净物,纯净物是前提,如果抛开了纯净物则可能是错误的结论,故B错误;
C、根据质量守恒定律可以知道反应前后元素的种类不变,所以含碳元素的物质充分燃烧会生成CO2,则燃烧能生成CO2的物质一定含碳元素。故C正确;
D、碳酸钠为盐,但是其水溶液呈碱性,故D错误,故选C。
11.D
【详解】
A、使用胶头滴管滴加少量液体时,注意胶头滴管不能伸入到试管内或接触试管内壁。应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,故选项错误;
B、不能用燃着的酒精灯点燃另一个酒精灯,否则易发生火灾,故选项错误;
C、用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许待测液滴在pH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定溶液的酸碱度,切记不能直接把试纸浸入待测液中,会污染原试剂,故选项错误;
D、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气,故选项正确。故选D。
12.B
【详解】
A、碳酸钠能与过量氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,但反应后得到的氢氧化钠溶液中混有过量的氢氧化钙溶液,同时无法得到碳酸钠,不能达到分离的目的,故选项实验方案不能达到实验目的;
B、碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,充分反应后,蒸发,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验方案能达到实验目的;
C、检验二氧化碳气体中含有少量的一氧化碳,不能用燃着的木条点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,一氧化碳是不会燃烧的,且会引入新杂质氧气,故选项实验方案不能达到实验目的;
D、无色酚酞遇酸性和中性溶液不变色,遇碱性溶液变红色,氯化钠溶液、氢氧化钠溶液和稀盐酸分别显中性、碱性、酸性,使酚酞溶液分别显示无色、红色、无色,不能出现三种明显不同的现象,不能鉴别,故选项实验方案不能达到实验目的。
13.A
【详解】
A、元素符号能表示一种元素,还能表示该元素的一个原子,故“H”既可以表示宏观的氢元素,也可以表示微观的一个氢原子,故选项说法正确.
B、纯碱是碳酸钠的俗称,是由金属离子和酸根离子构成的,属于盐,故选项说法错误.
C、金刚石、C60均为碳单质,由于碳原子的排列方式不同,故它们的物理性质不同,故选项说法错误.
D、泡沫灭火器的灭火原理主要是利用生成二氧化碳的密度比空气大,覆盖在可燃物表面,隔绝空气,进而达到灭火的目的,故选项说法错误.
故选A.
14.C
【详解】
A、NaOH、Ca(OH)2均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,方案不合理;
B、盐酸、氢氧化钙、氯化钠三种溶液分别显酸性、碱性、中性,分别能使紫色石蕊溶液显红色、蓝色、紫色,可以鉴别;分别能使无色酚酞溶液显无色、红色、无色,不能鉴别,方案不合理;
C、二氧化碳能使澄清石灰水变浑浊,通入澄清石灰水可以检验;二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红色,可以检验CO中是否有少量CO2,两种方案均合理;
D、铜粉和碳粉均不能与稀硫酸反应,不能分离铜粉和碳粉,方案不合理。
故选:C。
15.B
【详解】
A、碳酸钠溶液显碱性。 “大师”把纸放入水中,血手印又慢慢消失了,说明水中放了稀盐酸等酸性溶液,与碱性溶液反应后,呈中性,因此血手印又慢慢消失了,故选项正确;
B、一张雪白的纸上喷上了无色酚酞试液,并且晾干,因此酚酞试液不是放在水中,故选项错误;
C、氢氧化钠溶液显碱性,不与碳酸钠溶液反应,红色不会消失,故选项错误;
D、氯化钠溶液显中性,不与碳酸钠溶液反应,红色不会消失,故选项错误;
故选B。
16.B
【详解】
A、如果不慎将碱液沾到皮肤上,应立即用大量的清水冲洗然后涂上少量的硼酸溶液,中和残留的碱液,不能立即涂上盐酸溶液,选项说法错误;故不符合题意;
B、稀H2SO4能与K2CO3反应生成二氧化碳气体,能与BaCl2反应生成硫酸钡白色沉淀,与NaOH反应生成硫酸钠和水,反应放出热量,与氯化钠混合无明显变化,可以鉴别,选项实验方案的设计中可行;故符合题意;
C、酚酞和NaOH混合溶液中加稀硫酸红色褪去,是因为氢氧化钠溶液与稀硫酸发生了中和反应,而不是硫酸与酚酞发生了反应,选项说法错误;故不符合题意;
D、在滴有石蕊溶液的水中通入CO2后溶液变红,是因为CO2与水反应生成了碳酸,碳酸使石蕊溶液变红,选项说法错误;故不符合题意;
故选B
17.2NaOH+H2SO4═Na2SO4+2H2O H2SO4 12 AD 25 225
【详解】
(1)稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,2NaOH+H2SO4═Na2SO4+2H2O。
(2)由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,不断加入的是酸性溶液,使pH减小,故仪器A中溶液硫酸H2SO4。
(3)图3中V时,放出的热量最多,溶液恰好完全反应,pH=7,结合图2可知,图3中V的数值最接近12。
(4)A、b点溶液的pH大于7,溶液显碱性,b点所示溶液中的溶质是反应生成的Na2SO4和过量的NaOH,正确;
B、d点溶液的pH小于7,溶液显酸性,d点所示溶液中溶质是硫酸钠和过量的硫酸,溶液中所含微粒有Na+、、H+及溶剂水分子H2O,错误;
C、c→d,是完全反应后继续向溶液中滴加稀硫酸,溶液中Na2SO4的质量不变,错误;
D、e→f,温度逐渐升高,该变化趋势可说明该反应是放热反应,正确。
故选AD。
(5)设需要浓硫酸的质量为,根据溶液稀释前后溶质的质量不变,则250g×9.8%=×98%,=25g,需加水的质量为250g-25g=225g,水的密度为1g/mL,水的体积=225mL。
18.NaHCO3 红 中性或酸 小明的判断是正确的 CO2+2NaOH=Na2CO3+H2O 取溶液少许,向其中滴加足量氯化钙溶液,产生白色沉淀碳酸钙和氯化钠,向溶液中滴加无色酚酞溶液,若溶液变红色,说明含有氢氧化钠 47%
【详解】
(1)生活中常用于治疗胃酸过多的盐是碳酸氢钠,化学式为:NaHCO3;
(2)用试管取适量氢氧化钠溶液,滴加酚酞后溶液变红色,再往试管里滴入足量稀盐酸,稀盐酸和氢氧化钠发生反应生成氯化钠和水,振荡后溶液又变色,说明氢氧化钠被消耗完,溶液中溶质是氯化钠或氯化钠和氯化氢,因此溶液是中性和酸性;取反应后的溶液蒸发,出现了白色固体,白色固体只能是氯化钠,因为一方面稀盐酸是足量的,另一方面有氢氧化钠存在的条件下,溶液是红色的,因此小明的判断是正确的;
(3)盛放氢氧化钠溶液的试剂瓶若密封不严会使氢氧化钠发生变质,因为氢氧化钠溶液会吸收空气中的二氧化碳,反应的方程式为:CO2+2NaOH=Na2CO3+H2O;若该溶液为部分变质;则溶液中的溶质是碳酸钠和氢氧化钠,可用如下实验验证:取溶液少许,向其中滴加足量氯化钙溶液,产生白色沉淀碳酸钙和氯化钠,向溶液中滴加无色酚酞溶液,若溶液变红色,说明含有氢氧化钠;
(4)设混合物中含有氢氧化钠质量为x,则碳酸钠的质量为10-x,
x=4.7g,
则混合物中氢氧化铵的质量分数=%=47%;
答:样品中氢氧化钠的质量为4.7g,溶质质量分数为47%。
19.物理 碱性 蒸馏 肥皂水 煮沸 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 电能 0 71:4 2NaClO2+Cl2=2NaCl+2ClO2
【详解】
本题较全面地考查了水的净化的知识,涉及的知识面较广,全面地掌握有关的基础知识是解题的关键。
(1)感官指标表现的自来水的性质,不需要经过化学变化来表现,是物理性质,在化学指标中的pH=8时大于7,表明自来水呈碱性;
(2)在吸附、沉淀、过滤和蒸馏等方法净化水时,只有蒸馏得到的水是纯水,净化程度最高的方法是蒸馏;
(3)生活中可用肥皂水来区分硬水和软水,硬水遇肥皂水产生的泡沫少,遇软水产生的泡沫多,常用煮沸的方法来降低水的硬度;
(4)氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气,该反应的化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑;从能量变化角度看,该反应中将电能转化为化学能。
(5)O3是一种单质,氧元素的化合价是0,在NH2Cl中氯元素与氢元素的质量比是:35.5:(2×1)=71:4;
(6)根据反应中各物质分子的微观模型图,各物质的化学式分别为NaClO2、Cl2、NaCl、ClO2,则反应的化学方程式为2NaClO2+Cl2=2NaCl+2ClO2。
20.氧气 用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH 34 78.96 得到
【解析】
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝氧气防止腐烂;(2)实验室测定溶液pH的操作方法是用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH;(3)如图为硒元素的某些信息,根据质子数=核电荷数=原子序数,硒原子核内有34个质子,根据元素周期表中的一格可知,硒原子的相对原子质量是78.96,根据硒原子的和外电子排布规律可知,硒原子在化学反应中易得到2个电子达到稳定结构。
21.变为无色 50 10% 可能是小杰没有控制好稀盐酸的量而导致稀盐酸过量,因为稀盐酸过量时酚酞也为无色
【详解】
(1)因为停止滴加稀盐酸后,锥形瓶及溶液质量共为110g,而滴加稀盐酸前锥形瓶及溶液质量共为60g,故反应时消耗稀盐酸的质量为:110g-60g=50g
(2)加入烧碱溶液后,锥形瓶及溶液质量共为60g,锥形瓶的质量是20 g,则烧碱溶液的质量是:60 g-20 g=40g
设烧碱溶液的溶质质量分数为y
40 :36.5=40gy:(50g×7.3%) 解得y=10%
答:该瓶烧碱溶液的溶质质量分数是10%
(3)可能是小杰没有控制好稀盐酸的量而导致稀盐酸过量,因为稀盐酸过量时酚酞也为无色
22.SO2有一定的毒性 紫 20 是
【详解】
(1)SO2对人体有一定的毒性,所以SO2作为食品添加剂须严格控制用量,故填SO2有一定的毒性。
(2)①由步骤1、2可知,H2O2溶液将葡萄酒中的SO2完全转化成硫酸,且指示剂在pH<7的溶液中显紫色,所以步骤2中,滴入指示剂后溶液呈紫色,故填紫。
②设加入水的质量为x,10g×30%=(10g+x)×10%,x=20g,故填20。
③解:设100mL该葡萄酒中的SO2的质量为x
64:98=x:14.7mg
x=9.6mg
1L该葡萄酒中的SO2的质量为9.6mg/100mL×1000mL=96mg<250mg,所以该葡萄酒中SO2的含量符合国家标准,故填是。
一、选择题(共16题)
1.下列实验操作正确的是( )
A.熄灭酒精灯 B.液体读数
C.称量NaOH固体 D.测定溶液的pH
2.一些物质的pH范围如下,其中酸性最强的是
A.柠檬汁(2-3) B.酱油(4-5) C.西瓜汁(5-6) D.洗发水(8-9)
3.下列说法正确的是
A.为了提高水的利用率,农业上可将喷灌或滴灌改为大水漫灌
B.人体血浆的pH约为0.9~1.5
C.蚊虫叮咬后应涂一些含有酸性物质的溶液,可以减轻痛痒
D.石墨具有导电性,可以用做干电池的电极
4.测定pH最简单的方法是使用
A.石蕊溶液 B.澄清石灰水
C.酚酞溶液 D.pH试纸
5.向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是
A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中溶质都含有NaCl
6.某同学用pH试纸测定日常生活中的一些液体的pH.他的实验记录一定错误的是( )
A.肥皂水pH=10 B.纯碱溶液pH=11 C.橘子汁pH=4 D.食醋pH=7
7.小红观察在不同酸碱度下紫甘蓝(见右图)汁液所显示的颜色,记录如下。
pH 1 2~3 4~6 7~9 10 11 12~14
颜色 深红 紫红 浅紫 蓝 绿 黄绿 黄
下列物质中,能使紫甘蓝汁液变黄的是
A.水 B.食盐溶液 C.硫酸溶液 D.氢氧化钠溶液
8.下列有关化学知识的描述正确的是
A.催化剂不仅能改变化学反应速率,而且会增加生成物的质量
B.物质和氧气发生的反应是氧化反应,所以氧化反应一定有氧气参加
C.二氧化碳通入紫色石蕊试液,溶液变红色,说明二氧化碳具有酸性
D.含有不同种元素的纯净物一定是化合物
9.依据所给食物的近似 pH判断,下列说法正确的是:
食物 葡萄汁 苹果汁 牛奶 玉米粥
pH 3.5~4.5 2.9~3.3 6.3~6.6 6.8~8.0
A.苹果汁和葡萄汁显酸性 B.葡萄汁的酸性比苹果汁强
C.玉米粥和牛奶显碱性 D.胃酸过多的人不宜常喝玉米粥
10.逻辑推理是化学学习中常用的一种思维方法,以下四个推理中正确的是
A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应
B.化合物都是由不同元素组成的,则不同元素组成的物质一定是化合物
C.含碳元素的物质充分燃烧会生成CO2,燃烧能生成CO2的物质一定含碳元素
D.碱溶液的pH>7,则pH>7的溶液一定是碱的溶液
11.规范的化学实验操作是实验成功的关键。下列实验操作正确的是
A.滴加液体 B.点燃酒精灯
C.测溶液的pH D.检查装置气密性
12.下列实验方案中,能达到实验目的的是 ( )
选项 实验目的 实验方案
A 分离碳酸钠和氢氧化钠的混合物 加入过量氢氧化钙溶液,过滤
B 除去氯化钠固体中的少量碳酸钠 加入适量稀盐酸,充分反应后,蒸发
C 检验二氧化碳气体中含有少量的一氧化碳 用燃着的木条点燃
D 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸 各取少量溶液于试管中,分别滴加无色酚酞溶液,观察溶液颜色的变化
A.A B.B C.C D.D
13.下列描述正确的是( )
A.“H”既可以表示宏观的氢元素,也可以表示微观的一个氢原子
B.烧碱、熟石灰、纯碱按物质分类均属于碱
C.金刚石、均为碳单质,所以物理性质、化学性质完全相同
D.泡沫灭火器灭火的原理是提高了可燃物质的着火点
14.某同学对下列四个实验都设计了两种方案,两种方案均合理的是
选项 A B C D
实验目的 除去NaOH中的 Ca(OH)2 鉴别盐酸、氢氧化钙 氯化钠三种溶液 检验CO中是否有少量CO2 分离铜粉和 碳粉
方案1 滴加适量HC1 滴加紫色石蕊溶液 通入澄清石灰水 滴加稀硫酸
方案2 滴加适最Na2CO3 溶液 滴加无色酚酞溶液 通入紫色石蕊溶液 氧气中加热
A.A B.B C.C D.D
15.有一种“白纸血印”的街头骗术,原本是一张雪白的纸,只见“大师”用力一拍,纸上竟然出现了一个血手印,表明妖魔鬼怪被降服,接下来“大师”把纸放入水中,血手印又慢慢消失了,表明妖魔鬼怪被驱走了.其实“大师”事先在手上涂了碳酸钠溶液,在白纸和水中各加入了一种化学试剂,则在水中加入的化学试剂可能是
A.稀盐酸 B.酚酞试液 C.氢氧化钠溶液 D.氯化钠溶液
16.下列说法正确的是
A.如果不慎将碱液沾到皮肤上,应立即涂上盐酸溶液
B.用稀H2SO4可鉴别NaCl、NaOH、K2CO3、BaCl2四种白色固体
C.酚酞和NaOH混合溶液中加稀硫酸红色褪去,说明硫酸与酚酞发生了反应
D.在滴有石蕊溶液的水中通入CO2后溶液变红,说明CO2能与石蕊反应
二、综合题(共6题)
17.中和反应是一类重要的化学反应,某同学利用图1装置研究稀硫酸于氢氧化钠溶液反应的过程,并用PH传感器和温度传感器测量反应过程中相关的变化情况,得到图2和图3。
(1)烧杯中发生反应的化学方程式为______。
(2)仪器A中溶液的溶质是______(填化学式)。
(3)图3中V的数值最接近______((填“6”、“12”或“16”)。
(4)下列说法正确的是______。
A.图2中b点所示溶液中的溶质是Na2SO4和NaOH
B.图2中d点所示溶液中所含微粒有Na+、、H+
C.图2中c→d所示溶液中Na2SO4的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
(5)本实验中需要准备溶质质量分数为9.8%的稀硫酸250g,若用98%的浓硫酸来配制,需要浓硫酸______克,需加水______mL(水的密度为lg/mL)。
18.钠的化合物在日常生活中有着广泛的应用。
(1)根据生活经验,可用于治疗胃酸过多的含钠的盐是______(填化学式)。
(2)小明同学做中和反应并探究反应产物过程如下:用试管取适量氢氧化钠溶液,滴加酚酞后溶液变______色,再往试管里滴入足量稀盐酸,振荡后溶液又变色,此时溶液显______性;取反应后的溶液蒸发,出现了白色固体,对于白色固体成分(指示剂忽略),小明认为是氯化钠,小亮认为还可能是氯化钠和氢氧化钠的混合物。你认为谁的判断正确______?
(3)盛放氢氧化钠溶液的试剂瓶若密封不严会使氢氧化钠发生变质,氢氧化钠变质的原因是______(用化学方程式表示);若该溶液为部分变质,请设计实验证明______。(请写出简要的步骤、现象)
(4)有一瓶碳酸钠和氢氧化钠固体混合物。现取该样品10g,加入一定量稀盐酸溶液恰好完全反应,同时产生了2.2g气体。试计算该混合物中氢氧化钠的质量分数______。
19.下表是我国颁布的生活饮用水水质标准的部分内容。
项目 标准
感官指标 无异味、异臭等
化学指标 pH 6.5~8.5,铜<1.0mg L-1,氟化物<1.0mg L-1,游离氯≥0.3mg L-1等
(1)感官指标表现的是自来水的______性质(填“物理”或“化学”);若化学指标中的pH=8时,表明自来水呈________(填“酸性”、“碱性”或“中性”)。
(2)天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是__________。
(3)硬水给生活和生产带来很多麻烦,生活中可用______来区分硬水和软水,常用______的方法来降低水的硬度。
(4)液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为________;从能量变化角度看,该反应中将________能转化为化学能。
(5)饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是_____。NH2Cl中氯元素与氢元素的质量比是_______。
(6)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
该反应的化学方程式是_________。
20.甜瓜珍品——江西梨瓜以“脆、甜、香”而闻名。梨瓜中含有丰富的蛋白质、粗纤维、维生素、钙、磷、铁、镁、钾、硒等人体所需的营养素;
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝_______防止腐烂;
(2)梨瓜适宜生长在pH为6.0-6.8的土壤中,实验室测定溶液pH的操作方法是_______________;
(3)如图为硒元素的某些信息,硒原子核内有_______个质子,硒原子的相对原子质量是_____,硒原子在化学反应中易_______(填“得到”或“失去”)电子。
21.实验室有一瓶标签模糊的烧碱溶液,小杰设计实验测定了其溶质质量分数。请根据下图所示的实验过程和提供的数据进行分析和计算。(注:滴入酚酞试液的质量忽略不计)
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好________________时,停止滴液。反应所消耗稀盐酸的质量为_______g。
(2)通过计算确定该瓶烧碱溶液的溶质质量分数。(写出计算步骤)________
(3)问题讨论:小红做同样的实验得到的结果比小杰得到的结果偏小,从实验操作的角度分析产生这种误差的原因可能是_______________________(填写一条即可)。
22.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
参考答案
1.B
【详解】
A、熄灭酒精灯,用灯帽盖,不能用嘴吹,否则会引发危险,故A错误;
B、量取液体时,读取量筒内液体体积时,视线应与液体凹液面的最低处保持水平,故B正确;
C、氢氧化钠溶液是强碱,具有很强的腐蚀性,不能放在纸片上,应放玻璃器皿中,图中操作错误,故C错误;
D、pH试纸在使用时,不能直接将pH试纸伸入到待测液中,这样会污染溶液,故错误;
故选:B。
2.A
【详解】
由分析可知,在柠檬汁、酱油、西瓜汁、 洗发水中,柠檬汁的pH为(2-3)最小,所以柠檬汁的酸性最强,选项A符合题意。
故选A。
3.D
【详解】
A、为了提高水的利用率,农业上可将大水漫灌改为喷灌或滴灌,故A不正确;
B、人体血浆的pH约为7.35~7.45,故B不正确;
C、蚊虫叮咬后会产生蚁酸,需要涂抹碱性物质进行中和,故C不正确;
D、石墨具有导电性,可以用做干电池的电极,故D正确。故选D。
4.D
【详解】
A、石蕊溶液只能粗略的测定溶液的是否显酸性,不能测出溶液的具体pH值,故错误;
B、澄清石灰水不能测出溶液的pH值,故错误;
C、酚酞溶液只能粗略的测定出溶液是否显碱性,不能测出溶液的具体pH值,故错误;
D、pH试纸可以测出溶液的酸碱度,故正确。故选D。
5.D
【详解】
A. a点所示的溶液已经加入了少量的氢氧化钠溶液,发生了反应产生了NaCl和水,但pH小于7,说明盐酸没有反应完,含有的溶质是HCl和NaCl,不符合题意;
B. b点所示的溶液pH等于7,为中性,不能使紫色石蕊溶液变色,仍为紫色,不符合题意;
C. c点pH大于7,表示NaOH已经过量了,不符合题意;
D. 从加入氢氧化钠开始就产生了NaCl,所以a、b、c所示的溶液中溶质都含有NaCl,符合题意。故选D。
6.D
【详解】
当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性;肥皂水显碱性,pH大于7;纯碱溶液显碱性,pH大于7;橘子汁显酸性,pH小于7;食醋显酸性,pH应小于7。
7.D
【详解】
紫甘蓝汁液在碱性溶液中为黄色,水和食盐溶液为中性,硫酸为酸性,烧碱溶液为碱性,所以在烧碱溶液中紫甘蓝汁液变黄,故选D.
8.D
【详解】
A. 催化剂只改变化学反应速率,不影响生成物的质量,此选项错误;
B. 物质和氧发生的反应是氧化反应,所以有氧气参加的反应一定是氧化反应,此选项错误;
C. 二氧化碳通入紫色石蕊试液,溶液变红色,是二氧化碳与石蕊试液中的水反应生成了碳酸,生成的碳酸具有酸性,使石蕊试液变红,此选项错误;
D. 由不同种元素组成的纯净物是化合物,所以含有不同种元素的纯净物一定是化合物,此选项正确。故选D。
9.A
【详解】
pH<7的溶液呈酸性,且pH越小酸性越强;pH>7的溶液呈碱性,pH越大,碱性越强。A、由表格信息可知苹果汁和葡萄汁的pH<7,呈酸性,正确;B、葡萄汁的pH更大,即酸性比苹果汁弱,错误;C、牛奶显酸性,玉米粥可能呈碱性,错误;D、胃酸的主要成分是盐酸,盐酸呈酸性,故胃酸过多的人可以常喝玉米粥,错误。故选A。
10.C
【详解】
A、金属氧化物和酸反应生成盐和水,但不是中和反应,故A错误;
B、化合物都是由不同元素组成的纯净物,纯净物是前提,如果抛开了纯净物则可能是错误的结论,故B错误;
C、根据质量守恒定律可以知道反应前后元素的种类不变,所以含碳元素的物质充分燃烧会生成CO2,则燃烧能生成CO2的物质一定含碳元素。故C正确;
D、碳酸钠为盐,但是其水溶液呈碱性,故D错误,故选C。
11.D
【详解】
A、使用胶头滴管滴加少量液体时,注意胶头滴管不能伸入到试管内或接触试管内壁。应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,故选项错误;
B、不能用燃着的酒精灯点燃另一个酒精灯,否则易发生火灾,故选项错误;
C、用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许待测液滴在pH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定溶液的酸碱度,切记不能直接把试纸浸入待测液中,会污染原试剂,故选项错误;
D、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气,故选项正确。故选D。
12.B
【详解】
A、碳酸钠能与过量氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,但反应后得到的氢氧化钠溶液中混有过量的氢氧化钙溶液,同时无法得到碳酸钠,不能达到分离的目的,故选项实验方案不能达到实验目的;
B、碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,充分反应后,蒸发,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验方案能达到实验目的;
C、检验二氧化碳气体中含有少量的一氧化碳,不能用燃着的木条点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,一氧化碳是不会燃烧的,且会引入新杂质氧气,故选项实验方案不能达到实验目的;
D、无色酚酞遇酸性和中性溶液不变色,遇碱性溶液变红色,氯化钠溶液、氢氧化钠溶液和稀盐酸分别显中性、碱性、酸性,使酚酞溶液分别显示无色、红色、无色,不能出现三种明显不同的现象,不能鉴别,故选项实验方案不能达到实验目的。
13.A
【详解】
A、元素符号能表示一种元素,还能表示该元素的一个原子,故“H”既可以表示宏观的氢元素,也可以表示微观的一个氢原子,故选项说法正确.
B、纯碱是碳酸钠的俗称,是由金属离子和酸根离子构成的,属于盐,故选项说法错误.
C、金刚石、C60均为碳单质,由于碳原子的排列方式不同,故它们的物理性质不同,故选项说法错误.
D、泡沫灭火器的灭火原理主要是利用生成二氧化碳的密度比空气大,覆盖在可燃物表面,隔绝空气,进而达到灭火的目的,故选项说法错误.
故选A.
14.C
【详解】
A、NaOH、Ca(OH)2均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,方案不合理;
B、盐酸、氢氧化钙、氯化钠三种溶液分别显酸性、碱性、中性,分别能使紫色石蕊溶液显红色、蓝色、紫色,可以鉴别;分别能使无色酚酞溶液显无色、红色、无色,不能鉴别,方案不合理;
C、二氧化碳能使澄清石灰水变浑浊,通入澄清石灰水可以检验;二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊溶液变红色,可以检验CO中是否有少量CO2,两种方案均合理;
D、铜粉和碳粉均不能与稀硫酸反应,不能分离铜粉和碳粉,方案不合理。
故选:C。
15.B
【详解】
A、碳酸钠溶液显碱性。 “大师”把纸放入水中,血手印又慢慢消失了,说明水中放了稀盐酸等酸性溶液,与碱性溶液反应后,呈中性,因此血手印又慢慢消失了,故选项正确;
B、一张雪白的纸上喷上了无色酚酞试液,并且晾干,因此酚酞试液不是放在水中,故选项错误;
C、氢氧化钠溶液显碱性,不与碳酸钠溶液反应,红色不会消失,故选项错误;
D、氯化钠溶液显中性,不与碳酸钠溶液反应,红色不会消失,故选项错误;
故选B。
16.B
【详解】
A、如果不慎将碱液沾到皮肤上,应立即用大量的清水冲洗然后涂上少量的硼酸溶液,中和残留的碱液,不能立即涂上盐酸溶液,选项说法错误;故不符合题意;
B、稀H2SO4能与K2CO3反应生成二氧化碳气体,能与BaCl2反应生成硫酸钡白色沉淀,与NaOH反应生成硫酸钠和水,反应放出热量,与氯化钠混合无明显变化,可以鉴别,选项实验方案的设计中可行;故符合题意;
C、酚酞和NaOH混合溶液中加稀硫酸红色褪去,是因为氢氧化钠溶液与稀硫酸发生了中和反应,而不是硫酸与酚酞发生了反应,选项说法错误;故不符合题意;
D、在滴有石蕊溶液的水中通入CO2后溶液变红,是因为CO2与水反应生成了碳酸,碳酸使石蕊溶液变红,选项说法错误;故不符合题意;
故选B
17.2NaOH+H2SO4═Na2SO4+2H2O H2SO4 12 AD 25 225
【详解】
(1)稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,2NaOH+H2SO4═Na2SO4+2H2O。
(2)由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,不断加入的是酸性溶液,使pH减小,故仪器A中溶液硫酸H2SO4。
(3)图3中V时,放出的热量最多,溶液恰好完全反应,pH=7,结合图2可知,图3中V的数值最接近12。
(4)A、b点溶液的pH大于7,溶液显碱性,b点所示溶液中的溶质是反应生成的Na2SO4和过量的NaOH,正确;
B、d点溶液的pH小于7,溶液显酸性,d点所示溶液中溶质是硫酸钠和过量的硫酸,溶液中所含微粒有Na+、、H+及溶剂水分子H2O,错误;
C、c→d,是完全反应后继续向溶液中滴加稀硫酸,溶液中Na2SO4的质量不变,错误;
D、e→f,温度逐渐升高,该变化趋势可说明该反应是放热反应,正确。
故选AD。
(5)设需要浓硫酸的质量为,根据溶液稀释前后溶质的质量不变,则250g×9.8%=×98%,=25g,需加水的质量为250g-25g=225g,水的密度为1g/mL,水的体积=225mL。
18.NaHCO3 红 中性或酸 小明的判断是正确的 CO2+2NaOH=Na2CO3+H2O 取溶液少许,向其中滴加足量氯化钙溶液,产生白色沉淀碳酸钙和氯化钠,向溶液中滴加无色酚酞溶液,若溶液变红色,说明含有氢氧化钠 47%
【详解】
(1)生活中常用于治疗胃酸过多的盐是碳酸氢钠,化学式为:NaHCO3;
(2)用试管取适量氢氧化钠溶液,滴加酚酞后溶液变红色,再往试管里滴入足量稀盐酸,稀盐酸和氢氧化钠发生反应生成氯化钠和水,振荡后溶液又变色,说明氢氧化钠被消耗完,溶液中溶质是氯化钠或氯化钠和氯化氢,因此溶液是中性和酸性;取反应后的溶液蒸发,出现了白色固体,白色固体只能是氯化钠,因为一方面稀盐酸是足量的,另一方面有氢氧化钠存在的条件下,溶液是红色的,因此小明的判断是正确的;
(3)盛放氢氧化钠溶液的试剂瓶若密封不严会使氢氧化钠发生变质,因为氢氧化钠溶液会吸收空气中的二氧化碳,反应的方程式为:CO2+2NaOH=Na2CO3+H2O;若该溶液为部分变质;则溶液中的溶质是碳酸钠和氢氧化钠,可用如下实验验证:取溶液少许,向其中滴加足量氯化钙溶液,产生白色沉淀碳酸钙和氯化钠,向溶液中滴加无色酚酞溶液,若溶液变红色,说明含有氢氧化钠;
(4)设混合物中含有氢氧化钠质量为x,则碳酸钠的质量为10-x,
x=4.7g,
则混合物中氢氧化铵的质量分数=%=47%;
答:样品中氢氧化钠的质量为4.7g,溶质质量分数为47%。
19.物理 碱性 蒸馏 肥皂水 煮沸 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 电能 0 71:4 2NaClO2+Cl2=2NaCl+2ClO2
【详解】
本题较全面地考查了水的净化的知识,涉及的知识面较广,全面地掌握有关的基础知识是解题的关键。
(1)感官指标表现的自来水的性质,不需要经过化学变化来表现,是物理性质,在化学指标中的pH=8时大于7,表明自来水呈碱性;
(2)在吸附、沉淀、过滤和蒸馏等方法净化水时,只有蒸馏得到的水是纯水,净化程度最高的方法是蒸馏;
(3)生活中可用肥皂水来区分硬水和软水,硬水遇肥皂水产生的泡沫少,遇软水产生的泡沫多,常用煮沸的方法来降低水的硬度;
(4)氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气,该反应的化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑;从能量变化角度看,该反应中将电能转化为化学能。
(5)O3是一种单质,氧元素的化合价是0,在NH2Cl中氯元素与氢元素的质量比是:35.5:(2×1)=71:4;
(6)根据反应中各物质分子的微观模型图,各物质的化学式分别为NaClO2、Cl2、NaCl、ClO2,则反应的化学方程式为2NaClO2+Cl2=2NaCl+2ClO2。
20.氧气 用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH 34 78.96 得到
【解析】
(1)梨瓜贮存时常套一个塑料袋,其作用是阻止梨瓜中水分流失,还能隔绝氧气防止腐烂;(2)实验室测定溶液pH的操作方法是用玻璃棒蘸取待测液,滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,读出溶液的pH;(3)如图为硒元素的某些信息,根据质子数=核电荷数=原子序数,硒原子核内有34个质子,根据元素周期表中的一格可知,硒原子的相对原子质量是78.96,根据硒原子的和外电子排布规律可知,硒原子在化学反应中易得到2个电子达到稳定结构。
21.变为无色 50 10% 可能是小杰没有控制好稀盐酸的量而导致稀盐酸过量,因为稀盐酸过量时酚酞也为无色
【详解】
(1)因为停止滴加稀盐酸后,锥形瓶及溶液质量共为110g,而滴加稀盐酸前锥形瓶及溶液质量共为60g,故反应时消耗稀盐酸的质量为:110g-60g=50g
(2)加入烧碱溶液后,锥形瓶及溶液质量共为60g,锥形瓶的质量是20 g,则烧碱溶液的质量是:60 g-20 g=40g
设烧碱溶液的溶质质量分数为y
40 :36.5=40gy:(50g×7.3%) 解得y=10%
答:该瓶烧碱溶液的溶质质量分数是10%
(3)可能是小杰没有控制好稀盐酸的量而导致稀盐酸过量,因为稀盐酸过量时酚酞也为无色
22.SO2有一定的毒性 紫 20 是
【详解】
(1)SO2对人体有一定的毒性,所以SO2作为食品添加剂须严格控制用量,故填SO2有一定的毒性。
(2)①由步骤1、2可知,H2O2溶液将葡萄酒中的SO2完全转化成硫酸,且指示剂在pH<7的溶液中显紫色,所以步骤2中,滴入指示剂后溶液呈紫色,故填紫。
②设加入水的质量为x,10g×30%=(10g+x)×10%,x=20g,故填20。
③解:设100mL该葡萄酒中的SO2的质量为x
64:98=x:14.7mg
x=9.6mg
1L该葡萄酒中的SO2的质量为9.6mg/100mL×1000mL=96mg<250mg,所以该葡萄酒中SO2的含量符合国家标准,故填是。
