江苏省海门市2021-2022学年高三上学期期末教学质量调研化学试题(Word版含答案)
文档属性
| 名称 | 江苏省海门市2021-2022学年高三上学期期末教学质量调研化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 357.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-16 00:00:00 | ||
图片预览



文档简介
海门市2021-2022学年高三上学期期末教学质量调研
化学
本试卷分选择题和非选择题两部分,全卷满分100分,考试时间75分钟。
注意事项:
1.答题前,考生务必在答题纸姓名栏内写上自己的姓名、考试科目、准考证号等,并用2B铅笔涂写在答题纸上。
2.每小题选出正确答案后,用2B铅笔把答题纸,上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题纸交回。
可能用到的相对原子质量: H-1 C-12 O-16 Na-23 S-32 K-39 Cr-52
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.陶瓷是中华民族的重要文化遗产,以黏土(主要成分为Al2O3·SiO2·2H2O)为原料制备陶瓷,一般步骤为制泥、成型、干燥、烧制。下列说法正确的是
A.向黏土中加水,部分氧化铝转化为氢氧化铝
B. 陶瓷是纯净物
C.烧制过程中发生了复杂的化学变化
D.陶瓷属于有机高分子材料
2.光气(COCl2)是 一种重要的有机中间体。可用反应CHC13+H2O2=COCl2↑+HC1+H2O制备光气。下列叙述不正确的是
A. CHCl3的名称:三氯甲烷 B. HCl的电子式
C. H2O2 既含有极性键又有非极性键 D. C1- 比O2-原子核外多一个电子层
3.下列有关物质的性质与用途具有对应关系的是
A. SO2 有还原性,可用于漂白纸浆
B. BaSO4不溶于盐酸,可用于肠胃X射线造影检查
C. C2H4具有可燃性,可用作催熟剂
D. FeCl3 溶液呈酸性,可用于腐蚀电路板上的Cu
阅读下列材料,回答4~7题:
氨气是一种重要的化工原料,以氨为原料可以生产化肥和硝酸,在催化剂条件下,氨催化氧化生成NO,进而继续被氧化为NO2,再与水反应生成硝酸,氨气与硝酸反应可得氮肥硝酸铵。4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905.8kJ·mol-1
工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。
4.下列说法正确的是
A. NH3转化为NH4+,键角变大
B. [Cu(NH3)4]+中含有 离子键、配位键
C. NO 2- 空间构型为直线形
D.氨气易溶于水的原因是氨气分子间存在氢键
5.指定条件下,下列选项物质间转化不能一步实现的是
A. NH3 N2 B. Al3+ AlO2-
C. NO2 NO D. NH3NH4HSO4
6.下列装置用于实验室制NO2并回收硝酸铜,能达到实验目的的是
A.用装置甲制取NO2
B.用装置乙除NO2中的少量HNO3
C.用装置丙收集NO2
D.用装置丁蒸干Cu(NO3)2溶液制Cu(NO3)2·6H2O
7.对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列说法不正确的是
A.该反应在高温、低温条件下都能自发进行
B.催化剂的使用能改变反应的活化能但不能降低反应的焓变
C.分离出H2O(g),平衡右移,正反应速率增大
D.1molN-H断裂的同时有1mol O-H断裂说明反应到达该条件下的平衡状态
8.前四周期主族元素W、X、Y、Z原子序数依次增大,W与Z同主族、X与Y同主族且X的核电荷数是Y的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是
A.第一电离能: W>X>Y
B.原子半径: r(X)>r(W)
C.简单气态氢化物的稳定性: XD. Z的最高价氧化物对应水化物的酸性比W强
9.最近我国科学家提出一种有机电极(PTQ/HQ)与无机电极(MnO2)组成的二次电池,其放电时的工作原理如图所示。下列说法正确的是
A.放电时,a为电池的正极
B.充电时,氢离子从左室移向右室
C.放电时,b极反应为: Mn2+- 2e-+2H2O = MnO2+4H+
D.充电时,每生成lmol HQ将转移4mol电子
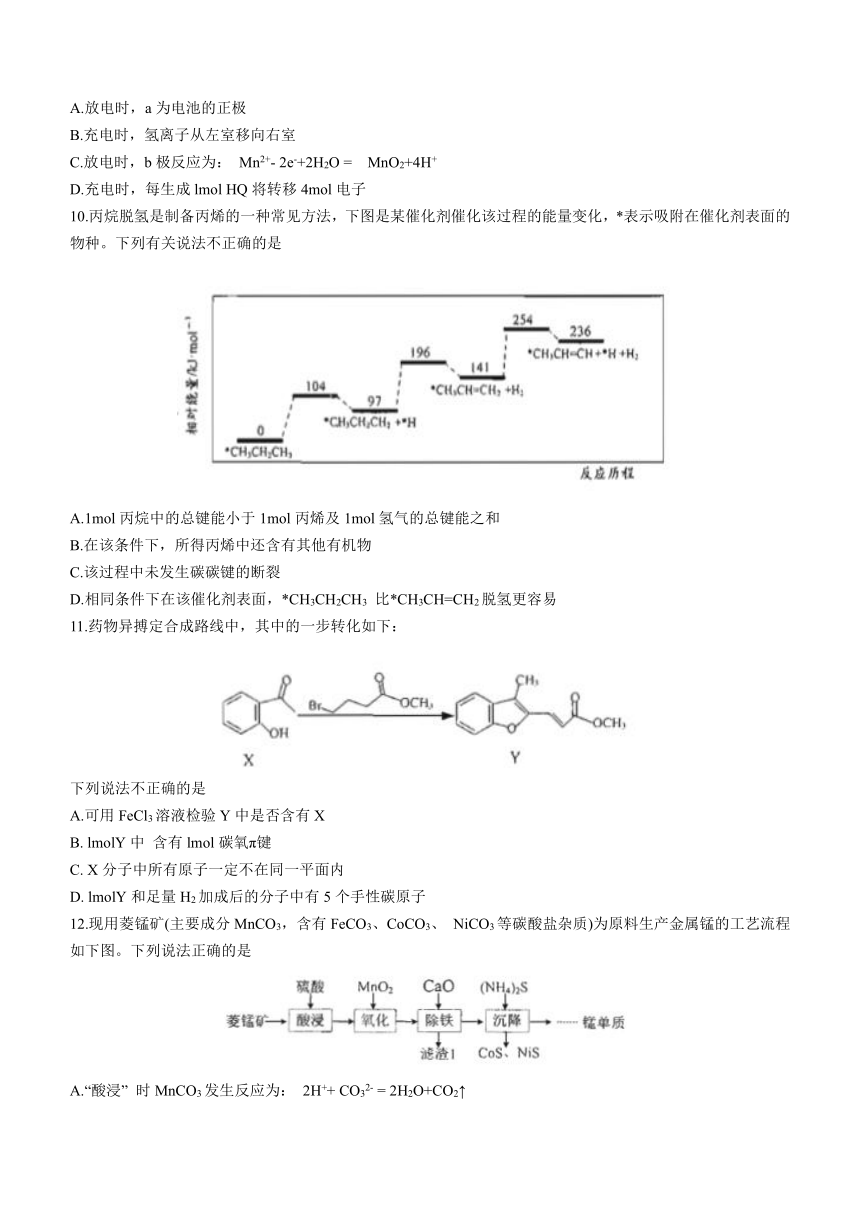
10.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法不正确的是
A.1mol丙烷中的总键能小于1mol丙烯及1mol氢气的总键能之和
B.在该条件下,所得丙烯中还含有其他有机物
C.该过程中未发生碳碳键的断裂
D.相同条件下在该催化剂表面,*CH3CH2CH3 比*CH3CH=CH2脱氢更容易
11.药物异搏定合成路线中,其中的一步转化如下:
下列说法不正确的是
A.可用FeCl3溶液检验Y中是否含有X
B. lmolY中 含有lmol碳氧π键
C. X分子中所有原子一定不在同一平面内
D. lmolY和足量H2加成后的分子中有5个手性碳原子
12.现用菱锰矿(主要成分MnCO3,含有FeCO3、CoCO3、 NiCO3等碳酸盐杂质)为原料生产金属锰的工艺流程如下图。下列说法正确的是
A.“酸浸” 时MnCO3发生反应为: 2H++ CO32- = 2H2O+CO2↑
B. MnO2氧化了Fe2+、Co2+、Ni2+
C.“沉降” 后溶液中主要存在的离子: NH4+、 Mn2+、 OH-、SO42-
D.分离Mn2+与Co2+、Ni2+是利用了它们硫化物Ksp的差异性
13.室温下: Ka1(H2C2O4)= 10-1.26、 Ka2(H2C2O4)= 10-4.27、 Ksp(CaC2O4)= 10-8.64
实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如下
实验 实验操作和现象
1 测定0.10mol·L-1NaHC2O4溶液的pH=a
2 配制pH相等的(NH4)2SO4、NH4Cl、 NH4HSO4三种溶液
3 向0.10mol·L-1Na2C2O4溶液中滴加等浓度盐酸后,混合溶液的pH=7
4 向0.10mol·L -1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10 -4mol·L-1
下列所得结论正确的是
A. a>7
B.实验2中溶液浓度的大小关系为: c(NH4Cl)>C.实验3混合溶液中有: c(Na+)= c(C2O42-)+c(HC2O4-)+c(Cl-)
D.实验4所得上层清液中的c(HC2O4-)= 10-4.37mol·L-1
14. 在某催化剂作用下CO2和H2合成甲酸仅涉及以下反应:
I. CO2(g)+H2(g) HCOOH(g) △H1<0
II. CO2(g)+H2(g) CO(g)+H2O(g) △H2
在2L刚性容器中,CO2(g)和H2(g)各投lmol发生反应,平衡时CO2的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的CO2的比值)随温度变化如图所示。下列说法正确的是
△H2<0
B.曲线b表示平衡时HCOOH的选择性
C.240°C时, 反应I的平衡常数K=
D.在200°C~360°C之间,温度对反应I的影响要小于反应II
二、非选择题:共4题,共58分
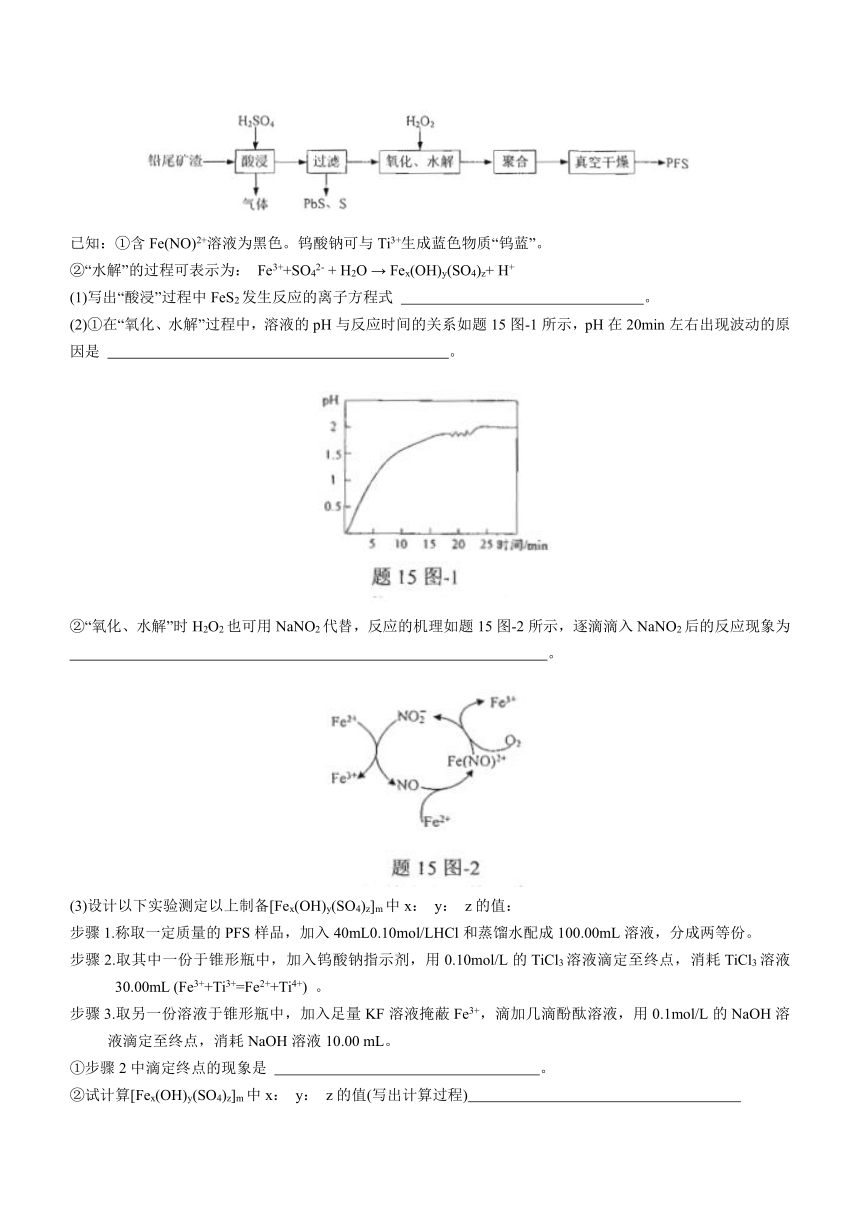
15. (13分)聚合硫酸铁(PFS) 是一种优质的絮凝剂,水溶液呈棕黄色,其化学组成可表示为[Fex(OH)y(SO4)z]m。以铅尾矿渣(含FeS2、PbS) 为原料制备聚合硫酸铁。
已知:①含Fe(NO)2+溶液为黑色。钨酸钠可与Ti3+生成蓝色物质“钨蓝”。
②“水解”的过程可表示为: Fe3++SO42- + H2O → Fex(OH)y(SO4)z+ H+
(1)写出“酸浸”过程中FeS2发生反应的离子方程式 。
(2)①在“氧化、水解”过程中,溶液的pH与反应时间的关系如题15图-1所示,pH在20min左右出现波动的原因是 。
②“氧化、水解”时H2O2也可用NaNO2代替,反应的机理如题15图-2所示,逐滴滴入NaNO2后的反应现象为
。
(3)设计以下实验测定以上制备[Fex(OH)y(SO4)z]m中x: y: z的值:
步骤1.称取一定质量的PFS样品,加入40mL0.10mol/LHCl和蒸馏水配成100.00mL溶液,分成两等份。
步骤2.取其中一份于锥形瓶中,加入钨酸钠指示剂,用0.10mol/L的TiCl3溶液滴定至终点,消耗TiCl3溶液30.00mL (Fe3++Ti3+=Fe2++Ti4+) 。
步骤3.取另一份溶液于锥形瓶中,加入足量KF溶液掩蔽Fe3+,滴加几滴酚酞溶液,用0.1mol/L的NaOH溶液滴定至终点,消耗NaOH溶液10.00 mL。
①步骤2中滴定终点的现象是 。
②试计算[Fex(OH)y(SO4)z]m中x: y: z的值(写出计算过程)
。
16. (15分)化合物F可以用于治疗哮喘、支气管炎、风湿等疾病。其一种合成路线如下:
(1)一个A分子中采用sp3杂化方式的碳原子数目 。
(2) A→B经历两步反应,第二步是消去,第一步反应类型为 。
(3) C分子式为C19H20O5, 则C的结构简式为 。
(4) H是F的同系物,相对分子质量比F小28,请写出同时符合下列条件的H的一种同分异构体的结构简式:
。
①分子中含有两个苯环;
②既能发生银镜反应又能发生水解,且水解得到的产物能与FeCl3溶液发生显色反应;
③其核磁共振氢谱有4组吸收峰,峰的面积比为1:1:2:2。
(5)设计以、为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
17. (15分)Li2CO3可用于制备锂电池的正极材料LiCoO2, 以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、 MnO、 MgF2 等杂质)制备Li2CO3。
已知:①Ksp[Fe(OH)3]=4.0 ×10 -38 Ksp[Mn(OH)2] =2 ×10-13
Ksp[Mg(OH)2]=1.2 ×10-11 Ksp[Al(OH)3]= 1.0 ×10 -33
②Co3O4、CoO均难溶于水。Co3O4难溶于酸,CoO能溶于酸中。
③当溶液中的离子浓度小于10 -5mol/L 时,已完全沉淀。
④部分物质的溶解度曲线见题17图-2。
利用锂云母矿石制备Li2CO3步骤如下:
(1)酸浸。向锂云母矿石中加入30%硫酸,加热至90°C, 装置如题17图-1所示。烧杯中试剂的作用是
。
(2)调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。再向滤液中继续滴加氢氧化钠溶液调
pH>13,过滤,此时的滤渣主要成分为 。 分两次调节pH的主要原因是
。
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入 杂质 (填化学式)。
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:
。
(5) Co3O4可由CoCO3热分解制备。CoCO3在有氧和无氧环境下的所得Co3O4和CoO的百分含量与温度关系如题17图-3所示.请补充完整由CoCO3制备较纯净的Co3O4实验方案,取一定质量的CoCO3于热解装置中,
, 干燥。
(须使用的试剂和仪器有: lmol/LH2SO4, 蒸馏水,BaCl2 溶液)
18.(15分)利用纳米铁粉及生物技术除去废水中的氮是当今环保领域重要的研究课题。
(1) 已知: i纳米铁粉还原含氧(O2)硝态(NO3-)废水的反应过程如题18图-1所示:
ii紫外光光度计可用于测定溶液中NO3-浓度
①液相还原法制备纳米铁粉:采用硼氢化物如KBH4、NaBH4 等与铁离子(Fe2+、Fe3+)混合反应。NaBH4(B 为+3价,pH=8.6)溶液还原Fe2+,除生成等物质的量的纳米铁粉和一种气体外,还生成B(OH)3。 写出该反应的离子方程式 。
②验证硝态废水中的氧气有助于提高硝态氮(NO3-)去除速率的实验方法是 。
③在纳米铁粉中添加适量的活性炭,能提高单位时间硝态氮去除率的原因是 。
(2) Fe2+能提高厌氧氨氧化菌生物活性,加快生物转化硝态氮生成氮气的速率。某科研小组利用厌氧氨氧化菌与纳米铁粉相结合的方法去除废水中的硝态氮。保持其他条件相同,在不同的温度下进行脱硝,测定废水中硝态氮的去除率与含氮产物的产率如题18图-2所示。与60°C相比,80°C时产物产率变化的原因是_
。
(3)厌氧氨氧化菌将NO 2- 转化为N2的可能机理如题18图-3所示,其中虚线框中物质转化过程可描述为
_ 。
2021~ 2022学年第一学期期末教学质量调研
高三化学参考答案及评分标准
单项选择题:本题包括14小题,每小题3分,共计42分。 每小题只有-个选项符合题意。
1C 2B 3B 4A 5B 6C 7C 8A 9D 10A 11D 12D 13D 14C
非选择题部分:包括4大题,共58分。
15. (1) FeS2+2H+= Fe2++H2S↑+S (3分)
(2)①H2O2氧化Fe2+消耗H+使溶液pH升高,生成的Fe3+水解产生H+使溶液的pH下降,两者速率的变化引起pH的波动。(2分)
②溶液由浅绿色(无色)变为黑色,后黑色褪去,如此反复,最终溶液呈棕黄色。(2分)
(3)①滴入最后半滴TiCl3溶液,溶液由无色变为蓝色,且30s无变化。(2分)
②一份溶液中n(TiCl3)=0.003mol
根据Ti3+~ Fe3+ n(Fe3+)=0.003mol (1分)
n(NaOH) =0.001mol
一份 溶液中n(HCl) =0.004mol ÷ 2=0.002mol
PFS中n(OH- ) =0.002mol-0.001mo 1 =0.001mo1(1分)
根据电荷守恒,3n(Fe3+)=2n(SO42- )+n(OH -)可得
n(SO42- )=0.004 mol (1分)
x:y:z=3:1:4 (1分) [共13分]
16. (1) 3 (2分)
(2)加成反应 (2分)
(3) (3分)
(4) (3分)
(5)
[共15分]
17. (1)吸收HF,防止污染空气(2分)
(2) Mg(OH)2、Mn(OH)2。 (2分)防止铝元素转化为 AlO2-,无法去除。(2分)
(3) Na2SO4 (2 分)
(4) 6Li2CO3+4Co3O4+O212LiCoO2+ 6CO2 (3分)
(5)在空气中加热固体(加热时鼓入氧气),温度在900~ 1000 °C保持一 段时间,取出固体,冷却。向固体中边搅拌、边加入1mol/LH2SO4至固体不再减少,过滤,用蒸馏水洗涤滤渣至最后一次洗涤液加BaCl2溶液无明显现象。(4分) [共15分]
18. (1)①2Fe2++BH4-+3OH- = =2Fe↓+2B(OH)3+2H2↑(3分)
②取含氧硝态废水平均分成两份,一份加热至沸腾除去氧气后冷却至室温(向其中一份溶液中通入足量氮气除去其中溶解氧),然后向两份溶液中加入等量的纳米铁粉,反应相同时间后用紫外光光度计检测两份溶液中剩余的NO3-浓度(3分)
③纳米铁粉和活性炭形成原电池,亚铁离子生成速率加快,快去除废水中硝态氮的速率;活性炭吸附了硝态氮
(3分)
(2)在80°C时厌氧氨氧化菌失去生理活性,纳米铁粉将硝态氮直接还原为NH4+沩主要反应。(3分)
(3)厌氧氨氧化菌提供的活性[H],在细胞色素中转化为H+,同时将电子转移至活化酶2中与NO、NH4+ (在活化酶2中)反应生成N2H4。(3 分)
(或厌氧氨氧化菌将活性[H]转移至细胞色素中,[H]在细胞色素转化为H+同时将电子转移至活化酶2中,与NO、NH4+在活化酶2中反应生成N2H4) [共15分]
化学
本试卷分选择题和非选择题两部分,全卷满分100分,考试时间75分钟。
注意事项:
1.答题前,考生务必在答题纸姓名栏内写上自己的姓名、考试科目、准考证号等,并用2B铅笔涂写在答题纸上。
2.每小题选出正确答案后,用2B铅笔把答题纸,上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题纸交回。
可能用到的相对原子质量: H-1 C-12 O-16 Na-23 S-32 K-39 Cr-52
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.陶瓷是中华民族的重要文化遗产,以黏土(主要成分为Al2O3·SiO2·2H2O)为原料制备陶瓷,一般步骤为制泥、成型、干燥、烧制。下列说法正确的是
A.向黏土中加水,部分氧化铝转化为氢氧化铝
B. 陶瓷是纯净物
C.烧制过程中发生了复杂的化学变化
D.陶瓷属于有机高分子材料
2.光气(COCl2)是 一种重要的有机中间体。可用反应CHC13+H2O2=COCl2↑+HC1+H2O制备光气。下列叙述不正确的是
A. CHCl3的名称:三氯甲烷 B. HCl的电子式
C. H2O2 既含有极性键又有非极性键 D. C1- 比O2-原子核外多一个电子层
3.下列有关物质的性质与用途具有对应关系的是
A. SO2 有还原性,可用于漂白纸浆
B. BaSO4不溶于盐酸,可用于肠胃X射线造影检查
C. C2H4具有可燃性,可用作催熟剂
D. FeCl3 溶液呈酸性,可用于腐蚀电路板上的Cu
阅读下列材料,回答4~7题:
氨气是一种重要的化工原料,以氨为原料可以生产化肥和硝酸,在催化剂条件下,氨催化氧化生成NO,进而继续被氧化为NO2,再与水反应生成硝酸,氨气与硝酸反应可得氮肥硝酸铵。4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =-905.8kJ·mol-1
工业上将含NO2废气通入氢氧化钠溶液中可获得NaNO3和NaNO2,也可向废气中通入NH3在催化剂的条件转化为无毒无害的气体排放。
4.下列说法正确的是
A. NH3转化为NH4+,键角变大
B. [Cu(NH3)4]+中含有 离子键、配位键
C. NO 2- 空间构型为直线形
D.氨气易溶于水的原因是氨气分子间存在氢键
5.指定条件下,下列选项物质间转化不能一步实现的是
A. NH3 N2 B. Al3+ AlO2-
C. NO2 NO D. NH3NH4HSO4
6.下列装置用于实验室制NO2并回收硝酸铜,能达到实验目的的是
A.用装置甲制取NO2
B.用装置乙除NO2中的少量HNO3
C.用装置丙收集NO2
D.用装置丁蒸干Cu(NO3)2溶液制Cu(NO3)2·6H2O
7.对于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列说法不正确的是
A.该反应在高温、低温条件下都能自发进行
B.催化剂的使用能改变反应的活化能但不能降低反应的焓变
C.分离出H2O(g),平衡右移,正反应速率增大
D.1molN-H断裂的同时有1mol O-H断裂说明反应到达该条件下的平衡状态
8.前四周期主族元素W、X、Y、Z原子序数依次增大,W与Z同主族、X与Y同主族且X的核电荷数是Y的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是
A.第一电离能: W>X>Y
B.原子半径: r(X)>r(W)
C.简单气态氢化物的稳定性: X
9.最近我国科学家提出一种有机电极(PTQ/HQ)与无机电极(MnO2)组成的二次电池,其放电时的工作原理如图所示。下列说法正确的是
A.放电时,a为电池的正极
B.充电时,氢离子从左室移向右室
C.放电时,b极反应为: Mn2+- 2e-+2H2O = MnO2+4H+
D.充电时,每生成lmol HQ将转移4mol电子
10.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法不正确的是
A.1mol丙烷中的总键能小于1mol丙烯及1mol氢气的总键能之和
B.在该条件下,所得丙烯中还含有其他有机物
C.该过程中未发生碳碳键的断裂
D.相同条件下在该催化剂表面,*CH3CH2CH3 比*CH3CH=CH2脱氢更容易
11.药物异搏定合成路线中,其中的一步转化如下:
下列说法不正确的是
A.可用FeCl3溶液检验Y中是否含有X
B. lmolY中 含有lmol碳氧π键
C. X分子中所有原子一定不在同一平面内
D. lmolY和足量H2加成后的分子中有5个手性碳原子
12.现用菱锰矿(主要成分MnCO3,含有FeCO3、CoCO3、 NiCO3等碳酸盐杂质)为原料生产金属锰的工艺流程如下图。下列说法正确的是
A.“酸浸” 时MnCO3发生反应为: 2H++ CO32- = 2H2O+CO2↑
B. MnO2氧化了Fe2+、Co2+、Ni2+
C.“沉降” 后溶液中主要存在的离子: NH4+、 Mn2+、 OH-、SO42-
D.分离Mn2+与Co2+、Ni2+是利用了它们硫化物Ksp的差异性
13.室温下: Ka1(H2C2O4)= 10-1.26、 Ka2(H2C2O4)= 10-4.27、 Ksp(CaC2O4)= 10-8.64
实验室进行多组实验测定某些酸、碱、盐性质,相关实验记录如下
实验 实验操作和现象
1 测定0.10mol·L-1NaHC2O4溶液的pH=a
2 配制pH相等的(NH4)2SO4、NH4Cl、 NH4HSO4三种溶液
3 向0.10mol·L-1Na2C2O4溶液中滴加等浓度盐酸后,混合溶液的pH=7
4 向0.10mol·L -1NaHC2O4溶液加入一定体积的等浓度CaCl2溶液产生白色沉淀,测得上层清液pH=4,c(Ca2+)=10 -4mol·L-1
下列所得结论正确的是
A. a>7
B.实验2中溶液浓度的大小关系为: c(NH4Cl)>
D.实验4所得上层清液中的c(HC2O4-)= 10-4.37mol·L-1
14. 在某催化剂作用下CO2和H2合成甲酸仅涉及以下反应:
I. CO2(g)+H2(g) HCOOH(g) △H1<0
II. CO2(g)+H2(g) CO(g)+H2O(g) △H2
在2L刚性容器中,CO2(g)和H2(g)各投lmol发生反应,平衡时CO2的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的CO2的比值)随温度变化如图所示。下列说法正确的是
△H2<0
B.曲线b表示平衡时HCOOH的选择性
C.240°C时, 反应I的平衡常数K=
D.在200°C~360°C之间,温度对反应I的影响要小于反应II
二、非选择题:共4题,共58分
15. (13分)聚合硫酸铁(PFS) 是一种优质的絮凝剂,水溶液呈棕黄色,其化学组成可表示为[Fex(OH)y(SO4)z]m。以铅尾矿渣(含FeS2、PbS) 为原料制备聚合硫酸铁。
已知:①含Fe(NO)2+溶液为黑色。钨酸钠可与Ti3+生成蓝色物质“钨蓝”。
②“水解”的过程可表示为: Fe3++SO42- + H2O → Fex(OH)y(SO4)z+ H+
(1)写出“酸浸”过程中FeS2发生反应的离子方程式 。
(2)①在“氧化、水解”过程中,溶液的pH与反应时间的关系如题15图-1所示,pH在20min左右出现波动的原因是 。
②“氧化、水解”时H2O2也可用NaNO2代替,反应的机理如题15图-2所示,逐滴滴入NaNO2后的反应现象为
。
(3)设计以下实验测定以上制备[Fex(OH)y(SO4)z]m中x: y: z的值:
步骤1.称取一定质量的PFS样品,加入40mL0.10mol/LHCl和蒸馏水配成100.00mL溶液,分成两等份。
步骤2.取其中一份于锥形瓶中,加入钨酸钠指示剂,用0.10mol/L的TiCl3溶液滴定至终点,消耗TiCl3溶液30.00mL (Fe3++Ti3+=Fe2++Ti4+) 。
步骤3.取另一份溶液于锥形瓶中,加入足量KF溶液掩蔽Fe3+,滴加几滴酚酞溶液,用0.1mol/L的NaOH溶液滴定至终点,消耗NaOH溶液10.00 mL。
①步骤2中滴定终点的现象是 。
②试计算[Fex(OH)y(SO4)z]m中x: y: z的值(写出计算过程)
。
16. (15分)化合物F可以用于治疗哮喘、支气管炎、风湿等疾病。其一种合成路线如下:
(1)一个A分子中采用sp3杂化方式的碳原子数目 。
(2) A→B经历两步反应,第二步是消去,第一步反应类型为 。
(3) C分子式为C19H20O5, 则C的结构简式为 。
(4) H是F的同系物,相对分子质量比F小28,请写出同时符合下列条件的H的一种同分异构体的结构简式:
。
①分子中含有两个苯环;
②既能发生银镜反应又能发生水解,且水解得到的产物能与FeCl3溶液发生显色反应;
③其核磁共振氢谱有4组吸收峰,峰的面积比为1:1:2:2。
(5)设计以、为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
17. (15分)Li2CO3可用于制备锂电池的正极材料LiCoO2, 以某锂云母矿石(主要成分为Li2O,还有Al2O3、Fe2O3、 MnO、 MgF2 等杂质)制备Li2CO3。
已知:①Ksp[Fe(OH)3]=4.0 ×10 -38 Ksp[Mn(OH)2] =2 ×10-13
Ksp[Mg(OH)2]=1.2 ×10-11 Ksp[Al(OH)3]= 1.0 ×10 -33
②Co3O4、CoO均难溶于水。Co3O4难溶于酸,CoO能溶于酸中。
③当溶液中的离子浓度小于10 -5mol/L 时,已完全沉淀。
④部分物质的溶解度曲线见题17图-2。
利用锂云母矿石制备Li2CO3步骤如下:
(1)酸浸。向锂云母矿石中加入30%硫酸,加热至90°C, 装置如题17图-1所示。烧杯中试剂的作用是
。
(2)调pH。向酸浸后的溶液中加入NaOH溶液,调节pH约为6,过滤。再向滤液中继续滴加氢氧化钠溶液调
pH>13,过滤,此时的滤渣主要成分为 。 分两次调节pH的主要原因是
。
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和Na2CO3溶液,加热煮沸,趁热过滤,将滤渣洗涤烘干,得Li2CO3固体。浓缩液中离子浓度过大将在产品中引入 杂质 (填化学式)。
(4)Li2CO3和Co3O4混合后,在空气中高温加热可以制备锂电池的正极材料LiCoO2,写出反应方程式:
。
(5) Co3O4可由CoCO3热分解制备。CoCO3在有氧和无氧环境下的所得Co3O4和CoO的百分含量与温度关系如题17图-3所示.请补充完整由CoCO3制备较纯净的Co3O4实验方案,取一定质量的CoCO3于热解装置中,
, 干燥。
(须使用的试剂和仪器有: lmol/LH2SO4, 蒸馏水,BaCl2 溶液)
18.(15分)利用纳米铁粉及生物技术除去废水中的氮是当今环保领域重要的研究课题。
(1) 已知: i纳米铁粉还原含氧(O2)硝态(NO3-)废水的反应过程如题18图-1所示:
ii紫外光光度计可用于测定溶液中NO3-浓度
①液相还原法制备纳米铁粉:采用硼氢化物如KBH4、NaBH4 等与铁离子(Fe2+、Fe3+)混合反应。NaBH4(B 为+3价,pH=8.6)溶液还原Fe2+,除生成等物质的量的纳米铁粉和一种气体外,还生成B(OH)3。 写出该反应的离子方程式 。
②验证硝态废水中的氧气有助于提高硝态氮(NO3-)去除速率的实验方法是 。
③在纳米铁粉中添加适量的活性炭,能提高单位时间硝态氮去除率的原因是 。
(2) Fe2+能提高厌氧氨氧化菌生物活性,加快生物转化硝态氮生成氮气的速率。某科研小组利用厌氧氨氧化菌与纳米铁粉相结合的方法去除废水中的硝态氮。保持其他条件相同,在不同的温度下进行脱硝,测定废水中硝态氮的去除率与含氮产物的产率如题18图-2所示。与60°C相比,80°C时产物产率变化的原因是_
。
(3)厌氧氨氧化菌将NO 2- 转化为N2的可能机理如题18图-3所示,其中虚线框中物质转化过程可描述为
_ 。
2021~ 2022学年第一学期期末教学质量调研
高三化学参考答案及评分标准
单项选择题:本题包括14小题,每小题3分,共计42分。 每小题只有-个选项符合题意。
1C 2B 3B 4A 5B 6C 7C 8A 9D 10A 11D 12D 13D 14C
非选择题部分:包括4大题,共58分。
15. (1) FeS2+2H+= Fe2++H2S↑+S (3分)
(2)①H2O2氧化Fe2+消耗H+使溶液pH升高,生成的Fe3+水解产生H+使溶液的pH下降,两者速率的变化引起pH的波动。(2分)
②溶液由浅绿色(无色)变为黑色,后黑色褪去,如此反复,最终溶液呈棕黄色。(2分)
(3)①滴入最后半滴TiCl3溶液,溶液由无色变为蓝色,且30s无变化。(2分)
②一份溶液中n(TiCl3)=0.003mol
根据Ti3+~ Fe3+ n(Fe3+)=0.003mol (1分)
n(NaOH) =0.001mol
一份 溶液中n(HCl) =0.004mol ÷ 2=0.002mol
PFS中n(OH- ) =0.002mol-0.001mo 1 =0.001mo1(1分)
根据电荷守恒,3n(Fe3+)=2n(SO42- )+n(OH -)可得
n(SO42- )=0.004 mol (1分)
x:y:z=3:1:4 (1分) [共13分]
16. (1) 3 (2分)
(2)加成反应 (2分)
(3) (3分)
(4) (3分)
(5)
[共15分]
17. (1)吸收HF,防止污染空气(2分)
(2) Mg(OH)2、Mn(OH)2。 (2分)防止铝元素转化为 AlO2-,无法去除。(2分)
(3) Na2SO4 (2 分)
(4) 6Li2CO3+4Co3O4+O212LiCoO2+ 6CO2 (3分)
(5)在空气中加热固体(加热时鼓入氧气),温度在900~ 1000 °C保持一 段时间,取出固体,冷却。向固体中边搅拌、边加入1mol/LH2SO4至固体不再减少,过滤,用蒸馏水洗涤滤渣至最后一次洗涤液加BaCl2溶液无明显现象。(4分) [共15分]
18. (1)①2Fe2++BH4-+3OH- = =2Fe↓+2B(OH)3+2H2↑(3分)
②取含氧硝态废水平均分成两份,一份加热至沸腾除去氧气后冷却至室温(向其中一份溶液中通入足量氮气除去其中溶解氧),然后向两份溶液中加入等量的纳米铁粉,反应相同时间后用紫外光光度计检测两份溶液中剩余的NO3-浓度(3分)
③纳米铁粉和活性炭形成原电池,亚铁离子生成速率加快,快去除废水中硝态氮的速率;活性炭吸附了硝态氮
(3分)
(2)在80°C时厌氧氨氧化菌失去生理活性,纳米铁粉将硝态氮直接还原为NH4+沩主要反应。(3分)
(3)厌氧氨氧化菌提供的活性[H],在细胞色素中转化为H+,同时将电子转移至活化酶2中与NO、NH4+ (在活化酶2中)反应生成N2H4。(3 分)
(或厌氧氨氧化菌将活性[H]转移至细胞色素中,[H]在细胞色素转化为H+同时将电子转移至活化酶2中,与NO、NH4+在活化酶2中反应生成N2H4) [共15分]
同课章节目录
