第三章 金属及其化合物>>第二节 几种重要的金属化合物
文档属性
| 名称 | 第三章 金属及其化合物>>第二节 几种重要的金属化合物 |

|
|
| 格式 | zip | ||
| 文件大小 | 22.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-02 00:00:00 | ||
图片预览










文档简介
课件70张PPT。1第二节 几种重要的金属化合物一、钠的重要化合物二、铝的重要化合物三、铁的重要化合物21. 氧化钠一、钠的重要化合物思考与交流1、回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
2、请你写出氧化钠与过氧化钠相互转化的化学方程式。Na2O是白色固体,Na2O2是淡黄色固体。目录氧化钠的化学性质3CaO+H2O=Ca(OH)2CaO+2HCl=CaCl2+H2OCaO+CO2=CaCO3Na2O+H2O=2NaOHNa2O+2HCl=2NaCl+H2ONa2O+CO2=Na2CO3Na2O碱性氧化物:能与酸反应生成盐和水的氧化物.酸性氧化物:能与碱反应生成盐和水的氧化物.4注意一般来说,如果金属氧化物所对应的氢氧化物可溶或微溶于水,那么该金属氧化物就 溶于水。例如,CaO相对应的氢氧化物Ca(OH)2微溶于水,所以CaO 溶于水。
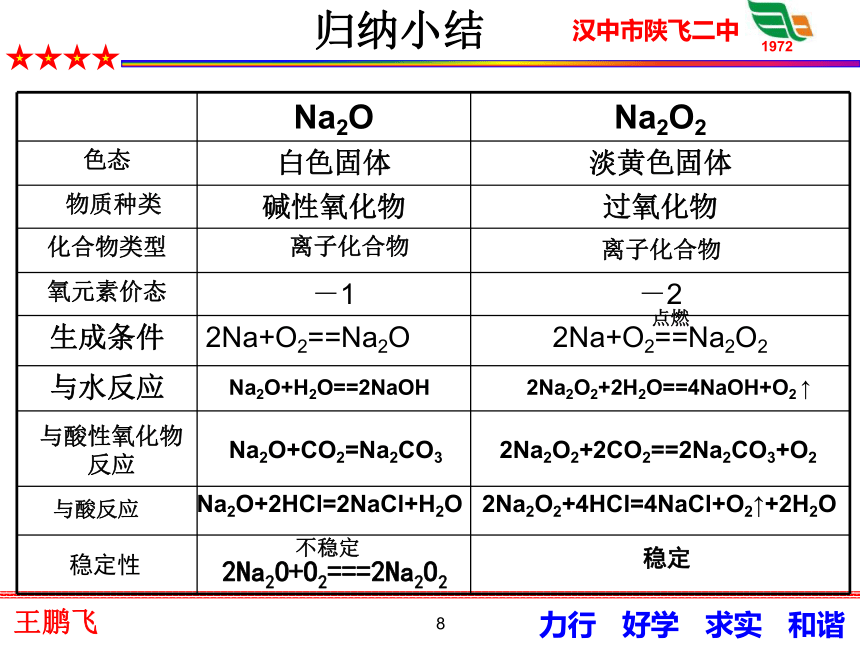
如果金属氧化物所对应的氢氧化物不溶于水,那么该金属氧化物 溶于水。例如,MgO相对应的氢氧化物Mg(OH)2不溶于水,所以MgO 溶于水。5实验3-5 把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液滴入酚酞溶液,有什么现象发生?现象:产生大量气泡;带火星的木条复燃;试管发热;溶液颜色变红。-10-2-22Na2O2 + 2H2O = 4NaOH + O2 ↑2.1 过氧化钠与水的反应:2.过氧化钠的化学性质(模拟)6 Na2O2的用途:在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂。2Na2O2 + 2CO2 = 2Na2CO3 + O2(模拟)写出过氧化钠与盐酸反应的化学方程式:合并得:2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑NaOH + HCl = NaCl + H2O ② Na2O2不是碱性氧化物 2Na2O2 + 2H2O = 4NaOH + O2 ↑ ①2.3过氧化钠与酸的反应:2.2过氧化钠与二氧化碳的反应:7呼吸面具8归纳小结?
点燃Na2O+CO2=Na2CO3Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2 ↑2Na2O2+2CO2==2Na2CO3+O2Na2O+2HCl=2NaCl+H2O2Na2O2+4HCl=4NaCl+O2↑+2H2O与酸反应与酸性氧化物
反应2Na2O+O2===2Na2O2不稳定稳定离子化合物离子化合物稳定性
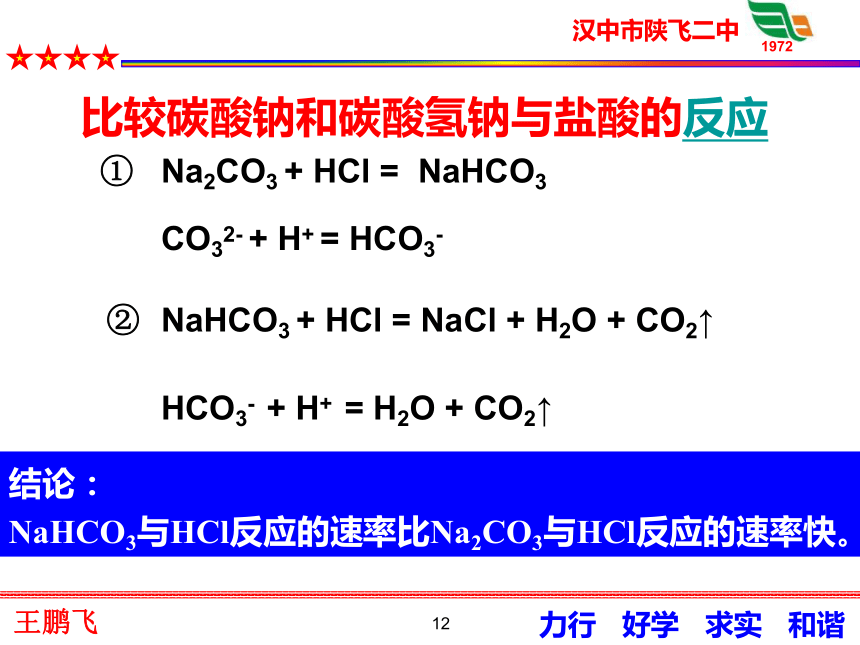
9在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗? 请思考!3、碳酸钠和碳酸氢钠碳酸钠(Na2CO3)俗名叫纯碱,也叫苏打;碳酸氢钠(NaHCO3)俗名叫小苏打。10科学探究3.1 碳酸钠和碳酸氢钠的性质白色粉末,加水结块变成晶体;放热 细小白色粉末,加水部分溶解;感受不到热量变化溶液变红(较深)溶液变微红色加水先变成含结晶水的晶体,溶液碱性比NaHCO3的强 加水部分溶解,溶液碱性比Na2CO3的弱 113.2 Na2CO3和NaHCO3的热稳定性(视频)3.3 Na2CO3和NaHCO3与盐酸的反应Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑澄清的石灰水不变浑浊澄清的石灰水变浑浊────受热不分解 受热易分解CO32- + 2H+ = H2O + CO2↑ 12NaHCO3 + HCl = NaCl + H2O + CO2↑CO32- + H+ = HCO3-HCO3- + H+ = H2O + CO2↑Na2CO3 + HCl = NaHCO3②①结论:
NaHCO3与HCl反应的速率比Na2CO3与HCl反应的速率快。比较碳酸钠和碳酸氢钠与盐酸的反应13结论溶解性: Na2CO3>NaHCO33.3 Na2CO3和NaHCO3的溶解性3.4 Na2CO3和NaHCO3与碱的反应Na2CO3+NaOH 不反应NaHCO3+NaOH=Na2CO3+H2O14小苏打纯碱、苏打白色粉末细小白色晶体易溶溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2O易溶Na2CO3>NaHCO3溶液变红,显碱性不稳定,加热分解Na2CO3不反应2NaHCO3= Na2CO3+H2O+CO2CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3碳酸钠用途非常广泛。虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要。
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁。
1920年,侯德榜先生毅然回国任职。他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。1924年8月,塘沽碱厂正式投产。1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章。产品不但畅销国内,而且远销日本和东南亚。
侯德榜先生经过上千次试验,在1943年研究成功了联合制碱法。这个新工艺是把氨厂和碱厂建在一起,联合生产。由氨厂提供碱厂需要的氨和二氧化碳。母液里的氯化铵用加入食盐的办法使它结晶出来,作为化工产品或化肥。食盐溶液又可以循环使用。为了实现这一设计,在1941一1943年抗日战争的艰苦环境中,在侯德榜的严格指导下,经过了500多次循环试验,分析了2000多个样品后,才把具体工艺流程定下来,这个新工艺使食盐利用率从70%一下子提高到96%,也使原来无用的氯化钙转化成化肥氯化铵,解决了氯化钙占地毁田、污染环境的难题。这方法把世界制碱技术水平推向了一个新高度,赢得了国际化工界的极高评价。1943年,中国化学工程师学会一致同意将这一新的联合制碱法命名为“侯氏联合制碱法”。
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3==Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2 =NH4Cl+NaHCO3↓
②2NaHCO3==Na2CO3+H2O+CO2↑18 碳酸钠粉末吸湿性很强,遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3?xH2O)。碳酸钠晶体在干燥空气中容易失去结晶水而变成碳酸钠粉末。 碳酸钠和碳酸氢钠都是盐,但溶液都呈碱性。日常的食用碱主要是十水碳酸钠,俗称洗涤碱;NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。 小知识19请思考! 大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?20黄色4.焰色反应 很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。黄色 ②钠燃烧时,火焰呈 。 实验3—6 用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。1.铂丝为什么要用盐酸洗涤? 2.为什么要用蓝色钴玻璃观察钾的焰色??21 一些金属及其化合物的焰色反应 黄色紫色砖红色洋红色绿色紫红色黄绿色节日燃放的五彩缤纷的烟花,就是碱金属、以及锶、钡等金属化合物所呈现的各种艳丽的色彩。221. 下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤练习√232.下列说法中不正确的是( )
A、Na2CO3比NaHCO3 易溶于水
B、Na2CO3比NaHCO3稳定
C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D、物质的量相等的Na2CO3和NaHCO3分别与盐酸反应得CO2的物质的量之比为2︰1
3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A、加热这两种固体物质,并将生成的气体通入澄清石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水√√244.有关Na2CO3和NaHCO3的性质,下列叙述错误的是()
A、等质量的Na2CO3和NaHCO3与足量的盐酸反应,在相同的条件下NaHCO3产生的CO2气体体积大
B、同一温度下,与等浓度的盐酸反应时,NaHCO3比 Na2CO3剧烈
C、与同种酸反应生成等量的CO2时,所消耗的酸的量相等
D、将石灰水加入到NaHCO3溶液中将会产生沉淀√25谢谢26在医疗上有一种药叫胃舒平,你知道它的作用吗?你知道它的成分是什么? 铝能与强酸、强碱反应,那么Al2O3能否也溶于强酸和强碱呢? 请思考!二、铝的重要化合物1、氧化铝27 氧化铝难溶于水,熔点很高,也很坚固;是冶炼金属铝的原料,也是一种比较好的耐火材料。物理性质:化学性质1.1 复习盐酸分别与MgO和Al2O3反应的化学方程式。1.2 桌面上有两堆白色粉末,已知它们分别是Al2O3和MgO,你能用什么方法加以鉴别?28 两性氧化物:既可以与酸反应又可以与碱反应生成盐和水的氧化物称为两性氧化物。 结论: Al2O3是一种两性氧化物。Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O2、氢氧化铝29AlCl3 + 3NH 3·H2O = Al(OH)3? + 3NH4Cl 氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。实验3 —71)制备制取氢氧化铝。Al(OH)3吸附色素问题:为什么不选用氢氧化钠来制备氢氧化铝?AlCl3+3NaOH=Al(OH)3+3NaCl30[ 实验3—8 ] 取新制取的氢氧化铝、氢氧化镁分别与2 mol/L 盐酸和氢氧化钠溶液反应。观察现象。2)Al(OH)3 和Mg(OH)2与强酸和强碱的反应Mg(OH)2与强酸反应
Mg(OH)2+2HCl=MgCl2+2H2O与强碱反应
Mg(OH)2+NaOH=\31结论:氢氧化铝既能跟强酸反应生成盐和水,又能跟强碱反应生成盐和水,所以氢氧化铝是两性氢氧化物。 注意:Al(OH)3不能溶于较弱的酸和弱碱两性氢氧化物:既能与酸反应生成盐和水又能与强碱反应生成盐和水的氢氧化物 与强酸反应
Al(OH)3+3HCl=AlCl3+3H2O与强碱反应
Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)332Al(OH)3是医用的胃酸中和剂中的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液酸度降低,起到中和过多胃酸的作用。3)不稳定性:氢氧化铝不稳定,受热易分解。 这是工业上制取纯净氧化铝的方法。3.偏铝酸盐的性质AlO2- + H+ + H2O = Al(OH)3
AlO2- + 4H+(过量) = Al3++2H2O33学与问为什么常用氨水与硫酸铝溶液反应制取氢氧化铝,而不用氢氧化钠溶液呢?答:因为氢氧化铝能溶于过量的氢氧化钠溶液中;另外,使用氨水过量时对产物没有影响。阅读教材:资料卡片——硫酸铝钾明矾晶体
[KAl(SO4)2?12H2O]34有关铝三角的基本图象:1、铝盐溶液和氨水的反应原理:Al3++3NH3· H2O = Al(OH)3 ↓ +3NH4+3352、在一定量AlCl3溶液中逐滴加入NaOH溶液原理:Al3++3OH- = Al(OH)3↓Al(OH)3+OH- = AlO2-+2H2O 34363、向偏铝酸盐溶液中通入CO2原理:CO2 +2AlO2- + 3H2O = 2Al(OH)3 ↓+CO32-1/2374、向一定量NaAlO2溶液中逐滴加入HCl溶液14原理: H+ +AlO2- + H2O = Al(OH)3 ↓Al(OH)3 +3H+ = Al3+ + 3H2O 385、向氯化镁和氯化铝的混合溶液中加足量的氢氧化钠原理:氢氧化钠先与氯化镁和氯化铝反应,生成氢氧化镁和氢氧化铝沉淀,然后氢氧化铝溶解,但氢氧化镁不溶。氢氧化镁氢氧化铝39Al3+Al(OH)33OH-AlO2-OH-3H+H++ H2O4OH-4H+“铝三角”1.怎样以AlCl3溶液为原料制取Al(OH)3?
2.怎样以NaAlO2溶液为原料制取Al(OH)3?思考40小结:铝盐与碱反应的现象及图像先产生沉淀,
后消失先无沉淀,
后产生沉淀产生沉淀不消失41小结:偏铝酸盐与酸反应的现象及图像先产生沉淀,
后消失先无沉淀,
后产生沉淀产生沉淀不消失421、不能用NaOH溶液除去括号中杂质的是( )
Mg(Al2O3) B.MgCl2(AlCl3)
C.Fe(Al) D.Fe2O3(Al2O3)
2、实验室制备Al(OH)3最好用( )
A.Al2O3和稀盐酸 B.Al2O3和水
C.Al2(SO4)3和KOH D.AlCl3和氨水
3、实验室中,要使AlCl3溶液中的Al3+离子全部沉淀
出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2 溶液 C.盐 D.氨水练习√√√433.在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。要使Mg2+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为( )
A.40mL B.72mL C.80mL D.128mL√44AlAl2O3Al(OH)3Al3+AlO2-H+H+OH-OH-CO2NH3OH-OH-H+H+书写以下反应方程式和离子方程式45谢谢46三、铁的重要化合物1、铁的氧化物——铁红磁性氧化铁黑色粉末红棕色粉末黑色晶体+2价+3价+2价、+3价不溶不溶不溶不稳定稳定稳定FeO + 2H+ = Fe2+ + H2OFe2O3 + 6H+ = Fe3+ + 3H2OFe3O4 + 8H+= Fe2+ + 2Fe3++4 H2O高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)472、铁的氢氧化物 白色絮状沉淀 → 灰绿色 → 红褐色沉淀 红褐色沉淀FeCl3+3NaOH ==== Fe(OH)3? +3NaClFeSO4 + 2NaOH =Fe(OH)2? + Na2SO4
4Fe(OH) 2 + O2+2H2O = 4Fe(OH)3?实验3-9:在FeCl3、FeSO4分别加入NaOH溶液 铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得。48学与问Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Fe(OH)3+ 3HCl = FeCl3 + 3H2O Fe(OH)2和Fe(OH)3都是不溶性碱,你能写出它们与酸反应的化学方程式吗?(1)氢氧化铁的性质氢氧化铁是一种难溶于水的红褐色固体49 讨论:通过以上实验,你认为氢氧化亚铁的化学性质与一般的氢氧化物有什么异同?①与酸反应②受热可分解(2)氢氧化亚铁的性质①与酸反应② 不稳定,易被空气中的氧气氧化Fe(OH)2+2HCl=FeCl2+2H2O4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(氧化剂)(还原剂)Fe(OH)3 + 2HCl = FeCl3 + 3H2O?要想能长时间的看到白色的氢氧化亚铁沉淀,你会采取哪些措施?50探究:1、可用两种方法制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,为防止氧化,还需加入 。
(2)除去蒸馏水中的O2常采用 方法。
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这种操作的理由 51方法二:在图2装置中用 NaOH溶液、铁屑、
稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入
试剂,打开止水夹,塞紧塞子后的实验步骤
是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。 ?? 52
试管Ⅰ中反应生成的H2充满了试管Ⅰ
和试管Ⅱ,且外界空气不容易进入稀H2SO4、铁屑NaOH溶液检验试管Ⅱ出口处排出的氢气的纯度。
当排出的H2纯净时,再夹紧止水夹.煮沸避免生成的Fe(OH)2沉淀接触O2 答案533、铁盐和亚铁盐(1)Fe3+离子的检验向FeCl3和FeCl2溶液中分别加入KSCN溶液 溶液呈血红色溶液颜色无变化交流和讨论: 还有哪些方法可以鉴别FeCl3溶液和FeCl2溶液? FeCl2 FeCl354(2)Fe3+离子的氧化性科学探究:在FeCl3溶液中加入足量Fe粉,振荡。再滴入几滴KSCN溶液,观察现象;在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2),再观察现象。2Fe3+ + Fe = 3Fe2+溶液不显血红色溶液变成血红色2Fe2+ + Cl2 = 2Fe3+ +2Clˉ总结:还原剂+氧化剂(Cl2)+还原剂(Fe)氧化剂Fe2+Fe3+Fe55研究课题一 Fe3+转化为Fe2+讨论:
1.常见的还原剂:
Fe (H2S、I-、Cu、Zn等)Fe2+和Fe3+ 的相互转化56探究实验1-1: Fe3+被Fe还原 溶液变成浅绿色Fe+2Fe3+===3Fe2+(1)取几小块铁片于试管(2)向试管中加入1~2ml FeCl3溶液,并加热57探究实验1-2: Fe3+被Cu还原 溶液变成蓝绿色Cu+2Fe3+===2Fe2++Cu2+(1)取几小块铜片于试管(2)向试管中加入1~2ml FeCl3溶液(3)加热58探究实验2: Fe3+被I-还原2Fe3++2I-=2Fe2++I2颜色变深黄色下层溶液呈紫色(1)向FeCl3溶液中加几滴KI溶液(2)向上述溶液中加1~2ml CCl4,振荡59研究课题二 Fe2+转化为Fe3+讨论:
1.常见的氧化剂:
Cl2(Br2、O2、H2O2、HNO3、浓硫酸、KMnO4等)60探究实验3: Fe2+被 KMnO4氧化紫色褪去溶液变红色5Fe2++MnO4-+8H+= 5Fe3++Mn2++4H2OFe3++3SCN-=Fe(SCN)3反应原理操作步骤(1)将FeSO4滴入酸KMnO4溶液中(2)再向上述溶液中滴几滴KSCN注:KMnO4溶液都要用稀硫酸酸化.61探究实验4:Fe2+被 H2O2氧化无明显变化溶液立即变红Fe3++3SCN-=Fe(SCN)32Fe2++H2O2+2H+=2Fe3++2H2O(1)在FeSO4溶液中加几滴KSCN溶液(2)再滴加几滴H2SO4和H2O2注:FeSO4或FeCl3溶液是强酸弱碱盐,显酸性,必有H+存在.62探究实验5:Fe2+被 Br2水氧化无明显变化溶液立即变红Fe3++3SCN-=Fe(SCN)32Fe2++Br2=2Fe3++2Br-(1)在FeSO4溶液中加几滴KSCN溶液(2)再滴加几滴Br2水6FeSO4+3Br2=2Fe2(SO4)3+2FeBr363氧化性
还原性氧化性氧化剂CI2、Br2、O2 、KMnO4、H2O2小结64 直接观色与KSCN色反应
利用显与铜片与淀粉
KI试纸鉴别方法 浅绿色 棕黄色血红色不显红色无明显现象Cu被腐蚀,溶
液变蓝绿色试纸不变蓝利用沉淀反应
与OH-作用白色沉淀迅速变灰
绿色最后呈红褐色立即产生
红褐色沉淀试纸变蓝色65阅读:资料卡片——铜盐图 3-21 出土的古代铜制品上往往覆盖着一层铜绿[主要成分是Cu2(OH)2CO3]66实践活动:铝盐和铁盐的净水作用不加试剂加入明矾加入硫酸铁溶液 2 min时5 min时无明显变化有明显沉降,溶液半透明有明显沉降溶液半透明沉淀沉在底部 溶液接近透明沉淀沉在底部 溶液接近透明 浑浊 , 略有沉降 明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂。结 论目录67练习运用铁及其化合物的知识,完成下列各题。
1、下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是( )
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸
2、既有氧化性,又有还原性的微粒是( )
A. Fe B. Fe2+ C. Fe3+
3、把过量的铁粉加入稀硝酸中,其结果是( )
A. 不反应 B. 生成硝酸铵 C. 生成硝酸亚铁√√√68 4、要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A. 滴入KSCN溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
5、当人体缺铁时,往往需要吃补铁保健品,人体能够吸收的是+2价铁元素。但是+2价铁元素很容易被氧化。查看一种补铁保健品,了解其中铁元素的价态。
①你认为可以采用什么方法检验补铁剂中铁元素的价态?
②天然食品中含有的大多是+3价铁元素,为了使+3价铁元素转化为+2价铁元素并被人体较好地吸收,你认为应该采取哪些措施?请查找资料,寻找办法。√69谢谢70
2、请你写出氧化钠与过氧化钠相互转化的化学方程式。Na2O是白色固体,Na2O2是淡黄色固体。目录氧化钠的化学性质3CaO+H2O=Ca(OH)2CaO+2HCl=CaCl2+H2OCaO+CO2=CaCO3Na2O+H2O=2NaOHNa2O+2HCl=2NaCl+H2ONa2O+CO2=Na2CO3Na2O碱性氧化物:能与酸反应生成盐和水的氧化物.酸性氧化物:能与碱反应生成盐和水的氧化物.4注意一般来说,如果金属氧化物所对应的氢氧化物可溶或微溶于水,那么该金属氧化物就 溶于水。例如,CaO相对应的氢氧化物Ca(OH)2微溶于水,所以CaO 溶于水。
如果金属氧化物所对应的氢氧化物不溶于水,那么该金属氧化物 溶于水。例如,MgO相对应的氢氧化物Mg(OH)2不溶于水,所以MgO 溶于水。5实验3-5 把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液滴入酚酞溶液,有什么现象发生?现象:产生大量气泡;带火星的木条复燃;试管发热;溶液颜色变红。-10-2-22Na2O2 + 2H2O = 4NaOH + O2 ↑2.1 过氧化钠与水的反应:2.过氧化钠的化学性质(模拟)6 Na2O2的用途:在呼吸面具、潜艇紧急情况时作供氧剂,作秸杆、织物的漂白剂。2Na2O2 + 2CO2 = 2Na2CO3 + O2(模拟)写出过氧化钠与盐酸反应的化学方程式:合并得:2Na2O2 + 4HCl = 4NaCl + 2H2O + O2 ↑NaOH + HCl = NaCl + H2O ② Na2O2不是碱性氧化物 2Na2O2 + 2H2O = 4NaOH + O2 ↑ ①2.3过氧化钠与酸的反应:2.2过氧化钠与二氧化碳的反应:7呼吸面具8归纳小结?
点燃Na2O+CO2=Na2CO3Na2O+H2O==2NaOH2Na2O2+2H2O==4NaOH+O2 ↑2Na2O2+2CO2==2Na2CO3+O2Na2O+2HCl=2NaCl+H2O2Na2O2+4HCl=4NaCl+O2↑+2H2O与酸反应与酸性氧化物
反应2Na2O+O2===2Na2O2不稳定稳定离子化合物离子化合物稳定性
9在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗? 请思考!3、碳酸钠和碳酸氢钠碳酸钠(Na2CO3)俗名叫纯碱,也叫苏打;碳酸氢钠(NaHCO3)俗名叫小苏打。10科学探究3.1 碳酸钠和碳酸氢钠的性质白色粉末,加水结块变成晶体;放热 细小白色粉末,加水部分溶解;感受不到热量变化溶液变红(较深)溶液变微红色加水先变成含结晶水的晶体,溶液碱性比NaHCO3的强 加水部分溶解,溶液碱性比Na2CO3的弱 113.2 Na2CO3和NaHCO3的热稳定性(视频)3.3 Na2CO3和NaHCO3与盐酸的反应Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑澄清的石灰水不变浑浊澄清的石灰水变浑浊────受热不分解 受热易分解CO32- + 2H+ = H2O + CO2↑ 12NaHCO3 + HCl = NaCl + H2O + CO2↑CO32- + H+ = HCO3-HCO3- + H+ = H2O + CO2↑Na2CO3 + HCl = NaHCO3②①结论:
NaHCO3与HCl反应的速率比Na2CO3与HCl反应的速率快。比较碳酸钠和碳酸氢钠与盐酸的反应13结论溶解性: Na2CO3>NaHCO33.3 Na2CO3和NaHCO3的溶解性3.4 Na2CO3和NaHCO3与碱的反应Na2CO3+NaOH 不反应NaHCO3+NaOH=Na2CO3+H2O14小苏打纯碱、苏打白色粉末细小白色晶体易溶溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2O易溶Na2CO3>NaHCO3溶液变红,显碱性不稳定,加热分解Na2CO3不反应2NaHCO3= Na2CO3+H2O+CO2CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁。
1920年,侯德榜先生毅然回国任职。他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。1924年8月,塘沽碱厂正式投产。1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章。产品不但畅销国内,而且远销日本和东南亚。
侯德榜先生经过上千次试验,在1943年研究成功了联合制碱法。这个新工艺是把氨厂和碱厂建在一起,联合生产。由氨厂提供碱厂需要的氨和二氧化碳。母液里的氯化铵用加入食盐的办法使它结晶出来,作为化工产品或化肥。食盐溶液又可以循环使用。为了实现这一设计,在1941一1943年抗日战争的艰苦环境中,在侯德榜的严格指导下,经过了500多次循环试验,分析了2000多个样品后,才把具体工艺流程定下来,这个新工艺使食盐利用率从70%一下子提高到96%,也使原来无用的氯化钙转化成化肥氯化铵,解决了氯化钙占地毁田、污染环境的难题。这方法把世界制碱技术水平推向了一个新高度,赢得了国际化工界的极高评价。1943年,中国化学工程师学会一致同意将这一新的联合制碱法命名为“侯氏联合制碱法”。
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3==Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2 =NH4Cl+NaHCO3↓
②2NaHCO3==Na2CO3+H2O+CO2↑18 碳酸钠粉末吸湿性很强,遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3?xH2O)。碳酸钠晶体在干燥空气中容易失去结晶水而变成碳酸钠粉末。 碳酸钠和碳酸氢钠都是盐,但溶液都呈碱性。日常的食用碱主要是十水碳酸钠,俗称洗涤碱;NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。 小知识19请思考! 大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?20黄色4.焰色反应 很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。黄色 ②钠燃烧时,火焰呈 。 实验3—6 用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧。1.铂丝为什么要用盐酸洗涤? 2.为什么要用蓝色钴玻璃观察钾的焰色??21 一些金属及其化合物的焰色反应 黄色紫色砖红色洋红色绿色紫红色黄绿色节日燃放的五彩缤纷的烟花,就是碱金属、以及锶、钡等金属化合物所呈现的各种艳丽的色彩。221. 下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要作氧化剂,Na2O2主要作还原剂
④Na2O2可作供氧剂,而Na2O不行
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A、都正确 B、②③④⑤ C、②③⑤ D、④⑤练习√232.下列说法中不正确的是( )
A、Na2CO3比NaHCO3 易溶于水
B、Na2CO3比NaHCO3稳定
C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D、物质的量相等的Na2CO3和NaHCO3分别与盐酸反应得CO2的物质的量之比为2︰1
3.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A、加热这两种固体物质,并将生成的气体通入澄清石灰水中
B、在这两种物质的溶液中加入CaCl2溶液
C、在这两种固体中加入同浓度的稀盐酸
D、在这两种物质的溶液中加入少量澄清的石灰水√√244.有关Na2CO3和NaHCO3的性质,下列叙述错误的是()
A、等质量的Na2CO3和NaHCO3与足量的盐酸反应,在相同的条件下NaHCO3产生的CO2气体体积大
B、同一温度下,与等浓度的盐酸反应时,NaHCO3比 Na2CO3剧烈
C、与同种酸反应生成等量的CO2时,所消耗的酸的量相等
D、将石灰水加入到NaHCO3溶液中将会产生沉淀√25谢谢26在医疗上有一种药叫胃舒平,你知道它的作用吗?你知道它的成分是什么? 铝能与强酸、强碱反应,那么Al2O3能否也溶于强酸和强碱呢? 请思考!二、铝的重要化合物1、氧化铝27 氧化铝难溶于水,熔点很高,也很坚固;是冶炼金属铝的原料,也是一种比较好的耐火材料。物理性质:化学性质1.1 复习盐酸分别与MgO和Al2O3反应的化学方程式。1.2 桌面上有两堆白色粉末,已知它们分别是Al2O3和MgO,你能用什么方法加以鉴别?28 两性氧化物:既可以与酸反应又可以与碱反应生成盐和水的氧化物称为两性氧化物。 结论: Al2O3是一种两性氧化物。Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O2、氢氧化铝29AlCl3 + 3NH 3·H2O = Al(OH)3? + 3NH4Cl 氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。实验3 —71)制备制取氢氧化铝。Al(OH)3吸附色素问题:为什么不选用氢氧化钠来制备氢氧化铝?AlCl3+3NaOH=Al(OH)3+3NaCl30[ 实验3—8 ] 取新制取的氢氧化铝、氢氧化镁分别与2 mol/L 盐酸和氢氧化钠溶液反应。观察现象。2)Al(OH)3 和Mg(OH)2与强酸和强碱的反应Mg(OH)2与强酸反应
Mg(OH)2+2HCl=MgCl2+2H2O与强碱反应
Mg(OH)2+NaOH=\31结论:氢氧化铝既能跟强酸反应生成盐和水,又能跟强碱反应生成盐和水,所以氢氧化铝是两性氢氧化物。 注意:Al(OH)3不能溶于较弱的酸和弱碱两性氢氧化物:既能与酸反应生成盐和水又能与强碱反应生成盐和水的氢氧化物 与强酸反应
Al(OH)3+3HCl=AlCl3+3H2O与强碱反应
Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)332Al(OH)3是医用的胃酸中和剂中的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液酸度降低,起到中和过多胃酸的作用。3)不稳定性:氢氧化铝不稳定,受热易分解。 这是工业上制取纯净氧化铝的方法。3.偏铝酸盐的性质AlO2- + H+ + H2O = Al(OH)3
AlO2- + 4H+(过量) = Al3++2H2O33学与问为什么常用氨水与硫酸铝溶液反应制取氢氧化铝,而不用氢氧化钠溶液呢?答:因为氢氧化铝能溶于过量的氢氧化钠溶液中;另外,使用氨水过量时对产物没有影响。阅读教材:资料卡片——硫酸铝钾明矾晶体
[KAl(SO4)2?12H2O]34有关铝三角的基本图象:1、铝盐溶液和氨水的反应原理:Al3++3NH3· H2O = Al(OH)3 ↓ +3NH4+3352、在一定量AlCl3溶液中逐滴加入NaOH溶液原理:Al3++3OH- = Al(OH)3↓Al(OH)3+OH- = AlO2-+2H2O 34363、向偏铝酸盐溶液中通入CO2原理:CO2 +2AlO2- + 3H2O = 2Al(OH)3 ↓+CO32-1/2374、向一定量NaAlO2溶液中逐滴加入HCl溶液14原理: H+ +AlO2- + H2O = Al(OH)3 ↓Al(OH)3 +3H+ = Al3+ + 3H2O 385、向氯化镁和氯化铝的混合溶液中加足量的氢氧化钠原理:氢氧化钠先与氯化镁和氯化铝反应,生成氢氧化镁和氢氧化铝沉淀,然后氢氧化铝溶解,但氢氧化镁不溶。氢氧化镁氢氧化铝39Al3+Al(OH)33OH-AlO2-OH-3H+H++ H2O4OH-4H+“铝三角”1.怎样以AlCl3溶液为原料制取Al(OH)3?
2.怎样以NaAlO2溶液为原料制取Al(OH)3?思考40小结:铝盐与碱反应的现象及图像先产生沉淀,
后消失先无沉淀,
后产生沉淀产生沉淀不消失41小结:偏铝酸盐与酸反应的现象及图像先产生沉淀,
后消失先无沉淀,
后产生沉淀产生沉淀不消失421、不能用NaOH溶液除去括号中杂质的是( )
Mg(Al2O3) B.MgCl2(AlCl3)
C.Fe(Al) D.Fe2O3(Al2O3)
2、实验室制备Al(OH)3最好用( )
A.Al2O3和稀盐酸 B.Al2O3和水
C.Al2(SO4)3和KOH D.AlCl3和氨水
3、实验室中,要使AlCl3溶液中的Al3+离子全部沉淀
出来,适宜用的试剂是( )
A.NaOH溶液 B.Ba(OH)2 溶液 C.盐 D.氨水练习√√√433.在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。要使Mg2+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为( )
A.40mL B.72mL C.80mL D.128mL√44AlAl2O3Al(OH)3Al3+AlO2-H+H+OH-OH-CO2NH3OH-OH-H+H+书写以下反应方程式和离子方程式45谢谢46三、铁的重要化合物1、铁的氧化物——铁红磁性氧化铁黑色粉末红棕色粉末黑色晶体+2价+3价+2价、+3价不溶不溶不溶不稳定稳定稳定FeO + 2H+ = Fe2+ + H2OFe2O3 + 6H+ = Fe3+ + 3H2OFe3O4 + 8H+= Fe2+ + 2Fe3++4 H2O高温时,都能与C、CO、H2反应,被还原生成Fe(炼铁原理)472、铁的氢氧化物 白色絮状沉淀 → 灰绿色 → 红褐色沉淀 红褐色沉淀FeCl3+3NaOH ==== Fe(OH)3? +3NaClFeSO4 + 2NaOH =Fe(OH)2? + Na2SO4
4Fe(OH) 2 + O2+2H2O = 4Fe(OH)3?实验3-9:在FeCl3、FeSO4分别加入NaOH溶液 铁的两种氢氧化物可以分别由相对应的可溶性盐和碱溶液反应制得。48学与问Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Fe(OH)3+ 3HCl = FeCl3 + 3H2O Fe(OH)2和Fe(OH)3都是不溶性碱,你能写出它们与酸反应的化学方程式吗?(1)氢氧化铁的性质氢氧化铁是一种难溶于水的红褐色固体49 讨论:通过以上实验,你认为氢氧化亚铁的化学性质与一般的氢氧化物有什么异同?①与酸反应②受热可分解(2)氢氧化亚铁的性质①与酸反应② 不稳定,易被空气中的氧气氧化Fe(OH)2+2HCl=FeCl2+2H2O4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(氧化剂)(还原剂)Fe(OH)3 + 2HCl = FeCl3 + 3H2O?要想能长时间的看到白色的氢氧化亚铁沉淀,你会采取哪些措施?50探究:1、可用两种方法制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时,为防止氧化,还需加入 。
(2)除去蒸馏水中的O2常采用 方法。
(3)用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这种操作的理由 51方法二:在图2装置中用 NaOH溶液、铁屑、
稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入
试剂,打开止水夹,塞紧塞子后的实验步骤
是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。 ?? 52
试管Ⅰ中反应生成的H2充满了试管Ⅰ
和试管Ⅱ,且外界空气不容易进入稀H2SO4、铁屑NaOH溶液检验试管Ⅱ出口处排出的氢气的纯度。
当排出的H2纯净时,再夹紧止水夹.煮沸避免生成的Fe(OH)2沉淀接触O2 答案533、铁盐和亚铁盐(1)Fe3+离子的检验向FeCl3和FeCl2溶液中分别加入KSCN溶液 溶液呈血红色溶液颜色无变化交流和讨论: 还有哪些方法可以鉴别FeCl3溶液和FeCl2溶液? FeCl2 FeCl354(2)Fe3+离子的氧化性科学探究:在FeCl3溶液中加入足量Fe粉,振荡。再滴入几滴KSCN溶液,观察现象;在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2),再观察现象。2Fe3+ + Fe = 3Fe2+溶液不显血红色溶液变成血红色2Fe2+ + Cl2 = 2Fe3+ +2Clˉ总结:还原剂+氧化剂(Cl2)+还原剂(Fe)氧化剂Fe2+Fe3+Fe55研究课题一 Fe3+转化为Fe2+讨论:
1.常见的还原剂:
Fe (H2S、I-、Cu、Zn等)Fe2+和Fe3+ 的相互转化56探究实验1-1: Fe3+被Fe还原 溶液变成浅绿色Fe+2Fe3+===3Fe2+(1)取几小块铁片于试管(2)向试管中加入1~2ml FeCl3溶液,并加热57探究实验1-2: Fe3+被Cu还原 溶液变成蓝绿色Cu+2Fe3+===2Fe2++Cu2+(1)取几小块铜片于试管(2)向试管中加入1~2ml FeCl3溶液(3)加热58探究实验2: Fe3+被I-还原2Fe3++2I-=2Fe2++I2颜色变深黄色下层溶液呈紫色(1)向FeCl3溶液中加几滴KI溶液(2)向上述溶液中加1~2ml CCl4,振荡59研究课题二 Fe2+转化为Fe3+讨论:
1.常见的氧化剂:
Cl2(Br2、O2、H2O2、HNO3、浓硫酸、KMnO4等)60探究实验3: Fe2+被 KMnO4氧化紫色褪去溶液变红色5Fe2++MnO4-+8H+= 5Fe3++Mn2++4H2OFe3++3SCN-=Fe(SCN)3反应原理操作步骤(1)将FeSO4滴入酸KMnO4溶液中(2)再向上述溶液中滴几滴KSCN注:KMnO4溶液都要用稀硫酸酸化.61探究实验4:Fe2+被 H2O2氧化无明显变化溶液立即变红Fe3++3SCN-=Fe(SCN)32Fe2++H2O2+2H+=2Fe3++2H2O(1)在FeSO4溶液中加几滴KSCN溶液(2)再滴加几滴H2SO4和H2O2注:FeSO4或FeCl3溶液是强酸弱碱盐,显酸性,必有H+存在.62探究实验5:Fe2+被 Br2水氧化无明显变化溶液立即变红Fe3++3SCN-=Fe(SCN)32Fe2++Br2=2Fe3++2Br-(1)在FeSO4溶液中加几滴KSCN溶液(2)再滴加几滴Br2水6FeSO4+3Br2=2Fe2(SO4)3+2FeBr363氧化性
还原性氧化性氧化剂CI2、Br2、O2 、KMnO4、H2O2小结64 直接观色与KSCN色反应
利用显与铜片与淀粉
KI试纸鉴别方法 浅绿色 棕黄色血红色不显红色无明显现象Cu被腐蚀,溶
液变蓝绿色试纸不变蓝利用沉淀反应
与OH-作用白色沉淀迅速变灰
绿色最后呈红褐色立即产生
红褐色沉淀试纸变蓝色65阅读:资料卡片——铜盐图 3-21 出土的古代铜制品上往往覆盖着一层铜绿[主要成分是Cu2(OH)2CO3]66实践活动:铝盐和铁盐的净水作用不加试剂加入明矾加入硫酸铁溶液 2 min时5 min时无明显变化有明显沉降,溶液半透明有明显沉降溶液半透明沉淀沉在底部 溶液接近透明沉淀沉在底部 溶液接近透明 浑浊 , 略有沉降 明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂。结 论目录67练习运用铁及其化合物的知识,完成下列各题。
1、下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是( )
A. 盐酸 B. 氯气 C. CuSO4溶液 D. 稀硫酸
2、既有氧化性,又有还原性的微粒是( )
A. Fe B. Fe2+ C. Fe3+
3、把过量的铁粉加入稀硝酸中,其结果是( )
A. 不反应 B. 生成硝酸铵 C. 生成硝酸亚铁√√√68 4、要除去FeCl2溶液中的少量FeCl3,可行的办法是( )
A. 滴入KSCN溶液 B. 通入氯气
C. 加入铜粉 D. 加入铁粉
5、当人体缺铁时,往往需要吃补铁保健品,人体能够吸收的是+2价铁元素。但是+2价铁元素很容易被氧化。查看一种补铁保健品,了解其中铁元素的价态。
①你认为可以采用什么方法检验补铁剂中铁元素的价态?
②天然食品中含有的大多是+3价铁元素,为了使+3价铁元素转化为+2价铁元素并被人体较好地吸收,你认为应该采取哪些措施?请查找资料,寻找办法。√69谢谢70
