2021~2022学年九年级化学第10章金属检测题(Word版有答案)
文档属性
| 名称 | 2021~2022学年九年级化学第10章金属检测题(Word版有答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 158.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 00:00:00 | ||
图片预览



文档简介
第10章《金属》检测题
一、单选题
1.取等质量的甲、乙、丙三种金属(在化合物中均为+2价)加入足量的稀盐酸中,充分反应后,测得生成H2质量和反应时间关系如图所示,则下列说法错误的是
A.生成H2的质量甲>乙>丙B.金属活动性乙>甲>丙
C.反应速度乙>甲>丙D.相对原子质量甲>乙>丙
2.下列图像不能正确表示对应叙述的是
A.高温煅烧石灰石B.锌和硝酸亚铁溶液反应C.高温一氧化碳还原氧化铁D.碳酸钙和稀盐酸
3.置换反应指的是
A.一种单质和一种化合物作用生成另一种单质和另一种化合物的反应
B.有单质和化合物生成的反应
C.有金属和非金属生成的反应
D.有单质和化合物参加的反应
4.将相同体积,相同溶质质量分数的稀硫酸,分别加入到等质量颗粒大小相同的X、Y、Z三种较活泼金属(金属完全反应),生成H2的质量与反应时间的关系如图;下列说法正确的是
A.消耗稀盐酸的质量顺序为 Z>Y>X
B.产生H2的速率顺序为X>Y>Z
C.3种金属的活动性顺序为Y>X>Z
D.相对原子质量由大到小顺序X>Y>Z
5.下列关于实验现象的描述中,正确的是
A.天然气在空气中燃烧产生蓝色火焰,生成二氧化碳和水
B.二氧化碳气体通入紫色石蕊试液,溶液变成蓝色
C.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
D.铁钉插入硫酸铜溶液中,铁钉表面有红色物质析出,溶液由蓝色变为无色
6.下列物质分类正确的是
A.液氮、干冰、水都是氧化物B.空气、石灰水、生铁都是混合物
C.海波、冰、沥青都是晶体D.金刚石、黄铜、钢都是合金
7.“铝热反应”是网络上流行的十大令人惊异化学反应之一,它的重要应用之一是用于焊接铁轨。其实验原理如下:2Al+Fe2O32Fe+Al2O3,该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.下列化学方程式书写完全正确的是
A. B.
C. D.
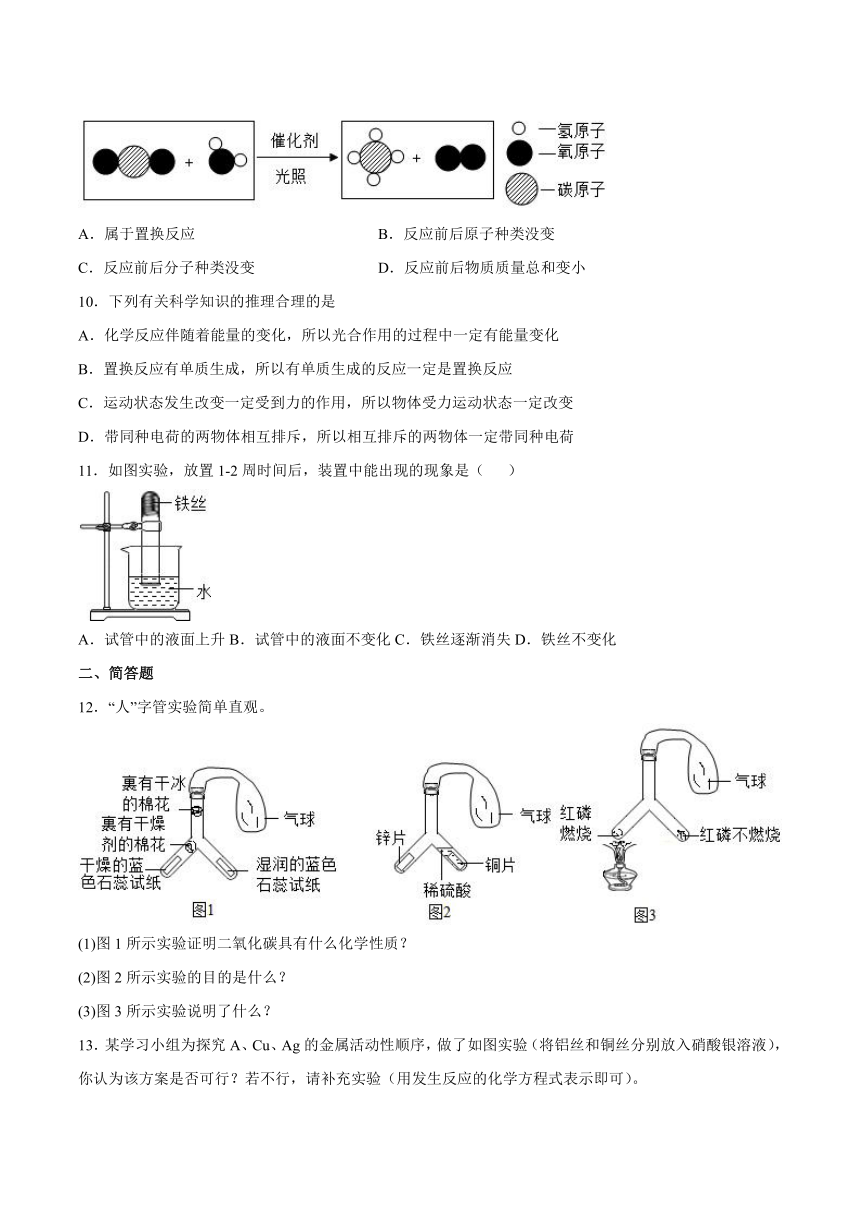
9.2020年科学家开发出新型催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如图,下列关于该反应的说法正确的是
A.属于置换反应 B.反应前后原子种类没变
C.反应前后分子种类没变 D.反应前后物质质量总和变小
10.下列有关科学知识的推理合理的是
A.化学反应伴随着能量的变化,所以光合作用的过程中一定有能量变化
B.置换反应有单质生成,所以有单质生成的反应一定是置换反应
C.运动状态发生改变一定受到力的作用,所以物体受力运动状态一定改变
D.带同种电荷的两物体相互排斥,所以相互排斥的两物体一定带同种电荷
11.如图实验,放置1-2周时间后,装置中能出现的现象是( )
A.试管中的液面上升B.试管中的液面不变化C.铁丝逐渐消失D.铁丝不变化
二、简答题
12.“人”字管实验简单直观。
(1)图1所示实验证明二氧化碳具有什么化学性质?
(2)图2所示实验的目的是什么?
(3)图3所示实验说明了什么?
13.某学习小组为探究A、Cu、Ag的金属活动性顺序,做了如图实验(将铝丝和铜丝分别放入硝酸银溶液),你认为该方案是否可行?若不行,请补充实验(用发生反应的化学方程式表示即可)。
三、推断题
14.有A、B、C、D、E、F、N、M八种物质,其中A为一种应用最广泛的金属,B由三种元素组成,C、D为单质且C为红色金属,D为黑色固体。它们之间有如下转化关系:①A + MB + C;②A + NB + H2↑;③A +O2F;④D + FA + CO2↑;⑤D+CO2E;⑥E + FA + CO2↑。请回答下列问题
(1)E的用途__________;M为蓝色溶液,则其中含有的金属阳离子是_______(填化学符号)。
(2)用化学方程式表示下列转化,并填空:
①A + MB + C _________;
②A + NB + H2↑ __________,观察到的现象是__________。
③D + FA + CO2↑_________,其反应的基本类型是_________。
15.有A、B、C、D四种常见物质,它们的关系如图所示图中“一”表示相连的物质两两之间可发生反应,“→”表示由某一物质可转化为另一物质。已知:A能供给呼吸,D是当今年产量最高的金属单质。
(1)请写出A的化学式:_____。
(2)若B是一种非金属单质,则B可能是_____。
(3)若C是一种化合物,则C→D的化学方程式为_____。
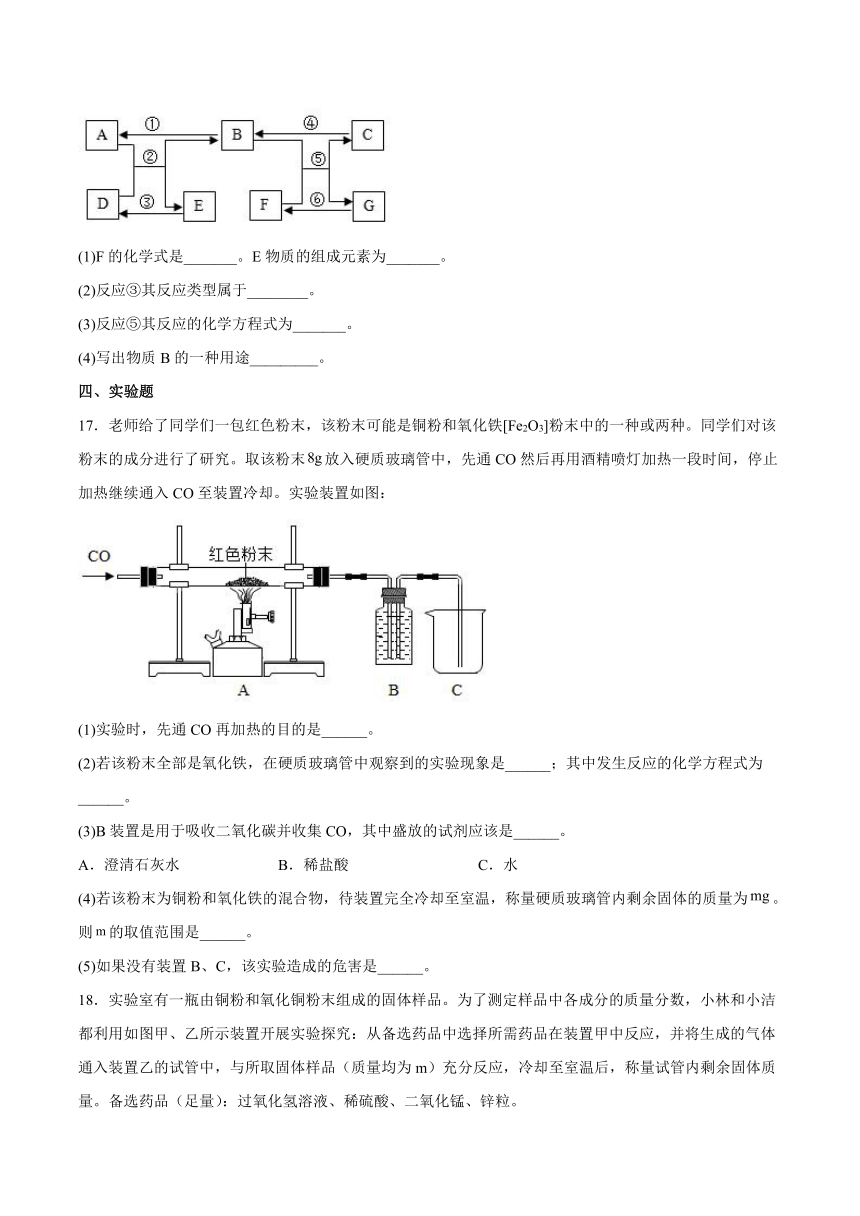
16.A~G是初中化学常见物质,其转化关系如图所示(部分反应物、生成物、反应条件已略去)。已知A是一种有毒气体,自然界中富含C的矿物可用作建筑材料,D、E含有同一种金属元素,且E物质的组成元素在地壳中的含量约占4.75%,位居第四。请回答下列问题:
(1)F的化学式是_______。E物质的组成元素为_______。
(2)反应③其反应类型属于________。
(3)反应⑤其反应的化学方程式为_______。
(4)写出物质B的一种用途_________。
四、实验题
17.老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁[Fe2O3]粉末中的一种或两种。同学们对该粉末的成分进行了研究。取该粉末放入硬质玻璃管中,先通CO然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
(1)实验时,先通CO再加热的目的是______。
(2)若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是______;其中发生反应的化学方程式为______。
(3)B装置是用于吸收二氧化碳并收集CO,其中盛放的试剂应该是______。
A.澄清石灰水 B.稀盐酸 C.水
(4)若该粉末为铜粉和氧化铁的混合物,待装置完全冷却至室温,称量硬质玻璃管内剩余固体的质量为。则的取值范围是______。
(5)如果没有装置B、C,该实验造成的危害是______。
18.实验室有一瓶由铜粉和氧化铜粉末组成的固体样品。为了测定样品中各成分的质量分数,小林和小洁都利用如图甲、乙所示装置开展实验探究:从备选药品中选择所需药品在装置甲中反应,并将生成的气体通入装置乙的试管中,与所取固体样品(质量均为m)充分反应,冷却至室温后,称量试管内剩余固体质量。备选药品(足量):过氧化氢溶液、稀硫酸、二氧化锰、锌粒。
相关实验数据如表所示。
反应前固体样品质量 反应后剩余固体质量
小林实验数据 m m+n
小洁实验数据 m m﹣n
请回答下列问题:
(1)装置甲中作为反应容器的玻璃仪器的名称是______,小林所选药品在装置甲中发生反应的化学方程式为______。
(2)小林所测样品中铜粉的质量分数为______(用含m、n的式子表示,下同),小洁所测样品中铜粉的质量分数为______。
(3)关于小林、小洁实验的下列说法正确的是______(填序号)。
a.小洁实验时,必须先通入甲中生成的气体一段时间后再点燃酒精灯
b.小洁实验中,若在熄灭酒精灯后立即停止通入气体,会导致铜粉的质量分数测定值偏大
c.小林实验中,若固体样品未完全反应,会导致铜粉的质量分数测定值偏小
d.所测固体样品中铜粉和氧化铜的质量比为4:5
19.比较Ag、Pd、Zn、Mn、Cu五种金属的活动性顺序。
(1)根据常见金属的活动性顺序表可知其中Ag、Zn、Cu金属的活动性由强至弱的顺序为______(填元素名称);
(2)通过实验确定Pd、Mn的活动性:
步骤一:通过金属与稀盐酸作用初步判断Pd、Mn的活动性
实验操作 实验现象 实验结论或化学方程式
将Mn片、Pd片分别放入稀盐酸中 ______ 活动性:Mn>H>Pd
步骤二:通过金属与可溶性化合物溶液作用比较Ag、Pd、Cu的活动性
实验操作 实验现象 化学方程式和实验结论
将Cu片浸入氯化钯(PdCl2)溶液中 铜丝表面覆盖一层银白色固体 化学方程式:______
将Ag片浸入PdCl2溶液中 无明显现象 实验结论:______
结论 Pd、Cu、Ag金属活动性由强至弱:______
(3)若要确切的得出五种金属的活动性顺序,还应补充的一个实验是______。
五、计算题
20.目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。工业上通常利用 冶炼金属铁。现有含氧化铁80%的赤铁矿400t,请计算:
(1)这些赤铁矿中含氧化铁______t。
(2)理论上利用这些赤铁矿可以炼成含铁96%的生铁多少吨?(写出计算过程,计算结果精确到小数点后一位)
21.我国早在南北朝时期就开始冶炼黄铜,黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取15.0g黄铜样品粉碎后置于烧杯中,慢慢加入稀硫酸使其充分反应,直至不再产生气泡为止,此时共用去49.5g稀硫酸,烧杯中剩余物质的质量为64.3g。试分析并计算:
(1)反应生成气体的质量为___g。
(2)黄铜样品中铜的质量分数(结果精确到0.1%)。
参考答案:
1.D 2.D 3.A 4.C 5.C 6.B 7.C 8.C 9.B 10.A 11.A
12.(1)二氧化碳可以与水反应
(2)判断两种金属的活动性
(3)燃烧的条件之一是温度达到着火点
13.不行;
14.(1) 在冶金工业中作还原剂或做气体燃料 Cu2+
(2) Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑ 有气泡产生,溶液由无色变浅绿色
置换反应
15.(1)O2
(2)碳##C
(3)
16.(1) Ca(OH)2 Fe
(2)化合反应
(3)
(4)灭火(或人工降雨等合理即可)
17.(1)防止加热时爆炸
(2) 红色粉末逐渐变成黑色
(3)A
(4)5.6<m<8
(5)未反应的一氧化碳直接排放到空气中,污染环境
18.(1) 锥形瓶
(2)
(3)abcd
19.(1)锌、铜、银
(2) Mn片上有气泡产生、Pd片上无明显变化 Cu+PdCl2=Pd+CuCl2 Pd比Ag活泼 Cu Pd Ag
(3)锰片插入硫酸锌溶液(或锰片插入氯化锌溶液等)
20.(1)320
(2)233.3t
解:炼成生铁质量为x,根据质量守恒铁元素质量不变,,x
答:生铁质量约为233.3t。
21.(1)0.2
(2)解:设黄铜样品中锌的质量为x
x=6.5g
黄铜样品中铜的质量分数为:
答:黄铜样品中铜的质量分数为56.7%
一、单选题
1.取等质量的甲、乙、丙三种金属(在化合物中均为+2价)加入足量的稀盐酸中,充分反应后,测得生成H2质量和反应时间关系如图所示,则下列说法错误的是
A.生成H2的质量甲>乙>丙B.金属活动性乙>甲>丙
C.反应速度乙>甲>丙D.相对原子质量甲>乙>丙
2.下列图像不能正确表示对应叙述的是
A.高温煅烧石灰石B.锌和硝酸亚铁溶液反应C.高温一氧化碳还原氧化铁D.碳酸钙和稀盐酸
3.置换反应指的是
A.一种单质和一种化合物作用生成另一种单质和另一种化合物的反应
B.有单质和化合物生成的反应
C.有金属和非金属生成的反应
D.有单质和化合物参加的反应
4.将相同体积,相同溶质质量分数的稀硫酸,分别加入到等质量颗粒大小相同的X、Y、Z三种较活泼金属(金属完全反应),生成H2的质量与反应时间的关系如图;下列说法正确的是
A.消耗稀盐酸的质量顺序为 Z>Y>X
B.产生H2的速率顺序为X>Y>Z
C.3种金属的活动性顺序为Y>X>Z
D.相对原子质量由大到小顺序X>Y>Z
5.下列关于实验现象的描述中,正确的是
A.天然气在空气中燃烧产生蓝色火焰,生成二氧化碳和水
B.二氧化碳气体通入紫色石蕊试液,溶液变成蓝色
C.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体
D.铁钉插入硫酸铜溶液中,铁钉表面有红色物质析出,溶液由蓝色变为无色
6.下列物质分类正确的是
A.液氮、干冰、水都是氧化物B.空气、石灰水、生铁都是混合物
C.海波、冰、沥青都是晶体D.金刚石、黄铜、钢都是合金
7.“铝热反应”是网络上流行的十大令人惊异化学反应之一,它的重要应用之一是用于焊接铁轨。其实验原理如下:2Al+Fe2O32Fe+Al2O3,该反应属于
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.下列化学方程式书写完全正确的是
A. B.
C. D.
9.2020年科学家开发出新型催化剂,光照下能将二氧化碳转化为甲烷,微观示意图如图,下列关于该反应的说法正确的是
A.属于置换反应 B.反应前后原子种类没变
C.反应前后分子种类没变 D.反应前后物质质量总和变小
10.下列有关科学知识的推理合理的是
A.化学反应伴随着能量的变化,所以光合作用的过程中一定有能量变化
B.置换反应有单质生成,所以有单质生成的反应一定是置换反应
C.运动状态发生改变一定受到力的作用,所以物体受力运动状态一定改变
D.带同种电荷的两物体相互排斥,所以相互排斥的两物体一定带同种电荷
11.如图实验,放置1-2周时间后,装置中能出现的现象是( )
A.试管中的液面上升B.试管中的液面不变化C.铁丝逐渐消失D.铁丝不变化
二、简答题
12.“人”字管实验简单直观。
(1)图1所示实验证明二氧化碳具有什么化学性质?
(2)图2所示实验的目的是什么?
(3)图3所示实验说明了什么?
13.某学习小组为探究A、Cu、Ag的金属活动性顺序,做了如图实验(将铝丝和铜丝分别放入硝酸银溶液),你认为该方案是否可行?若不行,请补充实验(用发生反应的化学方程式表示即可)。
三、推断题
14.有A、B、C、D、E、F、N、M八种物质,其中A为一种应用最广泛的金属,B由三种元素组成,C、D为单质且C为红色金属,D为黑色固体。它们之间有如下转化关系:①A + MB + C;②A + NB + H2↑;③A +O2F;④D + FA + CO2↑;⑤D+CO2E;⑥E + FA + CO2↑。请回答下列问题
(1)E的用途__________;M为蓝色溶液,则其中含有的金属阳离子是_______(填化学符号)。
(2)用化学方程式表示下列转化,并填空:
①A + MB + C _________;
②A + NB + H2↑ __________,观察到的现象是__________。
③D + FA + CO2↑_________,其反应的基本类型是_________。
15.有A、B、C、D四种常见物质,它们的关系如图所示图中“一”表示相连的物质两两之间可发生反应,“→”表示由某一物质可转化为另一物质。已知:A能供给呼吸,D是当今年产量最高的金属单质。
(1)请写出A的化学式:_____。
(2)若B是一种非金属单质,则B可能是_____。
(3)若C是一种化合物,则C→D的化学方程式为_____。
16.A~G是初中化学常见物质,其转化关系如图所示(部分反应物、生成物、反应条件已略去)。已知A是一种有毒气体,自然界中富含C的矿物可用作建筑材料,D、E含有同一种金属元素,且E物质的组成元素在地壳中的含量约占4.75%,位居第四。请回答下列问题:
(1)F的化学式是_______。E物质的组成元素为_______。
(2)反应③其反应类型属于________。
(3)反应⑤其反应的化学方程式为_______。
(4)写出物质B的一种用途_________。
四、实验题
17.老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁[Fe2O3]粉末中的一种或两种。同学们对该粉末的成分进行了研究。取该粉末放入硬质玻璃管中,先通CO然后再用酒精喷灯加热一段时间,停止加热继续通入CO至装置冷却。实验装置如图:
(1)实验时,先通CO再加热的目的是______。
(2)若该粉末全部是氧化铁,在硬质玻璃管中观察到的实验现象是______;其中发生反应的化学方程式为______。
(3)B装置是用于吸收二氧化碳并收集CO,其中盛放的试剂应该是______。
A.澄清石灰水 B.稀盐酸 C.水
(4)若该粉末为铜粉和氧化铁的混合物,待装置完全冷却至室温,称量硬质玻璃管内剩余固体的质量为。则的取值范围是______。
(5)如果没有装置B、C,该实验造成的危害是______。
18.实验室有一瓶由铜粉和氧化铜粉末组成的固体样品。为了测定样品中各成分的质量分数,小林和小洁都利用如图甲、乙所示装置开展实验探究:从备选药品中选择所需药品在装置甲中反应,并将生成的气体通入装置乙的试管中,与所取固体样品(质量均为m)充分反应,冷却至室温后,称量试管内剩余固体质量。备选药品(足量):过氧化氢溶液、稀硫酸、二氧化锰、锌粒。
相关实验数据如表所示。
反应前固体样品质量 反应后剩余固体质量
小林实验数据 m m+n
小洁实验数据 m m﹣n
请回答下列问题:
(1)装置甲中作为反应容器的玻璃仪器的名称是______,小林所选药品在装置甲中发生反应的化学方程式为______。
(2)小林所测样品中铜粉的质量分数为______(用含m、n的式子表示,下同),小洁所测样品中铜粉的质量分数为______。
(3)关于小林、小洁实验的下列说法正确的是______(填序号)。
a.小洁实验时,必须先通入甲中生成的气体一段时间后再点燃酒精灯
b.小洁实验中,若在熄灭酒精灯后立即停止通入气体,会导致铜粉的质量分数测定值偏大
c.小林实验中,若固体样品未完全反应,会导致铜粉的质量分数测定值偏小
d.所测固体样品中铜粉和氧化铜的质量比为4:5
19.比较Ag、Pd、Zn、Mn、Cu五种金属的活动性顺序。
(1)根据常见金属的活动性顺序表可知其中Ag、Zn、Cu金属的活动性由强至弱的顺序为______(填元素名称);
(2)通过实验确定Pd、Mn的活动性:
步骤一:通过金属与稀盐酸作用初步判断Pd、Mn的活动性
实验操作 实验现象 实验结论或化学方程式
将Mn片、Pd片分别放入稀盐酸中 ______ 活动性:Mn>H>Pd
步骤二:通过金属与可溶性化合物溶液作用比较Ag、Pd、Cu的活动性
实验操作 实验现象 化学方程式和实验结论
将Cu片浸入氯化钯(PdCl2)溶液中 铜丝表面覆盖一层银白色固体 化学方程式:______
将Ag片浸入PdCl2溶液中 无明显现象 实验结论:______
结论 Pd、Cu、Ag金属活动性由强至弱:______
(3)若要确切的得出五种金属的活动性顺序,还应补充的一个实验是______。
五、计算题
20.目前,我国钢铁产量居世界第一,为国民经济的发展奠定了坚实的基础。工业上通常利用 冶炼金属铁。现有含氧化铁80%的赤铁矿400t,请计算:
(1)这些赤铁矿中含氧化铁______t。
(2)理论上利用这些赤铁矿可以炼成含铁96%的生铁多少吨?(写出计算过程,计算结果精确到小数点后一位)
21.我国早在南北朝时期就开始冶炼黄铜,黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取15.0g黄铜样品粉碎后置于烧杯中,慢慢加入稀硫酸使其充分反应,直至不再产生气泡为止,此时共用去49.5g稀硫酸,烧杯中剩余物质的质量为64.3g。试分析并计算:
(1)反应生成气体的质量为___g。
(2)黄铜样品中铜的质量分数(结果精确到0.1%)。
参考答案:
1.D 2.D 3.A 4.C 5.C 6.B 7.C 8.C 9.B 10.A 11.A
12.(1)二氧化碳可以与水反应
(2)判断两种金属的活动性
(3)燃烧的条件之一是温度达到着火点
13.不行;
14.(1) 在冶金工业中作还原剂或做气体燃料 Cu2+
(2) Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑ 有气泡产生,溶液由无色变浅绿色
置换反应
15.(1)O2
(2)碳##C
(3)
16.(1) Ca(OH)2 Fe
(2)化合反应
(3)
(4)灭火(或人工降雨等合理即可)
17.(1)防止加热时爆炸
(2) 红色粉末逐渐变成黑色
(3)A
(4)5.6<m<8
(5)未反应的一氧化碳直接排放到空气中,污染环境
18.(1) 锥形瓶
(2)
(3)abcd
19.(1)锌、铜、银
(2) Mn片上有气泡产生、Pd片上无明显变化 Cu+PdCl2=Pd+CuCl2 Pd比Ag活泼 Cu Pd Ag
(3)锰片插入硫酸锌溶液(或锰片插入氯化锌溶液等)
20.(1)320
(2)233.3t
解:炼成生铁质量为x,根据质量守恒铁元素质量不变,,x
答:生铁质量约为233.3t。
21.(1)0.2
(2)解:设黄铜样品中锌的质量为x
x=6.5g
黄铜样品中铜的质量分数为:
答:黄铜样品中铜的质量分数为56.7%
