安徽省淮北一中2012-2013学年高二上学期期中考试化学试题(有扫描答案)
文档属性
| 名称 | 安徽省淮北一中2012-2013学年高二上学期期中考试化学试题(有扫描答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 259.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-03 00:00:00 | ||
图片预览



文档简介
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Mg 24 Al 27 Zn 65 Cu 64 Ag 108
第I卷(选择题 共50分,答案填写在Ⅱ卷上)
一、选择题(每题只有1个正确答案,每题2分,共50分)
1.NA代表阿伏加德罗常数的数值,下列叙述错误的是 ( )
A.在H2O 2+Cl2=2HCl+O2反应中,每生成32g氧气,转移2NA个电子
B.23gNa在氧气中完全燃烧失去电子数为NA
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.常温常压下,33.6L Cl2与56g Fe充分反应,转移电子数为3NA
2.根据反应:2H2S+O2===2S↓+2H2O, 4NaI+O2+2H2SO4===2I2+2Na2SO4+2H2O,
Na2S+I2===2NaI+S↓ 下列物质的氧化性强弱判断正确的是( )
A.O2>I2>S B.H2S>NaI>H2O C.S>I2>O2 D.H2O>NaI>H2S
3.对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
A.向溶液中加入稀硝酸后,再加入AgNO3溶液有白色沉淀生成,则溶液中可能含有Cl-
B. 向溶液中加入KSCN溶液,观察无明显现象,继续加入氯水,溶液变红色,说明溶液中一定含有Fe2+
C. 向溶液中加入NaOH 溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+
D. 向溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体,可推测溶液中含有CO32-。
4、用惰性电极实现电解,下列说法正确的是 ( )
A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
5.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知,氧化性:Fe2+<Ni2+<Cu2+( ( (
A、 阳极发生还原反应,其电极反应式:Ni2++2e(=Ni
B、电解过程中,阳极质量的减少与阴极质量的增加相等
C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D、电解后,电解槽底部的阳极泥中只有Cu和Pt
6、将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体 ( )
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
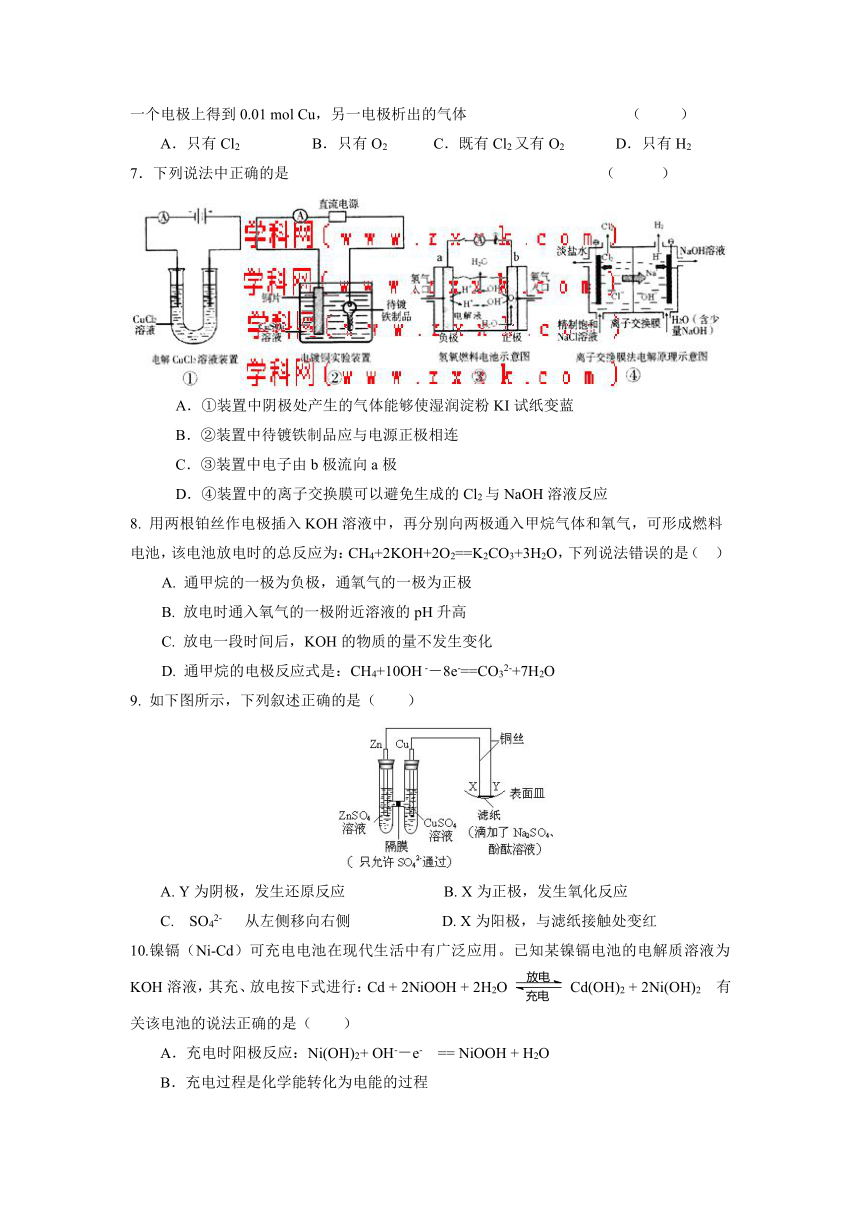
7.下列说法中正确的是 ( )
A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
8. 用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2==K2CO3+3H2O,下列说法错误的是( )
A. 通甲烷的一极为负极,通氧气的一极为正极
B. 放电时通入氧气的一极附近溶液的pH升高
C. 放电一段时间后,KOH的物质的量不发生变化
D. 通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O
9. 如下图所示,下列叙述正确的是( )
A. Y为阴极,发生还原反应 B. X为正极,发生氧化反应
C. SO42- 从左侧移向右侧 D. X为阳极,与滤纸接触处变红
10.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2+ OH--e- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
11、如图是探究铁发生腐蚀的装置图。发现开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升。下列说法不正确的是( )
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应均为:Fe - 2e- == Fe2+
D.析氢腐蚀的总反应为:2Fe + O2 + 2H2O == 2Fe(OH)2
12. 250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是 ( )
A. 是吸热反应 B. 熵增大效应大于焓减小效应
C. 是熵减少的反应 D. 是放热反应
13.下列说法中正确的是??( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强一定会破坏有气体反应的平衡状态
D.在其他条件不变时,使用催化剂可改变化学反应速率,但不能改变化学平衡状态
14.增大压强,对已达到平衡的下列反应产生的影响是 3P(g)+Q(g) 2R(g)+2S(s) ( )
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
15.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是 ( )
A.混合气体的压强 B.混合气体的密度
C.每生成2molB同时消耗1molC D.气体的总物质的量
16 一定条件下的密闭容器中:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.9 kJ· mol-1,下列叙述正确的是( )
A.4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ
B.平衡时,v正(O2)= v逆(NO)
C.平衡后降低压强,混合气体平均摩尔质量增大
D.平衡后升高温度,混合气体中NO含量降低
17 .在密闭容器中,对于反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
A.10 mol和10% B.20 mol和20% C.20 mol和40% D.20 mol和80%
18 下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是 ( )
A、纯Ni(s)和Ni(CO)4(g) B、纯Ni(s)和CO(g)
C、不纯Ni(s)和CO(g) D、不纯Ni(s)和Ni(CO)4(g)
19、已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是( )。
A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用N2O4表示的平均化学反应速率是0.04 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
20、在一密闭容器中进行反应2SO2 + O2 2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.2mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 ( )
A.SO2为 0.4mol/L,O2为0.3mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D. O2为0.1mol/L
21、乙酸蒸气能形成二聚分子2CH3COOH(g) (CH3COOH)2 (g) Δ H<0 ,欲测定单体乙酸的分子量,应采用的条件是 ( )
A.高温低压 B.低温高压 C.低温低压 D.高温高压
22.在一定条件下,固定容积的密闭容器中反应:2NO2(g)2NO(g)+O2(g);ΔH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
23.如图所示,反应2SO2(g)+O2(g)2SO3(g);ΔH<0,在不同温度、不同压强(P1>P2)下达到平衡时,混合气中SO3的体积φ(SO3)随温度变化的曲线应为( )
24.某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g);ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 ( )
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.到t4时反应物转化率最低
25、在t℃时,向一密闭容器(固定体积)中放入1mol A和1mol B,发生反应A(s) + B(g) ==== C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
A.2molA和1molB B.2molD,1molA和1molB
C.2molC和4molD D.1molC和1molD
第II卷(共50分)
26.(6分)在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热量。已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)该反应用于火箭推进剂,除释放大量热量和快速产生大量气体外,还有很突出的优点是 。
(2)写出肼和双氧水反应的热化学方程式_____________________________。
(3)已知H2O(l)=H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是 。
27、(10分)用图所示的装置进行电解。通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色。
(1)电源E为 极
(2)D电极的电极反应式为
(3)左侧烧杯中发生反应的化学方程式为: 。
(4)在右杯中观察到的现象是 。
(5)室温下,从电解开始到时间t s,A、B装置中共收集到气体0.168 L(STP),若电解过程中无其他副反应发生,经测定电解后A中溶液加水稀释为1000 mL,则A溶液的H+的浓度为___ ___。
28、(14分)在80 ℃时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,ΔH >0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s
n/mol
0
20
40
60
80
100
n(N2O4)
0.40
a
0.20
c
d
e
n(NO2)
0.00
0.24
b
0.52
0.60
0.60
(1)计算20~40 s内用N2O4表示的平均反应速率为____________mol· L-1·s-1。
(2)40s时,NO2的物质的量b= mol,反应最迟到 s到达平衡状态
(3)计算在80 ℃时该反应的平衡常数K=___________。
(4)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有___________(填序号)。
A、增大N2O4的起始浓度 B、向混合气体中通入NO2
C、使用高效催化剂 D、升高温度
(6)如图是80 ℃时容器中N2O4物质的量与时间的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量与时间的变化曲线。
29.(14分)在一定条件下,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如图:
(1)计算反应开始10分钟内,NH3的平均反应速率 。
(2)反应处于平衡状态的时间是:
(3)图中10~20分钟曲线发生变化的可能原因是 。
(4)第25分钟,平衡改变的条件是 ,此时正反应速率 (填增大、减小或不变),重新达平衡后,NH3的体积分数比原平衡 (填大、小或不变)。
(5)判断该反应达到平衡状态的标志是 (填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
30.(6分)Ⅰ 在某温度体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g)2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:
(1)________(2)(填“>”、“<”或“=”)。
(3)a、b、c取值必须满足的一般条件是 。
安徽省淮北一中2012-2013学年上学期高二年级期中考试化学试卷
答案:
同课章节目录
