广东省汕头市重点中学2012-2013学年高二上学期期中考试 化学试题(有答案)
文档属性
| 名称 | 广东省汕头市重点中学2012-2013学年高二上学期期中考试 化学试题(有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 233.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-03 13:08:45 | ||
图片预览

文档简介
2012-2013学年度第一学期期中考试
高二化学试卷 2012.11
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Zn 65
一.单项选择题(每小题2分,共10小题)
1.下述做法能改善空气质量的是( )
A.以煤等燃料作为主要生活燃料 B.限制使用电动车
C.利用太阳能、风能和氢能等能源替代化石能源
D.鼓励私人购买和使用汽车代替公交车
2. 下列对熵的理解不正确的是( )21世纪教育网
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.凡熵增的反应均为自发过程
D.2N2O5(g)===4NO2(g)+O2(g)是熵增的反应
3.将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol?L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol?L-1?s-1
②用物质 B 表示的反应的平均速率为 0.6 mol?L-1?s-1
③2 s 时物质 A 的转化率为70% ④2 s 时物质 B 的浓度为 0.7 mol?L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
4. 常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是( )
A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-15
5.把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( ) 21世纪教育网
A( 自来水 B( 0.5 mol / L盐酸
C( 0.5 mol / L CH3COOH溶液 D( 0.5 mol / L KCl溶液
6. 对A + 3B = 2C +2D来说,下列四种不同情况下的反应速率最快的是( )
A.υ(A)= 0.3 mol/(L·min) B.υ(B)= 0.6 mol/(L·min)
C.υ(C)= 0.5 mol/(L·min) D.υ(D)= 0.04 mol/(L·s)
7.下列说法中正确的是( )
A.溶液成中性就是pH=7 B.溶液成中性指的是c()=c()
C.pH=1的醋酸溶液和pH=1的NaOH溶液等体积混合,溶液一定成中性
D.等体积等物质的量浓度的硫酸和NaOH溶液等体积混合,溶液一定成中性
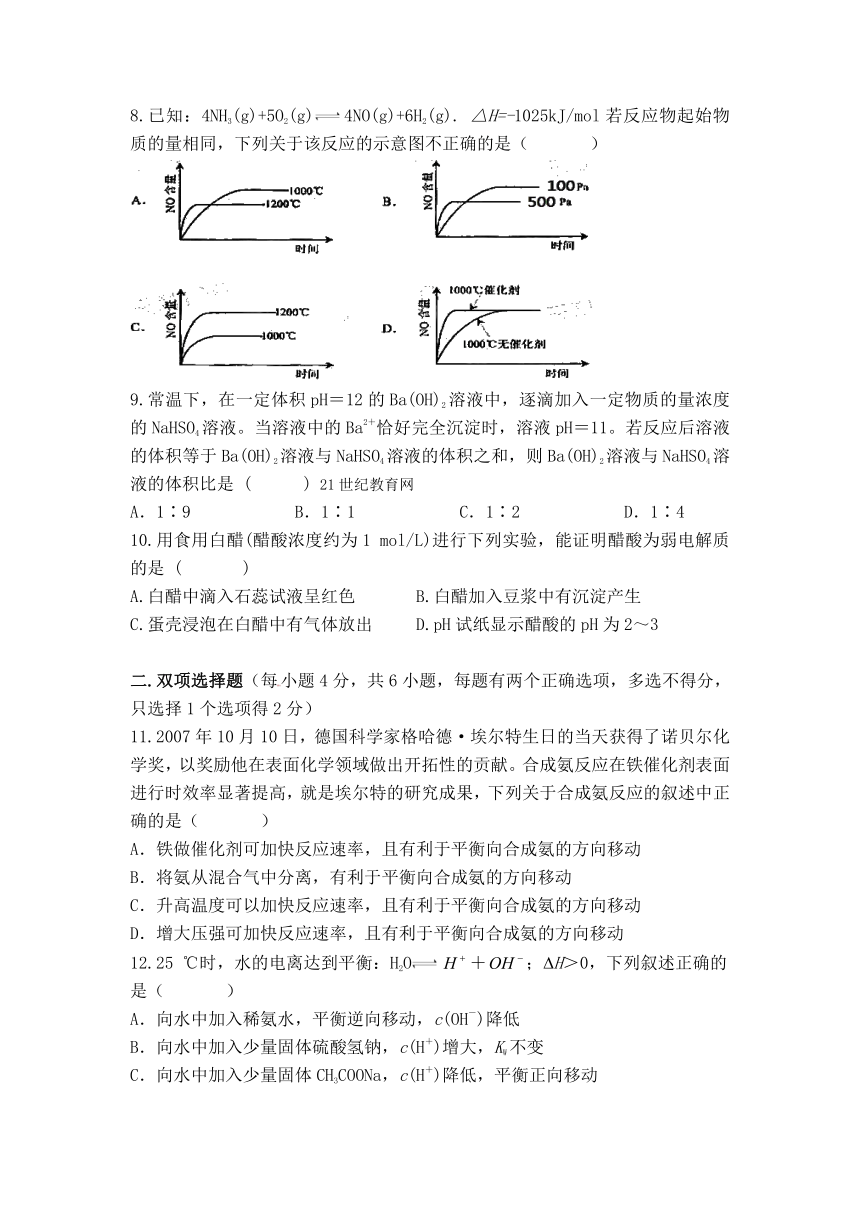
8.已知:4NH3(g)+5O2(g)4NO(g)+6H2(g). △H=-1025kJ/mol若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
9.常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液。当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 ( ) 21世纪教育网
A.1∶9 B.1∶1 C.1∶2 D.1∶4
10.用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是 ( )
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为2~3
二.双项选择题(每小题4分,共6小题,每题有两个正确选项,多选不得分,只选择1个选项得2分)
11.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是( )
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
12.25 ℃时,水的电离达到平衡:H2O+;(H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,c(H+)降低,平衡正向移动
D.将水加热,KW增大,pH不变
13.相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.开始时产生氢气的速率强酸大 D.产生相同体积的气体弱酸需要的时间短
14. 对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液lmL稀释至100mL后,pH等于3[来源:21世纪教育网]
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为。
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
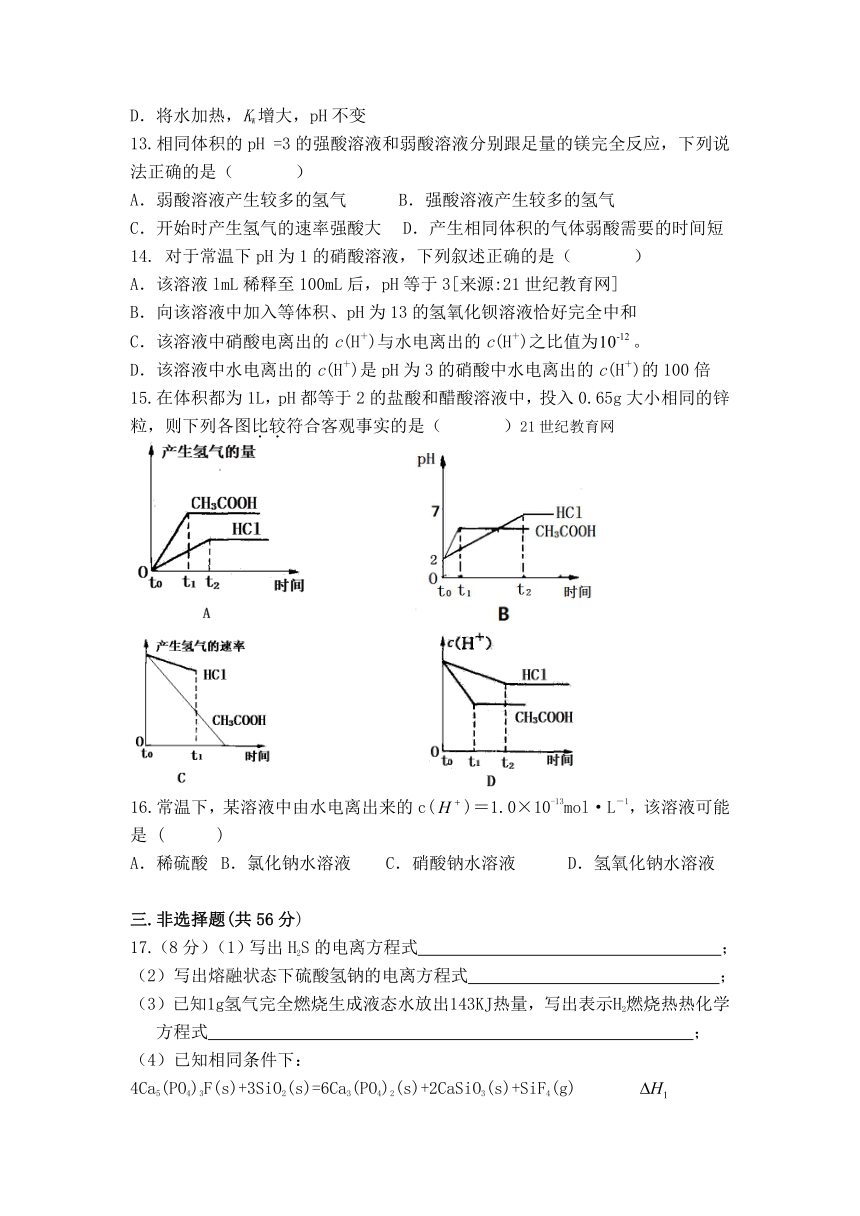
15.在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g大小相同的锌粒,则下列各图比较符合客观事实的是( )21世纪教育网
16.常温下,某溶液中由水电离出来的c()=1.0×10-13mol·L-1,该溶液可能是 ( )
A.稀硫酸 B.氯化钠水溶液 C.硝酸钠水溶液 D.氢氧化钠水溶液
三.非选择题(共56分)
17.(8分)(1)写出H2S的电离方程式 ;
(2)写出熔融状态下硫酸氢钠的电离方程式 ;
(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式 ;
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
SiO2(s)+CaO(s)=CaSiO3(s)
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) H
用、和表示H,H=
18.(8分)某温度下,测得某溶液的pH = 6,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。则此温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=10的NaOH溶液aL与pH=1的H2SO4溶液bL混合:
(1)若所得混合液为中性,则a︰b= 。21世纪教育网
(2)若所得混合液的pH=2,则a︰b= 。
19.(8分)373 K时,某1 L密闭容器中发生如下可逆反应:A (g)2B (g)。其中物质B的物质的量变化如图所示
(1)已知373 K时60 s达到平衡,则前60 s内A的平均反应速率为____________。
(2)若373 K时B的平衡浓度为A的3倍,473 K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473 K时A的物质的量随时间的变化曲线。
(3)若反应在373 K进行,在1 L密闭容器中加入1 mol B、0.2 mol He,达到平衡时B的转化率应______。
A.等于60% B.等于40% C.小于40% D.介于40%~60%之间21世纪教育网
(4)已知曲线上任意两点之间边线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义__________________________________。21世纪教育网
20.(14分)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%);
0.1[来源:21世纪教育网]
0.5
1
10
400
99.2
99.6
99.7
99.9
500
93.5
96.9
97.821世纪教育网
99.3
600
73.7
85.8
89.5
96.421世纪教育网
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论? ; (2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ; (3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”); (4)工业生产硫酸产生的尾气主要含SO2和SO3,会造成 (填环境问题),工业上常用足量的浓氨水来吸收,写出相关的离子方程式
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。(写出解题过程)
21.(18分)草酸晶体的组成可用H2C2O4·5H2O表示,为了测定某草酸样品中草酸晶体的纯度,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O21世纪教育网
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)______________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d. 铁架台(带滴定管夹) e.烧杯 f.漏斗 g. 胶头滴管 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________________式滴定管中,因为________________________________________________________。
(3)实验中用左手控制____________(填仪器及部位),眼睛注视______________,直至滴定终点。判断到达终点的现象是___________________。
(4)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是_________;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得结果会__________________________(偏大、偏小、无影响)
(5)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则该样品中草酸晶体的纯度为 21世纪教育网
2012年度高二第一学期期中考化学试卷答案答案
一.单项选择题(每小题2分,共10小题)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
B
A
B
D
B
C
D
D
二.双项选择题(每小题4分,共6小题,)
题号
11
12
13
14
15
16
答案
BD
BC
AD [来源:21世纪教育网]
AB
AB
AD
三.非选择题(共56分)
17. (8分,各2分)(1)H2SH++HS- HS-H++S2- (2)NaHSO4=Na++HSO4-
(3)H2(g)+1/2O2(g)=H2O(l);△H=-286kJ·mol-1(4)+3+18
18.(8分)中(1分) 高于(1分) 水的电离为吸热反应,升温有利于水的电离,使Kw增大(2分) 10︰1 (2分) 9︰2(2分)
19. (8分,各2分)(1)0.005 mol / (L·s)[来源:21世纪教育网]
(2)见答图。21世纪教育网
(曲线注意两点:A的起始及平衡时的物质的量;达到平衡所需时间应小于60 s)21世纪教育网
(3)B (4)某一时刻的反应速率(或即时速率、瞬时速率)
20. (14分) (1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;(2分) (2)增大压强对提高SO2转化率无显著影响,反而会增加成本;(2分) (3)否(1分) 否(1分) (4)酸雨(2分) SO2+2NH3·H2O=2NH4-+SO32-+H2O SO3+2NH3·H2O=2NH4-+SO42-+H2O(2分) (5)(4分)解:1万吨98%的硫酸含H2SO4的质量:9.8×109g 设需要SO3的质量为x,该反应产生的热量为y。 H2SO4 ~ SO3 ~ △H 98g 80g -196.6×0.5Kj21世纪教育网
9.8×109g x y x==8.0×109g=8.0×103t y==9.83×109kJ
21. (18分)(1)c , f , j (2分)还缺少100mL容量瓶,锥形瓶(2分)21世纪教育网
(2)酸(2分)因KMnO4溶液有强氧化性,能腐蚀橡皮管。(2分)
(3)滴定管活塞(1分) 溶液颜色的变化(1分) 当滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色且30s内不褪色(2分)(4)偏大(2分) 无影响(2分) (5) (2分)
高二化学试卷 2012.11
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Zn 65
一.单项选择题(每小题2分,共10小题)
1.下述做法能改善空气质量的是( )
A.以煤等燃料作为主要生活燃料 B.限制使用电动车
C.利用太阳能、风能和氢能等能源替代化石能源
D.鼓励私人购买和使用汽车代替公交车
2. 下列对熵的理解不正确的是( )21世纪教育网
A.同种物质气态时熵值最大,固态时熵值最小
B.体系越有序,熵值越小;越混乱,熵值越大
C.凡熵增的反应均为自发过程
D.2N2O5(g)===4NO2(g)+O2(g)是熵增的反应
3.将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol?L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol?L-1?s-1
②用物质 B 表示的反应的平均速率为 0.6 mol?L-1?s-1
③2 s 时物质 A 的转化率为70% ④2 s 时物质 B 的浓度为 0.7 mol?L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
4. 常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是( )
A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-15
5.把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( ) 21世纪教育网
A( 自来水 B( 0.5 mol / L盐酸
C( 0.5 mol / L CH3COOH溶液 D( 0.5 mol / L KCl溶液
6. 对A + 3B = 2C +2D来说,下列四种不同情况下的反应速率最快的是( )
A.υ(A)= 0.3 mol/(L·min) B.υ(B)= 0.6 mol/(L·min)
C.υ(C)= 0.5 mol/(L·min) D.υ(D)= 0.04 mol/(L·s)
7.下列说法中正确的是( )
A.溶液成中性就是pH=7 B.溶液成中性指的是c()=c()
C.pH=1的醋酸溶液和pH=1的NaOH溶液等体积混合,溶液一定成中性
D.等体积等物质的量浓度的硫酸和NaOH溶液等体积混合,溶液一定成中性
8.已知:4NH3(g)+5O2(g)4NO(g)+6H2(g). △H=-1025kJ/mol若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
9.常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液。当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是 ( ) 21世纪教育网
A.1∶9 B.1∶1 C.1∶2 D.1∶4
10.用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是 ( )
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为2~3
二.双项选择题(每小题4分,共6小题,每题有两个正确选项,多选不得分,只选择1个选项得2分)
11.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是( )
A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
12.25 ℃时,水的电离达到平衡:H2O+;(H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,c(H+)降低,平衡正向移动
D.将水加热,KW增大,pH不变
13.相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.开始时产生氢气的速率强酸大 D.产生相同体积的气体弱酸需要的时间短
14. 对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液lmL稀释至100mL后,pH等于3[来源:21世纪教育网]
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为。
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
15.在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g大小相同的锌粒,则下列各图比较符合客观事实的是( )21世纪教育网
16.常温下,某溶液中由水电离出来的c()=1.0×10-13mol·L-1,该溶液可能是 ( )
A.稀硫酸 B.氯化钠水溶液 C.硝酸钠水溶液 D.氢氧化钠水溶液
三.非选择题(共56分)
17.(8分)(1)写出H2S的电离方程式 ;
(2)写出熔融状态下硫酸氢钠的电离方程式 ;
(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式 ;
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)
SiO2(s)+CaO(s)=CaSiO3(s)
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) H
用、和表示H,H=
18.(8分)某温度下,测得某溶液的pH = 6,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。则此温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=10的NaOH溶液aL与pH=1的H2SO4溶液bL混合:
(1)若所得混合液为中性,则a︰b= 。21世纪教育网
(2)若所得混合液的pH=2,则a︰b= 。
19.(8分)373 K时,某1 L密闭容器中发生如下可逆反应:A (g)2B (g)。其中物质B的物质的量变化如图所示
(1)已知373 K时60 s达到平衡,则前60 s内A的平均反应速率为____________。
(2)若373 K时B的平衡浓度为A的3倍,473 K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473 K时A的物质的量随时间的变化曲线。
(3)若反应在373 K进行,在1 L密闭容器中加入1 mol B、0.2 mol He,达到平衡时B的转化率应______。
A.等于60% B.等于40% C.小于40% D.介于40%~60%之间21世纪教育网
(4)已知曲线上任意两点之间边线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义__________________________________。21世纪教育网
20.(14分)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%);
0.1[来源:21世纪教育网]
0.5
1
10
400
99.2
99.6
99.7
99.9
500
93.5
96.9
97.821世纪教育网
99.3
600
73.7
85.8
89.5
96.421世纪教育网
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论? ; (2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是: ; (3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”); (4)工业生产硫酸产生的尾气主要含SO2和SO3,会造成 (填环境问题),工业上常用足量的浓氨水来吸收,写出相关的离子方程式
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.9kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。(写出解题过程)
21.(18分)草酸晶体的组成可用H2C2O4·5H2O表示,为了测定某草酸样品中草酸晶体的纯度,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液,取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O21世纪教育网
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)______________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d. 铁架台(带滴定管夹) e.烧杯 f.漏斗 g. 胶头滴管 h.玻璃棒 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________________式滴定管中,因为________________________________________________________。
(3)实验中用左手控制____________(填仪器及部位),眼睛注视______________,直至滴定终点。判断到达终点的现象是___________________。
(4)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是_________;若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得结果会__________________________(偏大、偏小、无影响)
(5)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则该样品中草酸晶体的纯度为 21世纪教育网
2012年度高二第一学期期中考化学试卷答案答案
一.单项选择题(每小题2分,共10小题)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
B
A
B
D
B
C
D
D
二.双项选择题(每小题4分,共6小题,)
题号
11
12
13
14
15
16
答案
BD
BC
AD [来源:21世纪教育网]
AB
AB
AD
三.非选择题(共56分)
17. (8分,各2分)(1)H2SH++HS- HS-H++S2- (2)NaHSO4=Na++HSO4-
(3)H2(g)+1/2O2(g)=H2O(l);△H=-286kJ·mol-1(4)+3+18
18.(8分)中(1分) 高于(1分) 水的电离为吸热反应,升温有利于水的电离,使Kw增大(2分) 10︰1 (2分) 9︰2(2分)
19. (8分,各2分)(1)0.005 mol / (L·s)[来源:21世纪教育网]
(2)见答图。21世纪教育网
(曲线注意两点:A的起始及平衡时的物质的量;达到平衡所需时间应小于60 s)21世纪教育网
(3)B (4)某一时刻的反应速率(或即时速率、瞬时速率)
20. (14分) (1)压强一定时,温度升高时,SO2转化率下降,说明升温有利逆反应的进行,所以正反应为放热反应;(2分) (2)增大压强对提高SO2转化率无显著影响,反而会增加成本;(2分) (3)否(1分) 否(1分) (4)酸雨(2分) SO2+2NH3·H2O=2NH4-+SO32-+H2O SO3+2NH3·H2O=2NH4-+SO42-+H2O(2分) (5)(4分)解:1万吨98%的硫酸含H2SO4的质量:9.8×109g 设需要SO3的质量为x,该反应产生的热量为y。 H2SO4 ~ SO3 ~ △H 98g 80g -196.6×0.5Kj21世纪教育网
9.8×109g x y x==8.0×109g=8.0×103t y==9.83×109kJ
21. (18分)(1)c , f , j (2分)还缺少100mL容量瓶,锥形瓶(2分)21世纪教育网
(2)酸(2分)因KMnO4溶液有强氧化性,能腐蚀橡皮管。(2分)
(3)滴定管活塞(1分) 溶液颜色的变化(1分) 当滴入最后一滴KMnO4溶液时,溶液由无色变为紫红色且30s内不褪色(2分)(4)偏大(2分) 无影响(2分) (5) (2分)
同课章节目录
