第九单元溶液测试题—2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第九单元溶液测试题—2021-2022学年九年级化学人教版下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 278.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-19 00:00:00 | ||
图片预览


文档简介
第九单元《溶液》测试题
一、单选题
1.物质的组成和结构决定性质,性质决定用途。下列叙述不正确的是
A.洗洁精具有乳化作用,可以洗去油污
B.氧气具有可燃性,可以作为燃料
C.干冰升华吸热,可以用于人工降雨
D.金刚石硬度大,可以用于刻划玻璃
2.下列说法正确的是
A.恒温蒸发可使接近饱和的硝酸钾溶液变为饱和
B.双氧水在二氧化锰催化下才能产生氧气
C.可燃物的温度达到其着火点即可燃烧
D.汽油在清洗油污过程中起乳化作用
3.常温下,向各盛有100g水的甲、乙两个烧杯中分别加入等质量的M、N两种固体物质,搅拌,充分溶解后,发现只有甲烧杯底部有未溶固体存在。下列说法正确的是
A.所得两溶液质量相等 B.N溶液可能是饱和溶液
C.M、N两种物质都是易溶的 D.升高温度,M物质一定能继续溶解
4.向如图装置中的试管中加入一定量的下列物质能使U形管中的液面出现右高左低的是
A.蔗糖 B.氢氧化钠 C.硝酸钾 D.硝酸铵
5.下图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法不正确的是
A.通过升温可以将甲的不饱和溶液变为饱和溶液
B.甲、乙的溶解度都随温度的升高而增大
C.10℃时,分别用10g水配制饱和溶液,所用甲的质量多于乙
D.20℃时,甲、乙的饱和溶液溶质质量分数相等
6.下列说法正确的是
A.H2O和H2O2组成元素相同,化学性质也一定相同
B.溶液中有晶体析出时,溶质质量减小,溶液质量也一定减小
C.置换反应生成单质和化合物,有单质和化合物生成的反应也一定是置换反应
D.20℃,称取5.0gCa(OH)2固体,加入95.0mL蒸馏水充分搅拌,得到5.0%的澄清石灰水
7.下列关于溶液的叙述,正确的是
A.溶液都是均一、稳定的液体
B.饱和溶液就是不能再溶解任何物质的溶液
C.饱和溶液的质量一定比不饱和溶液的质量大
D.溶液析出晶体后,溶液的溶质质量分数不一定改变
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
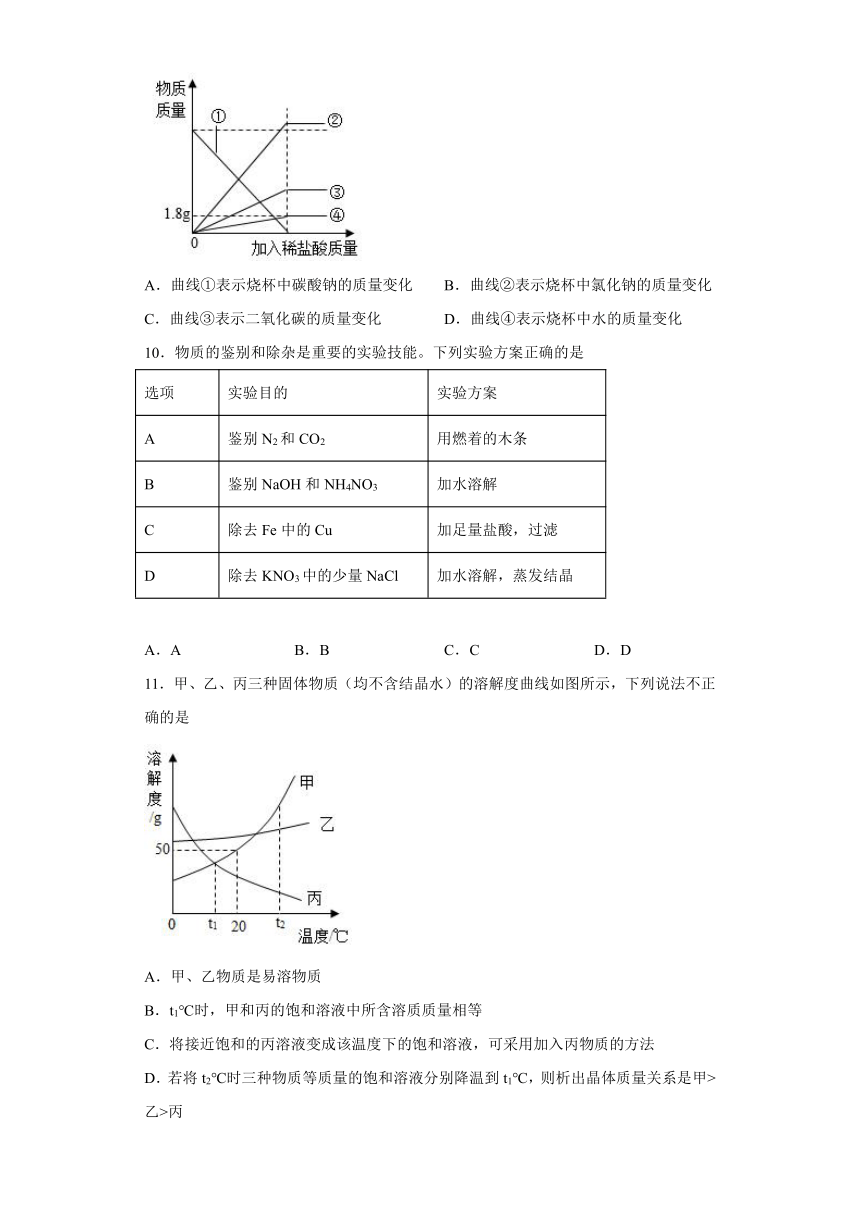
9.一烧杯中盛有10.6g碳酸钠粉末,向其中逐滴加入稀盐酸,该反应中有关物质质量与加入稀盐酸质量之间的关系如图所示,下列说法错误的是
A.曲线①表示烧杯中碳酸钠的质量变化 B.曲线②表示烧杯中氯化钠的质量变化
C.曲线③表示二氧化碳的质量变化 D.曲线④表示烧杯中水的质量变化
10.物质的鉴别和除杂是重要的实验技能。下列实验方案正确的是
选项 实验目的 实验方案
A 鉴别N2和CO2 用燃着的木条
B 鉴别NaOH和NH4NO3 加水溶解
C 除去Fe中的Cu 加足量盐酸,过滤
D 除去KNO3中的少量NaCl 加水溶解,蒸发结晶
A.A B.B C.C D.D
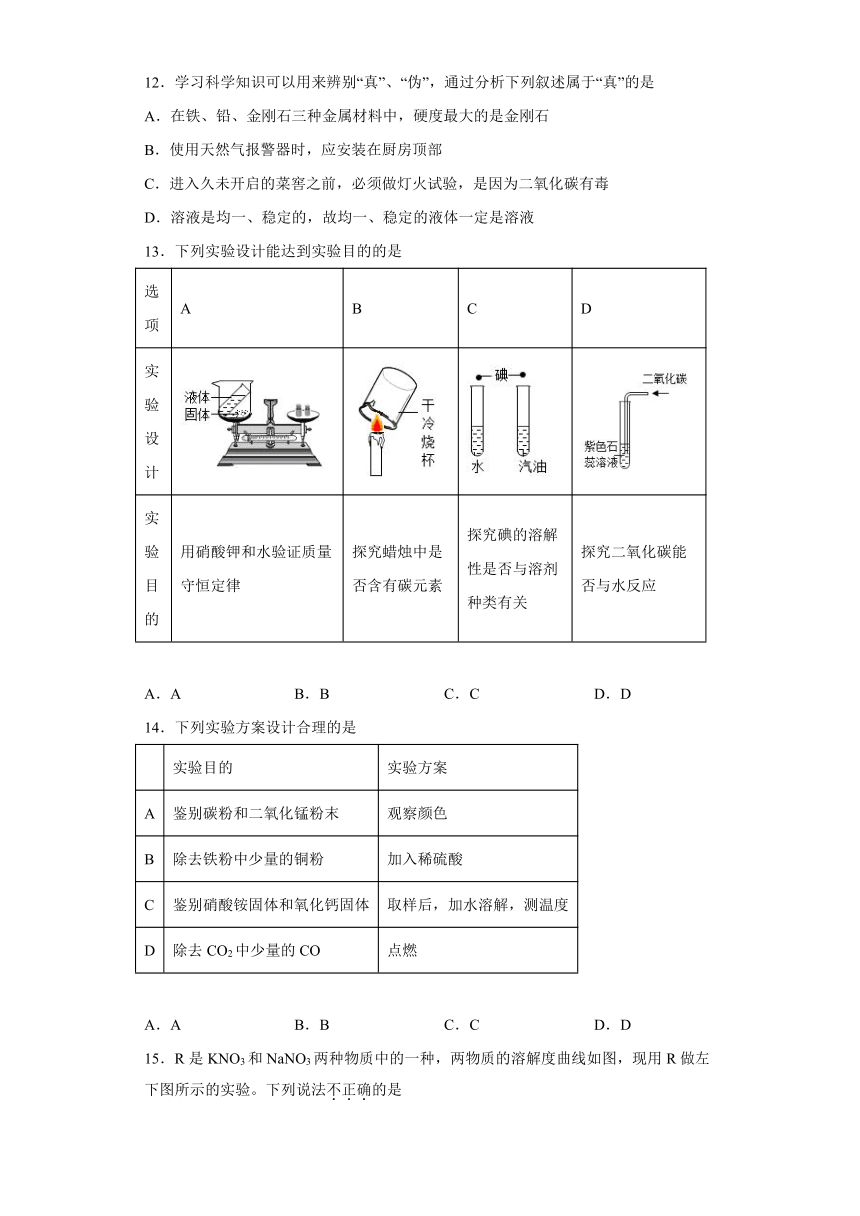
11.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是
A.甲、乙物质是易溶物质
B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等
C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法
D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙
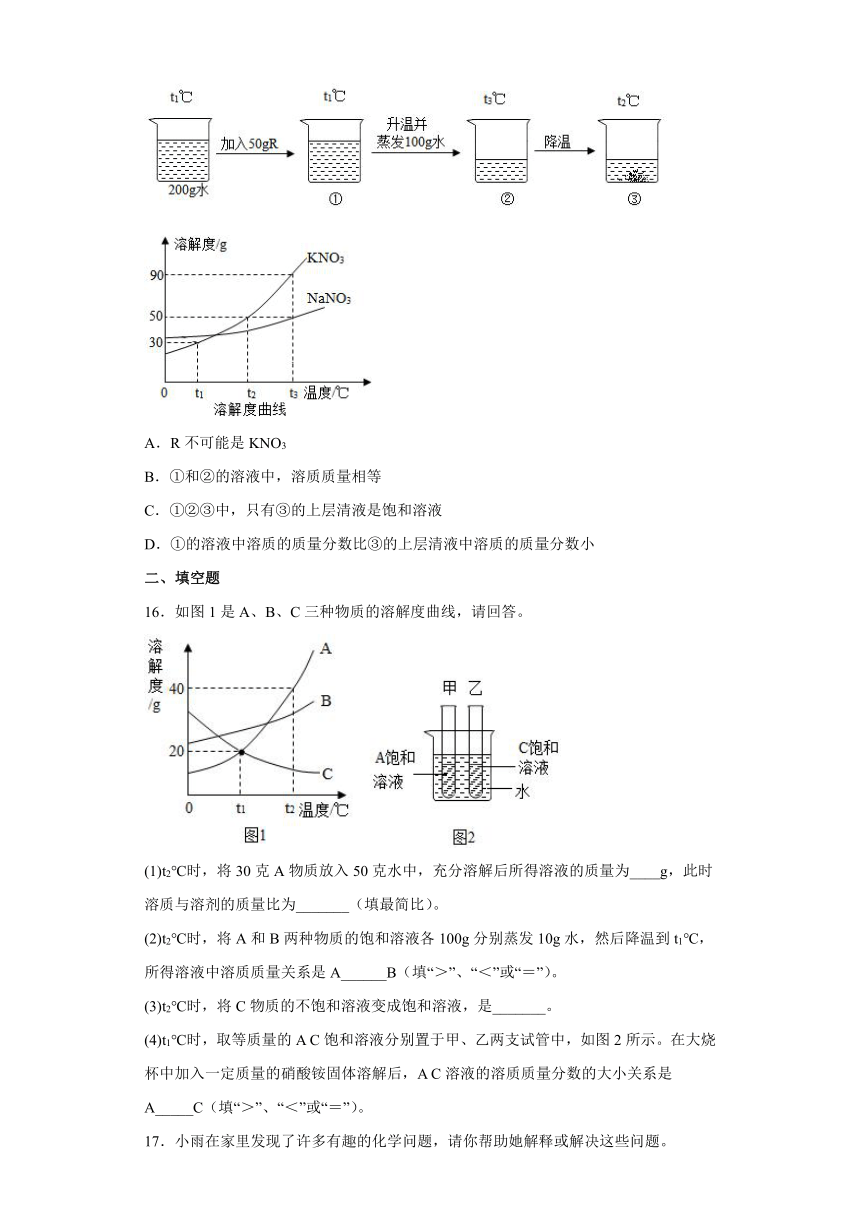
12.学习科学知识可以用来辨别“真”、“伪”,通过分析下列叙述属于“真”的是
A.在铁、铅、金刚石三种金属材料中,硬度最大的是金刚石
B.使用天然气报警器时,应安装在厨房顶部
C.进入久未开启的菜窖之前,必须做灯火试验,是因为二氧化碳有毒
D.溶液是均一、稳定的,故均一、稳定的液体一定是溶液
13.下列实验设计能达到实验目的的是
选项 A B C D
实验设计
实验目的 用硝酸钾和水验证质量守恒定律 探究蜡烛中是否含有碳元素 探究碘的溶解性是否与溶剂种类有关 探究二氧化碳能否与水反应
A.A B.B C.C D.D
14.下列实验方案设计合理的是
实验目的 实验方案
A 鉴别碳粉和二氧化锰粉末 观察颜色
B 除去铁粉中少量的铜粉 加入稀硫酸
C 鉴别硝酸铵固体和氧化钙固体 取样后,加水溶解,测温度
D 除去CO2中少量的CO 点燃
A.A B.B C.C D.D
15.R是KNO3和NaNO3两种物质中的一种,两物质的溶解度曲线如图,现用R做左下图所示的实验。下列说法不正确的是
A.R不可能是KNO3
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
二、填空题
16.如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液的质量为____g,此时溶质与溶剂的质量比为_______(填最简比)。
(2)t2℃时,将A和B两种物质的饱和溶液各100g分别蒸发10g水,然后降温到t1℃,所得溶液中溶质质量关系是A______B(填“>”、“<”或“=”)。
(3)t2℃时,将C物质的不饱和溶液变成饱和溶液,是_______。
(4)t1℃时,取等质量的A C饱和溶液分别置于甲、乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A C溶液的溶质质量分数的大小关系是A_____C(填“>”、“<”或“=”)。
17.小雨在家里发现了许多有趣的化学问题,请你帮助她解释或解决这些问题。
(1)妈妈做她最爱吃的“红烧肉”时加入了“加铁酱油”,其中“加铁酱油”中的“铁”指______(填“元素”或“原子”)。
(2)她发现加洗洁精能轻松除去碗碟上的油污,这是利用了洗洁精的____________作用。
(3)炒菜时油锅着火可用锅盖盖灭,所用原理是_________。
(4)从分子的角度分析,做饭时闻到饭菜的香味,是因为_________。
18.甲、乙三种物质的溶解度曲线如图所示。请完成下列问题:
(1)P点的含义是__。
(2)10℃时,将丙的不饱和溶液转化为该温度下的饱和溶液的一种方法是__。
(3)在30℃时,将等质量的甲、乙、丙三种固体物质完全溶于水,分别配制成该温度下的饱和溶液,所得溶液质量最多的是__。
(4)分别将50℃时等质量的甲、乙、丙三种物质的饱和溶液降温至10℃(忽略水分的蒸发),则所得溶液的溶质质量分数大小关系为__。
19.水是维系生命的重要物质,生活与化学实验中都会用到水。
(1)实验室配制一定溶质质量分数的NaCl溶液的流程图如下:
①应称量___________gNaCl固体。
②若称量NaCl固体时指针略向右偏转,其实验操作方法:___________。
③实验中加快NaCl固体溶解,合理的方法有___________(填序号)。
A.用玻璃棒搅拌 B.用热水溶解 C.用研钵将NaCl固体研碎
④下列操作中可能导致配制NaCl溶液的溶质质量分数偏小的是___________(填序号)。
A.NaCl中含有少量杂质 B.量取水时仰视
C.内壁蘸有少量水的烧杯溶解NaCl D.转移时,有少量溶液溅出
⑤若取上述溶液20g,将其稀释为5%的NaCl溶液,则需加___________g水。
(2)装有等量的水的A、B、C烧杯中分别加入10g、20g、25g某固体物质,充分溶解后,现象如图所示。
①三个烧杯中溶质质量分数最大的溶液___________(填“A”“B”或“C”)
②A、B、C中一定属于饱和溶液的是___________(填“A”“B”或“C”)
③如图中能表示该固体溶解度曲线的是___________(填“甲”或“乙”)
20.如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
(1)t2℃时,A B C三种物质的溶解度大小关系是 ______。
(2)t3℃时,将50g A物质加入到50g水中,充分溶解后,所得溶液的质量是 _____g。
(3)将t1℃时A和C的饱和溶液同时升高一定温度后,所得溶液中溶质的质量分数的大小关系是 ______。
(4)若A物质中含有少量的C物质,可通过______的方法提纯A(填“降温结晶”或“蒸发结晶”)。
(5)将100g 10%的A溶液稀释到4%需加入 ______g水。
三、推断题
21.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
四、实验题
22.化学是以实验为基础的科学,实验是科学探究的重要手段。根据图示回答下列问题:
(1)A实验中,将___________分别插入两个集气瓶中,比较氧气含量多少;
(2)B实验中,向两支试管中分别加入1-2小粒的碘和高锰酸钾,再各加入5mL水振荡,现象如图所示,由此得出的实验结论___________。
(3)C实验中,若要区分硬水和软水,向两支试管中分别加入___________。
(4)D实验中,铜片上白磷燃烧,水中白磷不燃烧,由此得出燃烧的条件之一是___________。
23.溶液对动植物的生理活动和人类的生产、科研活动具有很重要的意义
(1)厨房中有下列物质:①食盐、②料酒、③面粉、④豆油、⑤白糖、⑥面酱,将它们分别放入适量水中,充分搅拌,能够得到溶液的是
A.①②⑤ B.①②⑥ C.③⑤⑥ D.③④⑥
(2)下列有关溶液的说法中正确的是
A.m克蔗糖放入n克水中,得到蔗糖溶液的质量一定等于(m+n)克
B.溶质质量分数越大表明溶液越浓,溶液中所含溶质一定越多
C.将100g20%的KNO3饱和溶液恒温蒸发20g水后,溶质质量分数一定是20%
D.将不饱和溶液转化为饱和溶液后,溶液的质量一定增加
(3)根据图示回答:
①含有蔗糖晶体的溶液A,从冰箱里取出放置一段时间后晶体慢慢消失,形成溶液B。对于溶液A和B,一定处于饱和状态的是____;两者相比,较浓的溶液是_____。
②石灰水是氢氧化钙溶液的俗称,溶质的化学式是__________,向烧杯中加入试剂A观察到试管中石灰水变浑浊,则试剂A可能是________。
③一物体悬挂在饱和硝酸钾溶液中,向溶液中加入少量氯化钠晶体,弹簧秤读数_____
(4)下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:
实验序号 水的质量(g) 加入氯化钠的质量(g) 溶液的质量(g)
① 20 4 24
② 20 6 m
③ 20 8 27.2
④ 20 10 n
①表中m=26,n=______
②第3次实验得到的氯化钠溶液中溶质和溶剂的质量比是_______
五、计算题
24.请你仔细分析如图所示的实验过程和提供的数据,计算反应后所得溶液中溶质的质量分数是____?
25.实验室制取二氧化碳结束后,17中学化学兴趣小组的同学对锥形瓶内剩余的固液混合物(以下简称废液)做了如下实验:
请回答下列问题:
(1)实验中发生反应的化学方程式为___________。
(2)根据已知条件列出求解12.5g大理石中碳酸钙质量(x)的比例式___________。
(3)根据实验可知废液中含有的可溶性物质有___________(填化学式);
(4)所用废液中盐酸的质量分数为___________。
(5)操作A的名称为___________。
(6)下图中可以表示H+变化的是___________(填序号)。
参考答案:
1.B 2.A 3.B 4.B 5.A 6.B 7.D 8.A 9.D 10.B 11.B 12.B 13.C 14.C 15.C 16.(1) 70 2∶5
(2)<
(3)升高温度
(4)<
17.(1)元素
(2)乳化
(3)隔绝空气(氧气)
(4)分子在不停地运动
18.(1)10℃时,甲、乙、丙三种物质的溶解度相等
(2)增加溶质或恒温蒸发溶剂
(3)丙
(4)甲=乙>丙
19.(1) 7.5 左手拿药匙,右手拍打左手的手腕,靠振动掉下来的氯化钠固体加足用量 ABC ABC 40
(2) C B 甲
20.(1)A=B>C
(2)90
(3)A>C
(4)降温结晶
(5)150
21. 过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
22.(1)燃着的木条
(2)不同的溶质在同一溶剂中的溶解性不同
(3)肥皂水
(4)燃烧需要与氧气(或空气)接触
23.(1)A
(2)C
(3) A B Ca(OH)2 浓硫酸或氧化钙或氢氧化钠 变小
(4) 26 9:25
24.12.7%
25.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)
(3)HCl、CaCl2
(4)设废液中HCl质量为x
x=7.3g
所用废液中盐酸的质量分数为:
(5)过滤
(6)②
一、单选题
1.物质的组成和结构决定性质,性质决定用途。下列叙述不正确的是
A.洗洁精具有乳化作用,可以洗去油污
B.氧气具有可燃性,可以作为燃料
C.干冰升华吸热,可以用于人工降雨
D.金刚石硬度大,可以用于刻划玻璃
2.下列说法正确的是
A.恒温蒸发可使接近饱和的硝酸钾溶液变为饱和
B.双氧水在二氧化锰催化下才能产生氧气
C.可燃物的温度达到其着火点即可燃烧
D.汽油在清洗油污过程中起乳化作用
3.常温下,向各盛有100g水的甲、乙两个烧杯中分别加入等质量的M、N两种固体物质,搅拌,充分溶解后,发现只有甲烧杯底部有未溶固体存在。下列说法正确的是
A.所得两溶液质量相等 B.N溶液可能是饱和溶液
C.M、N两种物质都是易溶的 D.升高温度,M物质一定能继续溶解
4.向如图装置中的试管中加入一定量的下列物质能使U形管中的液面出现右高左低的是
A.蔗糖 B.氢氧化钠 C.硝酸钾 D.硝酸铵
5.下图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法不正确的是
A.通过升温可以将甲的不饱和溶液变为饱和溶液
B.甲、乙的溶解度都随温度的升高而增大
C.10℃时,分别用10g水配制饱和溶液,所用甲的质量多于乙
D.20℃时,甲、乙的饱和溶液溶质质量分数相等
6.下列说法正确的是
A.H2O和H2O2组成元素相同,化学性质也一定相同
B.溶液中有晶体析出时,溶质质量减小,溶液质量也一定减小
C.置换反应生成单质和化合物,有单质和化合物生成的反应也一定是置换反应
D.20℃,称取5.0gCa(OH)2固体,加入95.0mL蒸馏水充分搅拌,得到5.0%的澄清石灰水
7.下列关于溶液的叙述,正确的是
A.溶液都是均一、稳定的液体
B.饱和溶液就是不能再溶解任何物质的溶液
C.饱和溶液的质量一定比不饱和溶液的质量大
D.溶液析出晶体后,溶液的溶质质量分数不一定改变
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.20℃时,甲、乙饱和溶液中溶质的质量分数相等
B.将40℃时甲的饱和溶液降温至20℃,溶液质量不变
C.甲的溶解度大于乙的溶解度
D.将20℃时乙的饱和溶液升温至40℃,乙溶液仍为饱和溶液
9.一烧杯中盛有10.6g碳酸钠粉末,向其中逐滴加入稀盐酸,该反应中有关物质质量与加入稀盐酸质量之间的关系如图所示,下列说法错误的是
A.曲线①表示烧杯中碳酸钠的质量变化 B.曲线②表示烧杯中氯化钠的质量变化
C.曲线③表示二氧化碳的质量变化 D.曲线④表示烧杯中水的质量变化
10.物质的鉴别和除杂是重要的实验技能。下列实验方案正确的是
选项 实验目的 实验方案
A 鉴别N2和CO2 用燃着的木条
B 鉴别NaOH和NH4NO3 加水溶解
C 除去Fe中的Cu 加足量盐酸,过滤
D 除去KNO3中的少量NaCl 加水溶解,蒸发结晶
A.A B.B C.C D.D
11.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法不正确的是
A.甲、乙物质是易溶物质
B.t1℃时,甲和丙的饱和溶液中所含溶质质量相等
C.将接近饱和的丙溶液变成该温度下的饱和溶液,可采用加入丙物质的方法
D.若将t2℃时三种物质等质量的饱和溶液分别降温到t1℃,则析出晶体质量关系是甲>乙>丙
12.学习科学知识可以用来辨别“真”、“伪”,通过分析下列叙述属于“真”的是
A.在铁、铅、金刚石三种金属材料中,硬度最大的是金刚石
B.使用天然气报警器时,应安装在厨房顶部
C.进入久未开启的菜窖之前,必须做灯火试验,是因为二氧化碳有毒
D.溶液是均一、稳定的,故均一、稳定的液体一定是溶液
13.下列实验设计能达到实验目的的是
选项 A B C D
实验设计
实验目的 用硝酸钾和水验证质量守恒定律 探究蜡烛中是否含有碳元素 探究碘的溶解性是否与溶剂种类有关 探究二氧化碳能否与水反应
A.A B.B C.C D.D
14.下列实验方案设计合理的是
实验目的 实验方案
A 鉴别碳粉和二氧化锰粉末 观察颜色
B 除去铁粉中少量的铜粉 加入稀硫酸
C 鉴别硝酸铵固体和氧化钙固体 取样后,加水溶解,测温度
D 除去CO2中少量的CO 点燃
A.A B.B C.C D.D
15.R是KNO3和NaNO3两种物质中的一种,两物质的溶解度曲线如图,现用R做左下图所示的实验。下列说法不正确的是
A.R不可能是KNO3
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
二、填空题
16.如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液的质量为____g,此时溶质与溶剂的质量比为_______(填最简比)。
(2)t2℃时,将A和B两种物质的饱和溶液各100g分别蒸发10g水,然后降温到t1℃,所得溶液中溶质质量关系是A______B(填“>”、“<”或“=”)。
(3)t2℃时,将C物质的不饱和溶液变成饱和溶液,是_______。
(4)t1℃时,取等质量的A C饱和溶液分别置于甲、乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A C溶液的溶质质量分数的大小关系是A_____C(填“>”、“<”或“=”)。
17.小雨在家里发现了许多有趣的化学问题,请你帮助她解释或解决这些问题。
(1)妈妈做她最爱吃的“红烧肉”时加入了“加铁酱油”,其中“加铁酱油”中的“铁”指______(填“元素”或“原子”)。
(2)她发现加洗洁精能轻松除去碗碟上的油污,这是利用了洗洁精的____________作用。
(3)炒菜时油锅着火可用锅盖盖灭,所用原理是_________。
(4)从分子的角度分析,做饭时闻到饭菜的香味,是因为_________。
18.甲、乙三种物质的溶解度曲线如图所示。请完成下列问题:
(1)P点的含义是__。
(2)10℃时,将丙的不饱和溶液转化为该温度下的饱和溶液的一种方法是__。
(3)在30℃时,将等质量的甲、乙、丙三种固体物质完全溶于水,分别配制成该温度下的饱和溶液,所得溶液质量最多的是__。
(4)分别将50℃时等质量的甲、乙、丙三种物质的饱和溶液降温至10℃(忽略水分的蒸发),则所得溶液的溶质质量分数大小关系为__。
19.水是维系生命的重要物质,生活与化学实验中都会用到水。
(1)实验室配制一定溶质质量分数的NaCl溶液的流程图如下:
①应称量___________gNaCl固体。
②若称量NaCl固体时指针略向右偏转,其实验操作方法:___________。
③实验中加快NaCl固体溶解,合理的方法有___________(填序号)。
A.用玻璃棒搅拌 B.用热水溶解 C.用研钵将NaCl固体研碎
④下列操作中可能导致配制NaCl溶液的溶质质量分数偏小的是___________(填序号)。
A.NaCl中含有少量杂质 B.量取水时仰视
C.内壁蘸有少量水的烧杯溶解NaCl D.转移时,有少量溶液溅出
⑤若取上述溶液20g,将其稀释为5%的NaCl溶液,则需加___________g水。
(2)装有等量的水的A、B、C烧杯中分别加入10g、20g、25g某固体物质,充分溶解后,现象如图所示。
①三个烧杯中溶质质量分数最大的溶液___________(填“A”“B”或“C”)
②A、B、C中一定属于饱和溶液的是___________(填“A”“B”或“C”)
③如图中能表示该固体溶解度曲线的是___________(填“甲”或“乙”)
20.如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
(1)t2℃时,A B C三种物质的溶解度大小关系是 ______。
(2)t3℃时,将50g A物质加入到50g水中,充分溶解后,所得溶液的质量是 _____g。
(3)将t1℃时A和C的饱和溶液同时升高一定温度后,所得溶液中溶质的质量分数的大小关系是 ______。
(4)若A物质中含有少量的C物质,可通过______的方法提纯A(填“降温结晶”或“蒸发结晶”)。
(5)将100g 10%的A溶液稀释到4%需加入 ______g水。
三、推断题
21.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
四、实验题
22.化学是以实验为基础的科学,实验是科学探究的重要手段。根据图示回答下列问题:
(1)A实验中,将___________分别插入两个集气瓶中,比较氧气含量多少;
(2)B实验中,向两支试管中分别加入1-2小粒的碘和高锰酸钾,再各加入5mL水振荡,现象如图所示,由此得出的实验结论___________。
(3)C实验中,若要区分硬水和软水,向两支试管中分别加入___________。
(4)D实验中,铜片上白磷燃烧,水中白磷不燃烧,由此得出燃烧的条件之一是___________。
23.溶液对动植物的生理活动和人类的生产、科研活动具有很重要的意义
(1)厨房中有下列物质:①食盐、②料酒、③面粉、④豆油、⑤白糖、⑥面酱,将它们分别放入适量水中,充分搅拌,能够得到溶液的是
A.①②⑤ B.①②⑥ C.③⑤⑥ D.③④⑥
(2)下列有关溶液的说法中正确的是
A.m克蔗糖放入n克水中,得到蔗糖溶液的质量一定等于(m+n)克
B.溶质质量分数越大表明溶液越浓,溶液中所含溶质一定越多
C.将100g20%的KNO3饱和溶液恒温蒸发20g水后,溶质质量分数一定是20%
D.将不饱和溶液转化为饱和溶液后,溶液的质量一定增加
(3)根据图示回答:
①含有蔗糖晶体的溶液A,从冰箱里取出放置一段时间后晶体慢慢消失,形成溶液B。对于溶液A和B,一定处于饱和状态的是____;两者相比,较浓的溶液是_____。
②石灰水是氢氧化钙溶液的俗称,溶质的化学式是__________,向烧杯中加入试剂A观察到试管中石灰水变浑浊,则试剂A可能是________。
③一物体悬挂在饱和硝酸钾溶液中,向溶液中加入少量氯化钠晶体,弹簧秤读数_____
(4)下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:
实验序号 水的质量(g) 加入氯化钠的质量(g) 溶液的质量(g)
① 20 4 24
② 20 6 m
③ 20 8 27.2
④ 20 10 n
①表中m=26,n=______
②第3次实验得到的氯化钠溶液中溶质和溶剂的质量比是_______
五、计算题
24.请你仔细分析如图所示的实验过程和提供的数据,计算反应后所得溶液中溶质的质量分数是____?
25.实验室制取二氧化碳结束后,17中学化学兴趣小组的同学对锥形瓶内剩余的固液混合物(以下简称废液)做了如下实验:
请回答下列问题:
(1)实验中发生反应的化学方程式为___________。
(2)根据已知条件列出求解12.5g大理石中碳酸钙质量(x)的比例式___________。
(3)根据实验可知废液中含有的可溶性物质有___________(填化学式);
(4)所用废液中盐酸的质量分数为___________。
(5)操作A的名称为___________。
(6)下图中可以表示H+变化的是___________(填序号)。
参考答案:
1.B 2.A 3.B 4.B 5.A 6.B 7.D 8.A 9.D 10.B 11.B 12.B 13.C 14.C 15.C 16.(1) 70 2∶5
(2)<
(3)升高温度
(4)<
17.(1)元素
(2)乳化
(3)隔绝空气(氧气)
(4)分子在不停地运动
18.(1)10℃时,甲、乙、丙三种物质的溶解度相等
(2)增加溶质或恒温蒸发溶剂
(3)丙
(4)甲=乙>丙
19.(1) 7.5 左手拿药匙,右手拍打左手的手腕,靠振动掉下来的氯化钠固体加足用量 ABC ABC 40
(2) C B 甲
20.(1)A=B>C
(2)90
(3)A>C
(4)降温结晶
(5)150
21. 过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
22.(1)燃着的木条
(2)不同的溶质在同一溶剂中的溶解性不同
(3)肥皂水
(4)燃烧需要与氧气(或空气)接触
23.(1)A
(2)C
(3) A B Ca(OH)2 浓硫酸或氧化钙或氢氧化钠 变小
(4) 26 9:25
24.12.7%
25.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)
(3)HCl、CaCl2
(4)设废液中HCl质量为x
x=7.3g
所用废液中盐酸的质量分数为:
(5)过滤
(6)②
同课章节目录
