第二节 几种重要的金属化合物
文档属性
| 名称 | 第二节 几种重要的金属化合物 |

|
|
| 格式 | zip | ||
| 文件大小 | 56.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-12-03 00:00:00 | ||
图片预览


文档简介
第二节 几种重要的金属化合物
【三维目标】
〖知识与技能〗
1、了解氧化钠和过氧化钠的物理性质,了解焰色反应感受化学的现象美
2、了解氧化钠、过氧化钠的化学性质,会描述氧化钠、过氧化钠与水反应,与二氧化碳反应的现象,会写反应的化学方程式
3、加深对碱性氧化物的认识,知道过氧化钠是一种特殊氧化物,能说出过氧化钠的应用
4、认识Na2CO3、NaHCO3的性质及转化
5、掌握Al2O3、Al(OH)3的两性,掌握“Al三角”关系,掌握几种重要氢氧化物的制备和性质
6、掌握Fe(OH)2氧化成Fe(OH)3的过程,掌握Fe3+的检验及氧化性,明确Fe2+与Fe3+的相互转化,掌握“铁三角”
〖过程与方法〗
1、通过氧化钙和氧化钠的对比学习,锻炼学生由旧的知识联系迁移,学习新知识的能力
2、通过过氧化钠与水的反应学习,锻炼学生在学习中对实验的观察、分析、设计能力
3、通过演示实验和学生实验相结合的方法,使学生理解、掌握Al2O3和Al(OH)3的两性及Al(OH)3的制备方法
4、结合演示实验使学生理解Al(OH)3生成及溶解的有关图象,并能灵活分析解决一般的计算问题
5、通过启发、诱导和实验探究,突破教学难点
6、将实验探究与讨论交流密切结合;学习运用比较、归纳、分析、综合的学习方法
〖情感态度与价值观〗
1、激发学生学习兴趣,体验化学学科的丰富多彩
2、体验科学探究的艰辛和喜悦
3、让学生体会科学研究的乐趣,体验合作和动手的整个过程的积极的情绪
4、养成务实求真、勇于探索的科学态度,重点培养学生“主动参与、乐于探究、交流合作”的精神
【重点难点】
运用比较法学习金属氧化物的性质、Na2CO3、NaHCO3的性质及转化、Al2O3、Al(OH)3的两性、Al(OH)3生成和溶解的图象及计算、三价铁的氧化性 及Fe、Fe2+、Fe3+的转化、氢氧化亚铁的制备和性质、
【教学方法】
列表比较法、实验探究法、启发引导法、多媒体辅助教学
【实验准备】
实验3—5、实验3—6、实验3—7、实验3—8、实验3—9、实验3—10
第二课时(铝的重要化合物)
【教学过程】
【导入】在第一节里,我们学习了几种重要金属的化学性质,知道铝是地壳中含量最高的金属元素,铝的化学性质比较活泼,人们发现并制得单质铝却比较晚,从铝的化合物中提炼铝单质比较困难,但铝的许多化合物在人类的生产和生活中具有重要的作用。今天我们来学习铝的重要化合物,那么铝有哪些重要的化合物呢?他们在我们日常生活中都有什么作用呢。
【投影】
Al → Al2O3 → Al(OH)3 → 铝盐(如明矾)、偏铝酸盐(AlO2-)
【板书】二、铝的重要化合物
(一)氧化铝(Al2O3)
【阅读】教材P58页相关内容
【归纳】物理性质:白色固体,难溶于水,熔点高。是人选刚玉、人选宝石的主要成分。
化学性质:既能与强酸反应,又能与强碱反应。
用途:做耐火材料。
【板书】Al2O3 + 6HCl = 2AlCl3+3H2O
Al2O3 + 2NaOH = 2NaAlO2+H2O
两性氧化物:既能与酸反应又能与强碱反应的氧化物。
(二)氢氧化铝
【实验3-7】氢氧化铝的制备
【板书】1、制备:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【实验3-8】氢氧化铝与强酸和强碱反应
【板书】2、性质
Al(OH)3+ 3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O
两性氢氧化物:既能与酸反应又能与强碱反应的氢氧化物。
受热易分解:2Al(OH)3 Al2O3 +3H2O
3、用途:治疗胃酸过多。
【思考与交流】为什么常用可溶性的铝盐与氨水反应制取,而不用氢氧化钠溶液呢?
【过渡】根据氢氧化铝与酸和碱反应可知,铝元素的盐类有两类:铝盐(Al3+)和偏铝酸盐(AlO2-)
【板书】(三)铝盐(Al3+)和偏铝酸盐(AlO2-)
1、铝盐(Al3+):易与碱反应 制备氢氧化铝
重要的铝盐:氯化铝、硫酸铝、明矾。
【问题讨论】 ⑴在氯化铝溶液中逐滴加入氢氧化钠溶液至过量,请写出有关的离子反应方程式。
【例题】在100ml 1mol/L的AlCl3溶液中加入1mol/L的NaOH溶液,经检验生成了3.9克Al(OH)3沉淀,求加入的NaOH溶液的体积。
⑵在氢氧化钠溶液中逐滴加入氯化铝溶液至适量,请写出有关的离子反应方程式。
⑶请写出明矾[KAl(SO4)2]电离方程式。
⑷结合氯化铁和水反应制备氢氧化铁胶体,思考明矾净水原理?
【阅读】教材P59页,资料卡片。
【板书】KAl(SO4)2=K++Al3++2SO42-
Al3++ 3H2O Al(OH)3(胶体)+3H+(类似铁盐和水反应)
【板书】2、偏铝酸盐(AlO2-):与酸反应。
【讲解】只能存在于水溶液中。能与CO2、酸反应。
【板书】2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
H+不足量:AlO2-+ H++H2O=Al(OH)3↓
H+过量:Al(OH)3+ 3H+=Al3++ 3H2O
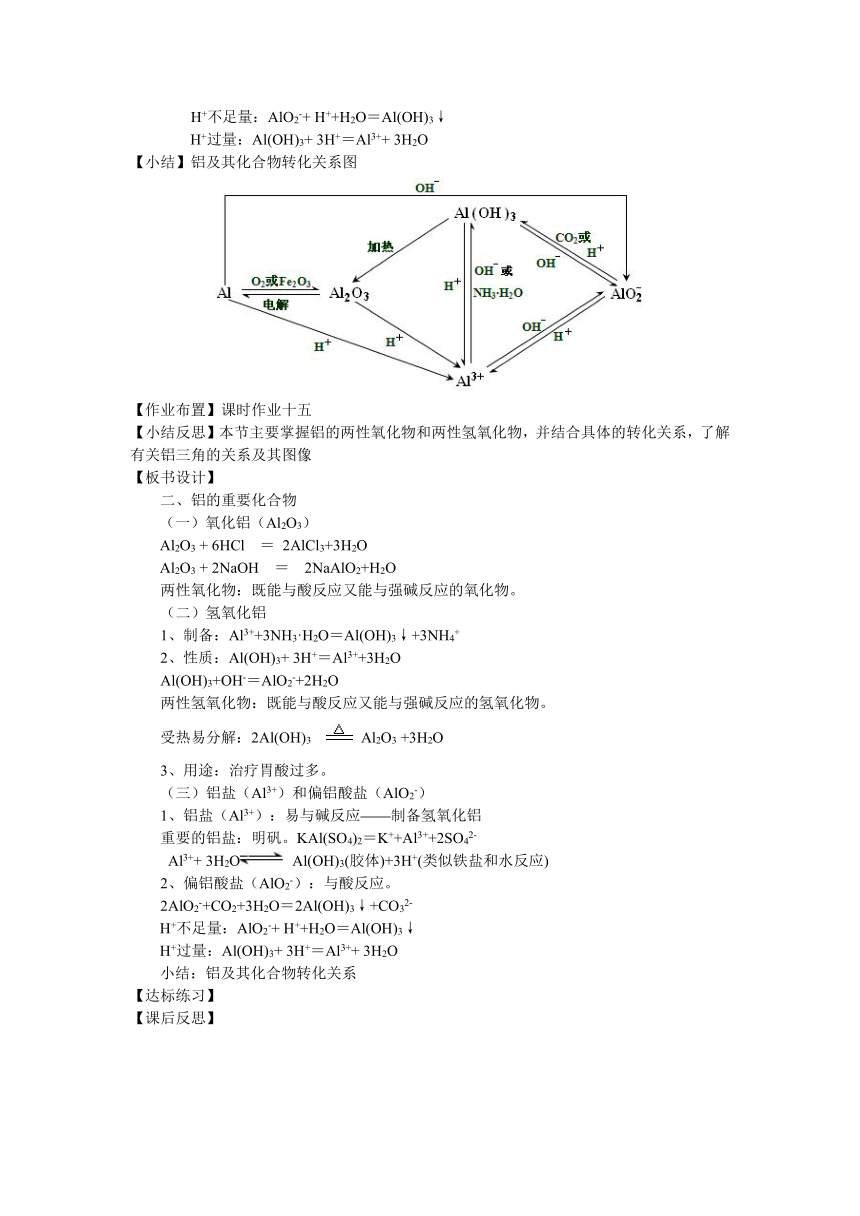
【小结】铝及其化合物转化关系图
【作业布置】课时作业十五
【小结反思】本节主要掌握铝的两性氧化物和两性氢氧化物,并结合具体的转化关系,了解有关铝三角的关系及其图像
【板书设计】
二、铝的重要化合物
(一)氧化铝(Al2O3)
Al2O3 + 6HCl = 2AlCl3+3H2O
Al2O3 + 2NaOH = 2NaAlO2+H2O
两性氧化物:既能与酸反应又能与强碱反应的氧化物。
(二)氢氧化铝
1、制备:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2、性质:Al(OH)3+ 3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
两性氢氧化物:既能与酸反应又能与强碱反应的氢氧化物。
受热易分解:2Al(OH)3 Al2O3 +3H2O
3、用途:治疗胃酸过多。
(三)铝盐(Al3+)和偏铝酸盐(AlO2-)
1、铝盐(Al3+):易与碱反应 制备氢氧化铝
重要的铝盐:明矾。KAl(SO4)2=K++Al3++2SO42-
Al3++ 3H2O Al(OH)3(胶体)+3H+(类似铁盐和水反应)
2、偏铝酸盐(AlO2-):与酸反应。
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
H+不足量:AlO2-+ H++H2O=Al(OH)3↓
H+过量:Al(OH)3+ 3H+=Al3++ 3H2O
小结:铝及其化合物转化关系
【达标练习】
【课后反思】
第三课时(铁的重要化合物)
【教学过程】
【导入】铁在地壳中的含量仅次于氧、硅和铝,居第四位,主要以+2和+3化合物的形式存在,它的重要化合物有氧化物、氢氧化物、盐。
【板书】三、铁的化合物(氧化物、氢氧化物、盐)
1、氧化物{FeO、Fe2O3、Fe3O4(FeO·Fe2O3)}
【投影】
氧化亚铁
三氧化二铁
四氧化三铁
颜色
黑色
红棕色
黑色有磁性
俗称
铁红
磁性氧化铁
溶解性
不溶
不溶
不溶
酸、碱性
碱性氧化物
碱性氧化物
复杂氧化物
与盐酸反应
与还原剂的反应(如氢气、铝等)
稳定性
不稳定
6FeO + O2 2Fe3O4
稳定
较稳定
【板书】2、氢氧化物Fe(OH)2、Fe(OH)3
1、制备:用可溶性的亚铁盐、铁盐与碱反应。
【实验3-9】Fe(OH)2、Fe(OH)3的制备
【投影】
氢氧化亚铁
氢氧化铁
制备
Fe2 + + 2OH- =Fe(OH)2
Fe3 + + 3OH- =Fe(OH)3
物理性质
白色固体,难溶于水。
红棕色固体,难溶于水。
与盐酸反应
Fe(OH)2 + 2H+= Fe2+ + 2H2O
Fe(OH)3 + 3H+= Fe3+ + 3H2O
稳定性
Fe(OH)2白色,不稳定,易被氧化红褐色Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
现象:白色→灰绿色→红褐色
Fe(OH)3红褐色,不稳定易分解为Fe2O3
2Fe(OH)3 Fe2O3+ 3H2O
【思考】看来Fe(OH)2很容易转化为Fe(OH)3,通常要制成较纯的Fe(OH)2需要采取什么的措施?
【板书】3、铁盐和亚铁盐
⑴Fe3+的检验:试剂KSCN或NH4SCN
【实验3-10】Fe3+的检验
【投影】
滴入KSCN溶液
FeCl3溶液
溶液呈红色(Fe3+ + 3SCN—= Fe(SCN)3)
FeCl2溶液
无明显变化
【板书】⑵Fe3+ 和Fe2 +的转化
【实验】Fe3+被Fe还原
【板书】Fe3+被还原为Fe2+:
2Fe3+ + Fe = 3Fe2+ (在Fe3+ 溶液中,加入Fe,Fe溶解而无气体)
【实验】Fe2+被氯水氧化
【板书】Fe2+被氧化为Fe3+:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl—(Cl2、Br2可氧化Fe2 + )
【投影】
操作
现象
反应的离子方程式
Fe3+溶液中加入铁粉、加入KSCN溶液
溶液先由黄色变为绿色,后无明显变化
2Fe3+ + Fe = 3Fe2+
Fe2+溶液中加入氯水、加入KSCN溶液
溶液先由浅绿色变为黄色,后变为红色
2Fe2++Cl2=Fe3++ 2Cl-
【小结】
2Fe3+ + Cu = 2Fe2+ + Cu2+用FeCl3溶液腐蚀铜,印刷电路)
2Fe3+ + 2I- = Fe2++ I2 (Fe3+ 能使KI淀粉试纸变蓝)
2Fe2 + + H2O2 + 2H + = 2Fe3 + + 2H2O (双氧水可氧化Fe2 + )
5Fe2 ++ MnO4- + 8H + = 5Fe3 ++ 5Mn2 + + 4H2O(Fe2+可使KMnO4溶液褪色)
【作业布置】课时作业十六
【小结反思】重点掌握铁三角关系,注意氧化还原反应的顺序!
【板书设计】
三、铁的化合物(氧化物、氢氧化物、盐)
1、氧化物{FeO、Fe2O3、Fe3O4(FeO·Fe2O3)}
2、氢氧化物Fe(OH)2、Fe(OH)3
3、铁盐和亚铁盐
【达标练习】
【课后反思】
【三维目标】
〖知识与技能〗
1、了解氧化钠和过氧化钠的物理性质,了解焰色反应感受化学的现象美
2、了解氧化钠、过氧化钠的化学性质,会描述氧化钠、过氧化钠与水反应,与二氧化碳反应的现象,会写反应的化学方程式
3、加深对碱性氧化物的认识,知道过氧化钠是一种特殊氧化物,能说出过氧化钠的应用
4、认识Na2CO3、NaHCO3的性质及转化
5、掌握Al2O3、Al(OH)3的两性,掌握“Al三角”关系,掌握几种重要氢氧化物的制备和性质
6、掌握Fe(OH)2氧化成Fe(OH)3的过程,掌握Fe3+的检验及氧化性,明确Fe2+与Fe3+的相互转化,掌握“铁三角”
〖过程与方法〗
1、通过氧化钙和氧化钠的对比学习,锻炼学生由旧的知识联系迁移,学习新知识的能力
2、通过过氧化钠与水的反应学习,锻炼学生在学习中对实验的观察、分析、设计能力
3、通过演示实验和学生实验相结合的方法,使学生理解、掌握Al2O3和Al(OH)3的两性及Al(OH)3的制备方法
4、结合演示实验使学生理解Al(OH)3生成及溶解的有关图象,并能灵活分析解决一般的计算问题
5、通过启发、诱导和实验探究,突破教学难点
6、将实验探究与讨论交流密切结合;学习运用比较、归纳、分析、综合的学习方法
〖情感态度与价值观〗
1、激发学生学习兴趣,体验化学学科的丰富多彩
2、体验科学探究的艰辛和喜悦
3、让学生体会科学研究的乐趣,体验合作和动手的整个过程的积极的情绪
4、养成务实求真、勇于探索的科学态度,重点培养学生“主动参与、乐于探究、交流合作”的精神
【重点难点】
运用比较法学习金属氧化物的性质、Na2CO3、NaHCO3的性质及转化、Al2O3、Al(OH)3的两性、Al(OH)3生成和溶解的图象及计算、三价铁的氧化性 及Fe、Fe2+、Fe3+的转化、氢氧化亚铁的制备和性质、
【教学方法】
列表比较法、实验探究法、启发引导法、多媒体辅助教学
【实验准备】
实验3—5、实验3—6、实验3—7、实验3—8、实验3—9、实验3—10
第二课时(铝的重要化合物)
【教学过程】
【导入】在第一节里,我们学习了几种重要金属的化学性质,知道铝是地壳中含量最高的金属元素,铝的化学性质比较活泼,人们发现并制得单质铝却比较晚,从铝的化合物中提炼铝单质比较困难,但铝的许多化合物在人类的生产和生活中具有重要的作用。今天我们来学习铝的重要化合物,那么铝有哪些重要的化合物呢?他们在我们日常生活中都有什么作用呢。
【投影】
Al → Al2O3 → Al(OH)3 → 铝盐(如明矾)、偏铝酸盐(AlO2-)
【板书】二、铝的重要化合物
(一)氧化铝(Al2O3)
【阅读】教材P58页相关内容
【归纳】物理性质:白色固体,难溶于水,熔点高。是人选刚玉、人选宝石的主要成分。
化学性质:既能与强酸反应,又能与强碱反应。
用途:做耐火材料。
【板书】Al2O3 + 6HCl = 2AlCl3+3H2O
Al2O3 + 2NaOH = 2NaAlO2+H2O
两性氧化物:既能与酸反应又能与强碱反应的氧化物。
(二)氢氧化铝
【实验3-7】氢氧化铝的制备
【板书】1、制备:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【实验3-8】氢氧化铝与强酸和强碱反应
【板书】2、性质
Al(OH)3+ 3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O
两性氢氧化物:既能与酸反应又能与强碱反应的氢氧化物。
受热易分解:2Al(OH)3 Al2O3 +3H2O
3、用途:治疗胃酸过多。
【思考与交流】为什么常用可溶性的铝盐与氨水反应制取,而不用氢氧化钠溶液呢?
【过渡】根据氢氧化铝与酸和碱反应可知,铝元素的盐类有两类:铝盐(Al3+)和偏铝酸盐(AlO2-)
【板书】(三)铝盐(Al3+)和偏铝酸盐(AlO2-)
1、铝盐(Al3+):易与碱反应 制备氢氧化铝
重要的铝盐:氯化铝、硫酸铝、明矾。
【问题讨论】 ⑴在氯化铝溶液中逐滴加入氢氧化钠溶液至过量,请写出有关的离子反应方程式。
【例题】在100ml 1mol/L的AlCl3溶液中加入1mol/L的NaOH溶液,经检验生成了3.9克Al(OH)3沉淀,求加入的NaOH溶液的体积。
⑵在氢氧化钠溶液中逐滴加入氯化铝溶液至适量,请写出有关的离子反应方程式。
⑶请写出明矾[KAl(SO4)2]电离方程式。
⑷结合氯化铁和水反应制备氢氧化铁胶体,思考明矾净水原理?
【阅读】教材P59页,资料卡片。
【板书】KAl(SO4)2=K++Al3++2SO42-
Al3++ 3H2O Al(OH)3(胶体)+3H+(类似铁盐和水反应)
【板书】2、偏铝酸盐(AlO2-):与酸反应。
【讲解】只能存在于水溶液中。能与CO2、酸反应。
【板书】2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
H+不足量:AlO2-+ H++H2O=Al(OH)3↓
H+过量:Al(OH)3+ 3H+=Al3++ 3H2O
【小结】铝及其化合物转化关系图
【作业布置】课时作业十五
【小结反思】本节主要掌握铝的两性氧化物和两性氢氧化物,并结合具体的转化关系,了解有关铝三角的关系及其图像
【板书设计】
二、铝的重要化合物
(一)氧化铝(Al2O3)
Al2O3 + 6HCl = 2AlCl3+3H2O
Al2O3 + 2NaOH = 2NaAlO2+H2O
两性氧化物:既能与酸反应又能与强碱反应的氧化物。
(二)氢氧化铝
1、制备:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
2、性质:Al(OH)3+ 3H+=Al3++3H2O
Al(OH)3+OH-=AlO2-+2H2O
两性氢氧化物:既能与酸反应又能与强碱反应的氢氧化物。
受热易分解:2Al(OH)3 Al2O3 +3H2O
3、用途:治疗胃酸过多。
(三)铝盐(Al3+)和偏铝酸盐(AlO2-)
1、铝盐(Al3+):易与碱反应 制备氢氧化铝
重要的铝盐:明矾。KAl(SO4)2=K++Al3++2SO42-
Al3++ 3H2O Al(OH)3(胶体)+3H+(类似铁盐和水反应)
2、偏铝酸盐(AlO2-):与酸反应。
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
H+不足量:AlO2-+ H++H2O=Al(OH)3↓
H+过量:Al(OH)3+ 3H+=Al3++ 3H2O
小结:铝及其化合物转化关系
【达标练习】
【课后反思】
第三课时(铁的重要化合物)
【教学过程】
【导入】铁在地壳中的含量仅次于氧、硅和铝,居第四位,主要以+2和+3化合物的形式存在,它的重要化合物有氧化物、氢氧化物、盐。
【板书】三、铁的化合物(氧化物、氢氧化物、盐)
1、氧化物{FeO、Fe2O3、Fe3O4(FeO·Fe2O3)}
【投影】
氧化亚铁
三氧化二铁
四氧化三铁
颜色
黑色
红棕色
黑色有磁性
俗称
铁红
磁性氧化铁
溶解性
不溶
不溶
不溶
酸、碱性
碱性氧化物
碱性氧化物
复杂氧化物
与盐酸反应
与还原剂的反应(如氢气、铝等)
稳定性
不稳定
6FeO + O2 2Fe3O4
稳定
较稳定
【板书】2、氢氧化物Fe(OH)2、Fe(OH)3
1、制备:用可溶性的亚铁盐、铁盐与碱反应。
【实验3-9】Fe(OH)2、Fe(OH)3的制备
【投影】
氢氧化亚铁
氢氧化铁
制备
Fe2 + + 2OH- =Fe(OH)2
Fe3 + + 3OH- =Fe(OH)3
物理性质
白色固体,难溶于水。
红棕色固体,难溶于水。
与盐酸反应
Fe(OH)2 + 2H+= Fe2+ + 2H2O
Fe(OH)3 + 3H+= Fe3+ + 3H2O
稳定性
Fe(OH)2白色,不稳定,易被氧化红褐色Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
现象:白色→灰绿色→红褐色
Fe(OH)3红褐色,不稳定易分解为Fe2O3
2Fe(OH)3 Fe2O3+ 3H2O
【思考】看来Fe(OH)2很容易转化为Fe(OH)3,通常要制成较纯的Fe(OH)2需要采取什么的措施?
【板书】3、铁盐和亚铁盐
⑴Fe3+的检验:试剂KSCN或NH4SCN
【实验3-10】Fe3+的检验
【投影】
滴入KSCN溶液
FeCl3溶液
溶液呈红色(Fe3+ + 3SCN—= Fe(SCN)3)
FeCl2溶液
无明显变化
【板书】⑵Fe3+ 和Fe2 +的转化
【实验】Fe3+被Fe还原
【板书】Fe3+被还原为Fe2+:
2Fe3+ + Fe = 3Fe2+ (在Fe3+ 溶液中,加入Fe,Fe溶解而无气体)
【实验】Fe2+被氯水氧化
【板书】Fe2+被氧化为Fe3+:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl—(Cl2、Br2可氧化Fe2 + )
【投影】
操作
现象
反应的离子方程式
Fe3+溶液中加入铁粉、加入KSCN溶液
溶液先由黄色变为绿色,后无明显变化
2Fe3+ + Fe = 3Fe2+
Fe2+溶液中加入氯水、加入KSCN溶液
溶液先由浅绿色变为黄色,后变为红色
2Fe2++Cl2=Fe3++ 2Cl-
【小结】
2Fe3+ + Cu = 2Fe2+ + Cu2+用FeCl3溶液腐蚀铜,印刷电路)
2Fe3+ + 2I- = Fe2++ I2 (Fe3+ 能使KI淀粉试纸变蓝)
2Fe2 + + H2O2 + 2H + = 2Fe3 + + 2H2O (双氧水可氧化Fe2 + )
5Fe2 ++ MnO4- + 8H + = 5Fe3 ++ 5Mn2 + + 4H2O(Fe2+可使KMnO4溶液褪色)
【作业布置】课时作业十六
【小结反思】重点掌握铁三角关系,注意氧化还原反应的顺序!
【板书设计】
三、铁的化合物(氧化物、氢氧化物、盐)
1、氧化物{FeO、Fe2O3、Fe3O4(FeO·Fe2O3)}
2、氢氧化物Fe(OH)2、Fe(OH)3
3、铁盐和亚铁盐
【达标练习】
【课后反思】
