2021-2022学年高一下学期化学鲁科版(2019)必修第二册第1章《原子结构元素周期律》测试题 含答案
文档属性
| 名称 | 2021-2022学年高一下学期化学鲁科版(2019)必修第二册第1章《原子结构元素周期律》测试题 含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 263.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-19 18:22:34 | ||
图片预览




文档简介
第1章《原子结构 元素周期律》测试题
一、单选题(共15题)
1.LiFePO4常用作锂电池的正极材料,其中锂为3号元素,在周期表中的位置是
A.第二周期第IA族 B.第二周期第IIA族
C.第三周期第IA族 D.第三周期第IIIA族
2.硅及其化合物在人类进步中发挥了重要作用。和用于制造芯片,用于制造光纤,用作木材防火剂。下列说法正确的是
A.在自然界以游离态存在 B.和具有优良的导电性
C.不与酸反应 D.溶液可与反应
3.下列说法不正确的是
A.侯德榜是我国著名化工专家,发明了侯氏制碱法
B.门捷列夫提出了元素周期律,编制出第一张元素周期表
C.玻尔发现原子中存在电子,电子在原子核外空间的一定轨道上绕核做高速圆周运动
D.舍勒发现了一种黄绿色气体,戴维确认该气体为氯气
4.化学与生活密切相关。下列叙述错误的是
A.氢氟酸可用于雕刻玻璃
B.铝制餐具不宜长时间存放酸性、碱性和咸的食物
C.超市中售卖的“苏打水”是因添加了而获名
D.农村推广风力发电、光伏发电有利于国家实现“碳达峰、碳中和”
5.德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是
A.“水瓶”、冰水混合物都是混合物 B.石墨和C60互为同位素
C.磷酸钙是电解质 D.一定条件下石墨转化为C60是物理变化
6.锗元素在元素周期表中的信息如图所示。下列有关锗元素的说法错误的是
A.属于金属元素 B.位于第四周期IVA族
C.原子核外有32个电子 D.相对原子质量为72.63g/mol
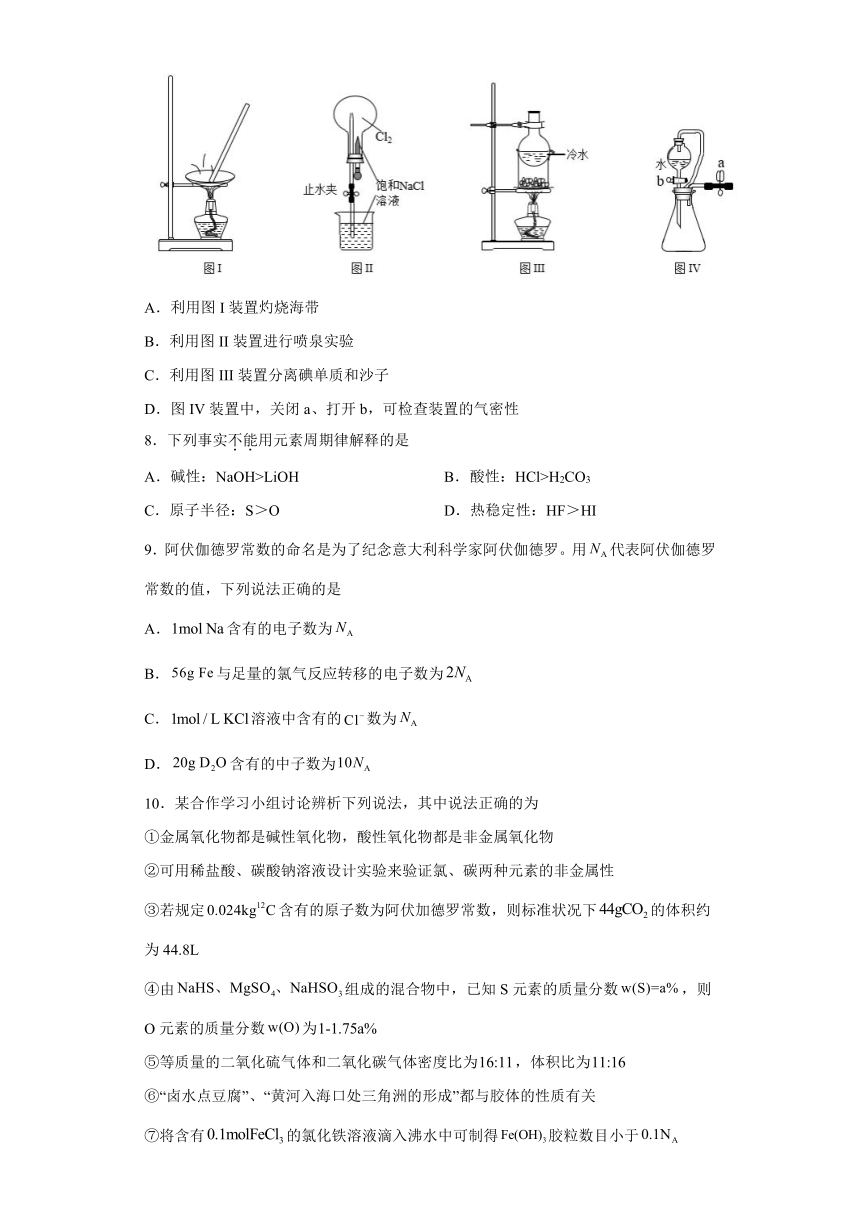
7.利用下列装置和试剂进行实验,能达到实验目的的是
A.利用图I装置灼烧海带
B.利用图II装置进行喷泉实验
C.利用图III装置分离碘单质和沙子
D.图IV装置中,关闭a、打开b,可检查装置的气密性
8.下列事实不能用元素周期律解释的是
A.碱性:NaOH>LiOH B.酸性:HCl>H2CO3
C.原子半径:S>O D.热稳定性:HF>HI
9.阿伏伽德罗常数的命名是为了纪念意大利科学家阿伏伽德罗。用代表阿伏伽德罗常数的值,下列说法正确的是
A.含有的电子数为
B.与足量的氯气反应转移的电子数为
C.溶液中含有的数为
D.含有的中子数为
10.某合作学习小组讨论辨析下列说法,其中说法正确的为
①金属氧化物都是碱性氧化物,酸性氧化物都是非金属氧化物
②可用稀盐酸、碳酸钠溶液设计实验来验证氯、碳两种元素的非金属性
③若规定含有的原子数为阿伏加德罗常数,则标准状况下的体积约为44.8L
④由组成的混合物中,已知S元素的质量分数,则O元素的质量分数为
⑤等质量的二氧化硫气体和二氧化碳气体密度比为,体积比为
⑥“卤水点豆腐”、“黄河入海口处三角洲的形成”都与胶体的性质有关
⑦将含有的氯化铁溶液滴入沸水中可制得胶粒数目小于
⑧氯气因为其沸点较高易液化
A.①②③⑥ B.②⑥⑦⑧ C.③④⑤⑦ D.④⑥⑦⑧
11.2021年4月9日,北京大学材料物理研究所叶堉团队利用相变和重结晶的方法,在非晶SiO2/Si表面上实现了二维半导体碲化钼( Te位于第五周期,第VIA族)单晶薄膜的无缝制备,发表在英国科学杂质《Science》上。下列叙述错误的是
A.0.5mol碲化钼含有的中子数目为102mol
B.碲原子有五个电子层,最外层电子数为6
C.重结晶过程可使不纯的物质的获得纯化
D.钼元素位于第五周期VIB族
12.不能用元素周期律解释的是
A.酸性: B.碱性:
C.与水反应:K比剧烈 D.与反应:比剧烈
13.一种由四种短周期主族元素组成的化合物(如图所示)可用作化肥和木材、纸张、织物的防火剂,也用于制药和反刍动物饲料添加剂,其中W、X、Y、Z的原子序数依次增大且X与Y、Z均相邻。下列有关说法错误的是
A.该化合物中Z的化合价为+5价 B.简单氢化物的沸点:X>Z
C.原子半径:Z>X>Y>W D.Z的最高价氧化物对应的水化物为强酸
14.半导体器件的研制正式开始于锗(元素符号为Ge),后来发展到研制与它同主族的硅,下列有关锗的叙述不合理的是
A.锗元素的氧化物化学式为GeO2
B.锗是原子序数为32的一种过渡元素
C.锗在周期表中的位置是第四周期IVA族
D.锗处于周期表中金属与非金属的分界处
15.下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法不正确的是
A.气态氢化物的稳定性:Y>X
B.Z与M两者的最高价氧化物的水化物能相互反应
C.X、Z形成的化合物中可能含有共价键
D.N的气态氢化物及其氧化物对应的水化物均为强酸
二、填空题(共8题)
16.含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向③中加入NaOH溶液并在空气中放置,现象是______有关化学方程式为__
(3)加入过量Na2O2溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
17.下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
一 ①
二 ② ③ ④ ⑤
三 ⑥ ⑦ ⑧ ⑨ ⑩
(1)金属性最强的是___________(填元素名称)。
(2)⑨的离子结构示意图为___________。
(3)⑤元素和⑩元素的最简单氢化物的稳定性由强到弱的关系是___________(填化学式)。
(4)④、⑤、⑥的简单离子半径由大到小的顺序为___________(用离子符号表示)。
(5)⑧、⑨、⑩最高价氧化物对应的水化物酸性由弱到强的顺序是___________(填化学式)
(6)用电子式表示④与⑥形成的原子个数比为1 ∶2的化合物的形成过程___________。
(7)⑧单质与⑥的最高价氧化物水化物的溶液发生反应,写出生成的阴离子为___________。
18.下表是元素周期表的一部分,请依据该表回答问题。
(1)第2周期VIIA族元素的原子结构示意图是___________,该元素与同周期IA族元素组成的化合物类型是___________(填“离子化合物”或“共价化合物”)。
(2)第3周期元素的最高价氧化物对应水化物中,碱性最强的是___________(填化学式,下同);具有两性的是___________。加热时,碳单质能与S的最高价氧化物对应的水化物的浓溶液反应,写出该反应的化学方程式___________。
(3)下列判断正确的是___________(填标号)。
A.最低负化合价的绝对值:P>S
B.非金属性:P>N
C.离子半径:Mg2+>O2
D.还原性:S2 >Cl
19.A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题。
(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式__。
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色。则F的化学式为__。
(3)若A为淡黄色固体,则A与水反应的化学方程式为___。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即__。C与F反应的化学方程式为___。
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式___。
20.A、B、C、D四种元素的核电荷数依次增多,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等;D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四种元素的符号依次是A_______;B_______;C_______;D_______。
(2)它们的原子半径由大到小的顺序是_______(用元素符号表示)。
(3)四种元素的简单离子的半径大小顺序是_______。
21.下表为元素周期表的短周期部分,①~⑦代表七种短周期元素。
① ② ③ ④
⑤ ⑥ ⑦
已知:⑤的焰色试验火焰呈黄色。
请填写下列空白:
(1)②在元素周期表中的位置为___________;①的原子结构示意图为___________。
(2)③的一种核素的中子数为10,其原子符号为___________(用形式表示)。
(3)④和⑦中非金属性较弱的是___________(填元素符号)。
(4)①和⑤中原子半径较大的是___________(填元素符号),与⑤同族的下一周期元素和③的最简单氢化物反应的离子方程式为___________。
(5)将⑥的氧化物加入⑤的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为___________。
22.按要求回答问题。
Ⅰ.(1)硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,则KAlSi3O8可表示为________________________,Al2Si2O5(OH)4可表示为________________________。
(2)将0.2mol钠和铝的混合物溶于足量的盐酸中,产生3136mL(标准状况下)氢气,则钠和铝的物质的量之比为___________;写出钠与足量盐酸反应的化学方程式__________________________________。
Ⅱ.将3.8 g Na2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62 g。求:
(1)混合物中NaHCO3的质量___________。
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,生成气体的的质量为___________。
23.氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。某兴趣小组用四氯化硅与氮气在氢气气氛保护下,加热发生反应,可得较高纯度的氮化硅及氯化氢,设计如图所示装置。
试回答下列问题:
(1)实验室制备氢气常用锌和稀硫酸反应,制取时常在反应混合物中加入少量硫酸铜溶液,其目的是_______。
(2)图中装置A的作用是_______、调节通入气体速率和充分混合气体。通过观察_______,来调节通入气体的速率。
(3)加热B玻璃管之前,为防止意外发生,必须进行的操作是_______(不用详述步骤),B中发生反应的化学方程式为_______。
(4)四氯化硅与水反应生成两种酸,写出用烧碱溶液吸收尾气中四氯化硅的化学方程式:_______。
参考答案:
1.A
【详解】
根据锂为3号元素,锂原子核外有3个电子,核外电子排布为2、1,故为第二周期第IA族,选A。
2.D
【详解】
A.硅在自然界中以化合态存在,而不是游离态形式存,故A错误;
B.和属于半导体,导电能力弱,故B错误;
C.SiO2能与氢氟酸发生反应,而不是不与任何酸反应,故C错误;
D.碳酸的酸性比硅酸强,则Na2SiO3溶液可与反应生成H2SiO3,故D正确;
故选:D。
3.C
【详解】
A.中国化学家侯德榜发明了侯氏制碱法,从而打破了外国对中国的技术封锁,A正确;
B.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循,B正确;
C.汤姆生发现了电子并由此提出了“葡萄干面包式”模型,波尔提出的原子结构模型为:电子在原子核外空间的一定轨道上绕核做高速圆周运动,C错误;
D.舍勒发现了一种黄绿色气体,戴维确认该气体为氯气,D正确;
故答案为:C。
4.C
【详解】
A.氢氟酸在常温下能和玻璃中的SiO2反应,所以氢氟酸可用于雕刻玻璃,故A正确;
B.铝能和酸、碱反应,在NaCl溶液中,铝会被腐蚀,所以铝制餐具不宜长时间存放酸性、碱性和咸的食物,故B正确;
C.超市中售卖的“苏打水”是因添加了 NaHCO3 而获名,碳酸钠碱性过强,不能添加到水中,故C错误;
D.农村推广风力发电、光伏发电,减少燃煤发电,有利于国家实现“碳达峰、碳中和”,故D正确;
故选C。
5.C
【详解】
A.冰水混合物只含一种物质,属于纯净物,A错误;
B.石墨和均是碳元素组成的单质,互称为同素异形体,B错误;
C.磷酸钙属于盐类,熔融状态下能导电,是电解质,C正确;
D.石墨转化为生成了新的物质,是化学变化,D错误;
故选C。
6.D
【详解】
A. 锗元素带“钅”字旁,属于金属元素,故A不选;
B. 锗原子有4个电子层,最外层有4个电子,位于第四周期IVA族,故B不选;
C. 原子序数是32号,原子核外有32个电子,故C不选
D. 相对原子质量的单位不是“g/mol”而是“1”,通常省略不写,故D选;
故选D。
7.C
【详解】
A.灼烧应在坩埚中进行,不能使用蒸发皿,A不符合题意;
B.氯气难溶于饱和氯化钠溶液,所以无法用该装置进行喷泉实验,B不符合题意;
C.碘易升华,而沙子的熔沸点较高,加热时,碘升华之后在烧瓶底部冷凝,实现碘单质和沙子的分离,C符合题意;
D.由于导管的存在,可以平衡压强,关闭a后即便气密性良好,分液漏斗中的水也能低落下来,无法检验气密性,D不符合题意;
综上所述答案为C。
8.B
【详解】
A.钠的金属性强于锂,其最高价氧化物水化物的碱性NaOH强于LiOH,能用元素周期律解释,A不符合题意;
B.HCl不是氯元素的最高价氧化物水化物,不能用元素周期律解释酸性:HCl>H2CO3,B符合题意;
C.同主族元素的原子半径从上往下逐渐增大,故原子半径:S>O,能用元素周期律解释,C不符合题意;
D.F的非金属性比I强,与H形成的共价键键能HF>HI,故热稳定性:HF>HI,能用元素周期律解释,D不符合题意;
故选B。
9.D
【详解】
A.Na是11号元素,含有的电子数为11,故A错误;
B.Fe与氯气反应生成氯化铁,为1mol,与足量的氯气反应转移的电子数为,故B错误;
C.未指明体积,无法计算,故C错误;
D.含有10个中子,为1mol,含有的中子数为,故D正确;
故答案为D。
10.D
【详解】
①金属氧化物不一定都是碱性氧化物,如氧化铝为两性氧化物,酸性氧化物不一定都是非金属氧化物,如七氧化二锰为酸性氧化物,故错误;
②非金属性的强弱与最高价氧化物对应水化物的酸性有关,与氢化物的酸性无关,则不能用稀盐酸、碳酸钠溶液设计实验来验证氯、碳两种元素的非金属性,故错误;
③若规定0.024kg12C含有的原子数为阿伏加德罗常数,则标准状况下44g二氧化碳的体积约为×44.8L/mol=22.4L,故错误;
④由NaH和Mg的式量都为24可知,混合物中NaH可以视作Mg,若硫元素的质量分数为a%,则Mg元素的质量分数为×a%=0.75a%,氧元素的质量分数为1—a%—0.75a%=1—1.75a%,故正确;
⑤缺同温同压的条件下,无法计算等质量的二氧化硫气体和二氧化碳气体的体积比,故错误;
⑥“卤水点豆腐”、“黄河入海口处三角洲的形成”都是电解质溶液使胶体产生聚沉的过程,都与胶体的性质有关,故正确;
⑦氢氧化铁胶体是粒子的聚合体,则将含有0.1mol氯化铁溶液滴入沸水中可制得氢氧化铁胶粒数目小于0.1NA,故正确;
⑧氯气因为常温常压下沸点较高,高亚低温条件下易液化得到液氯,故正确;
④⑥⑦⑧正确,故选D。
11.A
【详解】
A.0.5molMoTe2的含有中子的物质的量为102mol,数目应为102NA,选项A错误;
B.碲与氧同主族,位于第五周期,原子有五个电子层,最外层电子数为6,选项B正确;
C.重结晶是一种常见的提纯方法,可使不纯的物质的获得纯化,选项C正确;
D.钼元素位于第五周期VIB族,选项D正确;
答案选A。
12.A
【详解】
A.元素的非金属性与氢化物的酸性无关,则元素的酸性强于碳酸不能用元素周期律解释,故A符合题意;
B.同周期元素,从左到右元素的金属性依次减小,最高价氧化物对应水化物的碱性减弱,则氢氧化钠的碱性强于氢氧化镁能用元素周期律解释,故B不符合题意;
C.同主族元素,从上到下元素的金属性依次增强,与水反应的剧烈程度增大,则钾与水反应的剧烈程度强于钠能用元素周期律解释,故C不符合题意;
D.同主族元素,从上到下元素的非金属性依次减弱,与氢气反应的剧烈程度减弱,则氟气与氢气反应的剧烈程度强于氯气能用元素周期律解释,故D不符合题意;
故选A。
13.D
【详解】
根据上述分析可知:W是H,X是N,Y是O,Z是P元素。
A.根据物质结构可知该化合物化学式是NH4H2PO4,其中P元素化合价为+5价,A正确;
B.X是N,Z是P元素,它们形成的氢化物化学式分别是NH3、PH3,二者都是由分子构成,由于NH3分子之间除存在分子间作用力外还存在氢键,所以简单氢化物的沸点:NH3>PH3,用字母表示为:X>Z,B正确;
C.同一周期元素,原子序数越大,原子半径越小;不同周期元素,元素的周期序数越大,原子半径就越大,则四种元素的原子半径大小关系为:Z(P)>X(N)>Y(O)>W(H),C正确;
D.Z是P元素,P的最高价氧化物对应的水化物H3PO4是中强酸,在水中不能完全电离,存在电离平衡,因此H3PO4属于弱酸,D错误;
故合理选项是D。
14.B
【详解】
A.因锗(Ge)元素为+4价,则其氧化物的化学式为GeO2,选项A正确;
B.锗是原子序数为32的元素,位于第四周期ⅣA族元素,不属于过渡元素,选项B不正确;
C.锗是原子序数为32的元素,在周期表中的位置是第四周期IVA族,选项C正确;
D.锗(Ge)是第四周期第ⅣA元素,处于周期表中金属区与非金属区的交界线上,选项D正确;
答案选B。
15.D
【详解】
A.非金属性F>O,故气态氢化物稳定性HF>H2O,故A正确;
B.氢氧化铝具有两性,故能与氢氧化钠反应,故B正确;
C.Na与O形成的Na2O2中含有共价键,故C正确;
D.Cl的氧化物对应的水化物HClO为弱酸,故D错误;
故选D。
16.(1)Fe2+
(2) 生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色 Fe2++2OH—=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4 Fe(OH)3
(3)Al3+
(4) Fe3+ Ag+
(5)Fe3+
(6)Ag+
【解析】
(1)Fe2+既能被氧化为Fe3+,也能被还原为Fe,故此处填Fe2+;
(2)Fe2+遇到NaOH溶液,首先生成白色Fe(OH)2沉淀,之后迅速转化为灰绿色沉淀,最终转化为红褐色沉淀,故此处填:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;对应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)过量Na2O2加入溶液中,与水反应生成过量的NaOH,Al3+结合OH-生成Al(OH)3沉淀,由于Al(OH)3溶于NaOH溶液,故无沉淀,此处填Al3+;
(4)加入铁粉后,①号溶液与⑤号溶液能与Fe发生反应,①号溶液发生反应:Fe+2Ag+=2Ag+Fe2+,溶液质量减轻,⑤号溶液发生反应:Fe+2Fe3+=3Fe2+,溶液质量增重,故此处依次填:Fe3+、Ag+;
(5)Fe3+与SCN-结合生成Fe(SCN)3,使溶液显红色,故此处填Fe3+;
(6)Ag+与Cl-反应生成白色沉淀,可以用来鉴别Cl-,故此处填Ag+。
17.(1)钠
(2)
(3)HF>HCl
(4)r(O2-)>r(F-)>r(Na+)
(5)H2SiO3<H2SO4<HClO4
(6)
(7)
【解析】
由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为Si、⑨为S、⑩为Cl,据此解答。
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故表中各元素中Na的金属性最强;
(2)⑨为S、硫离子的结构示意图为;
(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则⑤元素和⑩元素的最简单氢化物的稳定性由强到弱的关系是HF>HCl;
(4)④、⑤、⑥的简单离子具有相同的核外电子排布,其离子半径随原子序数的增大而减小,则离子半径由大到小的顺序为r(O2-)>r(F-)>r(Na+)。
(5)同周期自左向右非金属性逐渐增强,最高价含氧酸的酸性逐渐增强,则⑧、⑨、⑩最高价氧化物对应的水化物酸性由弱到强的顺序是H2SiO3<H2SO4<HClO4;
(6)④与⑥形成的原子个数比为1∶2的化合物是离子化合物氧化钠,用电子式表示其形成过程为。
(7)⑧单质与⑥的最高价氧化物水化物的溶液发生反应生成硅酸钠和氢气,则生成的阴离子为。
18.(1) 离子化合物
(2) NaOH Al(OH)3 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(3)AD
【解析】
(1)第2周期ⅦA族元素含有2个电子层,最外层电子数为7,质子数为9,为F元素,F的原子结构示意图为,F与同周期IA族元素组成的化合物为LiF,LiF为离子化合物,故答案为:;离子化合物;
(2)第3周期元素中,Na的金属性最强,Al的氢氧化物具有两性,则第3周期元素的最高价氧化物对应水化物中,碱性最强的是NaOH,具有两性的氢氧化物为Al(OH)3;S的最高价氧化物对应的水化物的浓溶液为浓硫酸,加热时,碳单质能与浓硫酸反应生成二氧化碳、二氧化硫和水,该反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,
故答案为:NaOH;Al(OH)3;C+2H2SO4(浓)CO2↑+2SO2↑+2H2O;
(3)A.P、S的最低价分别为-3、-2,则最低负化合价的绝对值:P>S,故A正确;
B.同一主族从上到下非金属性逐渐减弱,则非金属性:P<N,故B错误;
C.Mg2+、O2-都含有2个电子层,核电荷数越大离子半径越小,则离子半径:Mg2+<O2-,故C错误;
D.非金属性S<Cl,非金属性越强,简单阴离子的还原性越弱,则阴离子的还原性:S2->Cl-,故D正确;
故答案为:AD。
19.(1)Fe+4H++=Fe3++NO↑+2H2O
(2)Na2CO3
(3) 2Na2O2+2H2O=4NaOH+O2↑ 酸雨 2H2S+SO2=3S↓+2H2O Al3+ +3+6H2O=4Al(OH)3↓
【解析】
(1)A为有色气体,若F是一种金属单质,由转化关系可知,F为变价金属,则为Fe,因为A为有色气体,与水反应生成B与E,则A为二氧化氮,B为硝酸,B和适量F反应生成C与气体E的离子方程式:Fe+4H++=Fe3++NO↑+2H2O;
(2)A为双原子分子,E具有漂白性,A与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,C为直线型分子,物质F焰色反应呈黄色,含有Na元素,结合转化关系可知,C为二氧化碳,F为Na2CO3;
(3)A为淡黄色固体,能与水反应,则A为过氧化钠,A与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题,结合转化关系,B为氧气、C为SO2、F为H2S,C的大量排放往往会造成严重的酸雨,C与F反应的化学方程式为2H2S+SO2=3S↓+2H2O;
②若物质A和D的式量相等,D为白色絮状沉淀,结合转化关系,B为NaOH、C为NaAlO2、F为铝盐、D为Al(OH)3,C与F反应的离子方程式Al3+ +3+6H2O=4Al(OH)3↓。
20.(1) S Cl K Ca
(2))K、Ca、S、Cl
(3)S2->Cl->K+>Ca2+
【解析】
A原子有3个电子层,电子数分别为2、8、6,故A为S元素;D原子有4个电子层,电子数分别为2、8、8、2,故D为Ca元素;由于A、B、C、D的能形成离子,且核电荷数依次增多,因此B为S元素、C为K元素;
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca;
(2)K、Ca位于第四周期,S、Cl位于第三周期,电子层数越多原子半径越大,电子层数相同的,原子序数越大的半径越小,则半径由大到小的顺序是:K、Ca、S、Cl;
(3)四种元素的简单离子都是18电子,电子层数相同,则原子序数越大的离子半径越小,大小顺序是S2->Cl->K+>Ca2+。
21.(1) 第二周期第ⅣA族
(2)
(3)Cl
(4) Na
(5)
【解析】
⑤的焰色试验呈黄色,说明⑤为Na元素,则①为Li元素,②为C元素,③为O元素,④为F元素,⑥为Al元素,⑦为Cl元素。
(1)②为C元素,位于周期表第二周期、第ⅣA族;①为3号Li元素,原子结构示意图为:;
(2)③为8号O元素,O元素质子数为8,其一种核素中子数为10,则其质量数A=8+10=18,符号为:;
(3)④为F元素,⑦为Cl元素,Cl元素非金属性比F弱,答案为:Cl;
(4)①为Li,电子层为2层,⑤为Na,电子层为3层,故Na原子半径大于Li,故此处填:Na;③为O元素,其最简单氢化物为H2O,与⑤同族的下一周期元素K与水反应生成KOH和H2,对应离子方程式为:2K +2H2O =2K++2OH- +H2↑;
(5)⑤为Na元素,最高价氧化物对应水化物为NaOH,⑥的氧化物Al2O3与NaOH溶液反应生成NaAlO2和H2O,对应离子方程式为:。
22. K2O Al2O3 6SiO2 Al2O3 2SiO2 2H2O 4:1 2Na +2HCl =2NaCl +H2↑ 1.68 g 0.968 g
【详解】
Ⅰ.(1)硅酸盐的化学式可表示为:活泼金属氧化物 金属氧化物 非金属氧化物 水,书写时满足原子守恒;则KAlSi3O8可表示为K2O Al2O3 6SiO2;Al2Si2O5(OH)4可表示为Al2O3 2SiO2 2H2O;
(2)设金属钠有xmol,金属铝有ymol,产生氢气的量为 =0.14mol;物质的量守恒:x+y=0.2,电子得失守恒:x+3y=0.14×2,解之,x=0.16mol,y=0.04mol;所以钠和铝的物质的量之比为4:1;钠与足量盐酸反应生成氯化钠和氢气,化学方程式为:2Na +2HCl =2NaCl +H2↑;
Ⅱ.(1)碳酸氢钠不稳定,受热分解,而碳酸钠较稳定;设混合物中碳酸氢钠有xg,
2NaHCO3= Na2CO3+CO2+H2O 固体质量减小
2×84 62
x 0.62
列方程,求出x=1.68g,既混合物中NaHCO3的质量1.68g,碳酸钠质量为2.12g;
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,即Na2CO3和NaHCO3各有1.9g,物质的量分别为:=0.018mol,=0.023mol,1.46 gHCl的稀盐酸溶质的量为0.04mol;混合物中加入盐酸先发生Na2CO3+HCl=NaHCO3+NaCl反应,消耗盐酸的量n=0.018mol,剩余盐酸n=0.04-0.018=0.022mol;碳酸钠完全反应后,再发生NaHCO3+HCl=NaCl+CO2+H2O反应,总的n(NaHCO3)=0.018+0.023=0.041mol,已过量,按照盐酸计算二氧化碳的量n=0.022mol,生成气体的的质量为0.022×44=0.968g。
23. 锌与硫酸铜反应置换出铜,铜 覆盖在锌表面在稀硫酸中构成原电池加快锌与稀硫酸的反应速率 干燥气体 单位时间内气泡的数目 先通入一段时间气体 3SiCl4 +2N2 +6H2Si3N4+ 12HC1 SiC14 + 6NaOH= Naz2SiO3 + 4NaCl+3H2O
一、单选题(共15题)
1.LiFePO4常用作锂电池的正极材料,其中锂为3号元素,在周期表中的位置是
A.第二周期第IA族 B.第二周期第IIA族
C.第三周期第IA族 D.第三周期第IIIA族
2.硅及其化合物在人类进步中发挥了重要作用。和用于制造芯片,用于制造光纤,用作木材防火剂。下列说法正确的是
A.在自然界以游离态存在 B.和具有优良的导电性
C.不与酸反应 D.溶液可与反应
3.下列说法不正确的是
A.侯德榜是我国著名化工专家,发明了侯氏制碱法
B.门捷列夫提出了元素周期律,编制出第一张元素周期表
C.玻尔发现原子中存在电子,电子在原子核外空间的一定轨道上绕核做高速圆周运动
D.舍勒发现了一种黄绿色气体,戴维确认该气体为氯气
4.化学与生活密切相关。下列叙述错误的是
A.氢氟酸可用于雕刻玻璃
B.铝制餐具不宜长时间存放酸性、碱性和咸的食物
C.超市中售卖的“苏打水”是因添加了而获名
D.农村推广风力发电、光伏发电有利于国家实现“碳达峰、碳中和”
5.德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是
A.“水瓶”、冰水混合物都是混合物 B.石墨和C60互为同位素
C.磷酸钙是电解质 D.一定条件下石墨转化为C60是物理变化
6.锗元素在元素周期表中的信息如图所示。下列有关锗元素的说法错误的是
A.属于金属元素 B.位于第四周期IVA族
C.原子核外有32个电子 D.相对原子质量为72.63g/mol
7.利用下列装置和试剂进行实验,能达到实验目的的是
A.利用图I装置灼烧海带
B.利用图II装置进行喷泉实验
C.利用图III装置分离碘单质和沙子
D.图IV装置中,关闭a、打开b,可检查装置的气密性
8.下列事实不能用元素周期律解释的是
A.碱性:NaOH>LiOH B.酸性:HCl>H2CO3
C.原子半径:S>O D.热稳定性:HF>HI
9.阿伏伽德罗常数的命名是为了纪念意大利科学家阿伏伽德罗。用代表阿伏伽德罗常数的值,下列说法正确的是
A.含有的电子数为
B.与足量的氯气反应转移的电子数为
C.溶液中含有的数为
D.含有的中子数为
10.某合作学习小组讨论辨析下列说法,其中说法正确的为
①金属氧化物都是碱性氧化物,酸性氧化物都是非金属氧化物
②可用稀盐酸、碳酸钠溶液设计实验来验证氯、碳两种元素的非金属性
③若规定含有的原子数为阿伏加德罗常数,则标准状况下的体积约为44.8L
④由组成的混合物中,已知S元素的质量分数,则O元素的质量分数为
⑤等质量的二氧化硫气体和二氧化碳气体密度比为,体积比为
⑥“卤水点豆腐”、“黄河入海口处三角洲的形成”都与胶体的性质有关
⑦将含有的氯化铁溶液滴入沸水中可制得胶粒数目小于
⑧氯气因为其沸点较高易液化
A.①②③⑥ B.②⑥⑦⑧ C.③④⑤⑦ D.④⑥⑦⑧
11.2021年4月9日,北京大学材料物理研究所叶堉团队利用相变和重结晶的方法,在非晶SiO2/Si表面上实现了二维半导体碲化钼( Te位于第五周期,第VIA族)单晶薄膜的无缝制备,发表在英国科学杂质《Science》上。下列叙述错误的是
A.0.5mol碲化钼含有的中子数目为102mol
B.碲原子有五个电子层,最外层电子数为6
C.重结晶过程可使不纯的物质的获得纯化
D.钼元素位于第五周期VIB族
12.不能用元素周期律解释的是
A.酸性: B.碱性:
C.与水反应:K比剧烈 D.与反应:比剧烈
13.一种由四种短周期主族元素组成的化合物(如图所示)可用作化肥和木材、纸张、织物的防火剂,也用于制药和反刍动物饲料添加剂,其中W、X、Y、Z的原子序数依次增大且X与Y、Z均相邻。下列有关说法错误的是
A.该化合物中Z的化合价为+5价 B.简单氢化物的沸点:X>Z
C.原子半径:Z>X>Y>W D.Z的最高价氧化物对应的水化物为强酸
14.半导体器件的研制正式开始于锗(元素符号为Ge),后来发展到研制与它同主族的硅,下列有关锗的叙述不合理的是
A.锗元素的氧化物化学式为GeO2
B.锗是原子序数为32的一种过渡元素
C.锗在周期表中的位置是第四周期IVA族
D.锗处于周期表中金属与非金属的分界处
15.下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法不正确的是
A.气态氢化物的稳定性:Y>X
B.Z与M两者的最高价氧化物的水化物能相互反应
C.X、Z形成的化合物中可能含有共价键
D.N的气态氢化物及其氧化物对应的水化物均为强酸
二、填空题(共8题)
16.含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向③中加入NaOH溶液并在空气中放置,现象是______有关化学方程式为__
(3)加入过量Na2O2溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
17.下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
一 ①
二 ② ③ ④ ⑤
三 ⑥ ⑦ ⑧ ⑨ ⑩
(1)金属性最强的是___________(填元素名称)。
(2)⑨的离子结构示意图为___________。
(3)⑤元素和⑩元素的最简单氢化物的稳定性由强到弱的关系是___________(填化学式)。
(4)④、⑤、⑥的简单离子半径由大到小的顺序为___________(用离子符号表示)。
(5)⑧、⑨、⑩最高价氧化物对应的水化物酸性由弱到强的顺序是___________(填化学式)
(6)用电子式表示④与⑥形成的原子个数比为1 ∶2的化合物的形成过程___________。
(7)⑧单质与⑥的最高价氧化物水化物的溶液发生反应,写出生成的阴离子为___________。
18.下表是元素周期表的一部分,请依据该表回答问题。
(1)第2周期VIIA族元素的原子结构示意图是___________,该元素与同周期IA族元素组成的化合物类型是___________(填“离子化合物”或“共价化合物”)。
(2)第3周期元素的最高价氧化物对应水化物中,碱性最强的是___________(填化学式,下同);具有两性的是___________。加热时,碳单质能与S的最高价氧化物对应的水化物的浓溶液反应,写出该反应的化学方程式___________。
(3)下列判断正确的是___________(填标号)。
A.最低负化合价的绝对值:P>S
B.非金属性:P>N
C.离子半径:Mg2+>O2
D.还原性:S2 >Cl
19.A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题。
(1)已知常温下A为有色气体。若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式__。
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色。则F的化学式为__。
(3)若A为淡黄色固体,则A与水反应的化学方程式为___。
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即__。C与F反应的化学方程式为___。
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式___。
20.A、B、C、D四种元素的核电荷数依次增多,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等;D原子的K、L层电子数之和等于电子总数的一半。回答以下问题:
(1)四种元素的符号依次是A_______;B_______;C_______;D_______。
(2)它们的原子半径由大到小的顺序是_______(用元素符号表示)。
(3)四种元素的简单离子的半径大小顺序是_______。
21.下表为元素周期表的短周期部分,①~⑦代表七种短周期元素。
① ② ③ ④
⑤ ⑥ ⑦
已知:⑤的焰色试验火焰呈黄色。
请填写下列空白:
(1)②在元素周期表中的位置为___________;①的原子结构示意图为___________。
(2)③的一种核素的中子数为10,其原子符号为___________(用形式表示)。
(3)④和⑦中非金属性较弱的是___________(填元素符号)。
(4)①和⑤中原子半径较大的是___________(填元素符号),与⑤同族的下一周期元素和③的最简单氢化物反应的离子方程式为___________。
(5)将⑥的氧化物加入⑤的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为___________。
22.按要求回答问题。
Ⅰ.(1)硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示其组成,则KAlSi3O8可表示为________________________,Al2Si2O5(OH)4可表示为________________________。
(2)将0.2mol钠和铝的混合物溶于足量的盐酸中,产生3136mL(标准状况下)氢气,则钠和铝的物质的量之比为___________;写出钠与足量盐酸反应的化学方程式__________________________________。
Ⅱ.将3.8 g Na2CO3和NaHCO3的混合物充分加热,混合物质量减少了0.62 g。求:
(1)混合物中NaHCO3的质量___________。
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,生成气体的的质量为___________。
23.氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途。某兴趣小组用四氯化硅与氮气在氢气气氛保护下,加热发生反应,可得较高纯度的氮化硅及氯化氢,设计如图所示装置。
试回答下列问题:
(1)实验室制备氢气常用锌和稀硫酸反应,制取时常在反应混合物中加入少量硫酸铜溶液,其目的是_______。
(2)图中装置A的作用是_______、调节通入气体速率和充分混合气体。通过观察_______,来调节通入气体的速率。
(3)加热B玻璃管之前,为防止意外发生,必须进行的操作是_______(不用详述步骤),B中发生反应的化学方程式为_______。
(4)四氯化硅与水反应生成两种酸,写出用烧碱溶液吸收尾气中四氯化硅的化学方程式:_______。
参考答案:
1.A
【详解】
根据锂为3号元素,锂原子核外有3个电子,核外电子排布为2、1,故为第二周期第IA族,选A。
2.D
【详解】
A.硅在自然界中以化合态存在,而不是游离态形式存,故A错误;
B.和属于半导体,导电能力弱,故B错误;
C.SiO2能与氢氟酸发生反应,而不是不与任何酸反应,故C错误;
D.碳酸的酸性比硅酸强,则Na2SiO3溶液可与反应生成H2SiO3,故D正确;
故选:D。
3.C
【详解】
A.中国化学家侯德榜发明了侯氏制碱法,从而打破了外国对中国的技术封锁,A正确;
B.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循,B正确;
C.汤姆生发现了电子并由此提出了“葡萄干面包式”模型,波尔提出的原子结构模型为:电子在原子核外空间的一定轨道上绕核做高速圆周运动,C错误;
D.舍勒发现了一种黄绿色气体,戴维确认该气体为氯气,D正确;
故答案为:C。
4.C
【详解】
A.氢氟酸在常温下能和玻璃中的SiO2反应,所以氢氟酸可用于雕刻玻璃,故A正确;
B.铝能和酸、碱反应,在NaCl溶液中,铝会被腐蚀,所以铝制餐具不宜长时间存放酸性、碱性和咸的食物,故B正确;
C.超市中售卖的“苏打水”是因添加了 NaHCO3 而获名,碳酸钠碱性过强,不能添加到水中,故C错误;
D.农村推广风力发电、光伏发电,减少燃煤发电,有利于国家实现“碳达峰、碳中和”,故D正确;
故选C。
5.C
【详解】
A.冰水混合物只含一种物质,属于纯净物,A错误;
B.石墨和均是碳元素组成的单质,互称为同素异形体,B错误;
C.磷酸钙属于盐类,熔融状态下能导电,是电解质,C正确;
D.石墨转化为生成了新的物质,是化学变化,D错误;
故选C。
6.D
【详解】
A. 锗元素带“钅”字旁,属于金属元素,故A不选;
B. 锗原子有4个电子层,最外层有4个电子,位于第四周期IVA族,故B不选;
C. 原子序数是32号,原子核外有32个电子,故C不选
D. 相对原子质量的单位不是“g/mol”而是“1”,通常省略不写,故D选;
故选D。
7.C
【详解】
A.灼烧应在坩埚中进行,不能使用蒸发皿,A不符合题意;
B.氯气难溶于饱和氯化钠溶液,所以无法用该装置进行喷泉实验,B不符合题意;
C.碘易升华,而沙子的熔沸点较高,加热时,碘升华之后在烧瓶底部冷凝,实现碘单质和沙子的分离,C符合题意;
D.由于导管的存在,可以平衡压强,关闭a后即便气密性良好,分液漏斗中的水也能低落下来,无法检验气密性,D不符合题意;
综上所述答案为C。
8.B
【详解】
A.钠的金属性强于锂,其最高价氧化物水化物的碱性NaOH强于LiOH,能用元素周期律解释,A不符合题意;
B.HCl不是氯元素的最高价氧化物水化物,不能用元素周期律解释酸性:HCl>H2CO3,B符合题意;
C.同主族元素的原子半径从上往下逐渐增大,故原子半径:S>O,能用元素周期律解释,C不符合题意;
D.F的非金属性比I强,与H形成的共价键键能HF>HI,故热稳定性:HF>HI,能用元素周期律解释,D不符合题意;
故选B。
9.D
【详解】
A.Na是11号元素,含有的电子数为11,故A错误;
B.Fe与氯气反应生成氯化铁,为1mol,与足量的氯气反应转移的电子数为,故B错误;
C.未指明体积,无法计算,故C错误;
D.含有10个中子,为1mol,含有的中子数为,故D正确;
故答案为D。
10.D
【详解】
①金属氧化物不一定都是碱性氧化物,如氧化铝为两性氧化物,酸性氧化物不一定都是非金属氧化物,如七氧化二锰为酸性氧化物,故错误;
②非金属性的强弱与最高价氧化物对应水化物的酸性有关,与氢化物的酸性无关,则不能用稀盐酸、碳酸钠溶液设计实验来验证氯、碳两种元素的非金属性,故错误;
③若规定0.024kg12C含有的原子数为阿伏加德罗常数,则标准状况下44g二氧化碳的体积约为×44.8L/mol=22.4L,故错误;
④由NaH和Mg的式量都为24可知,混合物中NaH可以视作Mg,若硫元素的质量分数为a%,则Mg元素的质量分数为×a%=0.75a%,氧元素的质量分数为1—a%—0.75a%=1—1.75a%,故正确;
⑤缺同温同压的条件下,无法计算等质量的二氧化硫气体和二氧化碳气体的体积比,故错误;
⑥“卤水点豆腐”、“黄河入海口处三角洲的形成”都是电解质溶液使胶体产生聚沉的过程,都与胶体的性质有关,故正确;
⑦氢氧化铁胶体是粒子的聚合体,则将含有0.1mol氯化铁溶液滴入沸水中可制得氢氧化铁胶粒数目小于0.1NA,故正确;
⑧氯气因为常温常压下沸点较高,高亚低温条件下易液化得到液氯,故正确;
④⑥⑦⑧正确,故选D。
11.A
【详解】
A.0.5molMoTe2的含有中子的物质的量为102mol,数目应为102NA,选项A错误;
B.碲与氧同主族,位于第五周期,原子有五个电子层,最外层电子数为6,选项B正确;
C.重结晶是一种常见的提纯方法,可使不纯的物质的获得纯化,选项C正确;
D.钼元素位于第五周期VIB族,选项D正确;
答案选A。
12.A
【详解】
A.元素的非金属性与氢化物的酸性无关,则元素的酸性强于碳酸不能用元素周期律解释,故A符合题意;
B.同周期元素,从左到右元素的金属性依次减小,最高价氧化物对应水化物的碱性减弱,则氢氧化钠的碱性强于氢氧化镁能用元素周期律解释,故B不符合题意;
C.同主族元素,从上到下元素的金属性依次增强,与水反应的剧烈程度增大,则钾与水反应的剧烈程度强于钠能用元素周期律解释,故C不符合题意;
D.同主族元素,从上到下元素的非金属性依次减弱,与氢气反应的剧烈程度减弱,则氟气与氢气反应的剧烈程度强于氯气能用元素周期律解释,故D不符合题意;
故选A。
13.D
【详解】
根据上述分析可知:W是H,X是N,Y是O,Z是P元素。
A.根据物质结构可知该化合物化学式是NH4H2PO4,其中P元素化合价为+5价,A正确;
B.X是N,Z是P元素,它们形成的氢化物化学式分别是NH3、PH3,二者都是由分子构成,由于NH3分子之间除存在分子间作用力外还存在氢键,所以简单氢化物的沸点:NH3>PH3,用字母表示为:X>Z,B正确;
C.同一周期元素,原子序数越大,原子半径越小;不同周期元素,元素的周期序数越大,原子半径就越大,则四种元素的原子半径大小关系为:Z(P)>X(N)>Y(O)>W(H),C正确;
D.Z是P元素,P的最高价氧化物对应的水化物H3PO4是中强酸,在水中不能完全电离,存在电离平衡,因此H3PO4属于弱酸,D错误;
故合理选项是D。
14.B
【详解】
A.因锗(Ge)元素为+4价,则其氧化物的化学式为GeO2,选项A正确;
B.锗是原子序数为32的元素,位于第四周期ⅣA族元素,不属于过渡元素,选项B不正确;
C.锗是原子序数为32的元素,在周期表中的位置是第四周期IVA族,选项C正确;
D.锗(Ge)是第四周期第ⅣA元素,处于周期表中金属区与非金属区的交界线上,选项D正确;
答案选B。
15.D
【详解】
A.非金属性F>O,故气态氢化物稳定性HF>H2O,故A正确;
B.氢氧化铝具有两性,故能与氢氧化钠反应,故B正确;
C.Na与O形成的Na2O2中含有共价键,故C正确;
D.Cl的氧化物对应的水化物HClO为弱酸,故D错误;
故选D。
16.(1)Fe2+
(2) 生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色 Fe2++2OH—=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4 Fe(OH)3
(3)Al3+
(4) Fe3+ Ag+
(5)Fe3+
(6)Ag+
【解析】
(1)Fe2+既能被氧化为Fe3+,也能被还原为Fe,故此处填Fe2+;
(2)Fe2+遇到NaOH溶液,首先生成白色Fe(OH)2沉淀,之后迅速转化为灰绿色沉淀,最终转化为红褐色沉淀,故此处填:生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;对应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)过量Na2O2加入溶液中,与水反应生成过量的NaOH,Al3+结合OH-生成Al(OH)3沉淀,由于Al(OH)3溶于NaOH溶液,故无沉淀,此处填Al3+;
(4)加入铁粉后,①号溶液与⑤号溶液能与Fe发生反应,①号溶液发生反应:Fe+2Ag+=2Ag+Fe2+,溶液质量减轻,⑤号溶液发生反应:Fe+2Fe3+=3Fe2+,溶液质量增重,故此处依次填:Fe3+、Ag+;
(5)Fe3+与SCN-结合生成Fe(SCN)3,使溶液显红色,故此处填Fe3+;
(6)Ag+与Cl-反应生成白色沉淀,可以用来鉴别Cl-,故此处填Ag+。
17.(1)钠
(2)
(3)HF>HCl
(4)r(O2-)>r(F-)>r(Na+)
(5)H2SiO3<H2SO4<HClO4
(6)
(7)
【解析】
由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为Si、⑨为S、⑩为Cl,据此解答。
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,故表中各元素中Na的金属性最强;
(2)⑨为S、硫离子的结构示意图为;
(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则⑤元素和⑩元素的最简单氢化物的稳定性由强到弱的关系是HF>HCl;
(4)④、⑤、⑥的简单离子具有相同的核外电子排布,其离子半径随原子序数的增大而减小,则离子半径由大到小的顺序为r(O2-)>r(F-)>r(Na+)。
(5)同周期自左向右非金属性逐渐增强,最高价含氧酸的酸性逐渐增强,则⑧、⑨、⑩最高价氧化物对应的水化物酸性由弱到强的顺序是H2SiO3<H2SO4<HClO4;
(6)④与⑥形成的原子个数比为1∶2的化合物是离子化合物氧化钠,用电子式表示其形成过程为。
(7)⑧单质与⑥的最高价氧化物水化物的溶液发生反应生成硅酸钠和氢气,则生成的阴离子为。
18.(1) 离子化合物
(2) NaOH Al(OH)3 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(3)AD
【解析】
(1)第2周期ⅦA族元素含有2个电子层,最外层电子数为7,质子数为9,为F元素,F的原子结构示意图为,F与同周期IA族元素组成的化合物为LiF,LiF为离子化合物,故答案为:;离子化合物;
(2)第3周期元素中,Na的金属性最强,Al的氢氧化物具有两性,则第3周期元素的最高价氧化物对应水化物中,碱性最强的是NaOH,具有两性的氢氧化物为Al(OH)3;S的最高价氧化物对应的水化物的浓溶液为浓硫酸,加热时,碳单质能与浓硫酸反应生成二氧化碳、二氧化硫和水,该反应的化学方程式为C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,
故答案为:NaOH;Al(OH)3;C+2H2SO4(浓)CO2↑+2SO2↑+2H2O;
(3)A.P、S的最低价分别为-3、-2,则最低负化合价的绝对值:P>S,故A正确;
B.同一主族从上到下非金属性逐渐减弱,则非金属性:P<N,故B错误;
C.Mg2+、O2-都含有2个电子层,核电荷数越大离子半径越小,则离子半径:Mg2+<O2-,故C错误;
D.非金属性S<Cl,非金属性越强,简单阴离子的还原性越弱,则阴离子的还原性:S2->Cl-,故D正确;
故答案为:AD。
19.(1)Fe+4H++=Fe3++NO↑+2H2O
(2)Na2CO3
(3) 2Na2O2+2H2O=4NaOH+O2↑ 酸雨 2H2S+SO2=3S↓+2H2O Al3+ +3+6H2O=4Al(OH)3↓
【解析】
(1)A为有色气体,若F是一种金属单质,由转化关系可知,F为变价金属,则为Fe,因为A为有色气体,与水反应生成B与E,则A为二氧化氮,B为硝酸,B和适量F反应生成C与气体E的离子方程式:Fe+4H++=Fe3++NO↑+2H2O;
(2)A为双原子分子,E具有漂白性,A与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,C为直线型分子,物质F焰色反应呈黄色,含有Na元素,结合转化关系可知,C为二氧化碳,F为Na2CO3;
(3)A为淡黄色固体,能与水反应,则A为过氧化钠,A与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑;
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题,结合转化关系,B为氧气、C为SO2、F为H2S,C的大量排放往往会造成严重的酸雨,C与F反应的化学方程式为2H2S+SO2=3S↓+2H2O;
②若物质A和D的式量相等,D为白色絮状沉淀,结合转化关系,B为NaOH、C为NaAlO2、F为铝盐、D为Al(OH)3,C与F反应的离子方程式Al3+ +3+6H2O=4Al(OH)3↓。
20.(1) S Cl K Ca
(2))K、Ca、S、Cl
(3)S2->Cl->K+>Ca2+
【解析】
A原子有3个电子层,电子数分别为2、8、6,故A为S元素;D原子有4个电子层,电子数分别为2、8、8、2,故D为Ca元素;由于A、B、C、D的能形成离子,且核电荷数依次增多,因此B为S元素、C为K元素;
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca;
(2)K、Ca位于第四周期,S、Cl位于第三周期,电子层数越多原子半径越大,电子层数相同的,原子序数越大的半径越小,则半径由大到小的顺序是:K、Ca、S、Cl;
(3)四种元素的简单离子都是18电子,电子层数相同,则原子序数越大的离子半径越小,大小顺序是S2->Cl->K+>Ca2+。
21.(1) 第二周期第ⅣA族
(2)
(3)Cl
(4) Na
(5)
【解析】
⑤的焰色试验呈黄色,说明⑤为Na元素,则①为Li元素,②为C元素,③为O元素,④为F元素,⑥为Al元素,⑦为Cl元素。
(1)②为C元素,位于周期表第二周期、第ⅣA族;①为3号Li元素,原子结构示意图为:;
(2)③为8号O元素,O元素质子数为8,其一种核素中子数为10,则其质量数A=8+10=18,符号为:;
(3)④为F元素,⑦为Cl元素,Cl元素非金属性比F弱,答案为:Cl;
(4)①为Li,电子层为2层,⑤为Na,电子层为3层,故Na原子半径大于Li,故此处填:Na;③为O元素,其最简单氢化物为H2O,与⑤同族的下一周期元素K与水反应生成KOH和H2,对应离子方程式为:2K +2H2O =2K++2OH- +H2↑;
(5)⑤为Na元素,最高价氧化物对应水化物为NaOH,⑥的氧化物Al2O3与NaOH溶液反应生成NaAlO2和H2O,对应离子方程式为:。
22. K2O Al2O3 6SiO2 Al2O3 2SiO2 2H2O 4:1 2Na +2HCl =2NaCl +H2↑ 1.68 g 0.968 g
【详解】
Ⅰ.(1)硅酸盐的化学式可表示为:活泼金属氧化物 金属氧化物 非金属氧化物 水,书写时满足原子守恒;则KAlSi3O8可表示为K2O Al2O3 6SiO2;Al2Si2O5(OH)4可表示为Al2O3 2SiO2 2H2O;
(2)设金属钠有xmol,金属铝有ymol,产生氢气的量为 =0.14mol;物质的量守恒:x+y=0.2,电子得失守恒:x+3y=0.14×2,解之,x=0.16mol,y=0.04mol;所以钠和铝的物质的量之比为4:1;钠与足量盐酸反应生成氯化钠和氢气,化学方程式为:2Na +2HCl =2NaCl +H2↑;
Ⅱ.(1)碳酸氢钠不稳定,受热分解,而碳酸钠较稳定;设混合物中碳酸氢钠有xg,
2NaHCO3= Na2CO3+CO2+H2O 固体质量减小
2×84 62
x 0.62
列方程,求出x=1.68g,既混合物中NaHCO3的质量1.68g,碳酸钠质量为2.12g;
(2)若将等质量的混合物与含有1.46 gHCl的稀盐酸反应,即Na2CO3和NaHCO3各有1.9g,物质的量分别为:=0.018mol,=0.023mol,1.46 gHCl的稀盐酸溶质的量为0.04mol;混合物中加入盐酸先发生Na2CO3+HCl=NaHCO3+NaCl反应,消耗盐酸的量n=0.018mol,剩余盐酸n=0.04-0.018=0.022mol;碳酸钠完全反应后,再发生NaHCO3+HCl=NaCl+CO2+H2O反应,总的n(NaHCO3)=0.018+0.023=0.041mol,已过量,按照盐酸计算二氧化碳的量n=0.022mol,生成气体的的质量为0.022×44=0.968g。
23. 锌与硫酸铜反应置换出铜,铜 覆盖在锌表面在稀硫酸中构成原电池加快锌与稀硫酸的反应速率 干燥气体 单位时间内气泡的数目 先通入一段时间气体 3SiCl4 +2N2 +6H2Si3N4+ 12HC1 SiC14 + 6NaOH= Naz2SiO3 + 4NaCl+3H2O
