2021-2022学年下学期高中化学人教版(2019)选择性必修2第三章第一节物质的聚集状态与晶体的常识——提升训练 含答案
文档属性
| 名称 | 2021-2022学年下学期高中化学人教版(2019)选择性必修2第三章第一节物质的聚集状态与晶体的常识——提升训练 含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 444.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-19 18:50:47 | ||
图片预览




文档简介
第三章晶体结构与性质第一节物质的聚集状态与晶体的常识——提升训练2021-2022学年高中化学人教版(2019)选择性必修2
一、选择题(共16题)
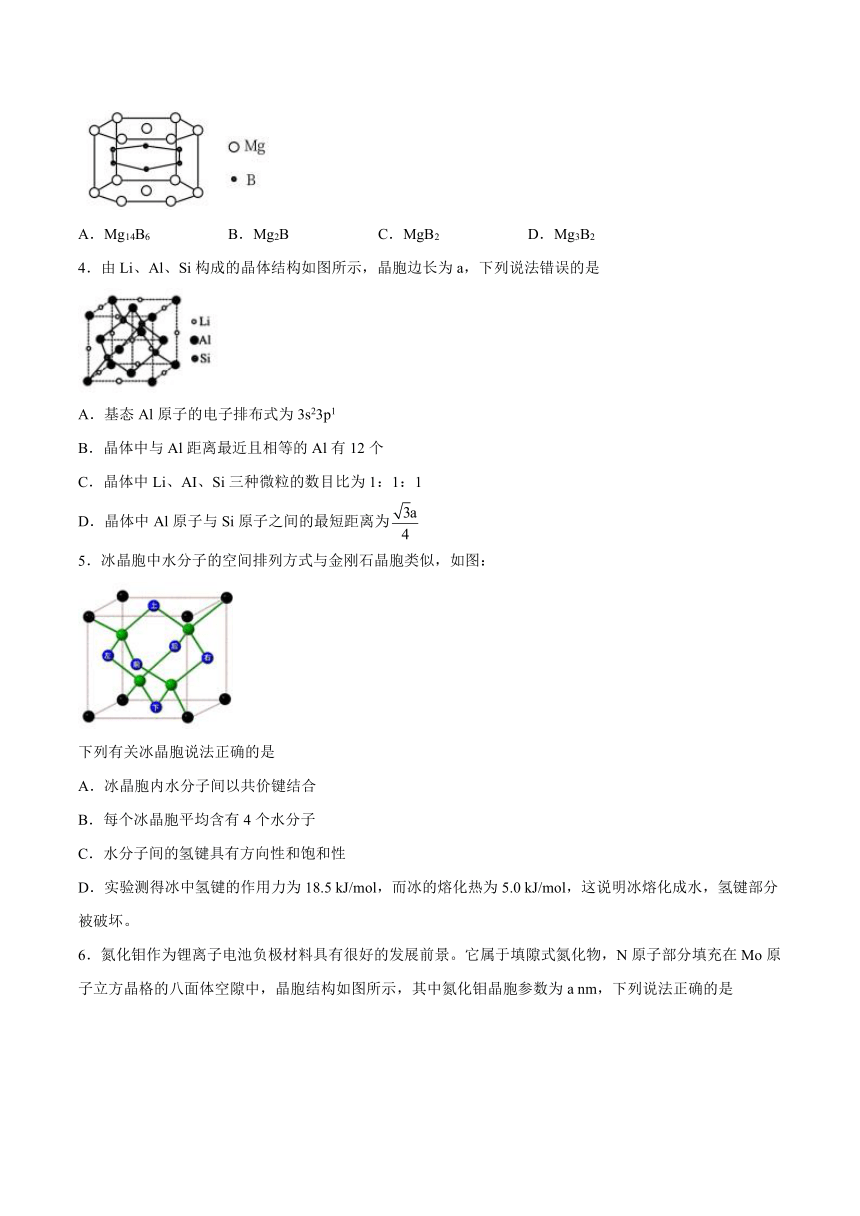
1.利用废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示,下列说法不正确的是
A.铜溶解时的离子方程式为Cu+H2O2+2H+=Cu2++2H2O
B.可用加热的方法除去过量的H2O2
C.调pH=2的目的是为了生成Cu(OH)2沉淀
D.1个铜晶胞(如图所示)中含4个Cu原子
2.Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为anm。下列叙述正确的是
A.电负性:Mg>Si
B.Mg核外电子有3种不同的运动状态
C.Mg与Si之间的最近距离为
D.Mg2Si的密度计算式为
3.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为
A.Mg14B6 B.Mg2B C.MgB2 D.Mg3B2
4.由Li、Al、Si构成的晶体结构如图所示,晶胞边长为a,下列说法错误的是
A.基态Al原子的电子排布式为3s23p1
B.晶体中与Al距离最近且相等的Al有12个
C.晶体中Li、AI、Si三种微粒的数目比为1:1:1
D.晶体中Al原子与Si原子之间的最短距离为
5.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
下列有关冰晶胞说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性
D.实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键部分被破坏。
6.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm,下列说法正确的是
A.相邻两个最近的N原子的距离为nm
B.氮化钼的化学式为
C.每个钼原子周围与其距离最近的钼原子有12个
D.晶体的密度
7.工业上通过Al2O3+N2+3C2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是
A.N2的电子式为:
B.AlN是分子晶体
C.27Al用原子中的中子数为14
D.基态氮原子轨道表示式:
8.工业上一种从海水中制备碘的方法为:取净化除氯后的含碘海水,加入AgNO3溶液,富集得到AgI悬浊液,进而制得粗碘。从AgI悬浊液中回收I2的流程如图1所示。
下列有关说法正确的是
A.Fe粉与AgI悬浊液反应的离子方程式为:Fe+2Ag+=Ag+Fe2+
B.可在含碘海水中直接通入Cl2制备粗碘
C.如图2所示I2的晶胞中有14个I2分子
D.流程中沉淀可进一步转化,实现AgNO3的循环使用
9.锌与硫所形成化合物晶体的晶胞如图所示。下列判断错误的是
A.Zn位于元素周期表的d区 B.该晶胞中和数目相等
C.位于构成的四面体空隙中 D.氧化锌的熔点高于硫化锌
10.单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是
A.S位于元素周期表p区 B.该物质的化学式为
C.S位于H构成的八面体空隙中 D.该晶体属于分子晶体
11.由Cu和O组成的某晶胞结构如图,其棱长为a nm,下列有关该晶胞的说法错误的是
A.黑色的原子为Cu B.晶胞化学式为Cu2O
C.氧原子的配位数为4 D.Cu与O的最近距离为
12.下列说法正确的是(NA为阿伏加德罗常数)
A.1molNaCl晶胞中含有4NA个NaCl分子
B.一个铜晶胞的质量为g
C.60gSiO2含有Si-O键的个数为2NA
D.1molSiC含有C-Si键的个数为4NA
13.硼可形成多种具有特殊性能的晶体。图甲为具有超导性能的硼化镁晶体的部分原子沿z轴方向的投影,晶体中一层镁一层硼分层相间排列;图乙为具有超硬耐磨性能的磷化硼立方晶胞,晶胞参数为a nm。
下列关于两种晶体的说法错误的是
A.硼化镁晶体中含有自由移动的电子
B.硼化镁晶体的化学式为MgB2
C.磷化硼晶体中磷原子的配位数为2
D.磷化硼晶体中P原子与B原子最近距离为 nm
14.设NA为阿伏加德罗常数的值。下列说法正确的是
A.36g CaO2中阴离子数目为NA
B.20gH218O中含有的中子数为10NA
C.12g石墨晶体中含有碳碳键的数目为3NA
D.用浓盐酸和KClO3反应制备1mol氯气时,转移的电子数为2NA
15.H3BO3是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键);与足量的NaOH反应生成NaH2BO3。下列说法正确的是
A.根据H3BO3结构可知,H3BO3易溶于水
B.分子中B、O最外层均为8电子稳定结构
C.含1 mol H3BO3的晶体中有6 mol氢键
D.H3BO3中B为+3价,属于三元弱酸
16.甲烷晶胞的晶胞结构如图所示,下列说法正确的是
A.甲烷晶胞中的一个球只表示一个C原子
B.晶体中与一个CH4等距且最近的CH4分子个数为8
C.一个甲烷晶胞中含有8个CH4分子
D.若晶胞参数为a=apm,则两个最近的甲烷分子之间的距离为0.707apm
二、综合题(共6题)
17.已知硼、氮、钴、铜是几种重要的元素,请回答下列向题:
(1)Co的基态原子中未成对电子数为________个;Cu的基态原子的电子排布式为_______。
(2)Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为________。其中氮原子的杂化方式是_______________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2 和N2, N2中δ键和π键数目之比是________;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
①晶胞中每个氮原子周围与其最近且等距离的硼原子有________个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化翻的晶胞中,B原子的坐标参数分别有:B (0,0,0);B(,0,);B (,(,,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
③已知氮化硼晶胞边长为apm,则氮化硼的密度为_______g·cm -3(设NA为阿伏加德罗常数值,只要求列算式)。
18.选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
X元素是宇宙中最丰富的元素
Y元素基态原子的核外p电子数比s电子数少1
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子
R元素在元素周期表的第十一列
Q元素在周期表里与R元素在同一个分区
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________,离子化合物YX5的电子式是_________。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是_________个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
①制备A的化学反应方程式是___________________;
②在A晶体中,Z的配位数为__________;
(4)R2+离子的外围电子层电子排布式为__________。R2O的熔点比R2S的_________(填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为_________g cm﹣3(列式并计算)。
19.I.2016年,我国研制的大型运输机运-20正式进入投产,标志着我国成为少数几个能生产大型军用运输机的国家之一。
(1)运-20的外壳大量使用了AM系列Mg-Al-Mn,铝的价电子排布图为_________________,第一电离能铝___________(填“大于”、“等于”或“小于”)镁
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为___________,其个数比为___________
II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___________
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___________,其中一个钨原子周围距离最近且相等的碳原子有___________个。
20.晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为,密度为。
(1)晶胞中,位于各顶点位置,位于_______位置,两个之间的最短距离为_______。
(2)用、表示阿伏加德罗常数的值_______(列计算式)。
21.磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为__。
22.GaAs的熔点为1238℃,硬度大,难溶于水。密度为ρg·cm-3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为_______,GaAs的熔点_______(填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGag mol-1和MAsg mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______。
试卷第1页,共3页
参考答案:
1.C
【详解】
A.酸性条件下,双氧水与铜反应生成铜离子和水,此过程可理解为双氧水将铜氧化为氧化铜,氧化铜与硫酸反应,离子方程式为Cu+H2O2+2H+=Cu2++2H2O,A正确;
B.可用加热的方法除去过量的H2O2,因为双氧水受热分解为氧气和水,B正确;
C.调pH=2的目的是为了防止生成Cu(OH)2沉淀,加入锌灰后发生置换,得到海绵铜,C错误;
D.顶点为8×=1,面心为6×=3,1个铜晶胞(如图所示)中含4个Cu原子,D正确;
答案选C。
2.C
【详解】
A.电负性是衡量原子对键合电子的吸引能力的,Si是非金属,Mg是金属,电负性:Mg<Si,A项错误;
B.Mg原子核外有12个电子,每个电子的运动状态都不相同,则Mg核外电子有12种不同的运动状态,B项错误;
C.Mg与Si之间的最近距离为体对角线的,晶胞参数为anm,则体对角线为a,则Mg与Si之间的最近距离为,C项正确;
D.该晶胞含有4个Si,8个Mg,即含有4个Mg2Si,则一个晶胞的质量为:g=g,该晶体的密度为,D项错误;
故选C。
3.C
4.A
【详解】
A.Al元素为13号元素,原子核外有13个电子,所以核外电子排布式为:1s22s22p63s23p1,故A错误;
B.晶体中Al位于顶点和面心,与Al距离最近且相等的Al有12个,故B正确;
C.该晶胞中,Li个数=12×+1=4,Al的个数=8×+6×=4,Si的个数=4,所以Li、Al、Si原子个数比为1:1:1,故C正确;
D.根据图知,每个Al原子连接4个相同的Si原子,Al原子与Si原子之间的最短距离为,故D正确;
故选:A。
5.D
【详解】
A.冰晶胞内水分子间以氢键结合,A错误;
B.每个冰晶胞平均占有分子个数=4+×8+×6=8,B错误;
C.氢键有饱和性和方向性,每个H原子只能形成一个氢键,氢键不是化学键,C错误;
D.冰中氢键的作用能为18.5 kJ mol-1,而冰熔化热为5.0 kJ mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且在液态水中仍存在氢键,D正确;
故合理选项是D。
6.C
【详解】
A.由晶胞图示可知,相邻两个最近的N原子的位置关系为:,故相邻两个最近的N原子的距离为nm,A错误;
B.由晶胞结构示意图可知,每个晶胞中含有Mo的个数为:,N的个数为:,故氮化钼的化学式为,B错误;
C.由晶胞结构示意图可知,钼原子位于8个顶点和6个面心上,故每个钼原子周围与其距离最近的钼原子有12个,C正确;
D.由B项分析可知,该晶胞中含有4个Mo,2个N,则一个晶胞的质量为:,一个晶胞的体积为:(a×10-7cm)3,gu 晶体的密度,D错误;
故答案为:C。
7.C
【详解】
A.N原子最外层有5个电子,2个N原子形成3对共用电子对,使物质分子中每个原子都达到最外层8个电子的稳定结构,故N2的电子式为:,A错误;
B.AlN是高温陶瓷材料,物质的熔沸点很高,说明AlN的存在状态是原子晶体,而不是熔沸点比较低的分子晶体,B错误;
C.Al是13号元素,原子核内质子数是13,27Al中的中子数为:27-13=14,C正确;
D.原子核外电子总是尽可能成单排列,而且自旋方向相同,这样排布使原子的能量最低,故基态氮原子轨道表示式是:,D错误;
故合理选项是C。
8.D
【详解】
A.Fe粉与AgI悬浊液反应的离子方程式为:Fe+2AgI(s)2Ag+Fe2++2I-,A错误;
B.由图可知,现将含碘海水中的碘转化为AgI,再转化为FeI2,进行I-的富集后,再通入Cl2制备粗碘,B错误;
C.如图2所示I2的晶胞中有个I2分子,C错误;
D.由题干流程可知,流程中沉淀即Ag和Fe加入一定量的稀硝酸可将Ag转化为AgNO3,实现AgNO3的循环使用,D正确;
故答案为:D。
9.A
【详解】
A.的价电子排布式为:,故位于元素周期表区,选项A错误;
B.由图可知,位于顶点和面心,个数为,位于体内,其个数为4,则离子数目相同,选项B正确;
C.由图可知每个周围有4个,选项C正确;
D.同类型的离子晶体中,离子半径越小,晶格能越大,因氧离子半径小于硫离子半径,则氧化锌的晶格能大于硫化锌,选项D正确。
答案选A。
10.D
【详解】
A.S的价电子排布式为:3s23p4,故S位于元素周期表p区,A正确;
B.由该物质形成晶体的晶胞可知:S个数为,H个数为:,故H、S原子个数比为3:1,故该物质的化学式为,B正确;
C.S位于H构成的八面体空隙中,如图所示,C正确;
D.由于该晶体是一种新型超导材料,说明其是由阴、阳离子构成的,故该晶体属于离子晶体,D错误;
故答案为:D。
11.D
【详解】
A.在该晶体中黑球与白球个数比是4:2=2:1,这是Cu、O两种元素形成的化合物,结合二者常见化合物及元素化合价特点可知:黑色表示的原子为Cu,白球白色的原子为O,A正确;
B.根据选项A分析可知黑球表示Cu,白球表示O原子,黑球与白球个数比是4:2=2:1,所以该晶体化学式是Cu2O,B正确;
C.根据图示可知:在晶胞中与O原子距离相等且最近的Cu原子有4个,故氧原子的配位数为4,C正确;
D.根据晶胞结构可知在Cu2O晶胞中,Cu与O的最近距离是晶胞体对角线的。已知晶胞中Cu2O组成的晶胞棱长为a nm,则体对角线为nm,所以Cu与O的最近距离为,D错误;
故合理选项是D。
12.D
【详解】
A.NaCl是离子晶体,没有NaCl分子,故A错误;
B.铜是面心立方晶胞,一个铜晶胞占用4个铜原子,一个铜晶胞的质量为g,故B错误;
C.60gSiO2的物质的量是1mol,含有Si-O键的个数为4NA,故C错误;
D.1个Si和周围4个C形成4个C-Si键,1个C和周围4个Si形成4个C-Si键,1molSiC含有C-Si键的个数为4NA,故D正确;
选D。
13.C
【详解】
A.由题意可知,硼化镁晶体具有超导性说明晶体中含有自由移动的电子,故A正确;
B.由投影图可知,每个镁原子上层距离其最近的硼原子有6个,下层距离其最近的硼原子也有6个,共12个,每个硼原子上层距离其最近的镁原子有3个,下层距离其最近的镁原子也有3个,共6个,则Mg、B原子个数比为1:2,化学式为MgB2,故B正确;
C.由晶胞结构可知,磷化硼晶体中,每个磷原子的周围有4个硼原子,配位数为4,故C错误;
D.由晶胞结构可知,磷化硼晶体中,磷原子与硼原子最近距离为四分之一体对角线,即nm,故D正确;
故选C。
14.B
【详解】
A.CaO2中的阴离子为过氧根离子,36g CaO2的物质的量为,0.5molCaO2中含有0.5mol过氧根离子,故36g CaO2中的阴离子数目为0.5NA,A项错误;
B.H218O的摩尔质量为20g mol-1,20gH218O的物质的量为1mol。1个H218O分子中含有10个中子,则1molH218O分子中含有的中子数为10NA,B项正确;
C.在石墨晶体中1个C原子对应1.5个碳碳键,12g石墨的物质的量为1mol,则12g石墨中含有碳碳键的个数为1.5NA,C项错误;
D.根据反应方程式:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,可知,当生成1mol氯气,转移的电子数为NA,D项错误;
答案选B。
15.A
【详解】
A.根据H3BO3结构可知,H3BO3含有羟基,羟基是亲水基,因此H3BO3易溶于水,A正确;
B.B原子最外层只有3个电子,与O原子形成3对共用电子对,因此B原子不是8e-的稳定结构,B错误;
C.1个H3BO3分子对应着6个氢键,每个氢键对应着2个H3BO3,则含1 mol H3BO3的晶体中有3 mol氢键,C错误;
D.根据化合物中元素化合价代数和为0,所以H3BO3中B为+3价,H3BO3与足量的NaOH反应生成NaH2BO3是正盐,可知H3BO3是一元酸,D错误;
故合理选项是A。
16.D
【详解】
A.甲烷是分子晶体,甲烷晶胞中的一个球表示一个CH4分子,A错误;
B.与位于晶胞顶点的CH4分子为例,与其等距离且最近的CH4分子个数为3××8=12,B错误;
C.一个甲烷晶胞中含有的CH4分子个数==4,C错误;
D.两个最近的甲烷分子之间的距离为晶胞面对角线的一半即apm=0.707apm,D正确;
选D。
17. 3 1s22s22p63s23p63d104s1 或[Ar] 3d104s1 N>O>C sp3杂化 l : 2 4 (l/4, l/4, l/4,)
【详解】
(1)Co的核电荷数为27,其价层电子排布式为3d74s2,其基态原子中未成对电子数为3个;Cu原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d104s1 或[Ar] 3d104s1 ;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C;N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化方式为sp3;
(3)N2中σ键和π键数目之比为1:2,等电子体结构相似,根据二氧化碳电子式书写N2O的电子式为;
(4)①晶胞中每个氮原子周围与其最近且等距离的硼原子形成正四面体结构,硼原子数目为4;
②该晶胞中N原子个数是4、B原子个数=8×+6×=4,则B-N键个数为12,距离上述三个B原子最近且等距的N原子的坐标参数为(、、);
③晶胞的体积为(a×10-10cm)3,晶胞的质量为g,则氮化硼的密度为g÷(a×10-10cm)3=g·cm -3。
18. sp3 2 TiO2+BaCO3═BaTiO3+CO2↑ 6 3d9 高 =4.1
【详解】
(1)NH3中N原子形成3个键,含有1对孤电子对,杂化轨道数目为4,N原子杂化类型为sp3,NH5属于离子化合物,由铵根离子与氢负离子构成,电子式为;故答案为sp3;;
(2)CO与N2互为等电子体,二者结构相似,所以CO分子结构式为C≡O,则1 个CO分子中含有的π键数目是2,故答案为2;
(3)①可知晶胞中Ba原子数目为1,O原子数目为12×=3、Ti原子数目为8×=,故A为BaTiO3,反应还生成二氧化碳,反应方程式为:TiO2+BaCO3═BaTiO3+CO2↑,故答案为TiO2+BaCO3═BaTiO3+CO2↑;
②由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,故答案为6;
③在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,故答案为面心;
(4)R为Cu,其原子核外电子排布式为1s22s22p63s23p63d104s1,则Cu2+离子的外围电子层电子排布式为3d9;离子电荷相同,氧离子半径小于硫离子半径,所以Cu2O的熔点比Cu2S的高;故答案为3d9;高;
(5)晶胞中S原子数目为8×+6×=4,Zn原子位于晶胞内部,共4个,则晶胞质量为4×(65+32)g/mol÷6.02×1023mol-1),晶胞的体积为(540.0×10-10cm)3,则密度为ρ==4.1g cm-3;故答案为=4.1。
19. 小于 sp2 、sp3 3:1 5d46s2 1:1 6
【详解】
(1)基态Al原子的价电子排布式为3s23p1,故铝的价电子排布图为;基态Mg原子的核外电子排布式为1s22s22p63s2, Mg元素的3s能级为全满状态,3p能级为全空状态,体系比较稳定,能量低不容易失去一个电子,所以铝的第一电离能比镁低。
(2)根据该树脂的结构简式,分子中的碳原子没有孤电子对,苯环中的每个碳原子形成3个键,不是苯环上的碳原子,每个碳原子形成4个键, 所以该物质中苯环上的碳原子采用sp2杂化,不是苯环上的碳原子采用sp3杂化;采用sp2杂化的碳原子数为6n+6m,采用sp3杂化碳原子数为2m+2n,故采用sp2杂化的碳原子数与sp3杂化碳原子数之比为:(6n+6m):(2m+2n)=3:1;
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,铬原子的价层电子排布式为3d54s1,故钨原子的价层电子排布式5d46s2;
(4)碳和钨形成的一种化合物的晶胞模型,在此结构中钨原子数目为1+2×+12×+6×=6,晶胞内部有6个C原子,故碳原子和钨原子个数比为6:6=1:1;以晶胞体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个。
20.(1) 面心
(2)
【解析】
(1)
Na3OCl晶体结构中空心白球类原子6×=3、顶点阴影球类原子8×=1、实心黑球类原子1×1=1、根据Na3OCl化学式,可判断钠原子应为空心白球处在晶体结构的面心,两个钠原子之间的最短距离为晶体结构中两个面心的距离,即为一半边长的倍,所以两个Na之间的最短距离为;
(2)
已知:晶胞参数为anm,密度为,,则。
21.PnO
【详解】
由题中信息可知,n个磷酸分子间脱去(n-1)个水分子形成链状的多磷酸,因此,如果有n个磷酸分子间脱水形成环状的多磷酸,则可脱去n个水分子得到(HPO3)n,其失去H+后得到相应的酸根,故该酸根可写为PnO。
22. 原子晶体 低于
【详解】
GaAs的熔点为1238℃,熔点高,所以属于原子晶体;As原子的半径大于N原子,原子晶体中原子半径越小,熔点越高,所以GaAs的熔点低于GaN;根据均摊原则,GaAs晶胞中Ga原子个数是4、As原子数是,1个晶胞中原子的总体积是;根据晶体密度的计算公式,cm3,GaAs晶胞中原子的体积占晶胞体积的百分率为。
答案第1页,共2页
一、选择题(共16题)
1.利用废电池铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示,下列说法不正确的是
A.铜溶解时的离子方程式为Cu+H2O2+2H+=Cu2++2H2O
B.可用加热的方法除去过量的H2O2
C.调pH=2的目的是为了生成Cu(OH)2沉淀
D.1个铜晶胞(如图所示)中含4个Cu原子
2.Mg2Si具有反萤石结构,晶胞结构如图所示,其晶胞参数为anm。下列叙述正确的是
A.电负性:Mg>Si
B.Mg核外电子有3种不同的运动状态
C.Mg与Si之间的最近距离为
D.Mg2Si的密度计算式为
3.2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。则该化合物的化学式可表示为
A.Mg14B6 B.Mg2B C.MgB2 D.Mg3B2
4.由Li、Al、Si构成的晶体结构如图所示,晶胞边长为a,下列说法错误的是
A.基态Al原子的电子排布式为3s23p1
B.晶体中与Al距离最近且相等的Al有12个
C.晶体中Li、AI、Si三种微粒的数目比为1:1:1
D.晶体中Al原子与Si原子之间的最短距离为
5.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
下列有关冰晶胞说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键具有方向性和饱和性
D.实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键部分被破坏。
6.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm,下列说法正确的是
A.相邻两个最近的N原子的距离为nm
B.氮化钼的化学式为
C.每个钼原子周围与其距离最近的钼原子有12个
D.晶体的密度
7.工业上通过Al2O3+N2+3C2AlN+3CO可制得高温陶瓷材料AlN。下列说法正确的是
A.N2的电子式为:
B.AlN是分子晶体
C.27Al用原子中的中子数为14
D.基态氮原子轨道表示式:
8.工业上一种从海水中制备碘的方法为:取净化除氯后的含碘海水,加入AgNO3溶液,富集得到AgI悬浊液,进而制得粗碘。从AgI悬浊液中回收I2的流程如图1所示。
下列有关说法正确的是
A.Fe粉与AgI悬浊液反应的离子方程式为:Fe+2Ag+=Ag+Fe2+
B.可在含碘海水中直接通入Cl2制备粗碘
C.如图2所示I2的晶胞中有14个I2分子
D.流程中沉淀可进一步转化,实现AgNO3的循环使用
9.锌与硫所形成化合物晶体的晶胞如图所示。下列判断错误的是
A.Zn位于元素周期表的d区 B.该晶胞中和数目相等
C.位于构成的四面体空隙中 D.氧化锌的熔点高于硫化锌
10.单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是
A.S位于元素周期表p区 B.该物质的化学式为
C.S位于H构成的八面体空隙中 D.该晶体属于分子晶体
11.由Cu和O组成的某晶胞结构如图,其棱长为a nm,下列有关该晶胞的说法错误的是
A.黑色的原子为Cu B.晶胞化学式为Cu2O
C.氧原子的配位数为4 D.Cu与O的最近距离为
12.下列说法正确的是(NA为阿伏加德罗常数)
A.1molNaCl晶胞中含有4NA个NaCl分子
B.一个铜晶胞的质量为g
C.60gSiO2含有Si-O键的个数为2NA
D.1molSiC含有C-Si键的个数为4NA
13.硼可形成多种具有特殊性能的晶体。图甲为具有超导性能的硼化镁晶体的部分原子沿z轴方向的投影,晶体中一层镁一层硼分层相间排列;图乙为具有超硬耐磨性能的磷化硼立方晶胞,晶胞参数为a nm。
下列关于两种晶体的说法错误的是
A.硼化镁晶体中含有自由移动的电子
B.硼化镁晶体的化学式为MgB2
C.磷化硼晶体中磷原子的配位数为2
D.磷化硼晶体中P原子与B原子最近距离为 nm
14.设NA为阿伏加德罗常数的值。下列说法正确的是
A.36g CaO2中阴离子数目为NA
B.20gH218O中含有的中子数为10NA
C.12g石墨晶体中含有碳碳键的数目为3NA
D.用浓盐酸和KClO3反应制备1mol氯气时,转移的电子数为2NA
15.H3BO3是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键);与足量的NaOH反应生成NaH2BO3。下列说法正确的是
A.根据H3BO3结构可知,H3BO3易溶于水
B.分子中B、O最外层均为8电子稳定结构
C.含1 mol H3BO3的晶体中有6 mol氢键
D.H3BO3中B为+3价,属于三元弱酸
16.甲烷晶胞的晶胞结构如图所示,下列说法正确的是
A.甲烷晶胞中的一个球只表示一个C原子
B.晶体中与一个CH4等距且最近的CH4分子个数为8
C.一个甲烷晶胞中含有8个CH4分子
D.若晶胞参数为a=apm,则两个最近的甲烷分子之间的距离为0.707apm
二、综合题(共6题)
17.已知硼、氮、钴、铜是几种重要的元素,请回答下列向题:
(1)Co的基态原子中未成对电子数为________个;Cu的基态原子的电子排布式为_______。
(2)Cu的配合物A的结构如右图,A中所含C、N、O三种元素的第一电离能由大到小的顺序为________。其中氮原子的杂化方式是_______________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2 和N2, N2中δ键和π键数目之比是________;N2O与CO2互为等电子体,结构相似,且N2O分子中O只与一个N相连,则N2O的电子式为________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
①晶胞中每个氮原子周围与其最近且等距离的硼原子有________个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化翻的晶胞中,B原子的坐标参数分别有:B (0,0,0);B(,0,);B (,(,,0)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为_________;
③已知氮化硼晶胞边长为apm,则氮化硼的密度为_______g·cm -3(设NA为阿伏加德罗常数值,只要求列算式)。
18.选修3——物质结构与性质
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素,相关信息如下:
X元素是宇宙中最丰富的元素
Y元素基态原子的核外p电子数比s电子数少1
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子
R元素在元素周期表的第十一列
Q元素在周期表里与R元素在同一个分区
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是________,离子化合物YX5的电子式是_________。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是_________个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐),A晶体的晶胞为正方体(如图1)。
①制备A的化学反应方程式是___________________;
②在A晶体中,Z的配位数为__________;
(4)R2+离子的外围电子层电子排布式为__________。R2O的熔点比R2S的_________(填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B,B晶体的晶胞为正方体(如图2),若晶胞棱长为5.4×10-8cm,则晶胞密度为_________g cm﹣3(列式并计算)。
19.I.2016年,我国研制的大型运输机运-20正式进入投产,标志着我国成为少数几个能生产大型军用运输机的国家之一。
(1)运-20的外壳大量使用了AM系列Mg-Al-Mn,铝的价电子排布图为_________________,第一电离能铝___________(填“大于”、“等于”或“小于”)镁
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为___________,其个数比为___________
II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___________
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___________,其中一个钨原子周围距离最近且相等的碳原子有___________个。
20.晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为,密度为。
(1)晶胞中,位于各顶点位置,位于_______位置,两个之间的最短距离为_______。
(2)用、表示阿伏加德罗常数的值_______(列计算式)。
21.磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为__。
22.GaAs的熔点为1238℃,硬度大,难溶于水。密度为ρg·cm-3,其晶胞结构如图所示。已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为_______,GaAs的熔点_______(填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGag mol-1和MAsg mol-1,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______。
试卷第1页,共3页
参考答案:
1.C
【详解】
A.酸性条件下,双氧水与铜反应生成铜离子和水,此过程可理解为双氧水将铜氧化为氧化铜,氧化铜与硫酸反应,离子方程式为Cu+H2O2+2H+=Cu2++2H2O,A正确;
B.可用加热的方法除去过量的H2O2,因为双氧水受热分解为氧气和水,B正确;
C.调pH=2的目的是为了防止生成Cu(OH)2沉淀,加入锌灰后发生置换,得到海绵铜,C错误;
D.顶点为8×=1,面心为6×=3,1个铜晶胞(如图所示)中含4个Cu原子,D正确;
答案选C。
2.C
【详解】
A.电负性是衡量原子对键合电子的吸引能力的,Si是非金属,Mg是金属,电负性:Mg<Si,A项错误;
B.Mg原子核外有12个电子,每个电子的运动状态都不相同,则Mg核外电子有12种不同的运动状态,B项错误;
C.Mg与Si之间的最近距离为体对角线的,晶胞参数为anm,则体对角线为a,则Mg与Si之间的最近距离为,C项正确;
D.该晶胞含有4个Si,8个Mg,即含有4个Mg2Si,则一个晶胞的质量为:g=g,该晶体的密度为,D项错误;
故选C。
3.C
4.A
【详解】
A.Al元素为13号元素,原子核外有13个电子,所以核外电子排布式为:1s22s22p63s23p1,故A错误;
B.晶体中Al位于顶点和面心,与Al距离最近且相等的Al有12个,故B正确;
C.该晶胞中,Li个数=12×+1=4,Al的个数=8×+6×=4,Si的个数=4,所以Li、Al、Si原子个数比为1:1:1,故C正确;
D.根据图知,每个Al原子连接4个相同的Si原子,Al原子与Si原子之间的最短距离为,故D正确;
故选:A。
5.D
【详解】
A.冰晶胞内水分子间以氢键结合,A错误;
B.每个冰晶胞平均占有分子个数=4+×8+×6=8,B错误;
C.氢键有饱和性和方向性,每个H原子只能形成一个氢键,氢键不是化学键,C错误;
D.冰中氢键的作用能为18.5 kJ mol-1,而冰熔化热为5.0 kJ mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且在液态水中仍存在氢键,D正确;
故合理选项是D。
6.C
【详解】
A.由晶胞图示可知,相邻两个最近的N原子的位置关系为:,故相邻两个最近的N原子的距离为nm,A错误;
B.由晶胞结构示意图可知,每个晶胞中含有Mo的个数为:,N的个数为:,故氮化钼的化学式为,B错误;
C.由晶胞结构示意图可知,钼原子位于8个顶点和6个面心上,故每个钼原子周围与其距离最近的钼原子有12个,C正确;
D.由B项分析可知,该晶胞中含有4个Mo,2个N,则一个晶胞的质量为:,一个晶胞的体积为:(a×10-7cm)3,gu 晶体的密度,D错误;
故答案为:C。
7.C
【详解】
A.N原子最外层有5个电子,2个N原子形成3对共用电子对,使物质分子中每个原子都达到最外层8个电子的稳定结构,故N2的电子式为:,A错误;
B.AlN是高温陶瓷材料,物质的熔沸点很高,说明AlN的存在状态是原子晶体,而不是熔沸点比较低的分子晶体,B错误;
C.Al是13号元素,原子核内质子数是13,27Al中的中子数为:27-13=14,C正确;
D.原子核外电子总是尽可能成单排列,而且自旋方向相同,这样排布使原子的能量最低,故基态氮原子轨道表示式是:,D错误;
故合理选项是C。
8.D
【详解】
A.Fe粉与AgI悬浊液反应的离子方程式为:Fe+2AgI(s)2Ag+Fe2++2I-,A错误;
B.由图可知,现将含碘海水中的碘转化为AgI,再转化为FeI2,进行I-的富集后,再通入Cl2制备粗碘,B错误;
C.如图2所示I2的晶胞中有个I2分子,C错误;
D.由题干流程可知,流程中沉淀即Ag和Fe加入一定量的稀硝酸可将Ag转化为AgNO3,实现AgNO3的循环使用,D正确;
故答案为:D。
9.A
【详解】
A.的价电子排布式为:,故位于元素周期表区,选项A错误;
B.由图可知,位于顶点和面心,个数为,位于体内,其个数为4,则离子数目相同,选项B正确;
C.由图可知每个周围有4个,选项C正确;
D.同类型的离子晶体中,离子半径越小,晶格能越大,因氧离子半径小于硫离子半径,则氧化锌的晶格能大于硫化锌,选项D正确。
答案选A。
10.D
【详解】
A.S的价电子排布式为:3s23p4,故S位于元素周期表p区,A正确;
B.由该物质形成晶体的晶胞可知:S个数为,H个数为:,故H、S原子个数比为3:1,故该物质的化学式为,B正确;
C.S位于H构成的八面体空隙中,如图所示,C正确;
D.由于该晶体是一种新型超导材料,说明其是由阴、阳离子构成的,故该晶体属于离子晶体,D错误;
故答案为:D。
11.D
【详解】
A.在该晶体中黑球与白球个数比是4:2=2:1,这是Cu、O两种元素形成的化合物,结合二者常见化合物及元素化合价特点可知:黑色表示的原子为Cu,白球白色的原子为O,A正确;
B.根据选项A分析可知黑球表示Cu,白球表示O原子,黑球与白球个数比是4:2=2:1,所以该晶体化学式是Cu2O,B正确;
C.根据图示可知:在晶胞中与O原子距离相等且最近的Cu原子有4个,故氧原子的配位数为4,C正确;
D.根据晶胞结构可知在Cu2O晶胞中,Cu与O的最近距离是晶胞体对角线的。已知晶胞中Cu2O组成的晶胞棱长为a nm,则体对角线为nm,所以Cu与O的最近距离为,D错误;
故合理选项是D。
12.D
【详解】
A.NaCl是离子晶体,没有NaCl分子,故A错误;
B.铜是面心立方晶胞,一个铜晶胞占用4个铜原子,一个铜晶胞的质量为g,故B错误;
C.60gSiO2的物质的量是1mol,含有Si-O键的个数为4NA,故C错误;
D.1个Si和周围4个C形成4个C-Si键,1个C和周围4个Si形成4个C-Si键,1molSiC含有C-Si键的个数为4NA,故D正确;
选D。
13.C
【详解】
A.由题意可知,硼化镁晶体具有超导性说明晶体中含有自由移动的电子,故A正确;
B.由投影图可知,每个镁原子上层距离其最近的硼原子有6个,下层距离其最近的硼原子也有6个,共12个,每个硼原子上层距离其最近的镁原子有3个,下层距离其最近的镁原子也有3个,共6个,则Mg、B原子个数比为1:2,化学式为MgB2,故B正确;
C.由晶胞结构可知,磷化硼晶体中,每个磷原子的周围有4个硼原子,配位数为4,故C错误;
D.由晶胞结构可知,磷化硼晶体中,磷原子与硼原子最近距离为四分之一体对角线,即nm,故D正确;
故选C。
14.B
【详解】
A.CaO2中的阴离子为过氧根离子,36g CaO2的物质的量为,0.5molCaO2中含有0.5mol过氧根离子,故36g CaO2中的阴离子数目为0.5NA,A项错误;
B.H218O的摩尔质量为20g mol-1,20gH218O的物质的量为1mol。1个H218O分子中含有10个中子,则1molH218O分子中含有的中子数为10NA,B项正确;
C.在石墨晶体中1个C原子对应1.5个碳碳键,12g石墨的物质的量为1mol,则12g石墨中含有碳碳键的个数为1.5NA,C项错误;
D.根据反应方程式:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,可知,当生成1mol氯气,转移的电子数为NA,D项错误;
答案选B。
15.A
【详解】
A.根据H3BO3结构可知,H3BO3含有羟基,羟基是亲水基,因此H3BO3易溶于水,A正确;
B.B原子最外层只有3个电子,与O原子形成3对共用电子对,因此B原子不是8e-的稳定结构,B错误;
C.1个H3BO3分子对应着6个氢键,每个氢键对应着2个H3BO3,则含1 mol H3BO3的晶体中有3 mol氢键,C错误;
D.根据化合物中元素化合价代数和为0,所以H3BO3中B为+3价,H3BO3与足量的NaOH反应生成NaH2BO3是正盐,可知H3BO3是一元酸,D错误;
故合理选项是A。
16.D
【详解】
A.甲烷是分子晶体,甲烷晶胞中的一个球表示一个CH4分子,A错误;
B.与位于晶胞顶点的CH4分子为例,与其等距离且最近的CH4分子个数为3××8=12,B错误;
C.一个甲烷晶胞中含有的CH4分子个数==4,C错误;
D.两个最近的甲烷分子之间的距离为晶胞面对角线的一半即apm=0.707apm,D正确;
选D。
17. 3 1s22s22p63s23p63d104s1 或[Ar] 3d104s1 N>O>C sp3杂化 l : 2 4 (l/4, l/4, l/4,)
【详解】
(1)Co的核电荷数为27,其价层电子排布式为3d74s2,其基态原子中未成对电子数为3个;Cu原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d104s1 或[Ar] 3d104s1 ;
(2)同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以这三种元素第一电离能大小顺序是N>O>C;N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化方式为sp3;
(3)N2中σ键和π键数目之比为1:2,等电子体结构相似,根据二氧化碳电子式书写N2O的电子式为;
(4)①晶胞中每个氮原子周围与其最近且等距离的硼原子形成正四面体结构,硼原子数目为4;
②该晶胞中N原子个数是4、B原子个数=8×+6×=4,则B-N键个数为12,距离上述三个B原子最近且等距的N原子的坐标参数为(、、);
③晶胞的体积为(a×10-10cm)3,晶胞的质量为g,则氮化硼的密度为g÷(a×10-10cm)3=g·cm -3。
18. sp3 2 TiO2+BaCO3═BaTiO3+CO2↑ 6 3d9 高 =4.1
【详解】
(1)NH3中N原子形成3个键,含有1对孤电子对,杂化轨道数目为4,N原子杂化类型为sp3,NH5属于离子化合物,由铵根离子与氢负离子构成,电子式为;故答案为sp3;;
(2)CO与N2互为等电子体,二者结构相似,所以CO分子结构式为C≡O,则1 个CO分子中含有的π键数目是2,故答案为2;
(3)①可知晶胞中Ba原子数目为1,O原子数目为12×=3、Ti原子数目为8×=,故A为BaTiO3,反应还生成二氧化碳,反应方程式为:TiO2+BaCO3═BaTiO3+CO2↑,故答案为TiO2+BaCO3═BaTiO3+CO2↑;
②由BaTiO3晶胞可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为为6,故答案为6;
③在BaTiO3晶体中,若将Ti4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-只能处于立方体的面心,故答案为面心;
(4)R为Cu,其原子核外电子排布式为1s22s22p63s23p63d104s1,则Cu2+离子的外围电子层电子排布式为3d9;离子电荷相同,氧离子半径小于硫离子半径,所以Cu2O的熔点比Cu2S的高;故答案为3d9;高;
(5)晶胞中S原子数目为8×+6×=4,Zn原子位于晶胞内部,共4个,则晶胞质量为4×(65+32)g/mol÷6.02×1023mol-1),晶胞的体积为(540.0×10-10cm)3,则密度为ρ==4.1g cm-3;故答案为=4.1。
19. 小于 sp2 、sp3 3:1 5d46s2 1:1 6
【详解】
(1)基态Al原子的价电子排布式为3s23p1,故铝的价电子排布图为;基态Mg原子的核外电子排布式为1s22s22p63s2, Mg元素的3s能级为全满状态,3p能级为全空状态,体系比较稳定,能量低不容易失去一个电子,所以铝的第一电离能比镁低。
(2)根据该树脂的结构简式,分子中的碳原子没有孤电子对,苯环中的每个碳原子形成3个键,不是苯环上的碳原子,每个碳原子形成4个键, 所以该物质中苯环上的碳原子采用sp2杂化,不是苯环上的碳原子采用sp3杂化;采用sp2杂化的碳原子数为6n+6m,采用sp3杂化碳原子数为2m+2n,故采用sp2杂化的碳原子数与sp3杂化碳原子数之比为:(6n+6m):(2m+2n)=3:1;
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,铬原子的价层电子排布式为3d54s1,故钨原子的价层电子排布式5d46s2;
(4)碳和钨形成的一种化合物的晶胞模型,在此结构中钨原子数目为1+2×+12×+6×=6,晶胞内部有6个C原子,故碳原子和钨原子个数比为6:6=1:1;以晶胞体内钨原子可知,1个钨原子周围距离钨原子最近的碳原子有6个。
20.(1) 面心
(2)
【解析】
(1)
Na3OCl晶体结构中空心白球类原子6×=3、顶点阴影球类原子8×=1、实心黑球类原子1×1=1、根据Na3OCl化学式,可判断钠原子应为空心白球处在晶体结构的面心,两个钠原子之间的最短距离为晶体结构中两个面心的距离,即为一半边长的倍,所以两个Na之间的最短距离为;
(2)
已知:晶胞参数为anm,密度为,,则。
21.PnO
【详解】
由题中信息可知,n个磷酸分子间脱去(n-1)个水分子形成链状的多磷酸,因此,如果有n个磷酸分子间脱水形成环状的多磷酸,则可脱去n个水分子得到(HPO3)n,其失去H+后得到相应的酸根,故该酸根可写为PnO。
22. 原子晶体 低于
【详解】
GaAs的熔点为1238℃,熔点高,所以属于原子晶体;As原子的半径大于N原子,原子晶体中原子半径越小,熔点越高,所以GaAs的熔点低于GaN;根据均摊原则,GaAs晶胞中Ga原子个数是4、As原子数是,1个晶胞中原子的总体积是;根据晶体密度的计算公式,cm3,GaAs晶胞中原子的体积占晶胞体积的百分率为。
答案第1页,共2页
