《质量守恒定律》教学案例
图片预览

文档简介
课题名称 №5*2质量守恒定律
教学设计 刘 国 东
学 校 汉川市实验中学
二○一二年十月
《质量守恒定律》教学案例
汉川市实验中学 刘国东
[教学目标]
知识与技能:能用质量守恒定律解释常见的化学反应中的质量关系,并注重状态的改变和比较对象的分析。能用微粒的观点解释质量守恒定律
过程与方法:通过探究实验认识质量守恒定律。
情感·态度·价值观:感悟“观察”与“实验”对化学学习的重要性,了解定量研究化学对社会发展的重要意义。
[教学重点]探究质量守恒定律
[教学难点]理解“参加”反应各物质的质量或“生成”各物质的质量的涵义。
[教学仪器与药品]天平、小烧杯(3)、药匙、砂纸、白纸;硫酸铜溶液、过氧化氢溶液、二氧化锰、小刀(6组)
[教学方法]组织学生分组探究、引导分析、多媒体辅助教学
[学习方法]在教师指导下学习运用实验观察、讨论、图示分析等学习化学知识。
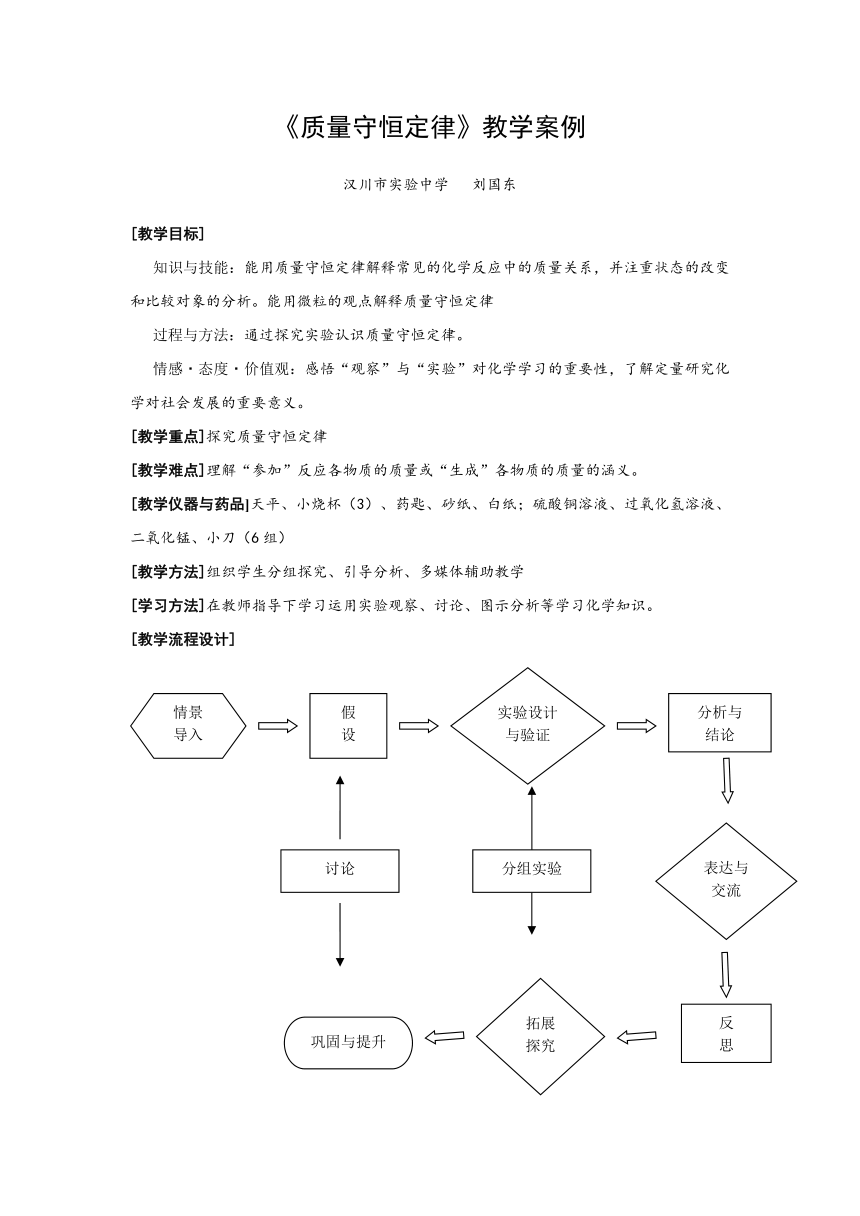
[教学流程设计]
[教学过程]
教师引导
学生活动
设计意图
[情景导入]通过前面的学习我们知道化学变化有新物质生成,物质发生了改变,物质的质量是否发生了改变?以家里的煤气为例,是越烧越多?还是越烧越少?还是不变?生成的二氧化碳和水呢?
通过生活经验及分析学生自主得到结论:随着化学反应的进行,反应物逐渐变少,生成物逐渐变多。
从学生熟悉的情景入手,激发兴趣,展开讨论。
[提出问题] 反应物减少的质量与生成物增加的质量有什么关系?(<、=、>)
[作出假设]
提示:地球上无处不在,无时无刻不在发生化学变化,地球的质量是否发生了变化?
学生的假设:反应物减少的质量=生成物增加的质量
用地球质量的变化引导学生作出假设。
[实验设计与验证]方案一:1.将装有硫酸铜溶液的小烧杯和一个用砂纸打磨的小刀一起放在已经调平的天平上称量。(称量后法码和游码不移动)2.把小刀加到装有硫酸铜溶液的小烧杯中,观察小刀表面的现象。3.一段时间后,再把小烧杯连同杯里的小刀放在天平上,观察天平是否平衡。
多媒体展示
方案二:硫酸铜晶体的加热
方案三:稀盐酸与氢氧化钠的反应
学生根据方案进行分组实验。(填写学案3)
实验方案一
铁+硫酸铜→铜+硫酸亚铁
反应前的质量
反应现象
反应后的质量
天平是否平衡
分析
通过观看结合亲身体验得到相同的结果。假设成立!
引导学生如何探究,亲身体验验证自己的假设。
不同实验,得到相同的结果,享受成功的喜悦。
[结论]反应物减少的质量即为“参加”反应的物质的质量总和,生成物增加的质量即为“生成”的物质的质量总和。
阐述:“参加”和“生成”的重要性。
1.木材在空气中燃烧是否消耗了空气中的所有氧气?
2.自然界中所有水是不是你在家里燃烧蜡烛生成的?
质量守恒定律:参加化学反应各物质的质量总和等于反应后生成的的各物质的质量总和。
学生根据生活经验能明确地回答问题。(完成学案4)
运用生活中的事例使“参加”和“生成”问题的理解简单化。
[表达与交流]
蜡烛+氧气 水+二氧化碳
氢气+氧气 水
用质量守恒定律的内容作具体的回答。(完成学案5)
用具体的例子说明质量守恒定律,强化了教学效果。
[反思]所有的化学反应为什么都遵守质量守恒定律呢?结合构成物质的粒子及化学变化的实质回答,并参考课本128页方案3图示。
学生通过观察思考分析:(完成学案6)
原子是化学变化中的最小粒子,所以原子的种类、数目、质量没有改变→元素的种类、质量不变→物质的总质量也不变。
引导与自学,思考与讨论结合,提高了学生的能力。
[拓展探究]1.将装有过氧化氢溶液的小烧杯和一个装有少量二氧化锰的小烧杯一起放在已经调平的天平上称量。(称量后法码和游码不移动)2.把过氧化氢溶液倒入装有二氧化锰的小烧杯中,观察现象。3.反应完毕冷却后,再把两只小烧杯一起放在天平上,观察天平是否平衡。
图示分析:
所有的化学反应都遵守质量守恒定律,分析某一化学反应质量的变化时,一定要注重“物质状态的改变”和“比较对象”结合图示进行分析变化了质量是什么物质引起的?并不是不符合质量守恒!
学生根据方案进行分组实验。(填写学案7)
文字表达式
反应前的质量
反应现象
反应后的质量
天平是否平衡
分析
学生模仿画图:质量守恒,物质的状态,比较对象。
用学过的化学反应进一步说明质量守恒定律,并设置问题,加强了学生学习的积极性和主动性。
用图示分析法,使问题直观化,简单化。学生模仿中学会分析,从而理解质量守恒定律,为后面的计算分析作铺垫。
[巩固与提升]分析高锰酸钾加热后剩余固体的质量_____,原因是____。
本节课学到了什么?有哪些收获、体会?
自主画图分析(完成学案8)
学生交流。
提高学生分析问题的能力。
感知本节课内容。
《质量守恒定律》学案
1.提出问题:反应物减少的质量与生成增加的质量有什么关系?
2.假设:反应物减少的质量________生成增加的质量(<、=、>)
3.实验设计与验证
实验方案一
铁+硫酸铜→铜+硫酸亚铁
反应前的质量
反应现象
反应后的质量
天平是否平衡
分析
4.结论:反应物减少的质量______生成物增加的质量。
质量守恒定律:______________________________________________________________。
5.表达与交流:(用质量守恒定律的内容作具体的回答)
①蜡烛+氧气 水+二氧化碳
______________________________________________________________
ag的蜡烛燃烧后剩余bg,生成cg的二氧化碳和dg水,参加反应蜡烛的质量为_______,参加反应氧气的质量为_________
②氢气+氧气 水
______________________________________________________________
6.反思
类别
反应前后
是否改变
类别
反应前后
是否改变
类别
反应前后
是否改变
类别
反应前后
是否改变
原子的
种类
元素的
种类
物质的
总质量
物质的
种类
原子的
个数
元素的
质量
分子的
种类
原子的
质量
质量守恒定律的微观解释:________________、________________、____________________。
7.拓展探究:
过氧化氢分解的文字表达式
反应前的质量
反应现象
反应后的质量
天平是否平衡
分析
8.巩固与提升:高锰酸钾加热后剩余固体的质量会_________,原因是_________。画图分析。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
