(新人教版)高中化学必修二 5.1.2硫酸、硫酸根离子的经验 同步课件(30页PPT)
文档属性
| 名称 | (新人教版)高中化学必修二 5.1.2硫酸、硫酸根离子的经验 同步课件(30页PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 18:00:56 | ||
图片预览







文档简介
(共30张PPT)
第五章 化工生产中的重要非金属元素
课时2 硫酸 硫酸根离子的检验
新人教版 必修二
新知导入
亲爱的水:
你好!
请允许我这样叫你,其实这么长时间以来,我一直深爱着你。每当遇见你,我就有种沸腾的感觉,全身会放出大量热,当我看不见你,我会在空气中寻找你的气息,寻找你的每一丝痕迹。
我有时脾气很暴躁,但这是我+6价的硫原子决定的,我无法改变我的脾气,就像我无法抑制寻觅你一样。
水,我可以对门捷列夫发誓,我会爱你一辈子,尽管别人认为我脾气不好。他们说我欺负金属,欺负H2S和Na2O2。其实这都是硝酸让他们传开的。难道硝酸不欺负它们吗?NO与NO2两位兄弟是可以证明的。我只从硫中抢了2个电子,可硝酸抢了5个,这不说明它比我更欺负弱小吗?
水,为什么你总是在硝酸和我之间犹豫呢?我可以为你付出一切,就算为了你,我变成稀硫酸也不后悔,而且我会像一位守护天使一样保护你,不让你受伤,尽管我的氧化性不如硝酸那么强,但是我对你的心是不会变的,因为我不挥发,这一点我比硝酸强!!!
水,请不要刻意回避我,即使你逃到天涯海角,我也会找到你,无论经历怎样的艰辛,我都会夺回氢氧重新合成你,因为我爱你。
此致
敬礼 98%的浓硫酸
新知讲解
一、硫酸
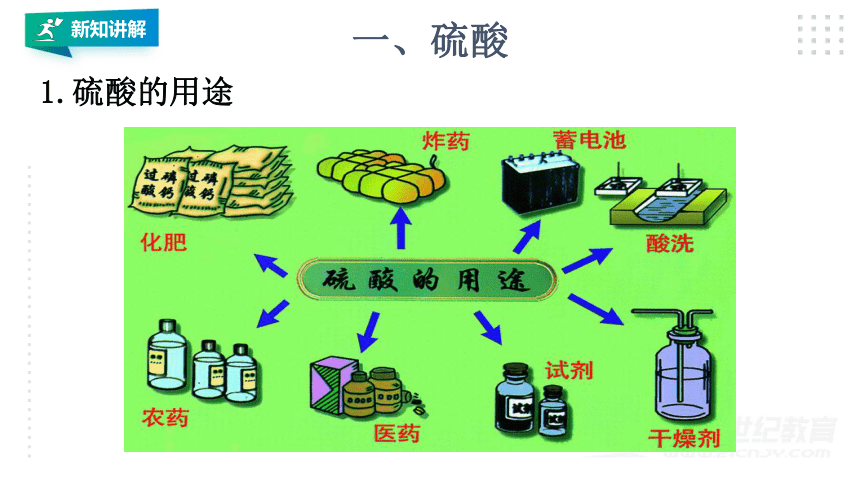
1.硫酸的用途
新知讲解
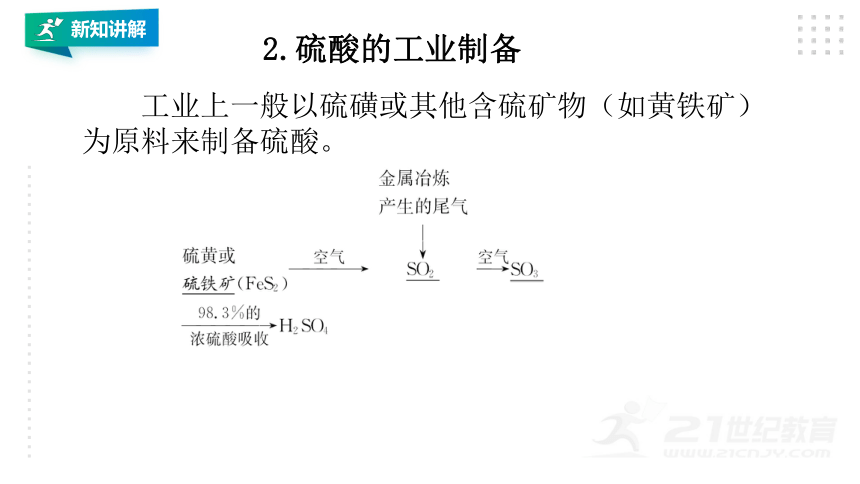
2.硫酸的工业制备
工业上一般以硫磺或其他含硫矿物(如黄铁矿)为原料来制备硫酸。
新知讲解
【做一做】 写出工业制备硫酸有关反应的化学方程式:
①制备SO2:__________________________或S+O2 SO2;
②制备SO3:__________________;
③吸收SO3:___________________。
点燃
4FeS2+11O2 2Fe2O3+8SO2
高温
2SO2 + O2 2SO3
催化剂
SO3 + H2O = H2SO4
思考:为什么不直接用水吸收SO3,而是用98.3%的浓硫酸吸收?
新知讲解
3.硫酸的性质
色态:
沸点:
密度:
溶解性:
无色 粘稠 油状液体
沸点高(难挥发酸)
密度大且浓度越大,密度越大
易溶于水,以任意比互溶,放出大量的热
(1)物理性质
新知讲解
(2)化学性质
硫酸是强酸,具有酸的通性,在水中可以电离。请同学们写出硫酸的电离方程式。
除此之外,浓硫酸还具有很强的氧化性,能氧化大多数金属单质和部分非金属单质。
H2SO4 = 2H+ + SO42-
新知讲解
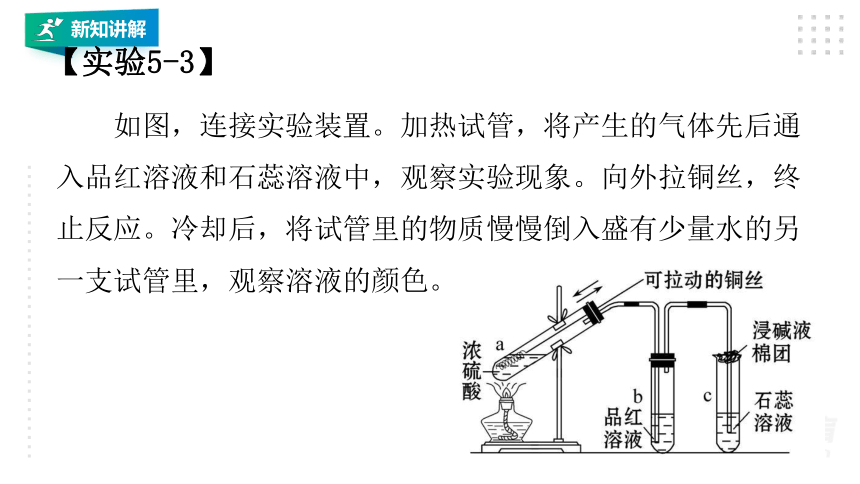
【实验5-3】
如图,连接实验装置。加热试管,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。
新知讲解
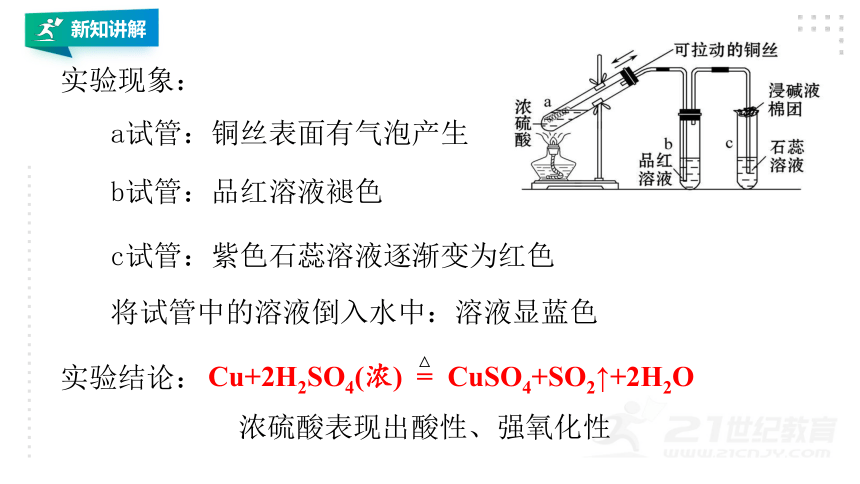
实验现象:
实验结论:
a试管:铜丝表面有气泡产生
b试管:品红溶液褪色
c试管:紫色石蕊溶液逐渐变为红色
将试管中的溶液倒入水中:溶液显蓝色
Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O
浓硫酸表现出酸性、强氧化性
新知讲解
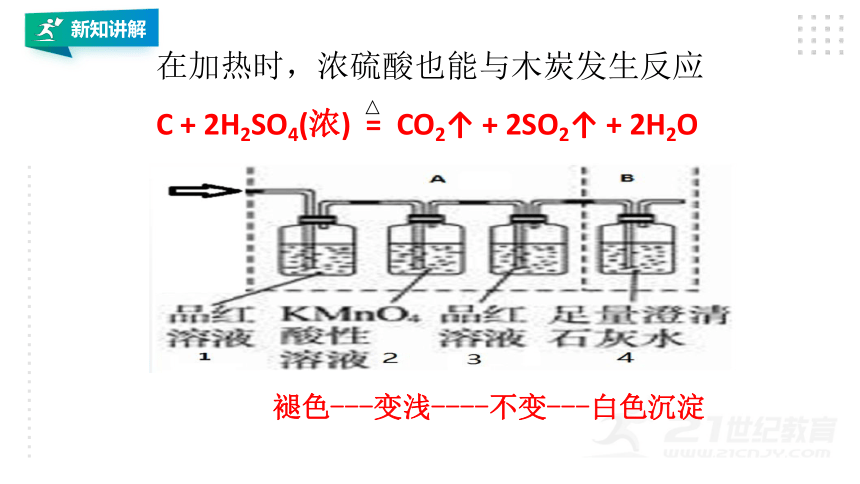
在加热时,浓硫酸也能与木炭发生反应
C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O
褪色---变浅----不变---白色沉淀
新知讲解
浓硫酸、浓硝酸与铁、铝接触时,发生钝化
常温:
钝化:表面生成致密的氧化物薄膜
提醒:若加热,反应可继续
——H2
加热时:
浓硫酸与绝大多数金属反应
SO2!
你认为常温下,铁、铝等活泼金属理论上能与浓硫酸反应吗?为什么?
能用铝槽车盛放、运输浓硫酸
新知讲解
【思考与讨论】
硫酸具有酸的哪些共同的性质?请举例写出相关反应的离子方程式。
实验室用金属与酸反应制取氢气时,往往用稀硫酸,而不用浓硫酸,这是为什么?
新知讲解
把浓硫酸沿器壁慢慢地注入水中,并不断搅动,使产生的热量迅速扩散。
【思考】如何将浓硫酸稀释为稀硫酸?
为什么不能将水注入浓硫酸中?
新知讲解
4.硫酸的特性
【实验探究1】 取适量蔗糖,放入小烧杯中,加入几滴水,再加入适量浓硫酸,迅速搅拌,观察实验现象。
现象:
蔗糖变黑,体积膨胀,形成疏松多孔物质,并有刺激性气体生成
新知讲解
原理:
C12H22O11 → 12C + 11H2O
浓H2SO4
脱水性
浓硫酸能将蔗糖、纸张、棉布和木材等有机物分子中的H:O=2:1(H2O)脱去,剩余黑色的炭。
新知讲解
【实验探究2】 向表面皿中加入少量胆矾,再加入约3ml浓硫酸,搅拌,观察实验现象。
现象:
蓝色
白色
新知讲解
吸水性:能吸收气体、液体中的水分子及固体中的结晶水
思考:什么气体都能干燥吗?
还原性气体(如:H2S、HI、HBr等)
不能干燥:
碱性气体(如:NH3)
新知讲解
脱水性和吸水性区别
吸收已经存在的水
如:结晶水
H:O=2:1脱去重新组合成H2O
物质中不含有H2O
只有H、O元素
物质中含有水H2O
新知讲解
皮肤上不慎沾上浓硫酸,该怎么办?
新知讲解
思考:如何检验硫酸根离子?
二、SO42-的检验
【实验5-4】 在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。
原理:Ba2+ + SO42- = BaSO4↓
新知讲解
原理:Ba2+ + SO42- = BaSO4↓
先生成白色沉淀,加入盐酸后,沉淀不溶解
先生成白色沉淀,加入盐酸后,沉淀不溶解
先生成白色沉淀,加入盐酸后,沉淀溶解且有气泡产生
新知讲解
在待测溶液中先加盐酸酸化,若无沉淀,再加BaCl2溶液,出现白色沉淀,则有SO42-。
盐酸的作用是什么?
能否把盐酸改为硝酸?
能否把BaCl2改为Ba(NO3)2
如何检验硫酸根离子?
新知讲解
胆矾
新知讲解
KAl(SO4)2 12H2O
新知讲解
请同学们阅读课本P6的思考与讨论,并完成以下表格
杂质 加入的试剂 离子方程式
硫酸盐
MgCl2
CaCl2
BaCl2溶液
NaOH溶液
Na2CO3溶液
CO32- + Ca2+ = CaCO3↓
SO42- + Ba2+ = BaSO4↓
2OH- + Mg2+ = Mg(OH)2↓
新知讲解
在设计除杂的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
除杂试剂必须过量
过量试剂必须除去
除杂途径必须选最佳
课堂总结
作业布置
【思考与讨论】
(1)过量的铜与一定量的浓硫酸反应时,硫酸能否全部参加反应?
(2)如果用过量的锌代替铜与一定量的浓硫酸反应,生成气体的成分有哪些?
https://www.21cnjy.com/help/help_extract.php
第五章 化工生产中的重要非金属元素
课时2 硫酸 硫酸根离子的检验
新人教版 必修二
新知导入
亲爱的水:
你好!
请允许我这样叫你,其实这么长时间以来,我一直深爱着你。每当遇见你,我就有种沸腾的感觉,全身会放出大量热,当我看不见你,我会在空气中寻找你的气息,寻找你的每一丝痕迹。
我有时脾气很暴躁,但这是我+6价的硫原子决定的,我无法改变我的脾气,就像我无法抑制寻觅你一样。
水,我可以对门捷列夫发誓,我会爱你一辈子,尽管别人认为我脾气不好。他们说我欺负金属,欺负H2S和Na2O2。其实这都是硝酸让他们传开的。难道硝酸不欺负它们吗?NO与NO2两位兄弟是可以证明的。我只从硫中抢了2个电子,可硝酸抢了5个,这不说明它比我更欺负弱小吗?
水,为什么你总是在硝酸和我之间犹豫呢?我可以为你付出一切,就算为了你,我变成稀硫酸也不后悔,而且我会像一位守护天使一样保护你,不让你受伤,尽管我的氧化性不如硝酸那么强,但是我对你的心是不会变的,因为我不挥发,这一点我比硝酸强!!!
水,请不要刻意回避我,即使你逃到天涯海角,我也会找到你,无论经历怎样的艰辛,我都会夺回氢氧重新合成你,因为我爱你。
此致
敬礼 98%的浓硫酸
新知讲解
一、硫酸
1.硫酸的用途
新知讲解
2.硫酸的工业制备
工业上一般以硫磺或其他含硫矿物(如黄铁矿)为原料来制备硫酸。
新知讲解
【做一做】 写出工业制备硫酸有关反应的化学方程式:
①制备SO2:__________________________或S+O2 SO2;
②制备SO3:__________________;
③吸收SO3:___________________。
点燃
4FeS2+11O2 2Fe2O3+8SO2
高温
2SO2 + O2 2SO3
催化剂
SO3 + H2O = H2SO4
思考:为什么不直接用水吸收SO3,而是用98.3%的浓硫酸吸收?
新知讲解
3.硫酸的性质
色态:
沸点:
密度:
溶解性:
无色 粘稠 油状液体
沸点高(难挥发酸)
密度大且浓度越大,密度越大
易溶于水,以任意比互溶,放出大量的热
(1)物理性质
新知讲解
(2)化学性质
硫酸是强酸,具有酸的通性,在水中可以电离。请同学们写出硫酸的电离方程式。
除此之外,浓硫酸还具有很强的氧化性,能氧化大多数金属单质和部分非金属单质。
H2SO4 = 2H+ + SO42-
新知讲解
【实验5-3】
如图,连接实验装置。加热试管,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。
新知讲解
实验现象:
实验结论:
a试管:铜丝表面有气泡产生
b试管:品红溶液褪色
c试管:紫色石蕊溶液逐渐变为红色
将试管中的溶液倒入水中:溶液显蓝色
Cu+2H2SO4(浓) = CuSO4+SO2↑+2H2O
浓硫酸表现出酸性、强氧化性
新知讲解
在加热时,浓硫酸也能与木炭发生反应
C + 2H2SO4(浓) = CO2↑ + 2SO2↑ + 2H2O
褪色---变浅----不变---白色沉淀
新知讲解
浓硫酸、浓硝酸与铁、铝接触时,发生钝化
常温:
钝化:表面生成致密的氧化物薄膜
提醒:若加热,反应可继续
——H2
加热时:
浓硫酸与绝大多数金属反应
SO2!
你认为常温下,铁、铝等活泼金属理论上能与浓硫酸反应吗?为什么?
能用铝槽车盛放、运输浓硫酸
新知讲解
【思考与讨论】
硫酸具有酸的哪些共同的性质?请举例写出相关反应的离子方程式。
实验室用金属与酸反应制取氢气时,往往用稀硫酸,而不用浓硫酸,这是为什么?
新知讲解
把浓硫酸沿器壁慢慢地注入水中,并不断搅动,使产生的热量迅速扩散。
【思考】如何将浓硫酸稀释为稀硫酸?
为什么不能将水注入浓硫酸中?
新知讲解
4.硫酸的特性
【实验探究1】 取适量蔗糖,放入小烧杯中,加入几滴水,再加入适量浓硫酸,迅速搅拌,观察实验现象。
现象:
蔗糖变黑,体积膨胀,形成疏松多孔物质,并有刺激性气体生成
新知讲解
原理:
C12H22O11 → 12C + 11H2O
浓H2SO4
脱水性
浓硫酸能将蔗糖、纸张、棉布和木材等有机物分子中的H:O=2:1(H2O)脱去,剩余黑色的炭。
新知讲解
【实验探究2】 向表面皿中加入少量胆矾,再加入约3ml浓硫酸,搅拌,观察实验现象。
现象:
蓝色
白色
新知讲解
吸水性:能吸收气体、液体中的水分子及固体中的结晶水
思考:什么气体都能干燥吗?
还原性气体(如:H2S、HI、HBr等)
不能干燥:
碱性气体(如:NH3)
新知讲解
脱水性和吸水性区别
吸收已经存在的水
如:结晶水
H:O=2:1脱去重新组合成H2O
物质中不含有H2O
只有H、O元素
物质中含有水H2O
新知讲解
皮肤上不慎沾上浓硫酸,该怎么办?
新知讲解
思考:如何检验硫酸根离子?
二、SO42-的检验
【实验5-4】 在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。
原理:Ba2+ + SO42- = BaSO4↓
新知讲解
原理:Ba2+ + SO42- = BaSO4↓
先生成白色沉淀,加入盐酸后,沉淀不溶解
先生成白色沉淀,加入盐酸后,沉淀不溶解
先生成白色沉淀,加入盐酸后,沉淀溶解且有气泡产生
新知讲解
在待测溶液中先加盐酸酸化,若无沉淀,再加BaCl2溶液,出现白色沉淀,则有SO42-。
盐酸的作用是什么?
能否把盐酸改为硝酸?
能否把BaCl2改为Ba(NO3)2
如何检验硫酸根离子?
新知讲解
胆矾
新知讲解
KAl(SO4)2 12H2O
新知讲解
请同学们阅读课本P6的思考与讨论,并完成以下表格
杂质 加入的试剂 离子方程式
硫酸盐
MgCl2
CaCl2
BaCl2溶液
NaOH溶液
Na2CO3溶液
CO32- + Ca2+ = CaCO3↓
SO42- + Ba2+ = BaSO4↓
2OH- + Mg2+ = Mg(OH)2↓
新知讲解
在设计除杂的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
除杂试剂必须过量
过量试剂必须除去
除杂途径必须选最佳
课堂总结
作业布置
【思考与讨论】
(1)过量的铜与一定量的浓硫酸反应时,硫酸能否全部参加反应?
(2)如果用过量的锌代替铜与一定量的浓硫酸反应,生成气体的成分有哪些?
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
