第二单元课题3制取氧气第一课时课件(共31张PPT)
文档属性
| 名称 | 第二单元课题3制取氧气第一课时课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 23.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-20 00:00:00 | ||
图片预览






文档简介
(共31张PPT)
第二单元 我们周围的空气
课题3 制取氧气
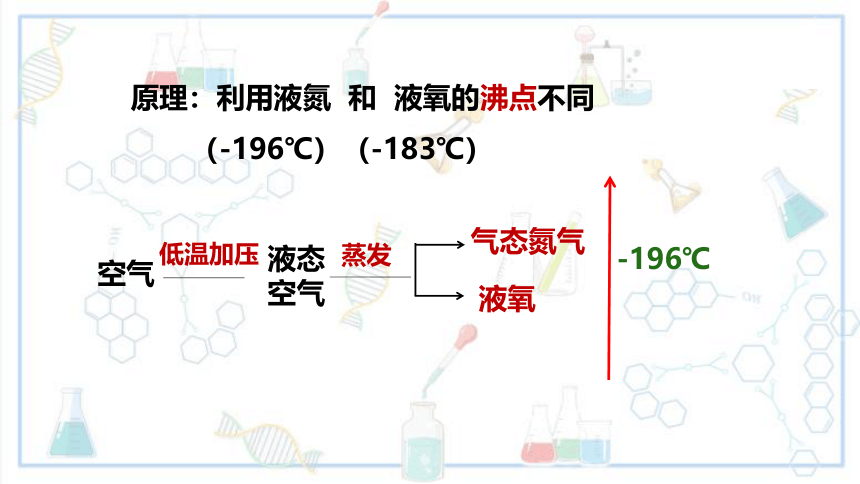
一、氧气的工业制法
--分离液态空气法
低温加压
蒸发
气态氮气
液氧
-196℃
空气
液态空气
原理:利用液氮 和 液氧的沸点不同
(-196℃)(-183℃)
1.工业上制备大量的氧气是采用 的方法,其原理是利用液态氮的沸点比液态氧的沸点 的性质.蒸发液态空气时, 首先蒸发出来,剩下的主要是 .剩余物体是 ,此变化属于 .工业上为了便于贮存、运输和使用,常把氧气加压到1.5*107 Pa,并贮存在钢瓶中.
分离液态空气
低
氮气
氧气
混合物
物理变化
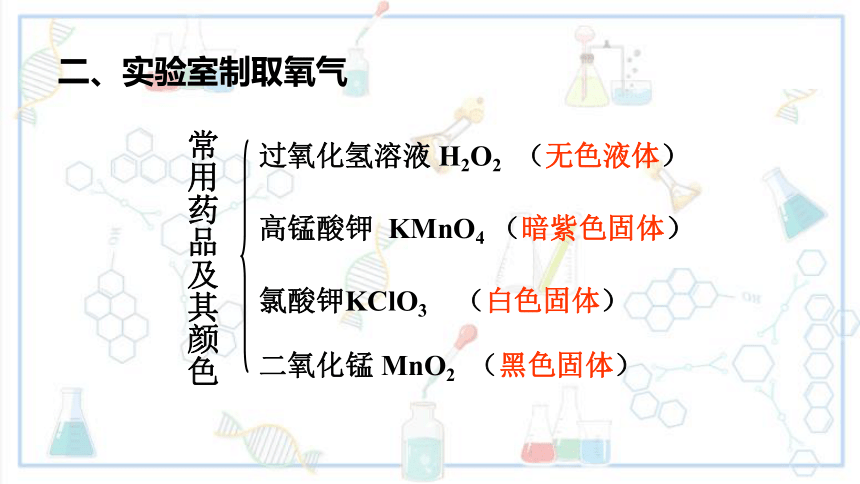
二、实验室制取氧气
过氧化氢溶液 H2O2 (无色液体)
高锰酸钾 KMnO4 (暗紫色固体)
氯酸钾KClO3 (白色固体)
二氧化锰 MnO2 (黑色固体)
常用药品及其颜色
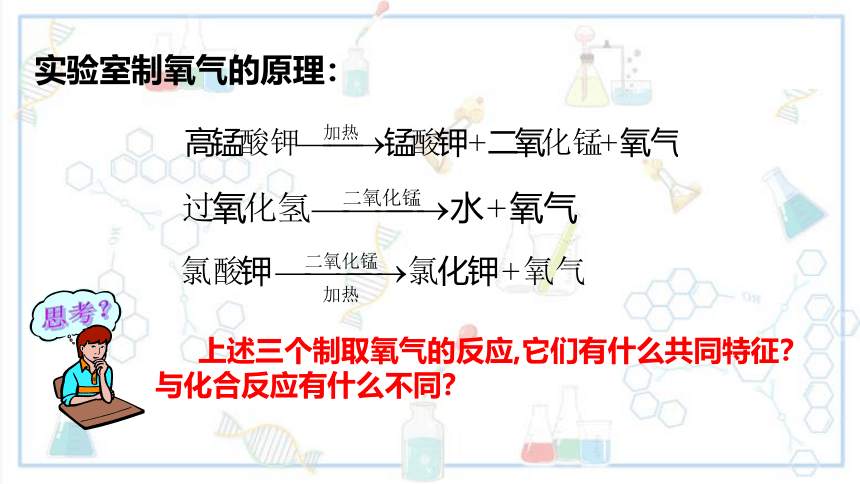
实验室制氧气的原理:
上述三个制取氧气的反应,它们有什么共同特征?与化合反应有什么不同?
思考?
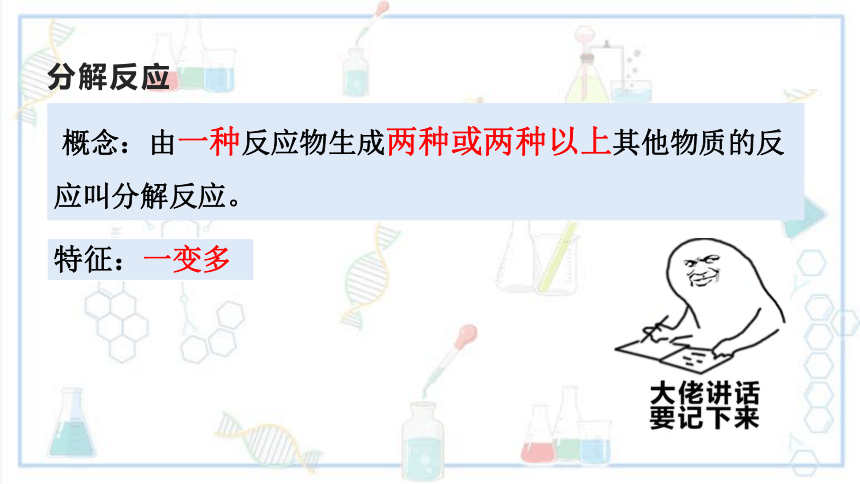
分解反应
概念:由一种反应物生成两种或两种以上其他物质的反应叫分解反应。
特征:一变多
【主要成分】过氧化氢
【含量规格】15%
【作用与用途】本品在分解过程中释放出活泼的新生态氧,用于养殖池塘的增氧,药性温和,使用方便,分解快,无残留,绿色环保。
【用法与用量】
用法:将本品以1000倍水稀释后直接泼洒于养殖池塘中。
用量:每亩水深1米用本品100~150ml,病情严重可加量使用
“氧来乐”是养鱼伯伯的“救命药”,鱼塘内定期使用可避免鱼儿缺氧死亡。
过氧化氢溶液有哪些作用
鱼塘增氧剂
种子引发剂
1.请同学阅读课本38页的探究实验,独立思考(3min)
2.小组讨论,用时(1min)
要求:小组整合组内观点,讨论实验,分工明确。
3.小组展示
要求:1位同学讲解,1位同学实验,1位同学板书。
限时
现象
结论
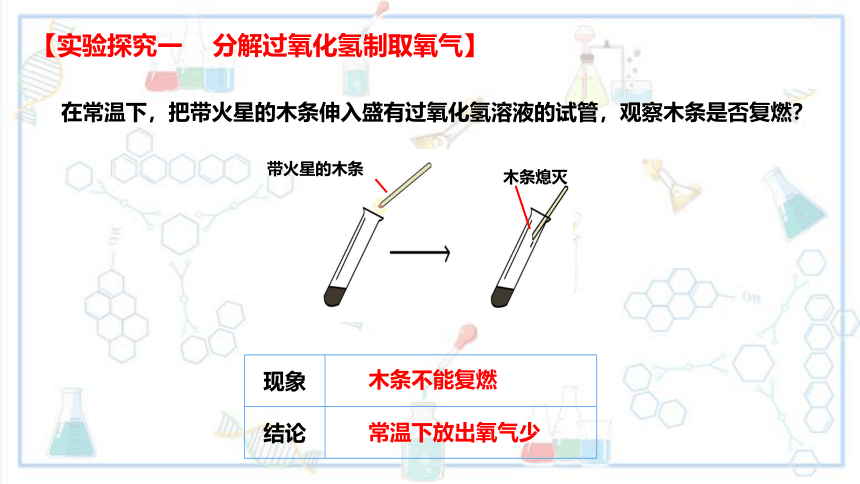
木条不能复燃
常温下放出氧气少
带火星的木条
木条熄灭
在常温下,把带火星的木条伸入盛有过氧化氢溶液的试管,观察木条是否复燃?
【实验探究一 分解过氧化氢制取氧气】
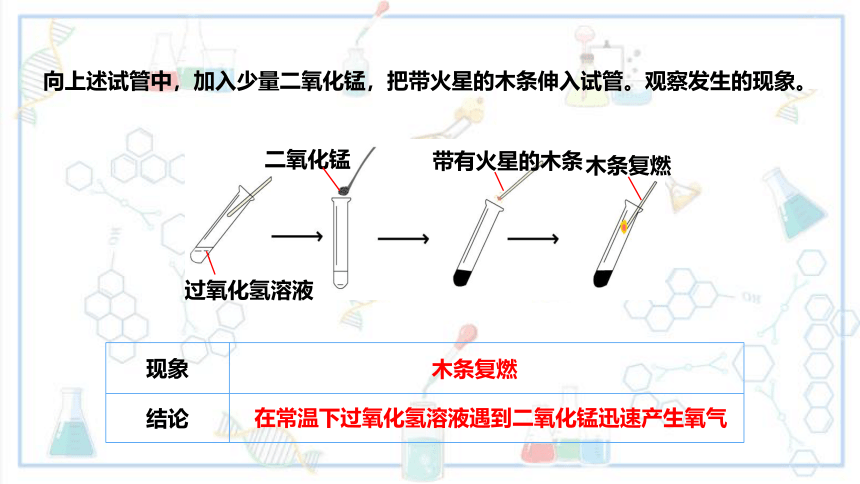
向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
过氧化氢溶液
二氧化锰
带有火星的木条
木条复燃
现象
结论
木条复燃
在常温下过氧化氢溶液遇到二氧化锰迅速产生氧气
反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象
带有火星的木条
木条复燃
过氧化氢溶液
现象
结论
木条复燃
二氧化锰仍然起作用
过氧化氢制氧气常见的三套装置
装 置
特 点
装置简单
不便于添加反应物
便于随时添加反应物
便于控制反应速率
简单装置
分液漏斗
理想装置
长颈漏斗
简易装置
长颈漏斗下端管口要液封。目的:防止气体从漏斗处逸出。
伸入锥形瓶内的导气管不宜过长。目的:便于氧气的排出
导气管应伸至接近集气瓶底部。目的:便于充分排出空气。
制取装置
①组→组装仪器;
②查→检查装置的气密性;
③装→先装固体,再装液体;
④塞→塞紧双孔胶塞;
⑤滴→向反应容器中滴加过氧化氢溶液;
⑥收→收集气体。
实验步骤:
思考:为什么先装固体后加液体?
防止液体溅出,发生危险。
二氧化锰好象永远也用不完,
二氧化锰在这个反应中到底扮演了一个什么角色呢?
科
学
探
究
的
一
般
过
程
一
提出问题
二
猜想与假设
三
制定计划
四
进行实验
五
观察实验现象
六
解释与结论
【实验探究二 二氧化锰在制氧气中的作用】
【提出问题】
二氧化锰的作用是什么?
【实验探究二 二氧化锰在制氧气中的作用】
【猜想与假设】
过氧化氢自身反应,放出氧气, 二氧化锰只是加速了反应进行。
二氧化锰与过氧化氢发生反应, 放出氧气。
不是反应物
是反应物
二氧化锰自身发生反应,放出氧气
【设计实验】
若m1= m2
若m1> m2
二氧化锰不是反应物 二氧化锰是反应物
【进行实验】
【实验现象】
带有火星的木条
木条复燃
过氧化氢溶液
现象
木条复燃
在实验(3)中,实验重复多次,每次只消耗了过氧化氢,二氧化锰好像永远用不完。
【解释与结论】
在实验(3)中,实验重复多次,每次只消耗了过氧化氢,二氧化锰好像永远用不完。 ①二氧化锰好象永远用不完,该物质 (是或不是)反应物吗,二氧化锰在反应中起 作用②“重复多次”说明 不变;③“好像永远用不完”说明 不变
不是
催化
化学性质
质量
催化剂
质量
化学性质
催化剂的定义
化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质
“一变二不变”
一变 :
二不变:
改变其它物质的反应速率
(加快或减慢)
催化剂自身的质量和化学性质不变
理解:
催化作用
【注意】此反应中,二氧化锰只是一种催化 剂,应算作反应条件,所以二氧化锰写在箭 头的上方。
过氧化氢 水 + 氧气
二氧化锰
催化剂在化学反应中所起的作用叫 催化 作用
注意:①催化剂只能改变化学反应速率,不能改变生成物的质量②催化剂不是反应物、又不是生成物;③催化剂仅针对某一反应,并不是所有反应的催化剂;④某一反应的催化剂可能不只一种. 在过氧化氢溶液制取氧气中,催化剂可以用硫酸铜溶液、氧化铁、氧化铜、红砖粉末等.
一个反应不只有一种催化剂
硫酸铜溶液
红砖粉末
催化剂的发展前景
2001年诺贝尔化学奖 “手性催化氢化反应”
2010年诺贝尔化学奖
" 有机合成中钯的催化”
催化剂的应用
石油炼制过程中,用 高效催化剂生产汽油、 煤油等
酿造工业和制药工业都 要用酶作催化剂,某些 酶制剂还是宝贵的药物
在汽车尾气处理中用 催化剂促进有害气体 的转化
第二单元 我们周围的空气
课题3 制取氧气
一、氧气的工业制法
--分离液态空气法
低温加压
蒸发
气态氮气
液氧
-196℃
空气
液态空气
原理:利用液氮 和 液氧的沸点不同
(-196℃)(-183℃)
1.工业上制备大量的氧气是采用 的方法,其原理是利用液态氮的沸点比液态氧的沸点 的性质.蒸发液态空气时, 首先蒸发出来,剩下的主要是 .剩余物体是 ,此变化属于 .工业上为了便于贮存、运输和使用,常把氧气加压到1.5*107 Pa,并贮存在钢瓶中.
分离液态空气
低
氮气
氧气
混合物
物理变化
二、实验室制取氧气
过氧化氢溶液 H2O2 (无色液体)
高锰酸钾 KMnO4 (暗紫色固体)
氯酸钾KClO3 (白色固体)
二氧化锰 MnO2 (黑色固体)
常用药品及其颜色
实验室制氧气的原理:
上述三个制取氧气的反应,它们有什么共同特征?与化合反应有什么不同?
思考?
分解反应
概念:由一种反应物生成两种或两种以上其他物质的反应叫分解反应。
特征:一变多
【主要成分】过氧化氢
【含量规格】15%
【作用与用途】本品在分解过程中释放出活泼的新生态氧,用于养殖池塘的增氧,药性温和,使用方便,分解快,无残留,绿色环保。
【用法与用量】
用法:将本品以1000倍水稀释后直接泼洒于养殖池塘中。
用量:每亩水深1米用本品100~150ml,病情严重可加量使用
“氧来乐”是养鱼伯伯的“救命药”,鱼塘内定期使用可避免鱼儿缺氧死亡。
过氧化氢溶液有哪些作用
鱼塘增氧剂
种子引发剂
1.请同学阅读课本38页的探究实验,独立思考(3min)
2.小组讨论,用时(1min)
要求:小组整合组内观点,讨论实验,分工明确。
3.小组展示
要求:1位同学讲解,1位同学实验,1位同学板书。
限时
现象
结论
木条不能复燃
常温下放出氧气少
带火星的木条
木条熄灭
在常温下,把带火星的木条伸入盛有过氧化氢溶液的试管,观察木条是否复燃?
【实验探究一 分解过氧化氢制取氧气】
向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
过氧化氢溶液
二氧化锰
带有火星的木条
木条复燃
现象
结论
木条复燃
在常温下过氧化氢溶液遇到二氧化锰迅速产生氧气
反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象
带有火星的木条
木条复燃
过氧化氢溶液
现象
结论
木条复燃
二氧化锰仍然起作用
过氧化氢制氧气常见的三套装置
装 置
特 点
装置简单
不便于添加反应物
便于随时添加反应物
便于控制反应速率
简单装置
分液漏斗
理想装置
长颈漏斗
简易装置
长颈漏斗下端管口要液封。目的:防止气体从漏斗处逸出。
伸入锥形瓶内的导气管不宜过长。目的:便于氧气的排出
导气管应伸至接近集气瓶底部。目的:便于充分排出空气。
制取装置
①组→组装仪器;
②查→检查装置的气密性;
③装→先装固体,再装液体;
④塞→塞紧双孔胶塞;
⑤滴→向反应容器中滴加过氧化氢溶液;
⑥收→收集气体。
实验步骤:
思考:为什么先装固体后加液体?
防止液体溅出,发生危险。
二氧化锰好象永远也用不完,
二氧化锰在这个反应中到底扮演了一个什么角色呢?
科
学
探
究
的
一
般
过
程
一
提出问题
二
猜想与假设
三
制定计划
四
进行实验
五
观察实验现象
六
解释与结论
【实验探究二 二氧化锰在制氧气中的作用】
【提出问题】
二氧化锰的作用是什么?
【实验探究二 二氧化锰在制氧气中的作用】
【猜想与假设】
过氧化氢自身反应,放出氧气, 二氧化锰只是加速了反应进行。
二氧化锰与过氧化氢发生反应, 放出氧气。
不是反应物
是反应物
二氧化锰自身发生反应,放出氧气
【设计实验】
若m1= m2
若m1> m2
二氧化锰不是反应物 二氧化锰是反应物
【进行实验】
【实验现象】
带有火星的木条
木条复燃
过氧化氢溶液
现象
木条复燃
在实验(3)中,实验重复多次,每次只消耗了过氧化氢,二氧化锰好像永远用不完。
【解释与结论】
在实验(3)中,实验重复多次,每次只消耗了过氧化氢,二氧化锰好像永远用不完。 ①二氧化锰好象永远用不完,该物质 (是或不是)反应物吗,二氧化锰在反应中起 作用②“重复多次”说明 不变;③“好像永远用不完”说明 不变
不是
催化
化学性质
质量
催化剂
质量
化学性质
催化剂的定义
化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质
“一变二不变”
一变 :
二不变:
改变其它物质的反应速率
(加快或减慢)
催化剂自身的质量和化学性质不变
理解:
催化作用
【注意】此反应中,二氧化锰只是一种催化 剂,应算作反应条件,所以二氧化锰写在箭 头的上方。
过氧化氢 水 + 氧气
二氧化锰
催化剂在化学反应中所起的作用叫 催化 作用
注意:①催化剂只能改变化学反应速率,不能改变生成物的质量②催化剂不是反应物、又不是生成物;③催化剂仅针对某一反应,并不是所有反应的催化剂;④某一反应的催化剂可能不只一种. 在过氧化氢溶液制取氧气中,催化剂可以用硫酸铜溶液、氧化铁、氧化铜、红砖粉末等.
一个反应不只有一种催化剂
硫酸铜溶液
红砖粉末
催化剂的发展前景
2001年诺贝尔化学奖 “手性催化氢化反应”
2010年诺贝尔化学奖
" 有机合成中钯的催化”
催化剂的应用
石油炼制过程中,用 高效催化剂生产汽油、 煤油等
酿造工业和制药工业都 要用酶作催化剂,某些 酶制剂还是宝贵的药物
在汽车尾气处理中用 催化剂促进有害气体 的转化
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
