9.2溶解度 3课时课件-2021-2022学年九年级化学人教版下册(共48张PPT内嵌视频)
文档属性
| 名称 | 9.2溶解度 3课时课件-2021-2022学年九年级化学人教版下册(共48张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-20 18:10:09 | ||
图片预览










文档简介
(共48张PPT)
课题2 溶解度
第1课时 饱和溶液和不饱和溶液
第九单元 溶液
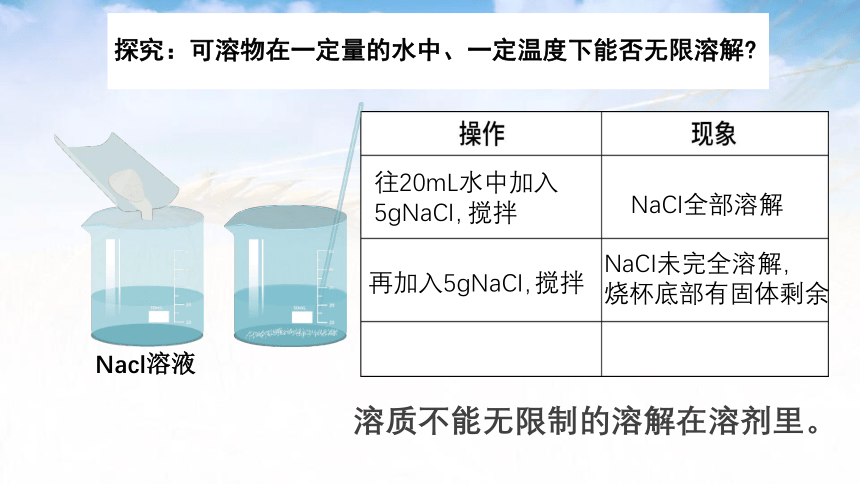
往20mL水中加入5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
探究:可溶物在一定量的水中、一定温度下能否无限溶解
往20mL水中加入
5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
再加入15mL水
烧杯内固体全部溶解
溶质在溶剂中的溶解量是受溶剂体积影响。
溶质不能无限制的溶解在(一定量)溶剂里。
探究:可溶物在一定量的水中、一定温度下能否无限溶解
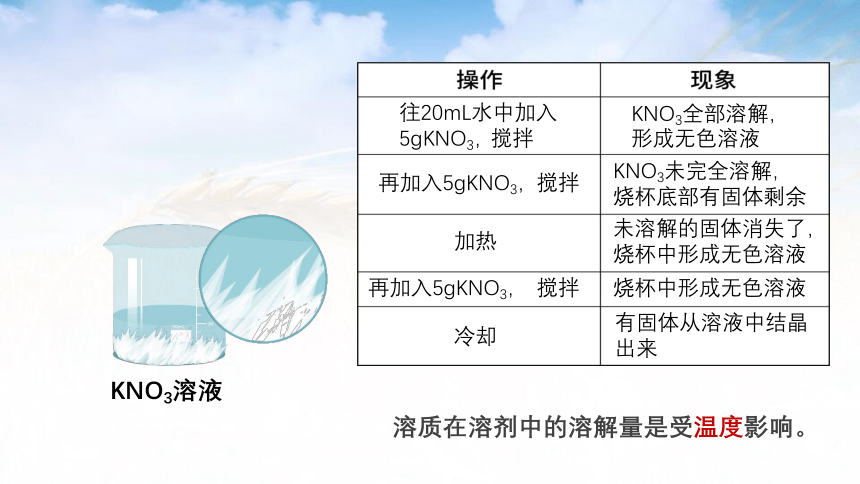
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
探究:可溶物在一定量的水中、一定温度下能否无限溶解
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
冷却
有固体从溶液中结晶出来
1.饱和溶液与不饱和溶液
(1)饱和溶液: 在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
(2 )不饱和溶液: 在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
饱和溶液
一
只有指明“一定温度”和“一定量溶剂”,“饱和”和“不饱和”才有意义。
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,但还能溶解其他溶质。因此,表述某溶质的饱和溶液要指明溶质。如氯化钠饱和溶液、硝酸钾饱和溶液。
如何验证某硝酸钾溶液已经达到饱和?
加入少量
高锰酸钾
取少量冷却后的饱和硝酸钾溶液与小试管中,加入少量高锰酸钾固体,观察高锰酸钾能否溶解?
此溶液为硝酸钾饱和溶液,高锰酸钾的不饱和溶液
思考1:20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量
饱和溶液
不包括未溶解的固体!
D
思考2:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?
加入溶质、蒸发溶剂、改变温度
加入硝酸钾、蒸发掉一些水、降低温度
思考3:将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些?
增加溶剂、升高温度
饱和溶液与不饱和溶液的转化条件:
不饱和溶液
饱和溶液
①增加溶质
①增加溶剂
大多数固体:
②蒸发溶剂
③降低温度
②升高温度
升高温度
降低温度
特例:氢氧化钙Ca(OH)2的溶液
不饱和溶液
饱和溶液
①Ca(OH)2和气体等,它的溶解度随温度升高而降低;
小结
饱和溶液与不饱和溶液之间的转化
在20℃时,要使接近饱和的石灰水变为饱和的石灰水,应采用的措施是_____
A.升高温度至刚好有晶体析出 B.加冰至刚好有晶体析出
C.加水 D.加氢氧化钙至不再溶解
AD
②最可靠的方法是:加溶质、蒸发溶剂。
硝酸钾晶体
雪花晶体
冷却热饱和溶液
【晶体】具有规则几何外形的固体即为晶体。
【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
结晶
较高温度下的硝酸钾溶液
烧杯底部有晶体析出
方法之一:降温结晶,又叫冷却热饱和溶液
如何将硝酸钾溶液中的溶质硝酸钾提取出来?
分离混合物的方法
海水
贮水池
蒸发池
结晶池
粗盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂
结晶方法之二:蒸发结晶
降温结晶:KNO3(冷却热饱和溶液法)
蒸发结晶法:NaCl
【结晶方法】
1.饱和溶液和不饱和溶液含义
2.饱和溶液和不饱和溶液的相互转化
3.结晶
(1)降温结晶(冷却热饱和溶液)。
(2)蒸发结晶。
①加水②升温
不饱和溶液 饱和溶液
①加溶质②降温③蒸发溶剂
课堂小结
1、下列关于饱和溶液的说法中,错误的是( )
A.在温度不变时,KNO3饱和溶液不能再溶解KNO3晶体
B.改变条件可以使不饱和溶液变成饱和溶液
C.室温下,与固体溶质共存的溶液一定是这种溶质的饱和溶液
D.在温度升高时,某物质的饱和溶液一定能继续溶解该物质
D
2、在温度为t℃时,某物质的饱和溶液一定是( )
A.稀溶液 B.含有100g溶剂的溶液
C.浓溶液 D.不能再溶解该物质的溶液
3、某物质的饱和溶液中,加入一些该溶质的固体,则下列说法中正确的是( )
A.溶质质量减少 B.溶液质量增大
C.固体质量不变 D.溶质质量增加
D
C
4、一定温度下,从500克的饱和溶液中倒出100克
溶液,剩余的溶液里,下列数值比原溶液减少的是( )
①溶质的质量; ②溶剂的质量;
③溶液的密度; ④溶液的质量;
⑤溶质的质量分数(即:浓度)
①②③④ B. ②③④⑤
C. ①②④ D.①②③④⑤
C
课题2 溶解度
第2课时
固体溶解度与溶解度曲线
第九单元 溶液
定量比较固体溶解能力大小的要素:
一定温度
100g溶剂
饱和状态
单位(克)
设计实验——怎样比较食盐和蔗糖哪一个更易溶于水?
讨论
20℃ ,
100g水,
20℃ ,
100g水,
36gNaCl
31.6g蔗糖
可行
饱和
溶解性:
一种物质(溶质)溶解在另一种物质(溶剂)里的能力。
溶解性大小:
如何定量描述物质溶解能力?
(定性)
易溶、可溶、微溶、难溶
1、固体物质的溶解度:
概念:
注意:
条件:
四元素
(s)
在一定温度下,某固态物质在100g溶剂里达到饱和状态时
所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
没有指明溶剂,溶剂默认为水。
标准:
单位:
状态:
在一定温度下。
在100g溶剂里。
饱和。
g
例题:下列有关NaCl的溶解度的说法正确的是( )
A.20℃时,18gNaCl溶解在50g水中达到饱和状态,20℃时,NaCl的溶解度为18g
B.36gNaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36g
C.20℃时,35gNaCl完全溶解在100g水中,20℃时,NaCl的溶解度为35g
D.20℃时,100g水中最多溶解36gNaCl,20℃时,NaCl的溶解度为36g
20℃时,100g水中最多能溶解36gNaCl
条件:
四元素
标准:
单位:
状态:
在一定温度下。
在100g溶剂里。
饱和。
g
D
溶解度的含义:
20℃时,NaCl的溶解度为36g
20℃时,NaCl在100g水中达到饱和状态时所溶解的质量为36g
【例1】判断下列说法是否正确,并指明错误原因。
①把20g某物质溶解在100g水里恰好制成饱和溶液,这种物质的溶解度就是20g。
②20℃时10g氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10g。
③20℃时10g氯化钠可溶解在100g水里,故20℃时氯化钠的溶解度是10g。
④20℃时36g食盐溶解在100g水中恰好饱和,故20℃时食盐的溶解度是36。
未指明温度
未指明溶剂的量
未指明溶液的状态是饱和
溶解度的单位是“克”
×
×
×
×
巩固与应用
练习:
1、在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是 g。
36
2、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
温度 溶质的质量 溶剂的质量 溶液的质量
20℃
31.6g
100g
131.6g
5 在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____。20 ℃时50g水中最多可溶解氯化钠________g,形成_________g氯化钠溶液。
6 在40℃时,200g水中溶解80g氯化钾溶液达到饱和,则40℃时氯化钾的溶解度是____。40 ℃时将40g氯化钾加入50g水中,充分溶解后,形成了氯化钾的________(填“饱和”或“不饱和”)溶液_____g 。
填一填:
36g
18
68
40g
70
饱和
2. 溶解性与溶解度的关系
溶解性 溶解度/g
易溶
可溶
微溶
难溶
>10
1~10
0.01~1
<0.01
常温下:20℃
0
0.01
1
10
易溶
可溶
微溶
难溶
练习:
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。
3、20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
难
A
例题:小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是( )
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃时,40gNaOH溶解在100g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,
析出的晶体前者比后者多
D
固体物质溶解度的影响因素:
内部因素:溶质和溶剂的性质(决定性作用)
外部因素:温度
3、固体物质溶解度受温度影响的表示方法
①列表法:
25℃和85℃下NaCl、KCl、NH4Cl、KNO3的溶解度是多少?
无法从表格中得到
无法给出任意温度下某物质的溶解度
局限性
无法直观的感受某物质溶解度随温度变化的趋势
②曲线法:
溶解度曲线:
大多数固体:
溶解度随温度变化的曲线。
少数固体:
溶解度随温度升高而增大,
且受温度影响较大。
但受温度影响较小。
溶解度随温度升高而增大,
NaCl
KCl
NH4Cl
KNO3
具体动画请看精讲视频—溶解度曲线
大多数固体:溶解度随温度升高而增大,且受温度影响较大。
少数固体:溶解度随温度升高而增大,但受温度影响较小。
极少数固体:
溶解度随温度升高而减小。
50
0
10
20
30
40
60
70
80
90
100
10
60
90
100
160
150
130
20
30
40
50
80
70
170
180
200
140
120
110
190
硝酸铵
硝酸钠
.a
.b
硝酸钾
氯化铵
氯化钠
硼酸
温度(t)
溶解度
(克)
1、点:曲线上的点均表示某物质在该温度下的溶解度。
2、交点:曲线的交点表示这两种物质在该温度下的溶解度相同。
3、线:曲线越陡,该物质的溶解度受温度影响越大。
(一)溶解度曲线的意义
4、面:
曲线下面的各点,表示的溶液不饱和;
曲线上面的各点,表示的溶液饱和且底部有未溶解的溶质;
(线上的是溶解度,线上方或下方的不是溶解度)
图像上任一点,
M剂=100g,
M质=纵坐标
例题:甲物质的溶液可用作化肥、电镀液等。甲的溶解度溶解度曲线如图所示,下列说法正确的是( )
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100g甲的饱和溶液中溶质质量为28.6g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
D
36.2
38.6
25℃和85℃下NaCl、KCl、NH4Cl、KNO3的溶解度是多少?
35.7
52.6
39.2
68.9
39.2
190
溶解度曲线优点:
①一定温度范围内任意温度对应的溶解度;
②更直观地表示物质的溶解度随温度变化的趋势。
溶解度曲线的应用:
1、可以查出某种物质在某温度时的溶解度大小。
6、通过溶解度曲线确定混合物的分离、提纯方法。
2、可以看出物质的溶解度随温度变化的规律。
3、比较不同物质在同一温度时的溶解度大小。
4、可以比较不同物质的溶解度受温度变化影响的大小。
5、可以根据溶解度曲线确定如何让制得某温度时的该物质的饱和溶液。
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
固体溶解度曲线的应用
(1)降温结晶:(又叫冷却热饱和溶液法)
(2)蒸发溶剂法:
适用于溶解度随温度变化影响较小的物质如:NaCl
适用于溶解度随温度变化影响较大的物质如:KNO3
从溶解度曲线分析结晶情况
4、应用----结晶方法
(3)升温结晶法:
适用于溶解度随温度升高而减小的物质如:Ca(OH) 2
(二)分离和提纯两种可溶性固体混合物:
甲固体:溶解性随温度的降低而减小且受温度影响变化较大。
乙固体:溶解性受温度影响不大。
乙物质中混有少量的甲物质:
甲物质中混有少量的乙物质:
冷却热饱和溶液
蒸发结晶
/溶解度随温度的升高而减小。
例1:物质甲与乙的溶解度曲线如图所示,下列说法一定正确的是( )【多选】
A.常温下,乙易溶于水
B.甲的溶解度比乙的大
C.从t2℃降至t1℃,甲溶液中有晶体析出
D.甲的溶解度受温度的影响程度比乙的大
AD
例2.如图是a、b、c三种物质的溶解度曲线。根据图回答:
(1)____℃时,a和c的溶解度相等。
(2)t3℃时,把a、b、c三种物质各20g分别加入到盛有50g水的烧杯中不断搅拌,所得溶液质量的大小关系为_____(填字母,下同);若将温度降低到t1℃,溶液质量的大小关系为_____。
A.c>a=b B. b>a=c C.a>b>c D.b>a>c
(3)在t2℃下,将c物质的不饱和溶液变为饱和溶液,
下列有关说法不正确的是_____(填字母)。
A.溶剂的质量可能变小 B.溶液的质量可能变大
C.溶质的质量一定变大 D.溶质的质量一定不变
t1
C
B
课题2 溶解度
第3课时 气体溶解度
第九单元 溶液
4、气体物质的溶解度
概念:
气体的压强为101kPa和一定温度时,
在一体积水里溶解达到
饱和状态时的气体体积。
四要素
条件:
101kPa和一定温度
一体积水
标准:
状态:饱和
单位:
体积/没有单位
CO2在0℃下的溶解度是1.713。
0℃,101kPa条件下,
一体积水中最多可以溶解1.713体积的CO2。
0℃,101kPa条件下,
水中最多溶解的CO2 的体积
水的体积
= 1.713
标准状况
(1)气体溶解度与固体溶解度的比较
气体溶解度 固体溶解度
溶剂的量
条件
单位
相同点 1体积水
100g溶剂
温度和压强(101kPa)
温度
体积/没有单位
克(g)
要求溶质溶解在溶剂中达到饱和状态
【思维风暴】天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
(2)压强:一般随压强增大而增大,压强减小而减小。
(1)温度:一般随温度升高而减小,温度降低而增大。
影响气体溶解度的因素:
四、气体的溶解度
天气闷热,温度升高,空气在水中的溶解度随温度升高而减小,水中氧气含量减小;而水面与空气接触,氧气含量相对多些,所以,鱼浮出水面呼吸。
(2)气体溶解度的影响因素
内部因素:
外部因素:
溶质的性质
CO2在0℃下的溶解度是1.713。
O2在0℃下的溶解度是0.049。
温度:
在压强不变的条件下,
温度越高,
气体溶解度越小。
T
溶解在水中的气体
压强:
在温度不变的条件下,
压强越大,
气体溶解度越大。
p↓
CO2
例题:生活中的下列现象,不能说明气体的溶解度随温度的升高而减小的是( )
A.刚烧水时,水中有气泡冒出
B.喝下汽水时,感觉有气体冲到鼻腔里
C.打开啤酒瓶盖时,有大量的泡沫溢出
D.夏季午后池塘里鱼常跃出水面
C
课题2 溶解度
第1课时 饱和溶液和不饱和溶液
第九单元 溶液
往20mL水中加入5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
探究:可溶物在一定量的水中、一定温度下能否无限溶解
往20mL水中加入
5gNaCI,
NaCI全部溶解
Nacl溶液
搅拌
再加入5gNaCI,
搅拌
NaCI未完全溶解,
烧杯底部有固体剩余
溶质不能无限制的溶解在溶剂里。
再加入15mL水
烧杯内固体全部溶解
溶质在溶剂中的溶解量是受溶剂体积影响。
溶质不能无限制的溶解在(一定量)溶剂里。
探究:可溶物在一定量的水中、一定温度下能否无限溶解
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
探究:可溶物在一定量的水中、一定温度下能否无限溶解
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
往20mL水中加入5gKNO3,
KNO3全部溶解,
KNO3溶液
搅拌
形成无色溶液
再加入5gKNO3,
搅拌
KNO3未完全溶解,
烧杯底部有固体剩余
加热
未溶解的固体消失了,
烧杯中形成无色溶液
溶质在溶剂中的溶解量是受温度影响。
再加入5gKNO3,
搅拌
烧杯中形成无色溶液
冷却
有固体从溶液中结晶出来
1.饱和溶液与不饱和溶液
(1)饱和溶液: 在一定的温度下,在一定量的溶剂里,不能再溶解某种物质的溶液叫做这种溶质的饱和溶液。
(2 )不饱和溶液: 在一定的温度下,在一定量的溶剂里,还能继续溶解某种物质的溶液叫做这种溶质的不饱和溶液。
饱和溶液
一
只有指明“一定温度”和“一定量溶剂”,“饱和”和“不饱和”才有意义。
饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液,但还能溶解其他溶质。因此,表述某溶质的饱和溶液要指明溶质。如氯化钠饱和溶液、硝酸钾饱和溶液。
如何验证某硝酸钾溶液已经达到饱和?
加入少量
高锰酸钾
取少量冷却后的饱和硝酸钾溶液与小试管中,加入少量高锰酸钾固体,观察高锰酸钾能否溶解?
此溶液为硝酸钾饱和溶液,高锰酸钾的不饱和溶液
思考1:20℃时,往盛有饱和食盐水的烧杯中加入5g食盐,加入食盐后的溶液中,质量不变的是( )
A.溶剂的质量 B.溶质的质量
C.溶液的质量 D.溶剂、溶质、溶液的质量
饱和溶液
不包括未溶解的固体!
D
思考2:有一瓶接近饱和的硝酸钾溶液,欲使其成为饱和溶液,可采用的方法有哪些?
加入溶质、蒸发溶剂、改变温度
加入硝酸钾、蒸发掉一些水、降低温度
思考3:将硝酸钾的饱和溶液配成不饱和溶解,可采用的方法有哪些?
增加溶剂、升高温度
饱和溶液与不饱和溶液的转化条件:
不饱和溶液
饱和溶液
①增加溶质
①增加溶剂
大多数固体:
②蒸发溶剂
③降低温度
②升高温度
升高温度
降低温度
特例:氢氧化钙Ca(OH)2的溶液
不饱和溶液
饱和溶液
①Ca(OH)2和气体等,它的溶解度随温度升高而降低;
小结
饱和溶液与不饱和溶液之间的转化
在20℃时,要使接近饱和的石灰水变为饱和的石灰水,应采用的措施是_____
A.升高温度至刚好有晶体析出 B.加冰至刚好有晶体析出
C.加水 D.加氢氧化钙至不再溶解
AD
②最可靠的方法是:加溶质、蒸发溶剂。
硝酸钾晶体
雪花晶体
冷却热饱和溶液
【晶体】具有规则几何外形的固体即为晶体。
【结晶】溶解在溶液里的溶质以晶体的形式析出,叫做结晶。
结晶
较高温度下的硝酸钾溶液
烧杯底部有晶体析出
方法之一:降温结晶,又叫冷却热饱和溶液
如何将硝酸钾溶液中的溶质硝酸钾提取出来?
分离混合物的方法
海水
贮水池
蒸发池
结晶池
粗盐
母液
氯化钠
多种化工原料
从海水中提取食盐
蒸发溶剂
结晶方法之二:蒸发结晶
降温结晶:KNO3(冷却热饱和溶液法)
蒸发结晶法:NaCl
【结晶方法】
1.饱和溶液和不饱和溶液含义
2.饱和溶液和不饱和溶液的相互转化
3.结晶
(1)降温结晶(冷却热饱和溶液)。
(2)蒸发结晶。
①加水②升温
不饱和溶液 饱和溶液
①加溶质②降温③蒸发溶剂
课堂小结
1、下列关于饱和溶液的说法中,错误的是( )
A.在温度不变时,KNO3饱和溶液不能再溶解KNO3晶体
B.改变条件可以使不饱和溶液变成饱和溶液
C.室温下,与固体溶质共存的溶液一定是这种溶质的饱和溶液
D.在温度升高时,某物质的饱和溶液一定能继续溶解该物质
D
2、在温度为t℃时,某物质的饱和溶液一定是( )
A.稀溶液 B.含有100g溶剂的溶液
C.浓溶液 D.不能再溶解该物质的溶液
3、某物质的饱和溶液中,加入一些该溶质的固体,则下列说法中正确的是( )
A.溶质质量减少 B.溶液质量增大
C.固体质量不变 D.溶质质量增加
D
C
4、一定温度下,从500克的饱和溶液中倒出100克
溶液,剩余的溶液里,下列数值比原溶液减少的是( )
①溶质的质量; ②溶剂的质量;
③溶液的密度; ④溶液的质量;
⑤溶质的质量分数(即:浓度)
①②③④ B. ②③④⑤
C. ①②④ D.①②③④⑤
C
课题2 溶解度
第2课时
固体溶解度与溶解度曲线
第九单元 溶液
定量比较固体溶解能力大小的要素:
一定温度
100g溶剂
饱和状态
单位(克)
设计实验——怎样比较食盐和蔗糖哪一个更易溶于水?
讨论
20℃ ,
100g水,
20℃ ,
100g水,
36gNaCl
31.6g蔗糖
可行
饱和
溶解性:
一种物质(溶质)溶解在另一种物质(溶剂)里的能力。
溶解性大小:
如何定量描述物质溶解能力?
(定性)
易溶、可溶、微溶、难溶
1、固体物质的溶解度:
概念:
注意:
条件:
四元素
(s)
在一定温度下,某固态物质在100g溶剂里达到饱和状态时
所溶解的质量,叫做这种物质在这种溶剂中的溶解度。
没有指明溶剂,溶剂默认为水。
标准:
单位:
状态:
在一定温度下。
在100g溶剂里。
饱和。
g
例题:下列有关NaCl的溶解度的说法正确的是( )
A.20℃时,18gNaCl溶解在50g水中达到饱和状态,20℃时,NaCl的溶解度为18g
B.36gNaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36g
C.20℃时,35gNaCl完全溶解在100g水中,20℃时,NaCl的溶解度为35g
D.20℃时,100g水中最多溶解36gNaCl,20℃时,NaCl的溶解度为36g
20℃时,100g水中最多能溶解36gNaCl
条件:
四元素
标准:
单位:
状态:
在一定温度下。
在100g溶剂里。
饱和。
g
D
溶解度的含义:
20℃时,NaCl的溶解度为36g
20℃时,NaCl在100g水中达到饱和状态时所溶解的质量为36g
【例1】判断下列说法是否正确,并指明错误原因。
①把20g某物质溶解在100g水里恰好制成饱和溶液,这种物质的溶解度就是20g。
②20℃时10g氯化钠溶解在水里制成饱和溶液,故20℃时氯化钠的溶解度是10g。
③20℃时10g氯化钠可溶解在100g水里,故20℃时氯化钠的溶解度是10g。
④20℃时36g食盐溶解在100g水中恰好饱和,故20℃时食盐的溶解度是36。
未指明温度
未指明溶剂的量
未指明溶液的状态是饱和
溶解度的单位是“克”
×
×
×
×
巩固与应用
练习:
1、在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是 g。
36
2、20℃时硝酸钾的溶解度是31.6g,这句话的含义是什么?将其关系代入下表:
温度 溶质的质量 溶剂的质量 溶液的质量
20℃
31.6g
100g
131.6g
5 在20℃时,100g水中溶解36g氯化钠溶液达到饱和,则20℃时氯化钠溶解度是____。20 ℃时50g水中最多可溶解氯化钠________g,形成_________g氯化钠溶液。
6 在40℃时,200g水中溶解80g氯化钾溶液达到饱和,则40℃时氯化钾的溶解度是____。40 ℃时将40g氯化钾加入50g水中,充分溶解后,形成了氯化钾的________(填“饱和”或“不饱和”)溶液_____g 。
填一填:
36g
18
68
40g
70
饱和
2. 溶解性与溶解度的关系
溶解性 溶解度/g
易溶
可溶
微溶
难溶
>10
1~10
0.01~1
<0.01
常温下:20℃
0
0.01
1
10
易溶
可溶
微溶
难溶
练习:
1、不溶物就是绝对不溶于水的物质。此话是否正确?
2、20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是___溶物质。
3、20℃时氯化钠的溶解度是36g,则氯化钠属于( )
A.易溶 物质 B.可溶物质 C.微溶物质 D.难溶物质
难
A
例题:小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是( )
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40℃时,40gNaOH溶解在100g酒精中达到饱和
D.将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,
析出的晶体前者比后者多
D
固体物质溶解度的影响因素:
内部因素:溶质和溶剂的性质(决定性作用)
外部因素:温度
3、固体物质溶解度受温度影响的表示方法
①列表法:
25℃和85℃下NaCl、KCl、NH4Cl、KNO3的溶解度是多少?
无法从表格中得到
无法给出任意温度下某物质的溶解度
局限性
无法直观的感受某物质溶解度随温度变化的趋势
②曲线法:
溶解度曲线:
大多数固体:
溶解度随温度变化的曲线。
少数固体:
溶解度随温度升高而增大,
且受温度影响较大。
但受温度影响较小。
溶解度随温度升高而增大,
NaCl
KCl
NH4Cl
KNO3
具体动画请看精讲视频—溶解度曲线
大多数固体:溶解度随温度升高而增大,且受温度影响较大。
少数固体:溶解度随温度升高而增大,但受温度影响较小。
极少数固体:
溶解度随温度升高而减小。
50
0
10
20
30
40
60
70
80
90
100
10
60
90
100
160
150
130
20
30
40
50
80
70
170
180
200
140
120
110
190
硝酸铵
硝酸钠
.a
.b
硝酸钾
氯化铵
氯化钠
硼酸
温度(t)
溶解度
(克)
1、点:曲线上的点均表示某物质在该温度下的溶解度。
2、交点:曲线的交点表示这两种物质在该温度下的溶解度相同。
3、线:曲线越陡,该物质的溶解度受温度影响越大。
(一)溶解度曲线的意义
4、面:
曲线下面的各点,表示的溶液不饱和;
曲线上面的各点,表示的溶液饱和且底部有未溶解的溶质;
(线上的是溶解度,线上方或下方的不是溶解度)
图像上任一点,
M剂=100g,
M质=纵坐标
例题:甲物质的溶液可用作化肥、电镀液等。甲的溶解度溶解度曲线如图所示,下列说法正确的是( )
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100g甲的饱和溶液中溶质质量为28.6g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
D
36.2
38.6
25℃和85℃下NaCl、KCl、NH4Cl、KNO3的溶解度是多少?
35.7
52.6
39.2
68.9
39.2
190
溶解度曲线优点:
①一定温度范围内任意温度对应的溶解度;
②更直观地表示物质的溶解度随温度变化的趋势。
溶解度曲线的应用:
1、可以查出某种物质在某温度时的溶解度大小。
6、通过溶解度曲线确定混合物的分离、提纯方法。
2、可以看出物质的溶解度随温度变化的规律。
3、比较不同物质在同一温度时的溶解度大小。
4、可以比较不同物质的溶解度受温度变化影响的大小。
5、可以根据溶解度曲线确定如何让制得某温度时的该物质的饱和溶液。
溶解度(克)
温度(t)
160
150
140
130
120
110
100
90
80
70
60
50
40
30
20
10
190
180
170
10
100
90
80
70
60
50
40
30
20
0
硝酸钾
氯化钠
固体溶解度曲线的应用
(1)降温结晶:(又叫冷却热饱和溶液法)
(2)蒸发溶剂法:
适用于溶解度随温度变化影响较小的物质如:NaCl
适用于溶解度随温度变化影响较大的物质如:KNO3
从溶解度曲线分析结晶情况
4、应用----结晶方法
(3)升温结晶法:
适用于溶解度随温度升高而减小的物质如:Ca(OH) 2
(二)分离和提纯两种可溶性固体混合物:
甲固体:溶解性随温度的降低而减小且受温度影响变化较大。
乙固体:溶解性受温度影响不大。
乙物质中混有少量的甲物质:
甲物质中混有少量的乙物质:
冷却热饱和溶液
蒸发结晶
/溶解度随温度的升高而减小。
例1:物质甲与乙的溶解度曲线如图所示,下列说法一定正确的是( )【多选】
A.常温下,乙易溶于水
B.甲的溶解度比乙的大
C.从t2℃降至t1℃,甲溶液中有晶体析出
D.甲的溶解度受温度的影响程度比乙的大
AD
例2.如图是a、b、c三种物质的溶解度曲线。根据图回答:
(1)____℃时,a和c的溶解度相等。
(2)t3℃时,把a、b、c三种物质各20g分别加入到盛有50g水的烧杯中不断搅拌,所得溶液质量的大小关系为_____(填字母,下同);若将温度降低到t1℃,溶液质量的大小关系为_____。
A.c>a=b B. b>a=c C.a>b>c D.b>a>c
(3)在t2℃下,将c物质的不饱和溶液变为饱和溶液,
下列有关说法不正确的是_____(填字母)。
A.溶剂的质量可能变小 B.溶液的质量可能变大
C.溶质的质量一定变大 D.溶质的质量一定不变
t1
C
B
课题2 溶解度
第3课时 气体溶解度
第九单元 溶液
4、气体物质的溶解度
概念:
气体的压强为101kPa和一定温度时,
在一体积水里溶解达到
饱和状态时的气体体积。
四要素
条件:
101kPa和一定温度
一体积水
标准:
状态:饱和
单位:
体积/没有单位
CO2在0℃下的溶解度是1.713。
0℃,101kPa条件下,
一体积水中最多可以溶解1.713体积的CO2。
0℃,101kPa条件下,
水中最多溶解的CO2 的体积
水的体积
= 1.713
标准状况
(1)气体溶解度与固体溶解度的比较
气体溶解度 固体溶解度
溶剂的量
条件
单位
相同点 1体积水
100g溶剂
温度和压强(101kPa)
温度
体积/没有单位
克(g)
要求溶质溶解在溶剂中达到饱和状态
【思维风暴】天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
(2)压强:一般随压强增大而增大,压强减小而减小。
(1)温度:一般随温度升高而减小,温度降低而增大。
影响气体溶解度的因素:
四、气体的溶解度
天气闷热,温度升高,空气在水中的溶解度随温度升高而减小,水中氧气含量减小;而水面与空气接触,氧气含量相对多些,所以,鱼浮出水面呼吸。
(2)气体溶解度的影响因素
内部因素:
外部因素:
溶质的性质
CO2在0℃下的溶解度是1.713。
O2在0℃下的溶解度是0.049。
温度:
在压强不变的条件下,
温度越高,
气体溶解度越小。
T
溶解在水中的气体
压强:
在温度不变的条件下,
压强越大,
气体溶解度越大。
p↓
CO2
例题:生活中的下列现象,不能说明气体的溶解度随温度的升高而减小的是( )
A.刚烧水时,水中有气泡冒出
B.喝下汽水时,感觉有气体冲到鼻腔里
C.打开啤酒瓶盖时,有大量的泡沫溢出
D.夏季午后池塘里鱼常跃出水面
C
同课章节目录
