8.2金属的化学性质(第2课时金属活动性顺序)课件--2021-2022学年九年级化学人教版下册(共32张PPT内嵌视频)
文档属性
| 名称 | 8.2金属的化学性质(第2课时金属活动性顺序)课件--2021-2022学年九年级化学人教版下册(共32张PPT内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-20 21:57:15 | ||
图片预览










文档简介
(共32张PPT)
第八单元 金属和金属材料
课题2 金属的化学性质 第2课时
金属与氧气反应
金属与酸反应
金属与金属化合物溶液反应
写出以下金属分别与氧气、稀盐酸和稀硫酸反应的化学方程式,并标出基本反应类型。
随堂小测
氧气 稀硫酸 硫酸铜
镁
铝
铁
2Mg + O2 2MgO
4Al + 3O2 2Al2O3
3Fe+2O2 Fe3O4
点燃
2Al + 3H2SO4 === Al2(SO4)3+ 3H2↑
一、金属的化学性质
1、金属 + 氧气 → 金属氧化物
2、金属 + 酸 → 金属化合物 + 氢气
二、判断金属活动性顺序的方法
1、相同条件下,金属与氧气反应越容易,金属活动性越强, 反应越剧烈,金属活动性越强。
2、金属与酸反应越剧烈,金属活动性越强。
复习回顾
3、金属 + 金属化合物 → 新金属 + 新金属化合物
3、一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
03 金属与金属化合物溶液的反应
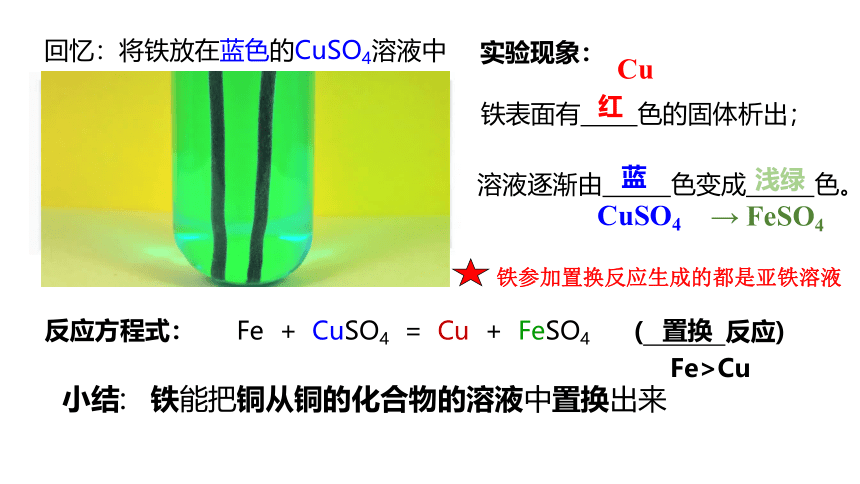
回忆:将铁放在蓝色的CuSO4溶液中
实验现象:
铁表面有 色的固体析出;
Cu
CuSO4
溶液逐渐由 色变成 色。
→ FeSO4
红
蓝
浅绿
Fe + CuSO4 = Cu + FeSO4
( 反应)
小结:
铁能把铜从铜的化合物的溶液中置换出来
置换
反应方程式:
Fe>Cu
铁参加置换反应生成的都是亚铁溶液
比较金属活泼性的方法三:
一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
我们是金属2的化合物
我是金属1
金属2
酸根
金属1
金属2
金属1
酸根
我把金属2赶走了,因为我比它的活动性更强
金属 + 金属化合物 → 新金属 + 新金属化合物
实验探究:利用铝丝、铜丝及 CuSO4、AgNO3、Al2(SO4)3溶液,设计实验判断Al、Cu、Ag的活动性。
观察与思考:
1.设计实验判断 Al 和 Cu 的活动性强弱
2.设计实验判断 Cu 和 Ag 的活动性强弱
比较金属活泼性的方法三:
一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
实验 现象 反应的化学方程式
铝片浸入硫酸铜溶液
铜丝浸入硫酸铝溶液
铝片表面有红色固体析出,溶液由蓝色变为无色
无明显现象
2Al + 3CuSO4=== Al2(SO4)3 + 3Cu
结论:金属活动性强弱:
实验前要将金属丝打磨,其目的是: 。
除去金属表面的氧化物
Al > Cu
2.设计实验判断Ag和Cu的活动性强弱
实验 现象 反应的化学方程式
铜丝浸入硝酸银溶液
铜丝表面有银白色固体析出,溶液由无色逐渐变为蓝色
Cu +2AgNO3 ===Cu(NO3)2 + 2Ag
结论:金属活动性强弱:
Cu > Ag
通过上述探究,你能得出铝、铜、银的金属活动性顺序吗?
Al Cu Ag
金属活动性:强 弱
04 金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
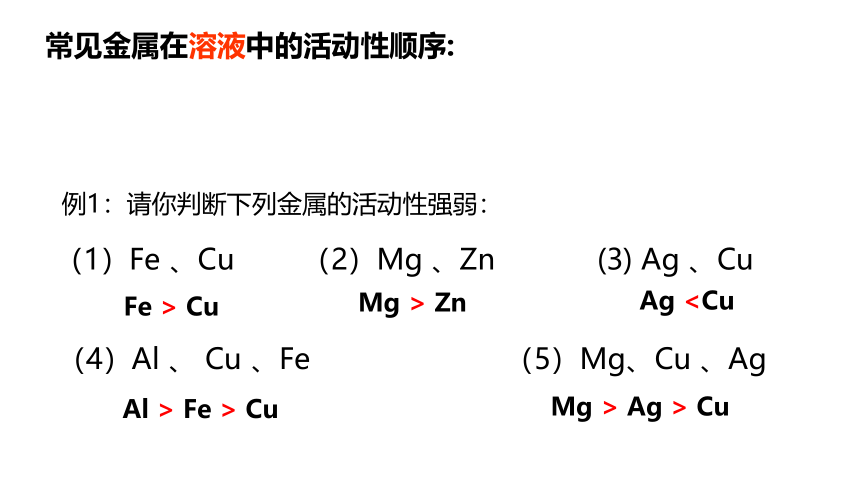
常见金属在溶液中的活动性顺序:
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
例1:请你判断下列金属的活动性强弱:
(1)Fe 、Cu (2)Mg 、Zn (3) Ag 、Cu
(4)Al 、 Cu 、Fe (5)Mg、Cu 、Ag
Fe > Cu
Mg > Zn
AgAl > Fe > Cu
Mg > Ag > Cu
嫁 给 那 美 女,身 体 细 纤 轻 ,总 共 一 百 斤
,
,
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常见金属在溶液中的活动性顺序:
,
,
位于H之前的金属才能置换出盐酸(HCl)或稀硫酸(H2SO4)的氢:
氢指的是氢元素不是氢气,因为酸中没有氢气。
例2:请你判断下列金属能否与稀盐酸、稀硫酸反应?
(1)Fe (2)Mg (3) Ag (4) Al
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常见金属在溶液中的活动性顺序:
,
,
位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来,反之不能。
Fe + CuSO4 =
Cu +2AgNO3 =
Cu +Al2(SO4)3
例3:请你判断下列反应能否发生?如果能写出反应的方程式。
(1)铜与硫酸锌溶液;
(2)锌与硫酸铜溶液;
(3)铝与硝酸银溶液;
FeSO4 + Cu
Cu(NO3)2 + 2Ag
不反应
K、Ca、Na除外
1.金属的位置越靠前,它的活动性越强。
2.位于氢前面的金属能置换出盐酸(HCl)、稀硫酸(H2SO4)中的氢。
3.位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
金属活动性顺序在工农业生产和科学研究中有着重要应用。
固体不能反应
注意:钾钙钠,要除外。
1、有 X、Y、Z 三种金属,如果把 X 和 Y 分别放入稀硫酸中,X 溶解并产生氢气,Y 不反应;如果把 Y 和Z 分别放入硝酸银溶液中,过一会儿,在 Y 表面有银析出,而 Z 没有变化。根据以上实验事实,判断 X、Y 和Z 的金属活动性顺序。
课本P13 7
解:三种金属的活动性由强到弱依次为X、Y、Z
2. 下列物质能否发生反应?写出能发生反应的化学方程式。
(1) 银与稀盐酸 (2) 锌与硫酸铜溶液
(3) 铜与硫酸锌溶液 (4) 铝与硝酸银溶液
(1) 不能,因为在金属活动性顺序中银位于氢的后面,又因为铜也位于氢的后面,所以(3)也不能反应。
(2) 反应的化学方程式为:Zn + CuSO4 Cu+ ZnSO4
(4) 反应的化学方程式为: Al +3AgNO3 Al (NO3)3 + 3Ag
课本P13 5
2Al+3CuSO4 Al2(SO4)3+3Cu
金属与金属化合物溶液反应
金属的化学性质
Cu+2AgNO3 Cu(NO3)2+2Ag
金属活动性顺序的应用
1.比较金属的活动性强弱
2.判断金属与酸能否发生置换反应
3.判断金属和金属化合物溶液能否发生置换反应
写出以下金属分别与氧气、稀盐酸和稀硫酸反应的化学方程式,并标出基本反应类型。
随堂小测
氧气 稀硫酸 硫酸铜
镁
铝
铁
2Mg + O2 2MgO
4Al + 3O2 2Al2O3
3Fe+2O2 Fe3O4
点燃
2Al + 3H2SO4 === Al2(SO4)3+ 3H2↑
一、金属的化学性质
1、金属 + 氧气 → 金属氧化物
2、金属 + 酸 → 金属化合物 + 氢气
二、判断金属活动性顺序的方法
1、相同条件下,金属与氧气反应越容易,金属活动性越强, 反应越剧烈,金属活动性越强。
2、金属与酸反应越剧烈,金属活动性越强。
复习回顾
3、金属 + 金属化合物 → 新金属 + 新金属化合物
3、一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
(1)提供一种单质,两种溶液,应如何设计?
(2)提供一种溶液,两种单质,应如何设计?
(将铜片分别插入硫酸铁溶液、硝酸银溶液中。)
(将铁丝、银片分别插入硫酸铜溶液中。)
二、三种金属(如:Zn、Cu、Ag) 试用最少的药品
两金夹一溶液
两溶液夹一金
设计实验验证金属活动性顺序
一、两种金属(如:Fe、Cu)
1、分别放入盐酸或稀硫酸
2、将一种金属放入另一种金属的盐溶液里
3. 通过置换反应可判断金属活动性顺序,某同学通过实验来比较铜、铝、汞的金属活动性顺序,现有铜、铝、汞的三种单质,如果另外只用一种试剂达到实验目的,则应选用下列试剂中的( )
A.稀硫酸 B.氯化铝溶液 C.硝酸汞溶液 D.硫酸铜溶液
D
4、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,选用的试剂是( )双选
A.MgCl2溶液 B.ZnSO4溶液 C.CuSO4溶液 D.稀硫酸
B、D
1.铁在海水中容易被锈蚀,通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁制船壳。该金属块的材料可以是( )
A.金 B.银 C.铜 D.锌
2.下列现象和事实,可用金属活动性顺序作出合理解释的是( )
①金属镁在空气中比金属铝更易被点燃 ②金属铝比金属铁更耐腐蚀 ③配制农药波尔多液(原料含硫酸铜)时,不宜用铁制容器盛放 ④金属锌与稀硫酸反应速率适中,更适用于实验室制取氢气
A.①② B.③④ C.①③④ D.①②③④
D
C
《导学案》P131 自我提升
3.分别向放有铁丝和铜丝的两支试管中加入下列溶液,不能证明铁和铜金属活动性强弱的是( )
A.稀硫酸 B.FeSO4溶液
C.CuSO4溶液 D.AgNO3溶液
4.已知锰的金属活动性位于铝和锌之间。下列化学反应不能发生的是( )
A.Fe+MnSO4=== FeSO4+Mn
B.Mg+MnSO4=== MgSO4+Mn
C.Mn+2HCl=== MnCl2+H2↑
D.Mn+CuSO4=== MnSO4+Cu
D
A
5.已知X、Y、Z三种金属能发生下列反应:
X+H2SO4=== XSO4+H2↑;
Y+Z(NO3)2=== Y(NO3)2+Z;
Z+X(NO3)2=== Z(NO3)2+X。
则X、Y、Z三种金属与氢的活动性由强到弱的顺序为( )
A.X>H>Y>Z B.X>H>Z>Y
C.Z>Y>X>H D.Y>Z>X>H
D
6.小雨同学为验证镁、铁、锌三种金属的活动性,进行了如图
所示实验:
(1)实验中,小雨观察到的现象是
,
由此得
出三种金属的活动性:镁>锌>铁。
(2)小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察
到的现象是 ,有关反应的化学方程式为 ,由此得出
铁、铜两种金属的活动性:铁 铜(填“>”“=”或“<”)。
三种金属表面都有气泡冒出,冒出气泡的速率:镁>锌>铁
铁片表面有红色固体析出,溶液由蓝色逐渐变成浅绿色
Fe+CuSO4═ FeSO4+Cu
>
Cl NO3 SO4 备 注
Zn
Mg
Fe
Fe
Cu
Al
Ag
1、在表格中写出相应化学式:
+2
+3
-1
-1
-2
+2
+2
+2
+3
+1
ZnCl2
Zn(NO3)2
ZnSO4
氯化某
硝酸某
硫酸某
AgCl
AgNO3
MgCl2
Mg(NO3)2
MgSO4
FeCl2
Fe(NO3)2
FeSO4
CuCl2
Cu(NO3)2
CuSO4
AlCl3
Al(NO3)3
Al2(SO4 )3
FeCl3
Fe(NO3)3
Fe2(SO4 )3
亚铁
铁
Ag2SO4
2、写出下列反应的化学方程式
(1)镁、锌、铁、铝与稀盐酸反应
(2)镁、锌、铁、铝与稀硫酸反应
(3)铁与硫酸铜溶液
铝与硫酸铜溶液
铜与硝酸银溶液
2Al + 3 H2SO4=Al2( SO4)3+ 3 H2↑
Cu + 2AgNO3= Cu(NO3)2 +2Ag
Fe+ CuSO4 =FeSO4 + Cu
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
2Al + 3 CuSO4= Al2( SO4)3+ 3Cu
+2
+2
+2
注意:铁在置换反应中表现为+2价而不是+3价
金属:大多数是银白色,如镁、铝、锌、铁
有Fe2+存在呈浅绿色,如FeCl2溶液、FeSO4溶液 、Fe(NO3)2溶液
有Fe3+存在呈黄色,如FeCl3溶液、Fe2(SO4)3溶液 、Fe(NO3)3溶液
有Cu2+存在呈蓝色,如CuCl2溶液、CuSO4溶液、Cu(NO3)2溶液
FeCl2溶液
FeSO4溶液
FeCl3溶液
CuSO4溶液
铜:红色 铁粉:黑色
溶液:大多数溶液是无色的
3、实验现象的描述
Cu +2AgNO3 =Cu(NO3)2 + 2Ag
现象:(1)铜的表面有 色物质生成 ;
(2)溶液由 色逐渐变成 色
银白色
无色
蓝色
银白
无
蓝
(2)溶液由 色逐渐变成 色
现象:(1)镁的表面有 产生 ;
气泡
无色
无色
气泡
无
无
Mg +2HCl =MgCl2 + H2 ↑
(2)溶液由 色逐渐变成 色
现象:(1)铁的表面有 产生 ;
气泡
无色
浅绿色
气泡
无
浅绿
Fe +2HCl =FeCl2 + H2↑
第八单元 金属和金属材料
课题2 金属的化学性质 第2课时
金属与氧气反应
金属与酸反应
金属与金属化合物溶液反应
写出以下金属分别与氧气、稀盐酸和稀硫酸反应的化学方程式,并标出基本反应类型。
随堂小测
氧气 稀硫酸 硫酸铜
镁
铝
铁
2Mg + O2 2MgO
4Al + 3O2 2Al2O3
3Fe+2O2 Fe3O4
点燃
2Al + 3H2SO4 === Al2(SO4)3+ 3H2↑
一、金属的化学性质
1、金属 + 氧气 → 金属氧化物
2、金属 + 酸 → 金属化合物 + 氢气
二、判断金属活动性顺序的方法
1、相同条件下,金属与氧气反应越容易,金属活动性越强, 反应越剧烈,金属活动性越强。
2、金属与酸反应越剧烈,金属活动性越强。
复习回顾
3、金属 + 金属化合物 → 新金属 + 新金属化合物
3、一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
03 金属与金属化合物溶液的反应
回忆:将铁放在蓝色的CuSO4溶液中
实验现象:
铁表面有 色的固体析出;
Cu
CuSO4
溶液逐渐由 色变成 色。
→ FeSO4
红
蓝
浅绿
Fe + CuSO4 = Cu + FeSO4
( 反应)
小结:
铁能把铜从铜的化合物的溶液中置换出来
置换
反应方程式:
Fe>Cu
铁参加置换反应生成的都是亚铁溶液
比较金属活泼性的方法三:
一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
我们是金属2的化合物
我是金属1
金属2
酸根
金属1
金属2
金属1
酸根
我把金属2赶走了,因为我比它的活动性更强
金属 + 金属化合物 → 新金属 + 新金属化合物
实验探究:利用铝丝、铜丝及 CuSO4、AgNO3、Al2(SO4)3溶液,设计实验判断Al、Cu、Ag的活动性。
观察与思考:
1.设计实验判断 Al 和 Cu 的活动性强弱
2.设计实验判断 Cu 和 Ag 的活动性强弱
比较金属活泼性的方法三:
一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
实验 现象 反应的化学方程式
铝片浸入硫酸铜溶液
铜丝浸入硫酸铝溶液
铝片表面有红色固体析出,溶液由蓝色变为无色
无明显现象
2Al + 3CuSO4=== Al2(SO4)3 + 3Cu
结论:金属活动性强弱:
实验前要将金属丝打磨,其目的是: 。
除去金属表面的氧化物
Al > Cu
2.设计实验判断Ag和Cu的活动性强弱
实验 现象 反应的化学方程式
铜丝浸入硝酸银溶液
铜丝表面有银白色固体析出,溶液由无色逐渐变为蓝色
Cu +2AgNO3 ===Cu(NO3)2 + 2Ag
结论:金属活动性强弱:
Cu > Ag
通过上述探究,你能得出铝、铜、银的金属活动性顺序吗?
Al Cu Ag
金属活动性:强 弱
04 金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
常见金属在溶液中的活动性顺序:
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
例1:请你判断下列金属的活动性强弱:
(1)Fe 、Cu (2)Mg 、Zn (3) Ag 、Cu
(4)Al 、 Cu 、Fe (5)Mg、Cu 、Ag
Fe > Cu
Mg > Zn
Ag
Mg > Ag > Cu
嫁 给 那 美 女,身 体 细 纤 轻 ,总 共 一 百 斤
,
,
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常见金属在溶液中的活动性顺序:
,
,
位于H之前的金属才能置换出盐酸(HCl)或稀硫酸(H2SO4)的氢:
氢指的是氢元素不是氢气,因为酸中没有氢气。
例2:请你判断下列金属能否与稀盐酸、稀硫酸反应?
(1)Fe (2)Mg (3) Ag (4) Al
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
常见金属在溶液中的活动性顺序:
,
,
位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来,反之不能。
Fe + CuSO4 =
Cu +2AgNO3 =
Cu +Al2(SO4)3
例3:请你判断下列反应能否发生?如果能写出反应的方程式。
(1)铜与硫酸锌溶液;
(2)锌与硫酸铜溶液;
(3)铝与硝酸银溶液;
FeSO4 + Cu
Cu(NO3)2 + 2Ag
不反应
K、Ca、Na除外
1.金属的位置越靠前,它的活动性越强。
2.位于氢前面的金属能置换出盐酸(HCl)、稀硫酸(H2SO4)中的氢。
3.位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
金属活动性顺序在工农业生产和科学研究中有着重要应用。
固体不能反应
注意:钾钙钠,要除外。
1、有 X、Y、Z 三种金属,如果把 X 和 Y 分别放入稀硫酸中,X 溶解并产生氢气,Y 不反应;如果把 Y 和Z 分别放入硝酸银溶液中,过一会儿,在 Y 表面有银析出,而 Z 没有变化。根据以上实验事实,判断 X、Y 和Z 的金属活动性顺序。
课本P13 7
解:三种金属的活动性由强到弱依次为X、Y、Z
2. 下列物质能否发生反应?写出能发生反应的化学方程式。
(1) 银与稀盐酸 (2) 锌与硫酸铜溶液
(3) 铜与硫酸锌溶液 (4) 铝与硝酸银溶液
(1) 不能,因为在金属活动性顺序中银位于氢的后面,又因为铜也位于氢的后面,所以(3)也不能反应。
(2) 反应的化学方程式为:Zn + CuSO4 Cu+ ZnSO4
(4) 反应的化学方程式为: Al +3AgNO3 Al (NO3)3 + 3Ag
课本P13 5
2Al+3CuSO4 Al2(SO4)3+3Cu
金属与金属化合物溶液反应
金属的化学性质
Cu+2AgNO3 Cu(NO3)2+2Ag
金属活动性顺序的应用
1.比较金属的活动性强弱
2.判断金属与酸能否发生置换反应
3.判断金属和金属化合物溶液能否发生置换反应
写出以下金属分别与氧气、稀盐酸和稀硫酸反应的化学方程式,并标出基本反应类型。
随堂小测
氧气 稀硫酸 硫酸铜
镁
铝
铁
2Mg + O2 2MgO
4Al + 3O2 2Al2O3
3Fe+2O2 Fe3O4
点燃
2Al + 3H2SO4 === Al2(SO4)3+ 3H2↑
一、金属的化学性质
1、金属 + 氧气 → 金属氧化物
2、金属 + 酸 → 金属化合物 + 氢气
二、判断金属活动性顺序的方法
1、相同条件下,金属与氧气反应越容易,金属活动性越强, 反应越剧烈,金属活动性越强。
2、金属与酸反应越剧烈,金属活动性越强。
复习回顾
3、金属 + 金属化合物 → 新金属 + 新金属化合物
3、一种金属能否把另一种金属从其金属化合物溶液中置换出来。若能,则这种金属的活动性强,否则就弱。
(1)提供一种单质,两种溶液,应如何设计?
(2)提供一种溶液,两种单质,应如何设计?
(将铜片分别插入硫酸铁溶液、硝酸银溶液中。)
(将铁丝、银片分别插入硫酸铜溶液中。)
二、三种金属(如:Zn、Cu、Ag) 试用最少的药品
两金夹一溶液
两溶液夹一金
设计实验验证金属活动性顺序
一、两种金属(如:Fe、Cu)
1、分别放入盐酸或稀硫酸
2、将一种金属放入另一种金属的盐溶液里
3. 通过置换反应可判断金属活动性顺序,某同学通过实验来比较铜、铝、汞的金属活动性顺序,现有铜、铝、汞的三种单质,如果另外只用一种试剂达到实验目的,则应选用下列试剂中的( )
A.稀硫酸 B.氯化铝溶液 C.硝酸汞溶液 D.硫酸铜溶液
D
4、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,选用的试剂是( )双选
A.MgCl2溶液 B.ZnSO4溶液 C.CuSO4溶液 D.稀硫酸
B、D
1.铁在海水中容易被锈蚀,通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁制船壳。该金属块的材料可以是( )
A.金 B.银 C.铜 D.锌
2.下列现象和事实,可用金属活动性顺序作出合理解释的是( )
①金属镁在空气中比金属铝更易被点燃 ②金属铝比金属铁更耐腐蚀 ③配制农药波尔多液(原料含硫酸铜)时,不宜用铁制容器盛放 ④金属锌与稀硫酸反应速率适中,更适用于实验室制取氢气
A.①② B.③④ C.①③④ D.①②③④
D
C
《导学案》P131 自我提升
3.分别向放有铁丝和铜丝的两支试管中加入下列溶液,不能证明铁和铜金属活动性强弱的是( )
A.稀硫酸 B.FeSO4溶液
C.CuSO4溶液 D.AgNO3溶液
4.已知锰的金属活动性位于铝和锌之间。下列化学反应不能发生的是( )
A.Fe+MnSO4=== FeSO4+Mn
B.Mg+MnSO4=== MgSO4+Mn
C.Mn+2HCl=== MnCl2+H2↑
D.Mn+CuSO4=== MnSO4+Cu
D
A
5.已知X、Y、Z三种金属能发生下列反应:
X+H2SO4=== XSO4+H2↑;
Y+Z(NO3)2=== Y(NO3)2+Z;
Z+X(NO3)2=== Z(NO3)2+X。
则X、Y、Z三种金属与氢的活动性由强到弱的顺序为( )
A.X>H>Y>Z B.X>H>Z>Y
C.Z>Y>X>H D.Y>Z>X>H
D
6.小雨同学为验证镁、铁、锌三种金属的活动性,进行了如图
所示实验:
(1)实验中,小雨观察到的现象是
,
由此得
出三种金属的活动性:镁>锌>铁。
(2)小明还补充了铁片与硫酸铜溶液反应的实验,实验中观察
到的现象是 ,有关反应的化学方程式为 ,由此得出
铁、铜两种金属的活动性:铁 铜(填“>”“=”或“<”)。
三种金属表面都有气泡冒出,冒出气泡的速率:镁>锌>铁
铁片表面有红色固体析出,溶液由蓝色逐渐变成浅绿色
Fe+CuSO4═ FeSO4+Cu
>
Cl NO3 SO4 备 注
Zn
Mg
Fe
Fe
Cu
Al
Ag
1、在表格中写出相应化学式:
+2
+3
-1
-1
-2
+2
+2
+2
+3
+1
ZnCl2
Zn(NO3)2
ZnSO4
氯化某
硝酸某
硫酸某
AgCl
AgNO3
MgCl2
Mg(NO3)2
MgSO4
FeCl2
Fe(NO3)2
FeSO4
CuCl2
Cu(NO3)2
CuSO4
AlCl3
Al(NO3)3
Al2(SO4 )3
FeCl3
Fe(NO3)3
Fe2(SO4 )3
亚铁
铁
Ag2SO4
2、写出下列反应的化学方程式
(1)镁、锌、铁、铝与稀盐酸反应
(2)镁、锌、铁、铝与稀硫酸反应
(3)铁与硫酸铜溶液
铝与硫酸铜溶液
铜与硝酸银溶液
2Al + 3 H2SO4=Al2( SO4)3+ 3 H2↑
Cu + 2AgNO3= Cu(NO3)2 +2Ag
Fe+ CuSO4 =FeSO4 + Cu
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
2Al + 3 CuSO4= Al2( SO4)3+ 3Cu
+2
+2
+2
注意:铁在置换反应中表现为+2价而不是+3价
金属:大多数是银白色,如镁、铝、锌、铁
有Fe2+存在呈浅绿色,如FeCl2溶液、FeSO4溶液 、Fe(NO3)2溶液
有Fe3+存在呈黄色,如FeCl3溶液、Fe2(SO4)3溶液 、Fe(NO3)3溶液
有Cu2+存在呈蓝色,如CuCl2溶液、CuSO4溶液、Cu(NO3)2溶液
FeCl2溶液
FeSO4溶液
FeCl3溶液
CuSO4溶液
铜:红色 铁粉:黑色
溶液:大多数溶液是无色的
3、实验现象的描述
Cu +2AgNO3 =Cu(NO3)2 + 2Ag
现象:(1)铜的表面有 色物质生成 ;
(2)溶液由 色逐渐变成 色
银白色
无色
蓝色
银白
无
蓝
(2)溶液由 色逐渐变成 色
现象:(1)镁的表面有 产生 ;
气泡
无色
无色
气泡
无
无
Mg +2HCl =MgCl2 + H2 ↑
(2)溶液由 色逐渐变成 色
现象:(1)铁的表面有 产生 ;
气泡
无色
浅绿色
气泡
无
浅绿
Fe +2HCl =FeCl2 + H2↑
同课章节目录
