第十单元课题2酸和碱的中和反应第2课时溶液酸碱度的表示方法pH-2021-2022学年九年级化学人教版下册(共29张PPT内嵌视频)
文档属性
| 名称 | 第十单元课题2酸和碱的中和反应第2课时溶液酸碱度的表示方法pH-2021-2022学年九年级化学人教版下册(共29张PPT内嵌视频) |

|
|
| 格式 | pptx | ||
| 文件大小 | 72.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-20 00:00:00 | ||
图片预览






文档简介
(共29张PPT)
第十单元 酸和碱
课题2
酸和碱的中和反应
第2课时 溶液酸碱度的
表示方法 — pH
1.学会用pH试纸检验溶液的酸碱性。
2.掌握溶液的酸碱度在实际中的意义。
课程目标
要点一、溶液酸碱度的表示方法 - pH
思考:利用无色酚酞溶液能否将两瓶不同浓度的盐酸和两瓶不同浓度的氢氧化钠溶液鉴别出来?
酸碱指示剂只能测出酸碱性,但是不能确定溶液的酸碱度。
新课导入
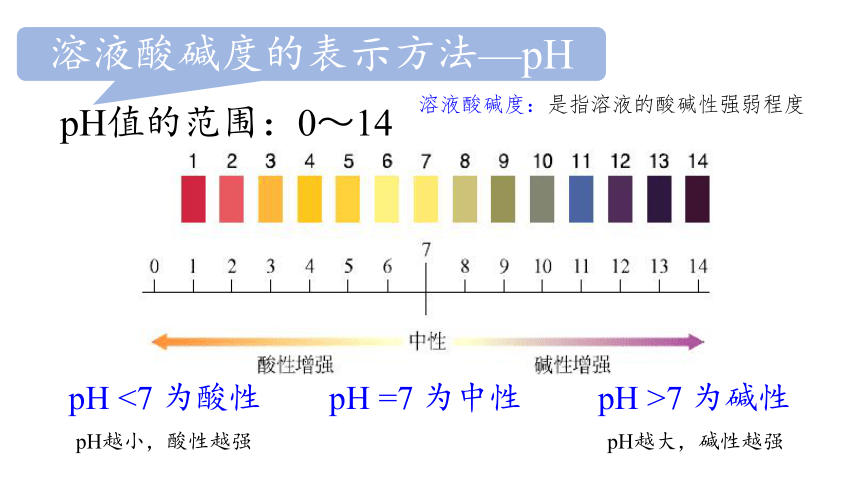
pH值的范围:0~14
pH <7 为酸性 pH =7 为中性 pH >7 为碱性
溶液酸碱度的表示方法—pH
溶液酸碱度:是指溶液的酸碱性强弱程度
pH越小,酸性越强 pH越大,碱性越强
pH试纸 只能精确到整数
pH计 可以精确到小数
用pH试纸测溶液的pH比较粗略,一般读数为整数
注意
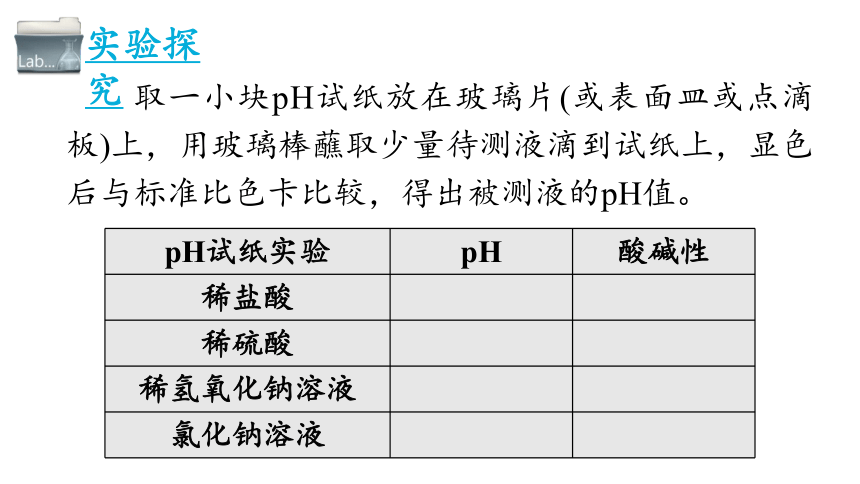
取一小块pH试纸放在玻璃片(或表面皿或点滴板)上,用玻璃棒蘸取少量待测液滴到试纸上,显色后与标准比色卡比较,得出被测液的pH值。
pH试纸实验 pH 酸碱性
稀盐酸
稀硫酸
稀氢氧化钠溶液
氯化钠溶液
实验探究
稀盐酸、稀硫酸
稀氢氧化钠溶液
实验探究
氯化钠溶液
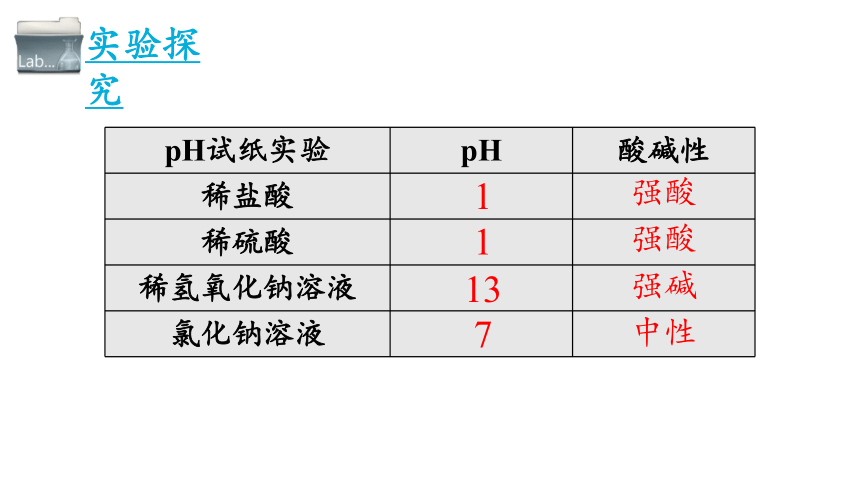
pH试纸实验 pH 酸碱性
稀盐酸
稀硫酸
稀氢氧化钠溶液
氯化钠溶液
1
13
7
强酸
强碱
中性
1
强酸
实验探究
注意
生活中常见物质的酸碱度是多少呢?
实验探究
生活中一些物质的pH
从实验结果中有什么新的发现?
pH<7的是酸性溶液,但不一定是酸溶液;
pH>7的是碱性溶液,但不一定是碱溶液。
pH是溶液中所含H+的浓度或OH-浓度大小的一种表示方法;
溶液中H+的浓度越大,酸性越强,pH越小;
溶液中OH-的浓度越大,碱性越强,pH越大;
当溶液中H+浓度与OH-浓度相等时,pH=7,溶液呈中性;
碱性溶液中一定含有OH-,但不一定是碱的溶液;
酸性溶液中一定含有H+,但不一定是酸的溶液
实验探究
下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液中,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,滴在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现的颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上,对照标准比色卡读数
D.用玻璃棒蘸取待测液滴在pH试纸上,3分钟后对照标准比色卡读数
B
×
√
×
×
典型例题
科学实验及化工生产有许多反应必须有一定pH溶液中才能进行
农作物一般适宜在pH接近或等于7的土壤中生长
要点二、了解溶液酸碱度的意义
溶液的酸碱度对工农业生产和生命活动的影响是很大的,了解溶液的酸碱度有十分重要的意义。主要表现为以下几方面
测定人体内或排出的液体的pH,可以了解人体的健康状况
测定雨水的pH可以了解空气污染情况(正常雨水pH约为5.6,酸雨的pH<5.6)
洗头时,先用洗发水再用护发素,这样对头发有保护作用。这是为什么呢?
洗发水呈碱性,能够帮助头发的毛鳞片打开,彻底清洁的同时还能吸收营养;护发素呈酸性,能关闭头发的毛鳞片,使头发顺滑。
思考
洗发水 护发素
化学物质及其变化与生活密切相关。
(1)健康人的体液pH必须维持在一定范围内。如果体液pH超越正常范围,就会导致某些疾病的产生。胃液的pH 7(填“大于”“小于”或“等于”) 。人体内二氧化碳排出不畅时,会导致血液pH (填“升高”或“降低”)。
小于
降低
典型例题
(2)下表是一些作物适宜生长的pH范围:
某地红土壤偏酸性。上述作物不适宜在红土壤中种植的是 。
甘草
1、填空题
(1)实验室中有A、B两种溶液,经测定,A溶液pH=4.5,B溶液pH=10.2。则A溶液呈____性,能使紫色石蕊溶液变____色;B溶液呈____性,能使无色酚酞溶液变___色。
(2)测定pH最简单的方法是使用________。测定时,用 蘸取待测溶液,滴在_________上,然后再与_____________对照,得出该溶液的pH。
酸
红
碱
红
pH试纸
玻璃棒
pH试纸
标准比色卡
课后练习
2、一些食物的近似pH如下:
下列说法中不正确的是( )。
A.鸡蛋清和牛奶显碱性
B.苹果汁和葡萄汁显酸性
C.苹果汁比葡萄汁的酸性强
D.胃酸过多的人应少饮葡萄汁和苹果汁
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
pH 3.5 4.5 2.9 3.3 6.3 6.6 7.6 8.0
A
3、某小型造纸厂向河中非法排放了大量碱性废液。请你根据所学的知识,设计两种检测碱性废液和受污染河水的方法,并试着提出治理的措施。
答:取样于试管:
方法一:滴入酚酞溶液,若溶液变为红色,则说明河水已被碱性溶液污染。
方法二:滴入石蕊溶液,若溶液变为蓝色,则说明河水已被碱性溶液污染。
方法四:在白瓷板或玻璃板上放一小片pH试纸,用玻璃棒蘸取河水样品滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,若读出该溶液的pH>7,则说明河水已被碱性溶液污染。
治理措施:向该呈碱性的被污染的河水中加入适量的酸性溶液中和。造纸厂的废水经处理检验合格后再排放。
方法三:取样,滴入硫酸铜溶液,若生成蓝色沉淀,则说明河水已被碱性溶液污染。
4、某学校化学课外活动小组的同学开展了下列实验活动:取刚降到地面的雨水水样用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:
(1)所降雨水是否为酸雨?
在测定期间,雨水的酸性是增强还是减弱?
测定时刻 5:05 5:10 5:15 5:20 5:25 5:30 5:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
是;增强
(2)经调查,这一地区有一家硫酸厂(生产过程中产生SO2)和一家电镀厂,这些工厂使用的燃料主要是煤。另外,这一地区的生活燃料也主要是煤,还有液化石油气。试分析造成这一地区酸雨的主要原因,你认为应采取什么措施。
原因:硫酸厂产生的SO2以及煤燃烧产生的SO2溶于水形成酸雨;
措施:硫酸厂的尾气处理达标后再排放,工业和生活用煤应做脱硫处理,改变燃料结构。
1、溶液的酸碱性用 鉴别,溶液的酸碱度用 测定。
酸碱指示剂
pH试纸
2、pH的范围在 之间。
pH<7,溶液呈 性;
pH=7,溶液呈 性;
pH>7,溶液呈 性。
0~14
酸
中
碱
课后巩固
3、了解溶液酸碱度的意义:
(1)化工生产中要控制pH范围;
(2)农作物适宜在pH=7或接近7的土壤中生长;
(3)测定雨水的pH,正常雨水pH约为 ,pH小于5.6的雨水为 ;
(4)测定人体内液体的pH,了解人体健康状况。
5.6
酸雨
第十单元 酸和碱
课题2
酸和碱的中和反应
第2课时 溶液酸碱度的
表示方法 — pH
1.学会用pH试纸检验溶液的酸碱性。
2.掌握溶液的酸碱度在实际中的意义。
课程目标
要点一、溶液酸碱度的表示方法 - pH
思考:利用无色酚酞溶液能否将两瓶不同浓度的盐酸和两瓶不同浓度的氢氧化钠溶液鉴别出来?
酸碱指示剂只能测出酸碱性,但是不能确定溶液的酸碱度。
新课导入
pH值的范围:0~14
pH <7 为酸性 pH =7 为中性 pH >7 为碱性
溶液酸碱度的表示方法—pH
溶液酸碱度:是指溶液的酸碱性强弱程度
pH越小,酸性越强 pH越大,碱性越强
pH试纸 只能精确到整数
pH计 可以精确到小数
用pH试纸测溶液的pH比较粗略,一般读数为整数
注意
取一小块pH试纸放在玻璃片(或表面皿或点滴板)上,用玻璃棒蘸取少量待测液滴到试纸上,显色后与标准比色卡比较,得出被测液的pH值。
pH试纸实验 pH 酸碱性
稀盐酸
稀硫酸
稀氢氧化钠溶液
氯化钠溶液
实验探究
稀盐酸、稀硫酸
稀氢氧化钠溶液
实验探究
氯化钠溶液
pH试纸实验 pH 酸碱性
稀盐酸
稀硫酸
稀氢氧化钠溶液
氯化钠溶液
1
13
7
强酸
强碱
中性
1
强酸
实验探究
注意
生活中常见物质的酸碱度是多少呢?
实验探究
生活中一些物质的pH
从实验结果中有什么新的发现?
pH<7的是酸性溶液,但不一定是酸溶液;
pH>7的是碱性溶液,但不一定是碱溶液。
pH是溶液中所含H+的浓度或OH-浓度大小的一种表示方法;
溶液中H+的浓度越大,酸性越强,pH越小;
溶液中OH-的浓度越大,碱性越强,pH越大;
当溶液中H+浓度与OH-浓度相等时,pH=7,溶液呈中性;
碱性溶液中一定含有OH-,但不一定是碱的溶液;
酸性溶液中一定含有H+,但不一定是酸的溶液
实验探究
下列检测某溶液pH的操作正确的是( )
A.将pH试纸投入待测液中,对照标准比色卡读数
B.用干燥、洁净的玻璃棒蘸取少量待测液,滴在置于洁净表面皿的pH试纸上,半分钟内根据试纸呈现的颜色,对照标准比色卡读数
C.用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上,对照标准比色卡读数
D.用玻璃棒蘸取待测液滴在pH试纸上,3分钟后对照标准比色卡读数
B
×
√
×
×
典型例题
科学实验及化工生产有许多反应必须有一定pH溶液中才能进行
农作物一般适宜在pH接近或等于7的土壤中生长
要点二、了解溶液酸碱度的意义
溶液的酸碱度对工农业生产和生命活动的影响是很大的,了解溶液的酸碱度有十分重要的意义。主要表现为以下几方面
测定人体内或排出的液体的pH,可以了解人体的健康状况
测定雨水的pH可以了解空气污染情况(正常雨水pH约为5.6,酸雨的pH<5.6)
洗头时,先用洗发水再用护发素,这样对头发有保护作用。这是为什么呢?
洗发水呈碱性,能够帮助头发的毛鳞片打开,彻底清洁的同时还能吸收营养;护发素呈酸性,能关闭头发的毛鳞片,使头发顺滑。
思考
洗发水 护发素
化学物质及其变化与生活密切相关。
(1)健康人的体液pH必须维持在一定范围内。如果体液pH超越正常范围,就会导致某些疾病的产生。胃液的pH 7(填“大于”“小于”或“等于”) 。人体内二氧化碳排出不畅时,会导致血液pH (填“升高”或“降低”)。
小于
降低
典型例题
(2)下表是一些作物适宜生长的pH范围:
某地红土壤偏酸性。上述作物不适宜在红土壤中种植的是 。
甘草
1、填空题
(1)实验室中有A、B两种溶液,经测定,A溶液pH=4.5,B溶液pH=10.2。则A溶液呈____性,能使紫色石蕊溶液变____色;B溶液呈____性,能使无色酚酞溶液变___色。
(2)测定pH最简单的方法是使用________。测定时,用 蘸取待测溶液,滴在_________上,然后再与_____________对照,得出该溶液的pH。
酸
红
碱
红
pH试纸
玻璃棒
pH试纸
标准比色卡
课后练习
2、一些食物的近似pH如下:
下列说法中不正确的是( )。
A.鸡蛋清和牛奶显碱性
B.苹果汁和葡萄汁显酸性
C.苹果汁比葡萄汁的酸性强
D.胃酸过多的人应少饮葡萄汁和苹果汁
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
pH 3.5 4.5 2.9 3.3 6.3 6.6 7.6 8.0
A
3、某小型造纸厂向河中非法排放了大量碱性废液。请你根据所学的知识,设计两种检测碱性废液和受污染河水的方法,并试着提出治理的措施。
答:取样于试管:
方法一:滴入酚酞溶液,若溶液变为红色,则说明河水已被碱性溶液污染。
方法二:滴入石蕊溶液,若溶液变为蓝色,则说明河水已被碱性溶液污染。
方法四:在白瓷板或玻璃板上放一小片pH试纸,用玻璃棒蘸取河水样品滴到pH试纸上,把试纸显示的颜色与标准比色卡比较,若读出该溶液的pH>7,则说明河水已被碱性溶液污染。
治理措施:向该呈碱性的被污染的河水中加入适量的酸性溶液中和。造纸厂的废水经处理检验合格后再排放。
方法三:取样,滴入硫酸铜溶液,若生成蓝色沉淀,则说明河水已被碱性溶液污染。
4、某学校化学课外活动小组的同学开展了下列实验活动:取刚降到地面的雨水水样用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:
(1)所降雨水是否为酸雨?
在测定期间,雨水的酸性是增强还是减弱?
测定时刻 5:05 5:10 5:15 5:20 5:25 5:30 5:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
是;增强
(2)经调查,这一地区有一家硫酸厂(生产过程中产生SO2)和一家电镀厂,这些工厂使用的燃料主要是煤。另外,这一地区的生活燃料也主要是煤,还有液化石油气。试分析造成这一地区酸雨的主要原因,你认为应采取什么措施。
原因:硫酸厂产生的SO2以及煤燃烧产生的SO2溶于水形成酸雨;
措施:硫酸厂的尾气处理达标后再排放,工业和生活用煤应做脱硫处理,改变燃料结构。
1、溶液的酸碱性用 鉴别,溶液的酸碱度用 测定。
酸碱指示剂
pH试纸
2、pH的范围在 之间。
pH<7,溶液呈 性;
pH=7,溶液呈 性;
pH>7,溶液呈 性。
0~14
酸
中
碱
课后巩固
3、了解溶液酸碱度的意义:
(1)化工生产中要控制pH范围;
(2)农作物适宜在pH=7或接近7的土壤中生长;
(3)测定雨水的pH,正常雨水pH约为 ,pH小于5.6的雨水为 ;
(4)测定人体内液体的pH,了解人体健康状况。
5.6
酸雨
同课章节目录
